夏秋季太湖4个控藻区鳙体内微囊藻毒素累积分析
高鸽,周游,王小林,沈振华,陈永进,徐东坡(.南京农业大学无锡渔业学院,江苏无锡408;.中国水产科学研究院淡水渔业研究中心,农业部长江下游渔业资源环境科学观测实验站,江苏无锡408;.江苏省太湖渔业管理委员会办公室,江苏苏州5004)
夏秋季太湖4个控藻区鳙体内微囊藻毒素累积分析
高鸽1,周游2,王小林3,沈振华3,陈永进2,徐东坡2
(1.南京农业大学无锡渔业学院,江苏无锡214081;2.中国水产科学研究院淡水渔业研究中心,农业部长江下游渔业资源环境科学观测实验站,江苏无锡214081;3.江苏省太湖渔业管理委员会办公室,江苏苏州215004)
为探讨微囊藻毒素(Microcystin,MCs)对水产品食用安全性的影响,于2015年6月向太湖4个控藻区(竺山湖、月亮湾、三国城、乌龟山)水体中投放规格约3 g/尾的鳙Aristichthysnobilis幼鱼,8—11月每月中旬从各控藻区固定采集鳙样本15尾,分别测定水体、鳙不同组织和器官中MCs的含量,并结合各控藻区的水质指标分析了MCs在鳙体内的累积规律及影响因子。结果表明:4个控藻区鳙不同组织和器官中总MCs含量依次为肌肉>肝胰脏>血清,且肌肉、肝胰脏中累积的总MCs极显著高于血清(P<0.01);肌肉、肝胰脏和血清中MCs的累积在不同控藻区间均无显著性差异(P>0.05);鳙肌肉、肝胰脏和血清中MCs的累积月份间有极显著性差异(P<0.01);水温和藻类胞内MCs含量对血清、肝胰脏和肌肉中MCs的累积均有极显著影响(P<0.01),体长对血清、肝胰脏中的MCs累积也有极显著影响(P<0.01);蓝藻爆发期间,MCs含量较高,据世界卫生组织(WHO)建议的MC-LR日允许摄入量,4个湖区中每日人均可摄入鳙肉229.62~977.20 g,并不会给人类健康造成危害。本研究可为微囊藻毒素在鳙体内不同组织、器官的积累效应和水产品食用安全风险评估提供理论依据。
微囊藻毒素;鳙;累积;太湖;水质指标
近年来,随着全球内陆水体富营养化趋势的加剧,蓝藻水华及其次级代谢产物之一微囊藻毒素(Microcystin,MCs)的生物累积对生态系统和人体健康构成了严重威胁,已成为当前环境科学研究的热点[1-2]。鳙Aristichthys nobilis作为最重要的淡水滤食性鱼类之一,不仅是中国水产养殖品种的主要构成部分[3-4],而且是太湖的优势鱼类。目前,太湖水体富营养化趋势并未得到有效遏制,据统计, 2004—2008年间太湖具有明确时间、地点的蓝藻水华发生次数高达414次,蓝藻水华总面积约为72 890 km2[5]。水质污染给环境和经济造成了严重的威胁,已影响到周边人民的日常生活。多年来,江苏省政府一直采取积极措施应对水质污染,除全面启动生态清淤、蓝藻打捞等应急工程外,还应用生物操纵理论进行生物治理和生态修复,如在湖泊等大水面开展鱼类增殖放流等[6]。
慢性毒性试验显示,微囊藻毒素能在滤食性鱼类的肌肉、肝、肠和血液中积累,该鱼类对此能产生生理上的适应,从而能与毒藻共存[7]。近年来,已有学者对凡纳滨对虾Litopenaeus vannamei[8]、尼罗罗非鱼Oreochromis niloticus[9-10]、鲫Carassiusau-ratus[11-12]、大型溞Daphnia magna[13]、罗氏沼虾Macrobrachium rosenbergii[13]、鲢Aristichthys nobil-is[14]等体内MCs的累积及影响因子进行了研究,涉及水域有东湖[15]、滇池[16]、鄱阳湖[17]等,而截至目前,对太湖中鱼类MCs的研究仅有关于罗非鱼[9-10]、鲢[14]的报道,其中杨坚波等[18]为了解无锡太湖水体中MCs的污染情况,于2001年7、11月对太湖水体及主要鱼种体内MCs含量进行了初步调查。其研究中虽涉及鳙,但试验样本数仅为8尾,且试验目的主要为监测太湖水质[19-21],故尚无针对鳙累积MCs的系统性研究,且MCs是否会通过食物链危害人类健康尚无直接证据。
本试验于2015年6月在4个控藻区分别利用围网、网箱方式放养一定数目的鳙,自7月开始进行水体藻毒素的监测,8月开始进行鳙样本的采集,从生物和水质角度出发,探讨了太湖4个控藻区微囊藻毒素在鳙体内不同组织、器官中的累积效应,以期为微囊藻毒素的生物累积和水产品食用安全风险评估提供理论依据与参考。
1 材料与方法
1.1 采样点布设及样品采集
于2015年6月20日前后分别向4个不同控藻区(竺山湖、月亮湾、三国城、乌龟山)投放规格约为3 g/尾的鳙,围网囤养方式中(月亮湾、三国城)放养密度为1.5尾/m2,网箱囤养方式中(竺山湖、乌龟山)放养密度为30尾/m3。2015年7—11月,逐月对太湖4个不同控藻区进行样品采集,样品包括水样和鳙血液、肝胰脏、肌肉。
图1 采样区示意图Fig.1Schematic diagram of the sampling areas
1.2 方法
1.2.1 水样采集在同一控藻区内均匀选取3处采样点,用5 L有机玻璃采水器,采集水面约30 cm以下水体各2.5 L,混匀,低温保存,带回实验室后准确量取200 mL水样,用真空泵经0.22滋m孔径玻璃纤维滤膜过滤,得滤液和滤膜两部分,滤膜部分藻细胞用于测定胞内毒素。
1.2.2 鳙血液及肝胰脏、肌肉样品采集从各采样点随机捞取规格基本一致(放流时鱼苗规格基本一致)的鳙15尾,依次编号,用吸水纸吸干鱼体表水分,分别测定鱼全长、体长和体质量等生物学指标。用经肝素润洗过的2.5 mL注射器尾静脉采血,抽取全血1~2 mL,注入事先加有20滋L肝素的2 mL离心管中,并置于放有碎冰的保温箱中暂存。带回实验室后,采用冷冻离心机在4益下以4000 r/min离心10 min,吸取上层血清,并将血清置于冰箱(-20益)中冻存,待测。采血后的鱼体迅速解剖,并完整剥取其肝胰脏,用吸水纸吸干表面血液后,放入编号的离心管中;再用剪刀和镊子撕开鱼体背部皮肤,取背鳍下方的背部肌肉约5 g,放入离心管中。肝胰脏和肌肉样品均置于铺有碎冰的保温箱中暂存,带回实验室后,置于冰箱(-20益)中冻存,待测。
1.2.3 微囊藻毒素(MCs)的提取和测定MCs的富集纯化采用C18固相萃取柱萃取,MCs的测定分析采用高效液相色谱-串联质谱法(LC-MS)和酶联免疫法(ELISA)[22]。LC-MS法检出限较ELISA法更低,可达到0.01滋g/L[23-24]。LC-MS法虽然精确度高,但仪器价格昂贵,样品制备过程复杂、耗时长[25],故本试验中藻样MCs的检测选用LC-MS法,鳙体内MCs的检测选用ELISA法。
(1)MCs的萃取与检测[26]。用孔径为0.22滋m的滤膜进行抽滤,所得滤膜及附着在滤膜上的藻细胞,用30 mL甲醇(75%)提取,在4益下以200 r/min振荡3 h,并连续提取3次,得到的悬浊液用高速冷冻离心机离心30 min(4益,15 000 r/min),分离得到的上清液用去离子水稀释6倍。水样滤液和经稀释的上清液再分别用C18固相萃取柱(0.5 g)富集,富集前萃取柱用10 mL甲醇(100%,分析纯)和10 mL去离子水活化调节,然后用20 mL 100%甲醇洗脱萃取柱中的MCs。洗脱液经旋转蒸发仪蒸干后得到的固态物质用100滋L去离子水溶解并定容,最后用Waters ZMD 4000高效液相色谱-串联质谱法进行测定。
(2)鳙肌肉、肝胰脏和血清样品中MCs的萃取与检测[26]。将制备好的各组织匀浆上清液加入用纯化抗体包被好的试剂盒微孔板(购自上海江莱生物)中,所含MCs与HRP标记的抗体结合,形成抗体-抗原-酶标抗体复合物,经洗涤后加入TMB显色剂进行显色反应,并在酸终止液的作用下最终转化成黄色,使用酶标仪在450 nm波长下测定吸光度(OD值),并利用绘制的标准曲线计算出样品中MCs的浓度。
1.3 数据处理
采用SPSS 20.0软件检测试验数据是否近似服从正态分布,并对MCs累积结果进行单因素方差分析(ANOVA)和Tukey蒺s-b多重比较,对潜在影响MCs累积的生物及非生物因素进行Pearson相关性分析。显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 太湖4个控藻区水体的理化特征
2015年8—11月,不同控藻区水质存在一定的空间差异;其中月亮湾水体平均总氮(TN)含量最高,竺山湖水体平均NH+4-N含量最高,乌龟山水体平均NO-2-N和CODMn含量最高,三国城水体平均TP和Chl-a含量最高(表1)。
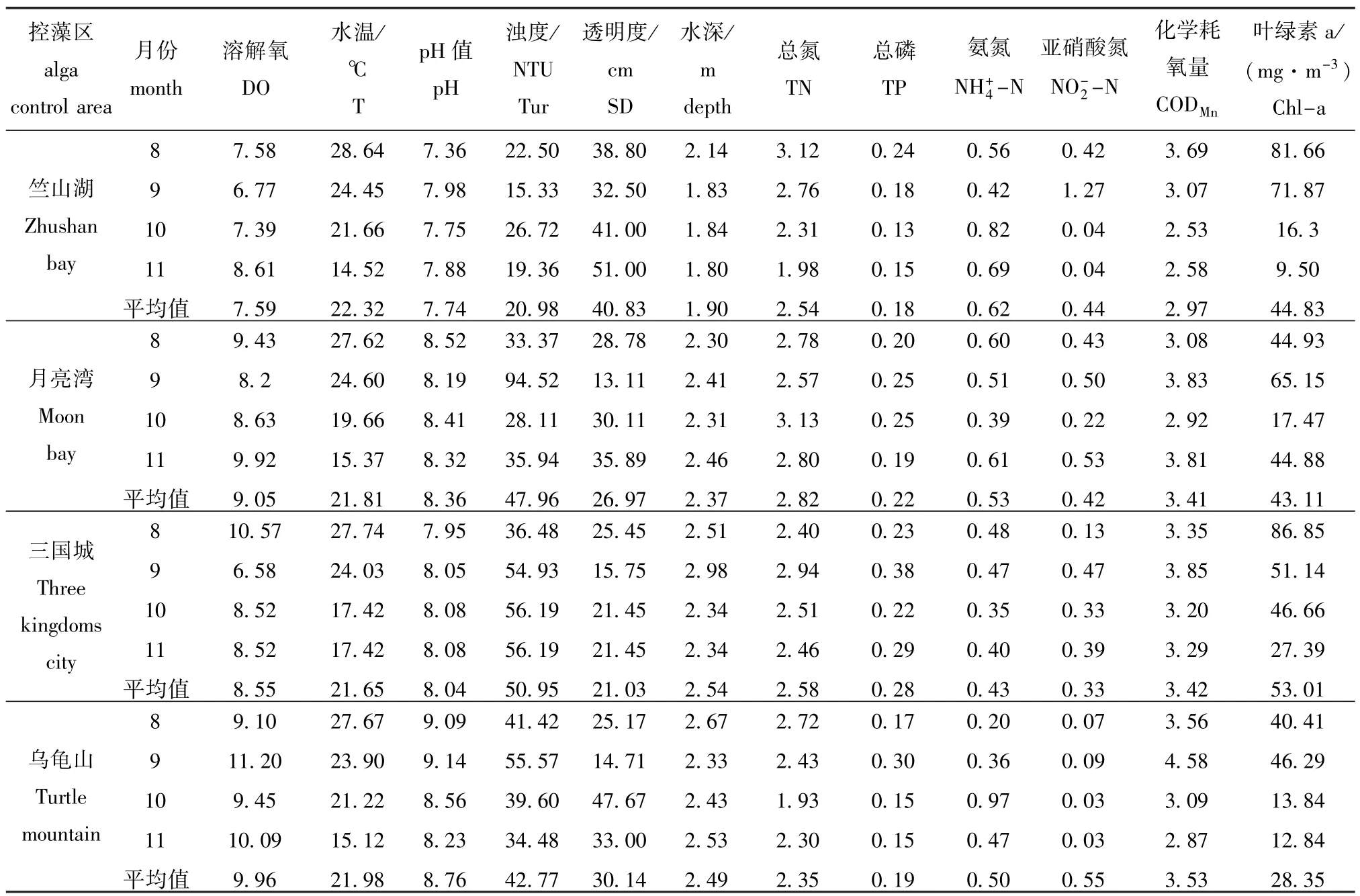
表1 采样区水质指标Tab.1W ater quality parameters in the four sam p ling areas in Taihu Lake mg/L
2.2 不同控藻区浮游植物密度及生物量
在4个控藻区共鉴定出绿藻门Chlorophyta、硅藻门Bacillariophyta、蓝藻门Cyanophyta、隐藻门Cryptophyta、金藻门Chrysophyta、甲藻门Pyrrophy-ta、裸藻门Euglenophyta和黄藻门Xanthophyta共8门藻类。2015年8—11月,不同生物控藻区浮游植物密度和生物量存在一定的空间差异;其中月亮湾浮游植物平均密度最高,乌龟山浮游植物平均生物量最高,三国城浮游植物丰富度指数最高(表2)。
2.3 微囊藻毒素在鳙体内的累积
从表3可见:4个控藻区鳙不同组织、器官中累积的总MCs由高到低依次为肌肉>肝胰脏>血清;鳙肌肉内MCs累积量变化范围为3.07~8.71 ng/g,平均值为(5.65依1.29)ng/g;肝胰脏内MCs累积量变化范围为2.17~7.85 ng/g,平均值为(5.01依1.38)ng/g;血清中MCs累积量变化范围为0.13~0.75 ng/mL,平均值为(0.39依0.20) ng/mL(血清密度近似为1 g/mL);肌肉、肝胰脏内总MCs含量极显著高于血清(P<0.01),而肝胰脏和肌肉内总MCs含量无显著性差异(P> 0.05)。
2.4 空间差异对MCs在鳙体内累积的影响
鳙3种组织、器官中累积的MCs含量在4个控藻区间无显著性差异(P>0.05)(肌肉,F= 1.092,P=0.354>0.05;肝胰脏,F=1.584,P= 0.626>0.05;血清,F=0.585,P=0.626>0.05) (表3)。此外,由于竺山湖与乌龟山,明月湾与三国城的囤养方式相同,而地理位置不同,故鳙肌肉、肝胰脏和血清中MCs含量在竺山湖和乌龟山控藻区间无显著性差异(P>0.05)(t值分别为0.725、0.812、0.768,均大于0.05),在月亮湾和三国城控藻区间也无显著性差异(P>0.05)(t值分别为0.543、0.638、0.846,均大于0.05)。通过对两组中MCs含量差异性的分析表明,空间差异对MCs含量影响较小。综上所述,空间差异对鳙体内MCs累积效果无显著性影响(P>0.05)。
2.5 时间差异对微囊藻毒素在水体及鳙体内累积
的影响
对4个采样控藻区藻类胞内MCs含量检测结果显示,胞内MCs含量变化范围为4.78~32.11 ng/g,随着时间推移,胞内MCs含量总体均呈下降趋势,除月亮湾外均以11月MCs含量最低(图2)。
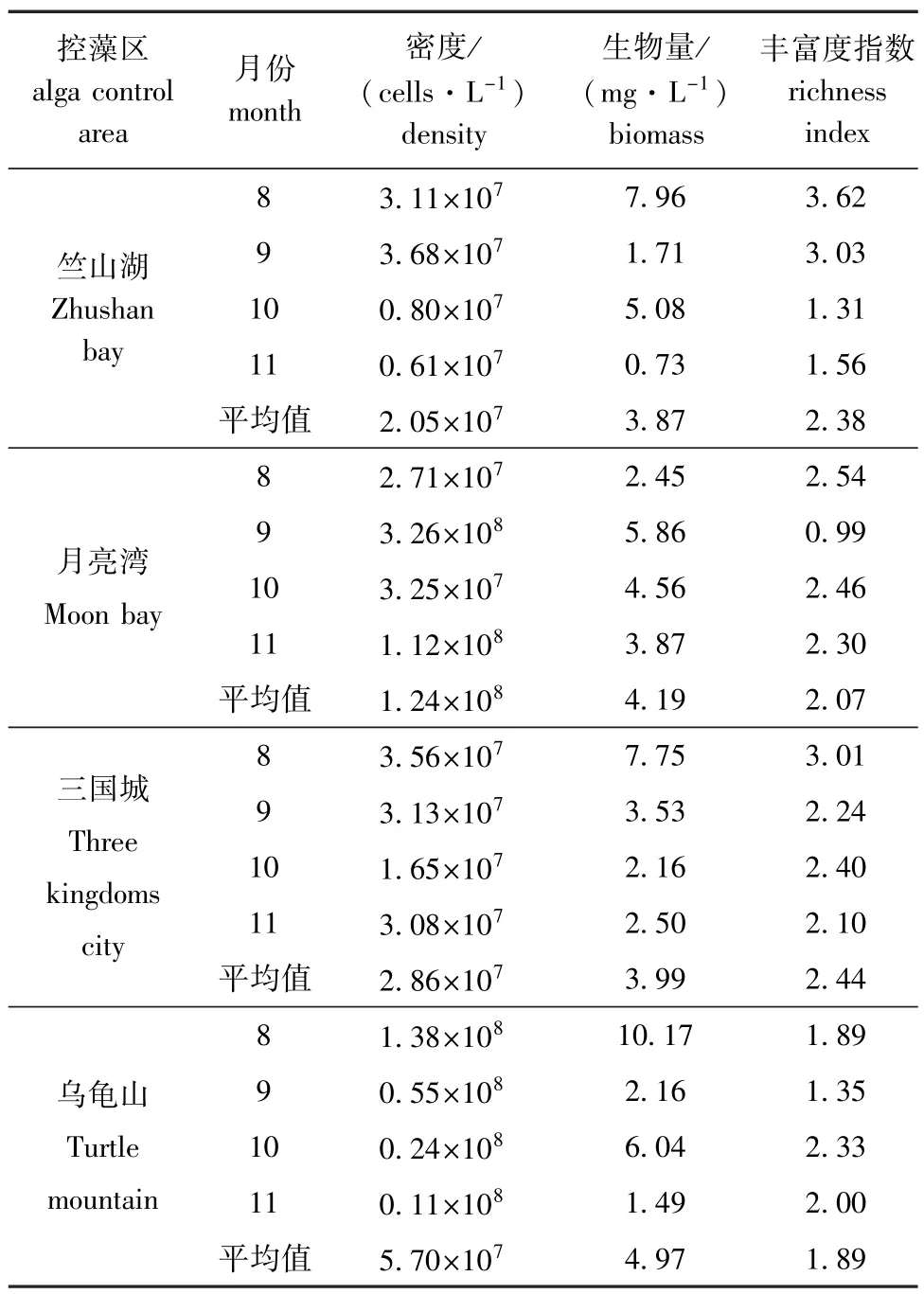
表24 个控藻区浮游植物各月动态变化Tab.2Monthly changes in phytoplankton parameters in the four sampling areas
单因素方差分析结果显示,月份对鳙各组织内MCs含量有极显著性影响(肌肉,F=8.877,P< 0.001;肝胰脏,F=22.465,P<0.001;血清, F=57.328,P<0.001)。

图2 不同月份各控藻区水体胞内MCs含量Fig.2M onthly content of MCs in phytop lankton cells in the four sampling areas
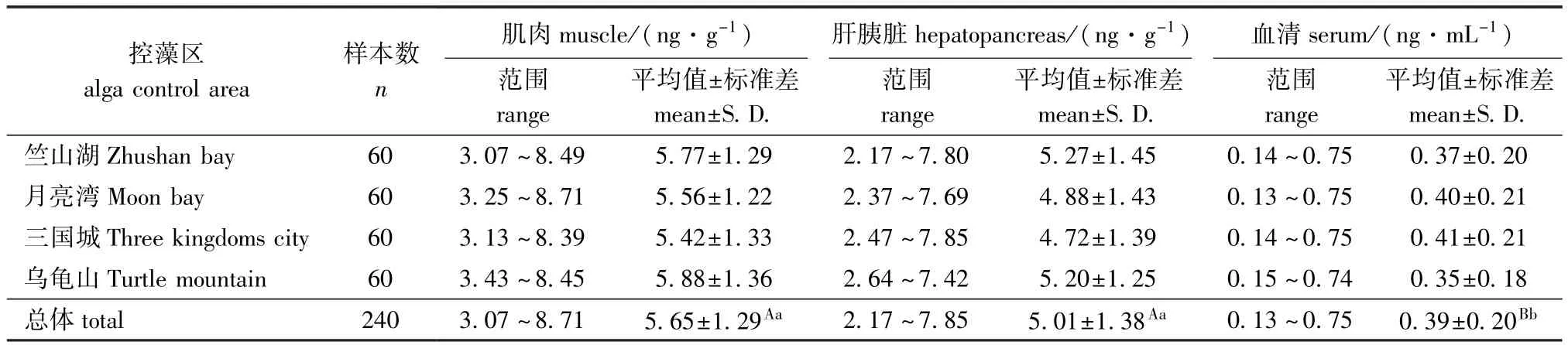
表3MCs在鳙体内的累积趋势Tab.3Cumulation of MCs in bighead carp Aristichthys nobilis in Taihu Lake
2015年8—10月,鳙肌肉、肝胰脏内MCs含量均表现为较高的浓度累积,从10月开始,鳙肌肉、肝胰脏内微囊藻毒素含量开始逐渐降低,11月后大幅减少(P<0.05);相反,血清中MCs含量从10月起开始逐渐上升,11月后大幅增加(P< 0.05)(图3)。
分别检测4个控藻区鳙体内MCs累积效果与时间变化的关系(图4)。结果显示,相同囤养方式下各月鳙体内MCs累积变化曲线趋势相似。网箱囤养的竺山湖和乌龟山控藻区,鳙肌肉中MCs累积量均在10月达到最高值,平均值分别为6.16、6.46 ng/g;围网囤养的月亮湾和三国城控藻区,鳙肌肉中MCs累积量均在8月达到最高值,平均值分别为6.71、6.59 ng/g,肝胰脏中MCs累积量均在9月达到最高值,平均值分别为5.74、6.11 ng/g。
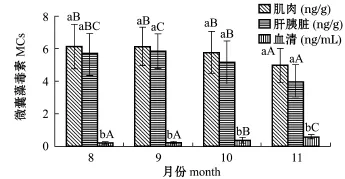
图3 不同月份4个控藻区鳙体内MCs含量的平均累积Fig.3Accumulation of MCs in bighead carp Aristich-thys nobilis in four samp ling areas in different months
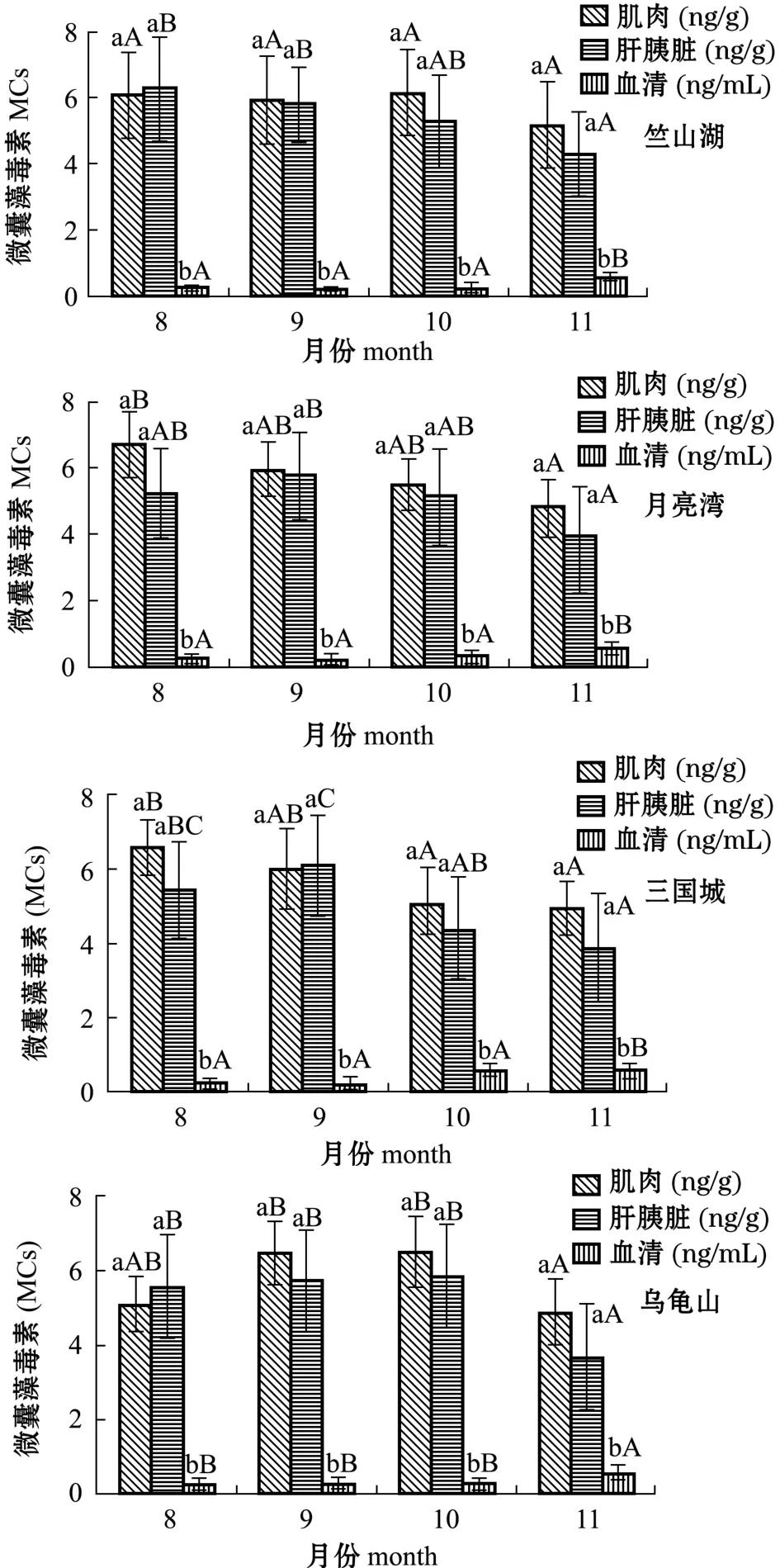
图4 竺山湖、月亮湾、三国城、乌龟山不同月份鳙体内MCs的累积Fig.4Monthly accumulation of MCs in bighead carp Aristichthys nobilis in Zhushan bay,M oon bay, Three kingdoms city,and Turtlemountain
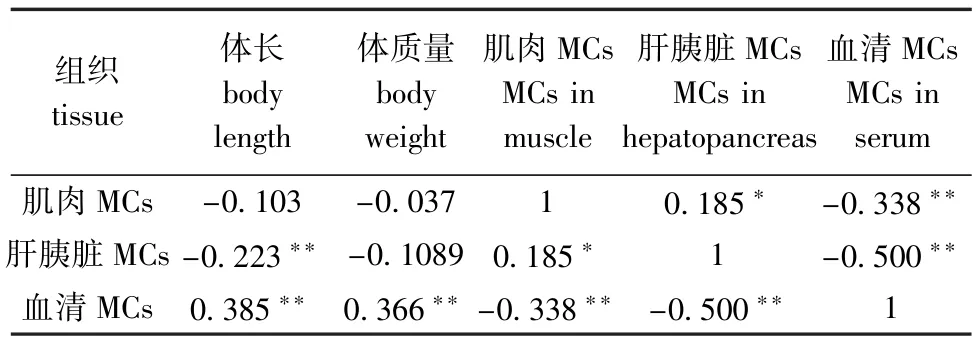
表4 不同组织MCs的累积与体长、体质量的相关性分析Tab.4Correlations between MCs and body length and body weight
2.6 囤养模式对鳙体内微囊藻毒素累积的影响
由“2.5冶节推测,囤养方式可能与MCs累积规律有关,故依据囤养方式不同,将竺山湖、乌龟山的样本为一组(同为网箱囤养),月亮湾、三国城的样本为一组(同为围网囤养),组内采用的囤养方式相同,仅所处空间位置不同(“2.4冶节中已述不同控藻区空间差异对MCs含量影响较小),可以发现,围网囤养组鳙肝胰脏中MCs累积量显著小于网箱囤养组(P<0.05),而两组肌肉和血清中MCs累积则无显著性差异(P>0.05)。
2.7 影响鳙体内微囊藻毒素累积的其他因素
由鳙不同组织、器官之间MCs累积量及其与其体质量、体长的相关分析(表4)表明:血清中MCs与体质量、体长均呈极显著正相关(P< 0.01);肝胰脏中MCs与体长呈极显著负相关(P<0.01);肌肉中MCs与肝胰脏中MCs呈显著正相关(P<0.05);肌肉、肝胰脏中MCs与血清中MCs均呈极显著负相关(P<0.01)。不同组织MC累积量与水环境因子的相关分析(表5)表明,肌肉、肝胰脏中MCs与水体藻细胞内MCs、水温均呈极显著正相关(P<0.01),肝胰脏中MCs与Chl-a含量呈显著正相关(P<0.05);血清MCs与水体胞内MCs、水温呈极显著负相关(P<0.01)。
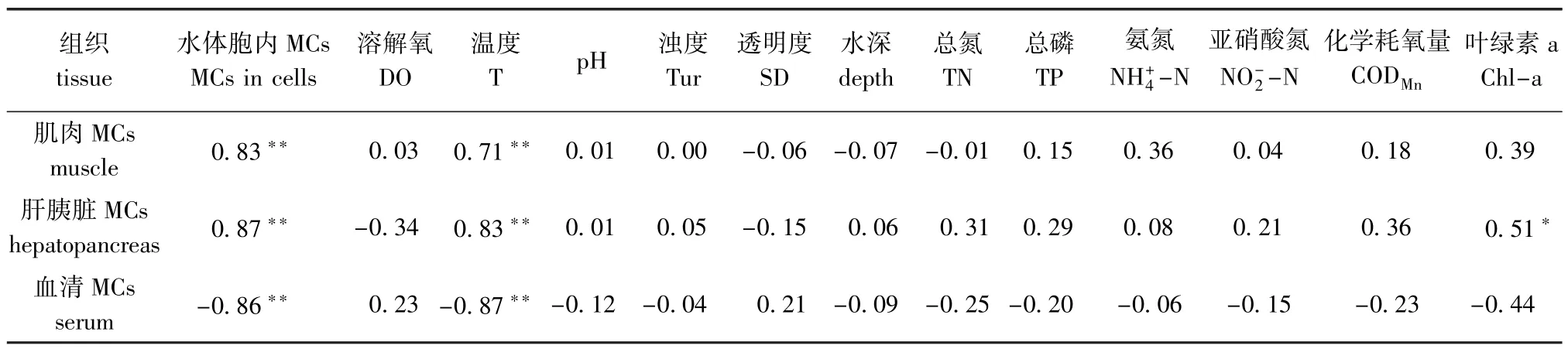
表5 不同组织MCs累积与水环境因子的相关性分析Tab.5Correlations between MCs accum ulation and water environmental factors
3 讨论
3.1 采样点与采样时间的设置
本试验中设置的4个控藻区分别位于太湖的不同位置(图1),竺山湖控藻区位于竺山湖内,月亮湾控藻区和三国城控藻区分别位于梅梁湾的西、东两侧,此3个控藻区均设置在太湖大型湖湾内,且是每年太湖蓝藻的高发区域;相比而言,乌龟山控藻区更靠近大太湖,且相对位置偏东,高浓度蓝藻持续的时间相对较短。从鱼类的饵料丰富程度分析,乌龟山控藻区较其他3处控藻区贫乏;从囤养方式分析,竺山湖和乌龟山控藻区采用网箱对鳙进行囤养,月亮湾区和三国城控藻区则采用大型网围对鳙进行囤养。故而选择这4个采样点可综合蓝藻持续时间、饵料丰富度、囤养方式等变量,更全面地得出微囊藻毒素在鳙体内的累积规律。
太湖4个控藻区8—11月TN平均含量为2.57 mg/L,TP平均含量为0.217 5 mg/L。据文献报道,蓝藻最适宜生长温度是25益。在这种温度条件下,营养盐含量高、有机质丰富的碱性水体极有利于蓝藻生长[27]。日本湖泊学家坂本也曾研究指出,当湖水的TN和TP浓度比值在10颐1至25颐1范围时,处于最佳氮磷比值范围,藻类生长与氮、磷浓度存在着直线相关关系[28]。N/P值是蓝藻丰度变化的重要影响因子之一[29]。本试验期间,太湖的水温、营养盐状况和pH值接近蓝藻最适生长条件,平均水温为21.94益、N/P平均值为12.57、pH=8.22>8非常适宜藻类生长。夏秋季正是太湖蓝藻爆发期,故选择8—11月为研究时段,与本试验目的一致。
3.2 鳙体内微囊藻毒素的累积规律
鳙是典型的滤食性鱼类[3],蓝藻和鳙构成了一个简单的水生食物链。本研究中鳙不同组织、器官中累积的MCs水平由高到低依次为肌肉>肝胰脏>血清(血清密度近似为1 g/mL),这与其他学者对罗非鱼和白鲢的研究结果(肝胰脏>肌肉>血清)不同[9-10,14,18-19]。可能是因为摄食中肠道可有效阻止MCs进入肝胰脏[7,30-31],血清中MCs来源于肝胰脏等各器官代谢后的产物,其含量显著减少可以间接证明MCs未全部累积到肝胰脏中,而是经过代谢大部分排出体外。此外,可能本研究中所采集的鱼样在累积—净化的动态过程中,净化处于优势[32],且胆汁在MCs净化过程中起到重要作用[33],因此,肝胰脏中累积的MCs首先被净化排除体外,因而肝胰脏中MCs浓度较低。通过MCs在水体及鳙体内含量范围可知,即使在MCs含量较低的水体中(图2、图4,11月各藻区),MCs也可通过食物链在鳙体内进行累积,故而除定期打捞蓝藻外,定期捕捞鳙也会对减少水中MCs起到一定作用。
3.3 鳙体内微囊藻毒素的累积与时间的关系
本试验中,月份对鳙肌肉、肝胰脏中MCs含量有极显著性影响,11月检测结果最低,较10月有较大幅度减少。这一现象一方面应与蓝藻水华的爆发规律密切相关,7—10月水温偏高,蓝藻大量增殖;进入11月后水温下降(表1),蓝藻大量死亡,蓝藻生物量减少,导致鳙通过摄食所获得的MCs来源有限,因此,水体藻细胞内MCs含量以11月最低。另一方面,鳙自身机体有可能通过代谢排除一部分MCs,从而使得肌肉、肝胰脏内MCs的含量表现为少量下降[34]。而血清中MCs累积量并未降低,11月反而升高,这一方面,可能是由于个体过小的鱼体血液样本采集困难,导致血清检测样本较肌肉、肝胰脏少,样本量不充足,存在误差;另一方面,当鱼类摄食的有毒微囊藻细胞在消化道破裂后,释放出来的MCs经肠道首先进入血液,随时间推移,鱼体生长后滤食能力增强,使得血清中MCs累积现象明显[35]。
3.4 鳙体内微囊藻毒素的累积与囤养方式的关系
10月蓝藻爆发时,围网囤养的月亮湾、三国城控藻区中鳙肝胰脏累积的MCs含量显著小于竺山湖、乌龟山控藻区网箱囤养的鳙肝胰脏的MCs含量。围网的囤养方式与网箱比较,鱼类活动空间更大,水的流动性更好,水体停留时间更短,由于MCs是由部分产毒藻细胞合成并释放到水体中的[36],Romo等[37]的研究指出,产毒蓝藻细胞种群占蓝藻生物量的比例及其产毒能力与水体停留时间呈正相关,因此,围网囤养的鳙体内MCs累积量较少。
3.5 鳙体内微囊藻毒素的累积与人类健康
据已有的流行病学调查研究发现,在中国肝癌高发的东南沿海地区,原发性肝癌(HCC)发病率与其生产和生活中使用沟塘水有密切关系。通常饮用水标准中MCs含量标准一般均指MC-LR (MCs的一种主要同分异构体[38]),世界卫生组织(WHO)推荐的饮用水中MCs(MC-LR)标准安全上限为1.0滋g/L[39],中国新版《生活饮用水卫生标准》(GB 5749—2006)与其一致。而对于食品中MCs的安全标准尚未制定。
据杨坚波等[18]报道,7月和11月太湖(中桥、梅园、雪浪和华庄)水体MCs含量分别为(9.874 8依4.636 6)、(0.142 8依0.123 1)滋g/L。太湖有五大湖湾,分别为东太湖、胥口湾、贡湖湾、梅梁湾、竺山湾,其中东太湖水草茂盛,水质较好;胥口湾部分水草覆盖,水质相对良好;而梅梁湾和竺山湾因水域较为封闭,水浅、水流缓慢,交换较差,污染较为严重;贡湖湾是一个“藻草混合型冶湖区,其富营养化水平较梅梁湾轻[27]。本次调查中三国城控藻区位置与上述中桥、梅园、雪浪和华庄的地理位置相近,竺山湖控藻区又位于竺山湖湖湾内,因此,本次检测采样点包含蓝藻较为严重的区域。据世界卫生组织(WHO)建议的MC-LR日允许摄入量(TDI)为0.04滋g/kg,按普通成人体质量为50~75 kg计,结合本次检测结果MCs含量区间为3.07~8.71 ng/g,人均每日可摄入鳙肉量为229.62~977.20 g,属于正常摄入量,可见蓝藻爆发期间,适量食用生长于富营养化污染较重湖区的鳙并不会对人类健康造成威胁。
[1]沈建国.微囊藻毒素的污染现状、毒性机理和检测方法[J].预防医学情报杂志,2001,17(1):10-11,16.
[2]李莉.微囊藻毒素对滤食性鱼类影响的毒理学实验和野外研究[D].武汉:中国科学院研究生院(水生生物研究所),2006.
[3]Liang Yanling,Melack JM,Wang Ji.Primary production and fish yields in Chinese ponds and lakes[J].Transactions of the Ameri-can Fisheries Society,1981,110(3):346-350.
[4]Tang Y A.Evaluation of balance between fishes and available fish foods inmultispecies fish culture ponds in Taiwan[J].Transactions of the American Fisheries Society,1970,99(4):708-718.
[5]刘聚涛,杨永生,高俊峰,等.太湖蓝藻水华分级及其时空变化[J].长江流域资源与环境,2011,20(2):156-160.
[6]Xie Ping,Liu Jiankang.Practical success of biomanipulation using filter-feeding fish to control cyanobacteria blooms:synthesisof dec-ades of research and application in a subtropical hypereutrophic lake[J].The Scientific World Journal,2001,1:337-356.
[7]Xie Liqiang,Xie Ping,Ozawa K,et al.Dynamics ofmicrocystins-LR and-RR in the phytoplanktivorous silver carp in a sub-chron-ic toxicity experiment[J].Environmental Pollution,2004,127 (3):431-439.
[8]傅一鸣.微囊藻毒素对凡纳滨对虾细胞免疫相关基因表达水平的影响[D].上海:上海海洋大学,2014:1-48.
[9]李旭光,周刚,周军,等.太湖微囊藻毒素在罗非鱼体内累积及生物降解的初步研究[J].水生态学杂志,2010,3(1):67-71.
[10]张美娜.微囊藻毒素-LR在罗非鱼体内的动态变化研究[D].南京:南京农业大学,2009:1-51.
[11]杨静东,胡梁斌,周威,等.微囊藻毒素在鲋鱼体内生物富集及其体内的抗氧化反应[J].生态环境学报,2009,18(6): 2044-2050.
[12]李莉,雷和花,侯杰,等.微囊藻毒素在银鲫肠道中的累积及其病理学影响[J].生态毒理学报,2014,9(6):1189-1196.
[13]苏晓明.微囊藻毒素在大型溞和罗氏沼虾体内的生物累积和传递[D].上海:上海海洋大学,2013:1-43.
[14]贾军梅,罗维,吕永龙.微囊藻毒素在太湖白鲢体内的累积规律及其影响因素[J].生态毒理学报,2014,9(2):382-390.
[15]隋海霞,严卫星,徐海滨,等.武汉东湖微囊藻毒素污染及其在鱼体内的动态研究[J].卫生研究,2014,33(1):39-41.
[16]吴幸强,龚艳,王智,等.微囊藻毒素在滇池鱼体内的积累水平及分布特征[J].水生生物学报,2010,34(2):388-393.
[17]徐海滨,孙明,隋海霞,等.江西鄱阳湖微囊藻毒素污染及其在鱼体内的动态研究[J].卫生研究,2003,32(3):192-194.
[18]杨坚波,陈艳,林玉娣,等.太湖水域及鱼类体内微囊藻毒素的调查[J].环境与健康杂志,2007,24(1):32-33.
[19]Xie Liqiang,Xie Ping,Guo Longgen,et al.Organ distribution and bioaccumulation of microcystins in freshwater fish at different trophic levels from the eutrophic lake Chaohu,China[J].Envi-ronmental Toxicology,2005,20(3):293-300.
[20]Magalh觔es V F,Marinho M M,Domingos P,et al.Microcystins (cyanobacteria hepatotoxins)bioaccumulation in fish and crusta-ceans from Sepetiba Bay(Brasil,RJ)[J].Toxicon,2003,42 (3):289-295.
[21]de Magalh觔es V F,Soares P M,Azevedo SM F O.Microcystin contamination in fish from the Jacarepagu佗Lagoon(Rio de Janei-ro,Brazil):ecological implication and human health risk[J].Toxicon,2001,39(7):1077-1085.
[22]范赛,赵榕,李兵,等.水产品中微囊藻毒素检测方法的研究进展[J].色谱,2012,30(5):434-439.
[23]顾丽丽.ELISA试剂盒法测定水中LR型微囊藻毒素[J].化学分析计量,2013,22(1):97-99.
[24]罗碧容,钱蜀,谢振伟,等.高效液相色谱-串联质谱法同时测定水中13种有机污染物[J].色谱,2015,33(7):740-745.
[25]区晖,周志洪,吴清柱.高效液相色谱法测定地表水中的微囊藻毒素-LR[J].广州化学,2009,34(1):50-53.
[26]朱荣,王欢,余得昭,等.2013年洱海水华期间微囊藻毒素和浮游植物动态变化[J].湖泊科学,2015,27(3):378-384.
[27]山东省水产学校.淡水生物学[M].北京:农业出版社,1997: 12-14.
[28]严力蛟,焦荔,金晓辉,等.千岛湖水体营养主控因子分析[J].当代生态农业,2001(3):89-93.
[29]金相灿,刘鸿亮,屠清瑛,等.中国湖泊富营养化[M].北京:中国环境科学出版社,1990:373-388.
[30]Zhang Dawen,Xie Ping,Liu Yaqin,et al.Transfer,distribution and bioaccumulation of microcystins in the aquatic food web in Lake Taihu,China,with potential risks to human health[J].Sci-ence of the Total Environment,2009,407(7):2191-2199.
[31]Chen Jun,Xie Ping,Zhang Dawen,et al.In situ studies on the distribution patterns and dynamics ofmicrocystins in a biomanip- ulation fish-bighead carp(Aristichthys nobilis)[J].Environmen-tal Pollution,2007,147(1):150-157.
[32]Ibelings BW,Chorus I.Accumulation of cyanobacterial toxins in freshwater“seafood冶and its consequences for public health:a re-view[J].Environmental Pollution,2007,150(1):177-192.
[33]Tencalla F,Dietrich D.Biochemical characterization ofmicrocys-tin toxicity in rainbow trout(Oncorhynchusmykiss)[J].Toxicon, 1997,35(4):583-595.
[34]刘霞.太湖蓝藻水华中长期动态及其与相关环境因子的研究[D].武汉:华中科技大学,2012.
[35]雷汶龙.微囊藻对白鲢摄食、消化的影响及其毒性研究[D].新乡:河南师范大学,2014:5.
[36]KardinaalW E A,Janse I,Agterveld M K,etal.Microcystis geno-type succession in relation tomicrocystin concentrations in fresh-water lakes[J].Aquat Microb Ecol,2007,48:1-12.
[37]Romo S,Soria J,Fern佗ndez F,etal.Water residence time and the dynamics of toxic cyanobacteria[J].Freshwater Biology,2013,58 (3):513-522.
[38]赵起越,赵红帅,刘保献,等.直接进样-高效液相色谱-串联质谱法测定地表水中9种微囊藻毒素[J].分析化学,2015, 43(4):594-598.
[39]周伦,鱼达,余海,等.饮用水源中的微囊藻毒素与大肠癌发病的关系[J].中华预防医学杂志,2000,34(4):224-226.
Accumulation ofm icrocystins in bighead carp Aristichthys nobilis in four alga control areas of Taihu Lake in summer and autumn
GAO Ge1,ZHOU You2,WANG Xiao-lin3,SHEN Zhen-hua3,CHEN Yong-jin2,XU Dong-po2
(1.Wuxi Fisheries College,Nanjing Agricultural University,Wuxi214081,China;2.Yangtze River Downstream Fisheries Resources and Environmen-tal Science Observation Station,Ministry of Agriculture,Freshwater Fisheries Research Center,Chinese Academy of Fishery Sciences,Wuxi214081, China;3.Taihu Fishery Management Committee Office of Jiangsu Province,Suzhou 215004,China)
Juvenile bighead carp Aristichthys nobilis with body weight of about3 g were stocked into four alga con-trol areas including Zhushan bay,Moon bay,Three kingdoms city and Turtlemountain in Taihu Lake at a rate of 1.5 individuals/m2in June 2015,and microcystin(MCs)levels weremonthly determined in water and tissues of the bighead carp sampled from the four alga control areas from August2015 to November 2015 to evaluate the effect of MCs on aquatic edible products during the eruption period of cyanobacteria.Itwas found that the order of MCs accumulation in different tissues and organs of bighead carp was ranged from high to low as:muscle>hepatopancre-as>serum,the accumulation of MCs very significantly higher in muscle and hepatopancreas than that in serum(P< 0.01),and without significant difference amongmuscle,hepatopancreas and serum in different areas(P>0.05). In differentmonth,however,there was significant difference in MCs accumulation among muscle,hepatopancreas and serum(P<0.01).The accumulation of MCs inmuscle,hepatopancreas and serum was very significantly influ-enced by water temperature and the MCs level in the algae in water(P<0.01),body length showing very significant impacting on the accumulation ofMCs in hepatopancreas and serum(P<0.01).The higher level ofMCs in bighead carp was observed during the outbreak of cyanobacteria.According to the recommended daily intakes of MC-LR from WHO,the daily intake of 229.62-977.20 g for bighead carp in the four areas is suggested without human health risk.The findings provide reference with assessmentof accumulation ofMCs in bighead carp and food safety.
microcystins(MCs);Aristichthys nobilis;accumulation;Taihu Lake;water quality index
S93
A
10.16535/j.cnki.dlhyxb.2017.03.013
2095-1388(2017)03-0334-08
2016-08-22
太湖治理专项省级统筹项目(苏财建[2015]162-2)
高鸽(1993—),女,本科生。E-mail:gaoge930@163.com
徐东坡(1982—),男,副研究员。E-mail:xudp@ffrc.cn

