不同途径感染白斑综合征病毒 (WSSV)对日本沼虾的致病性
殷嵘,郭媛媛,韦章良,施定基,何培民,贾睿
不同途径感染白斑综合征病毒 (WSSV)对日本沼虾的致病性
殷嵘1,2,郭媛媛1,2,韦章良3,施定基4,何培民1,2,贾睿1,2
1 上海海洋大学海洋生态与环境学院,上海 201306 2 上海海洋大学水产与生命学院,上海 201306 3 中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室,广州 510301 4 中国科学院植物研究所,北京 100093

殷嵘, 郭媛媛, 韦章良, 等. 不同途径感染白斑综合征病毒 (WSSV) 对日本沼虾的致病性. 生物工程学报, 2017, 33(6): 946–956.Yin R, Guo YY, Wei ZL, et al. Pathogenicity of white-spot syndrome virus in Macrobrachium nipponensis via different infection routes. Chin J Biotech, 2017, 33(6): 946–956.
日本沼虾肉质鲜美、经济价值高,但其对白斑综合征病毒(White spot syndrome virus, WSSV) 的易感性尚不明确。采用流行病学调查、感染试验和荧光定量PCR (qPCR) 等方法,研究了日本沼虾对WSSV的易感性、感染发病率以及WSSV在其体内的增殖情况。结果表明:日本沼虾是WSSV的自然宿主,上海市附近省份地区120个样本的自然携带率为8.33%。日本沼虾可以通过注射、摄食、浸泡途径感染WSSV,10 d内累计感染率均为100%,累计死亡率分别为100%、75%和0%。其中注射途径感染日本沼虾,感染后5 d肌肉病毒含量达到感染后1 d的1 000倍,8 d死亡率达100%。用注射WSSV感染日本沼虾死亡率来测量病毒致死日本沼虾的半数致死剂量 (LD50),2.71×105病毒粒子/µL能使日本沼虾死亡率达到50%以上。在养殖生产中,日本沼虾可以通过摄食感染WSSV的病虾或死虾而感染WSSV,也能通过浸泡在含WSSV的水体中而感染,并因此成为一种传播媒介,从而影响了WSSV的迅速传播与致病。
日本沼虾,河虾,白斑综合征病毒,增殖,半数致死剂量
日本沼虾,俗称河虾、青虾,属于节肢动物门 (Arthropoda)、甲壳纲 (Crustacea)、十足目 (Decapoda)、长臂虾科 (Palaemonidae)、沼虾属 ()[1],是许多亚洲国家养殖的主要淡水品种之一[2-4]。我国日本沼虾养殖区主要集中于长江中下游一带[5-7],2009年产量已超过20万t,日本沼虾已经成为我国重要的淡水经济虾类[8]。我国虾类养殖品种众多,养殖效益巨大,然而近年来虾病频繁暴发,已报道的虾类疾病种类有白头病、黑鳃病和软体病等[9-12],以及暴发快危害大的病毒病如:对虾白斑综合征病毒 (White spot syndrome virus,WSSV)、桃拉综合症病毒 (Taura syndrome virus,TSV)、传染性皮下造血器官坏死病毒 (Infectious hypodermal and hematopoietic necrosis virus,IHHNV) 等[13],给虾类养殖产业造成了巨大灾难,尤其是WSSV,一旦暴发对虾几乎100%死亡,目前尚无有效药物应用。
WSSV于20世纪90年代初首先在我国台湾地区发现,WSSV在全球暴发按亚洲-美洲-欧洲-非洲的顺序,据报道25个国家发生WSSV感染[14]。1992年WSSV从我国台湾北部分离到后,已经鉴定到它可感染18种对虾、7种螯虾、7种龙虾、8种长臂虾以及39种蟹[15-17],涉及到我们常见的大部分虾蟹类水产品[18]。其中,造成经济损失最大的是对虾养殖。WSSV感染对虾后,3−10 d内其死亡率可达100%[19-20],已成为全球养虾业中蔓延最广、传播最快、死亡率最高的病毒。它感染宿主范围很广,在甲壳类和昆虫纲动物中均有其敏感的宿主[21-22]。另外有研究者[23]在浮游生物、海葵、糠虾、白虾、毛虾等动物中也检测出WSSV[24-27]。然而关于WSSV感染沼虾方面的研究却很少,虽有文献对比过罗氏沼虾、拟长腕沼虾等对白斑综合征病毒的抗性[28],但目前还鲜有关于日本沼虾是否能够感染WSSV以及感染途径、发病规律及病毒在其体内增殖的研究。
为此,本研究通过qPCR以及流行病学调查方法,初步研究了日本沼虾对WSSV的易感性、发病规律和WSSV在日本沼虾体内的增殖情况。实验结果进一步丰富了白斑综合征病毒对不同种类虾的感染,同时也揭示日本沼虾在养殖过程中是否感染WSSV及其感染过程,从而在日本沼虾感染WSSV时可以采取有效的预防措施,为日本沼虾的健康养殖提供理论基础。
1 材料与方法
1.1 野生日本沼虾体内WSSV携带率调查
实验所用野生日本沼虾收集于上海市附近省份地区,40尾/次。收集时间和日本沼虾生长阶段分别为:2015年11月,成虾阶段,雌雄比例为18∶22;2016年4月,幼体与幼虾阶段,雌性比例21∶19;2016年9月,幼虾与成虾阶段,雌雄比例为23∶17。收集后置于–40 ℃冻存,随后采用PCR方法检测WSSV,计算WSSV携带率。
1.2 材料
感染所用日本沼虾为养殖日本沼虾,购买于上海市浦东新区古棕路市场。挑选个体健壮、附肢完整的日本沼虾 (平均体长为(5.5±0.5) cm,平均体质量为(1.8±0.2) g/尾) 暂养于长宽高分别为55 cm、45 cm和20 cm的室内养殖箱中。对暂养的日本沼虾进行随机取样,经PCR检测为WSSV阴性。养殖用水为曝气2 d的自来水,水温控制在 (28±0.5) ℃,光暗比为12 h∶12 h。每日投喂饲料2次 (9:00与21:00),并及时吸除残饵和污物,每天换水1/3,24 h持续充气。
PCR及qPCR实验所用各种试剂盒均购于天根生化科技 (北京) 有限公司。病毒定量缓冲液均购于生工生物 (上海) 公司。
1.3 病毒制备与定量
1.3.1 病毒材料制备
WSSV初始悬液来自于国家海洋局第三海洋研究所,悬液由WSSV提纯方法[29]得到,浓度为2×108copies/µL。将病毒悬液按1∶100进行稀释,然后对健康克氏原螯虾进行注射感染。注射剂量为100 µL/尾[30],注射部位为第3腹节处。收集濒死克氏原螯虾,保存于–80 ℃备用。
取人工注射接种WSSV濒死的淡水克氏原螯虾3尾 (在6−7 d濒死的最佳),剥离头胸甲,去除肝胰腺,将剩余的所有组织称重;并用剪刀剪碎于预冷的缓冲液PBS (pH 7.4) 1∶10 (/) 中,然后将剪碎的组织在10 000 r/min下高速匀浆5 s,重复匀浆3次;匀浆液在4 ℃、8 000×下离心5 min,上清液先过400目筛绢,再过0.45 μm滤膜过滤除菌,滤液分装在新离心管中,全程在4 ℃或冰上进行操作。病毒粗悬液可立即使用或是分装成病毒保存液,–80 ℃冻存备用。
取上述提取病毒粗悬液对健康克氏原螯虾进行注射感染,收集大量感染病虾保存于–80 ℃作为实验病毒材料待用。感染实验前重复上述步骤,对WSSV进行活化后再使用。
1.3.2 病毒定量
取人工注射接种WSSV濒死的淡水克氏原螯虾6尾 (在6−7 d濒死的最佳) ,参照秦崇涛等[31]的病毒提纯方法,对WSSV进行纯化。提取过程中严格进行梯度离心,直至获得乳白色的WSSV悬液。然后,参照秦崇涛等定量测定WSSV悬液的方法,测定悬液的600,并参照公式:=600×6.79×108病毒粒子/µL,计算悬液WSSV浓度。
1.4 感染实验
1.4.1 注射感染
感染实验分2组,肌肉注射感染组和阴性对照各1组,每组2个重复,感染周期为10 d。将暂养4 d且摄食稳定后的日本沼虾随机分成4箱,每箱30尾。肌肉注射感染部位为腹部第3腹节处,将病毒悬液 (600=0.4) 按1∶10稀释注射病毒液50 µL/尾,注射剂量来自预实验,对照组以相同方法注射同等剂量TM缓冲液 (50 mmol/L Tris-HCl,5 mmol/L MgCl2,150 mmol/L NaCl,pH 7.4)。
1.4.2 口服 (摄食) 感染
感染实验分2组,口服感染组和阴性对照各1组,每组2个重复,感染周期为10 d。将暂养4 d且摄食稳定后的日本沼虾随机分成4箱,每箱30尾。口服感染方法为投喂WSSV感染后濒死的克氏原螯虾尾部肌肉;阴性对照组投喂WSSV阴性健康克氏原螯虾尾部肌肉。投喂前进行饥饿处理12 h,投喂当天取5尾感染克氏原螯虾,液氮下研磨并混匀,随机取5个样进行病毒含量测定,为5.6×106copies/mg,余下部分进行投喂。投喂量为体重的5%[32],每天2次,连续投喂2 d,后改为投喂普通饲料。
1.4.3 浸泡感染
浸泡感染实验分2组,浸泡感染组和阴性对照各1组,每组2个重复,感染周期为10 d。将暂养4 d且摄食稳定后的日本沼虾随机分成4箱,每箱30尾。将人工注射感染濒死的克氏原螯虾参照1.3.2中方法对WSSV进行提纯和定量。使水体中病毒达105病毒粒子/L,对日本沼虾进行浸泡攻毒4 h,阴性对照组添加同等剂量的TM缓冲溶液,然后转移到新鲜水体中进行培养观察。
1.5 养殖管理
感染后,每日投喂普通适口饵料2次,并及时吸除残饵和污物,每天换水1/3,24 h持续充气,光暗比12 h∶12 h;每天观察6次,及时去除死亡沼虾并记录。
1.6 病毒qPCR检测
根据质粒制备方法[33]制备WSSV标准品并将标准品进行梯度稀释为107、106、105、104、103拷贝数构建标准曲线,另外按照DNA提取试剂盒使用说明,从20 mg尾部肌肉提取DNA作为qPCR模板。qPCR使用引物[34]为VP28- 140Fw (5′-AGG-TGT-GGA-ACA-ACA-CAT-CAA- G-3′) 和VP28-140Rv (5′-TGC-CAA-CTT-CAT- CCT-CAT-CA-3′),长度为141 bp。qPCR反应体系为20 µL:2 µL的各DNA稀释模板,10 µL SYBR Green,0.6 µL各引物 (300 nmol/L),6.8 µL无酶水。RT-PCR反应在FTC-3000仪器上进行,反应条件为:95 ℃预变性5 min;94 ℃ 30 s,61 ℃ 30 s,72 ℃ 30 s,扩增35个循环;72 ℃延伸5 min。荧光值在延伸阶段进行采集。
1.7 病毒感染日本沼虾的半数致死剂量(LD50)
为了测定日本沼虾体内增殖WSSV对其本身的半数致死剂量 (LD50),将实验分为6个感染组,1个阴性对照组,每组2个重复,每个重复14尾虾,所用日本沼虾PCR检测为WSSV阴性。收集注射感染实验组中死亡的日本沼虾,然后对WSSV进行提纯和定量方法同上述1.3.2部分;定量后将病毒液进行连续10倍的稀释,稀释倍数为100−105;然后对感染组每组日本沼虾进行病毒注射感染,注射部位为第3腹节处,剂量为50 µL/尾,阴性对照组注射同剂量的TM缓冲液;日本沼虾的死亡率和临床症状观察周期为10 d,养殖标准同1.5部分。
1.8 数据处理
记录各组日本沼虾死亡数量,计算其死亡率并根据对照组死亡率进行校正:
死亡率校正公式[35]:=(–)/(1–)
其中为死亡率,为实测死亡率,为对照组死亡率。
2 结果与分析
2.1 野生日本沼虾WSSV检测
PCR检测结果显示 (表1),每批日本沼虾都有部分携带WSSV,自然携带率约为8.33%,这些携带WSSV的日本沼虾检测结果为阳性和弱阳性,未出现强阳性样本 (C值在20以内或电泳条带很亮)。此结果说明在自然环境中的日本沼虾能够携带WSSV,并因此使其处于潜伏感染状态。病毒携带率和携带量与该疾病的暴发密切相关。

表1 野生日本沼虾体内感染WSSV的调查
Notes: –: negative; +: weak positive; ++: positive; +++: strong positive.
2.2 日本沼虾口服感染WSSV
日本沼虾口服经WSSV感染的螯虾组织后,48 h后出现了食欲减退、活动量降低等症状,72 h内还会进行少量摄食,之后停止摄食,并出现了静卧水体、反应迟钝等症状,随后又出现了头胸部肿胀和附肢脱落等症状,但日本沼虾感染后至死亡一直未出现白斑症状。在84 h时出现了少量死亡,随后在96−120 h时出现了大量死亡,然后死亡速度迅速下降,在192 h后未出现死亡状况,10 d内总体死亡率分别为76%和80%,阴性对照组至实验结束分别死亡1尾和2尾 (图1)。通过提取死亡及未死亡日本沼虾DNA,进行PCR及电泳实验后表明未死亡日本沼虾也已经感染WSSV (图2)。实验结果表明,日本沼虾可以通过摄食感染WSSV的病虾或死虾而感染WSSV。
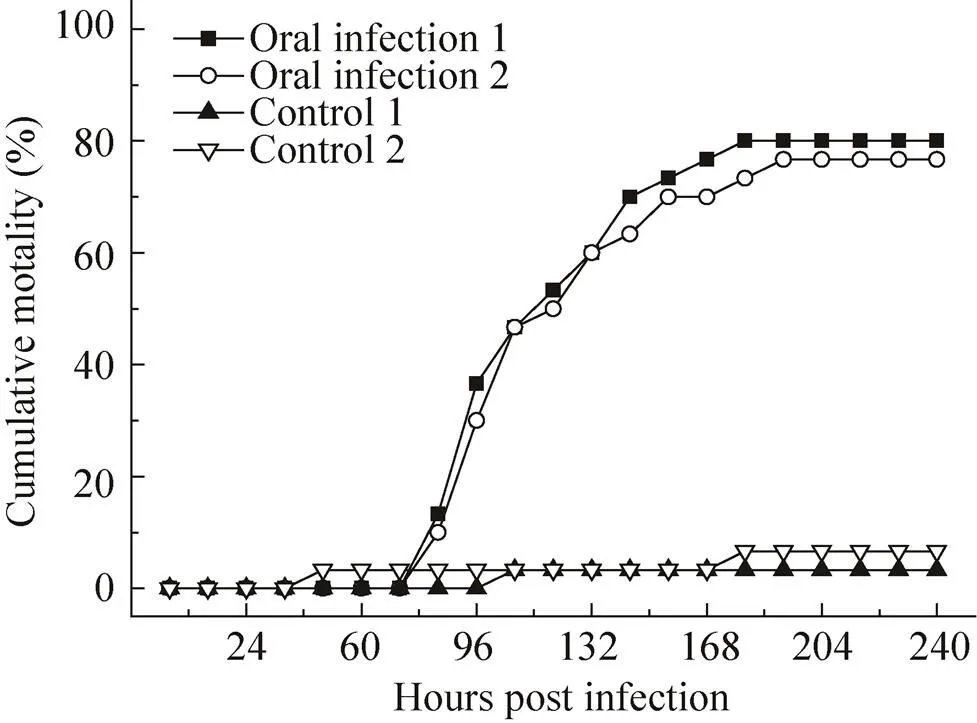
图1 口服感染WSSV后日本沼虾累计死亡数
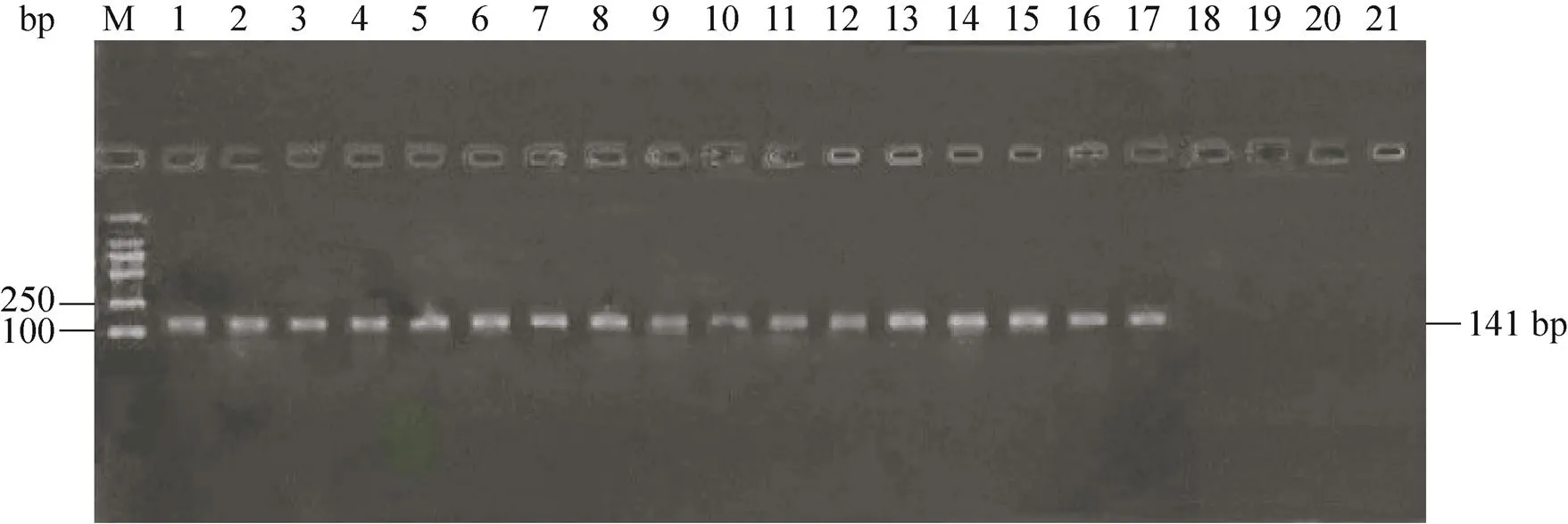
图2 口服WSSV病虾后日本沼虾WSSV检测为阳性
2.3 日本沼虾注射感染WSSV
定量注射WSSV病毒液后,24 h后日本沼虾出现了食欲减退状况,48 h后几乎不进行摄食,并出现反应迟钝、头胸部肿胀等症状,随后又出现了部分脱落症状,而且日本沼虾感染后至死亡和口服感染一样也一直未出现白斑症状。在感染48 h后出现了少量死亡,72 h时出现大量死亡,96 h时累计死亡量超过50%,随后死亡速度下降,192 h时累计死亡率为100%,另外两个阴性对照组至实验结束分别死亡2尾和4尾 (图3)。取日本沼虾的肌肉组织进行定量PCR检测发现,感染病毒24 h后肌肉组织中的WSSV含量随着时间增加急剧增加,96 h后增长减缓,120 h濒死的日本沼虾肌肉内WSSV含量是感染12 h时肌肉含量的1 000倍。研究结果表明,日本沼虾注射感染WSSV后,病毒可以在日本沼虾体内迅速增殖,并且当累计到一定量后可以导致日本沼虾发病甚至 死亡。
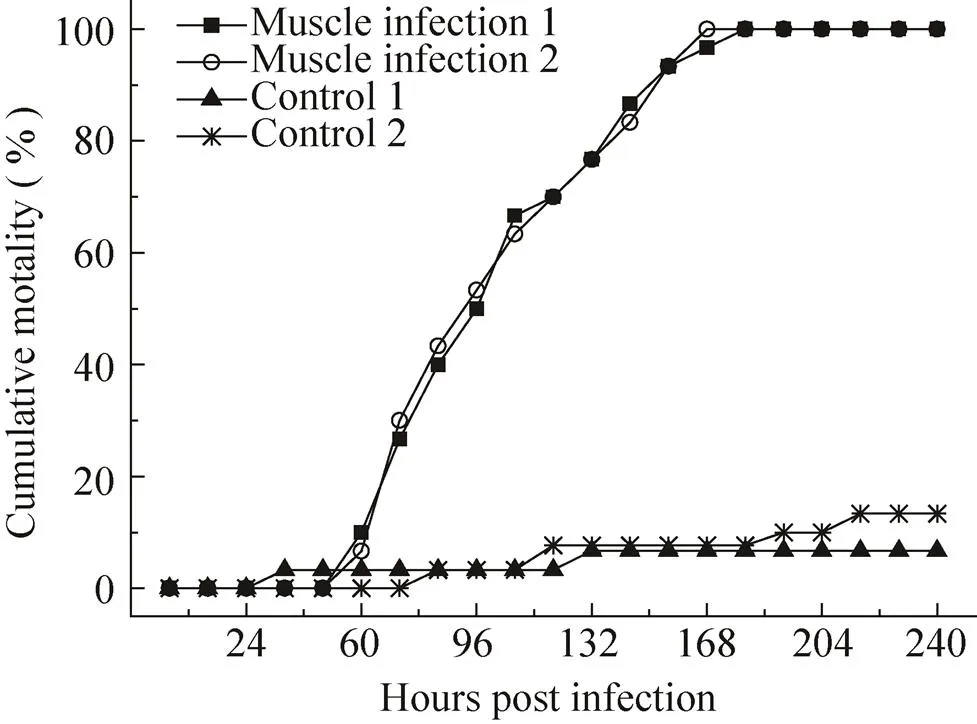
图3 注射感染WSSV后日本沼虾累计死亡数
2.4 日本沼虾浸泡感染WSSV
当用105病毒粒子/L的水体浸泡日本沼虾后,结果显示,日本沼虾在10 d的观察期中均未出现死亡状况,但均出现了食欲减退、活力降低的症状,并且其中2尾出现了静卧趴伏不动症状。10 d后,经PCR结果显示 (图4),日本沼虾虽未出现死亡,但都已感染WSSV;其中静卧趴伏不动的2尾电泳条带明显较亮 (图4中9、10泳道)。
2.5 WSSV的半数致死剂量(LD50)

图4 浸泡WSSV粒子10 d后日本沼虾WSSV检测为阳性

图5 日本沼虾注射不同WSSV稀释液后累计死亡率
3 讨论
已有研究[36]表明WSSV宿主可以通过摄食和浸泡途径感染白斑综合症,其感染的宿主十分广泛,已鉴定到它可感染40种虾、39种蟹。本研究结果表明,日本沼虾是WSSV的自然宿主,它可以通过摄食感染WSSV的病虾或死虾而使WSSV通过消化道进入血液并在其体内增殖,也能通过浸泡在含WSSV的水体中通过腮和消化道而感染。因此越来越多的宿主通过水平传播方式参与了WSSV的感染,同时由于当下海水虾蟹[37-38]的淡化养殖日益普及,将咸淡水中WSSV的宿主都并联起来,极大地增加了WSSV传播的可能性。所以,在养殖生产中要充分考虑存在的各种WSSV宿主。
本研究结果显示,口服感染组日本沼虾在摄食WSSV病虾组织后,第4天 (84 h) 时开始死亡,并且在第8天 (192 h) 时死亡率超过75%;注射感染组在注射病毒液后,第3天 (60 h) 时开始死亡,在第8天 (192 h) 时死亡率则达100%;另外,口服与注射两组各自对应的阴性对照组死亡率分别为5%和10%,说明日本沼虾可以通过摄食WSSV感染的病虾而感染,WSSV的感染和快速增殖是日本沼虾发病和死亡的决定因素。用含WSSV粒子水体浸泡日本沼虾结果显示,浸泡方式能够引起其感染,这与戴俊逸等[39]研究认为当水体WSSV浓度达到103病毒粒子/L以上时能引起对虾感染相符,但此浓度下10 d内未能导致日本沼虾死亡,这可能与水体病毒粒子浓度和感染方式有关。注射感染能使日本沼虾迅速进入急性感染状态,这也被多位研究者证明[40-41];摄食方式感染也能使日本沼虾进入急性感染状态,但进入急性感染状态的时间比注射感染推迟1 d且死亡率未达100%,浸泡感染 (105病毒粒子/L) 方式使日本沼虾进入潜伏感染状态未出现死亡状况,这3种途径引发的不同死亡率现象可能与不同感染途径引发的免疫机制和不同途径下日本沼虾对病毒的耐受能力有关。另外实验结果也显示,口服、注射及浸泡3种感染方式都未使日本沼虾出现白斑症状;注射组在第192 h时累计死亡率才达到100%,而口服感染组死亡率则未达100%,与其他虾类感染WSSV 48 h[42]头胸甲处可见白斑和96 h[43]累计死亡可达100%不符。这可能与沼虾对WSSV易感性低所致。WSSV的LD50经常用于攻毒实验中。本实验通过一系列病毒稀释液来确定日本沼虾的LD50。日本沼虾死亡率达100%稀释倍数可以用于攻毒实验[44],实验结果显示WSSV的稀释倍数从100−102时致死率为100%,而103稀释倍数时致死率为57.1%,所以推测半数致死剂量WSSV的稀释倍数为103(1.26×105病毒粒子/µL)。因此,本研究建议WSSV的102稀释倍数 (2.71×106病毒粒子/µL) 可以作为以后日本沼虾攻毒试验的病毒剂量。
目前尚无有效的药物应用于生产,主要以预防为主[45-47]。预防工作重点是针对其传播方式切断传染源,同时优化养殖环境,增强体质,提高抗病力,从而预防感染以及防止WSSV从潜伏感染转为急性暴发。WSSV的传播途径主要有2种:水平传播、垂直传播。另外本文研究以及大量研究表明[13,48]WSSV在注射、摄食、浸泡3种感染途径中,注射感染是使WSSV直接进入血液,口服是通过口腔-食道-胃途径,而浸泡感染则是通过腮-血液以及口腔-食道-胃途径。由于在自然条件下WSSV只会发生后两者的感染,即经口感染[49],因此在生产预防工作中要重点切断水平传播途径,做好监测工作。监测不但要注重食物来源的监控,同时要密切关注对水体中病毒粒子的监控,尤其后者往往会被忽略。另外在防治方面,目前有学者[50-51]从WSSV囊膜蛋白方面进行免疫防治研究,也有比较显著的防治效果。虽然现在还鲜有报导关于日本沼虾暴发白斑综合征的情况,但日本沼虾作为WSSV的天然宿主,生产中依然要做好对该病的防范工作。另外本实验结果显示发病的日本沼虾均未出现WSSV特有的白斑症状,所以研究结果提醒在生产中判断日本沼虾是否感染WSSV需以科学的手段检测,如果单凭白斑来判断,则可能给生产带来巨大损失。
[1] Zhang QY, Cheng QQ, Guan WB. Mitochondrial COI gene sequence variation and taxonomic status of threespecies. Zool Res, 2009, 30(6): 613–619.
[2] Hong YJ, Hu CY, Guan SF. Preliminary investigation onPoyang Lake resources. Res Fish, 2003, 23(3): 38–39 (in Chinese).洪一江, 胡成钰, 官少飞. 鄱阳湖沼虾资源的初步调查. 水利渔业, 2003, 23(3): 38–39.
[3] Huang YL. China’s shrimp aquaculture overview. Res Fish, 2003, 23(1): 1–3 (in Chinese).黄玉玲. 我国虾类淡水养殖概述. 水利渔业, 2003, 23(1): 1–3.
[4] Kong YQ. Japanese prawn () physiology of juveniles of copper in health[D]. Shanghai: E Chin Normal Univ, 2014 (in Chinese).孔有琴. 日本沼虾 () 幼虾的铜营养生理研究[D]. 上海: 华东师范大学, 2014.
[5] Li CC, Li Y, Xie QM, et al. Studies on the largest sustainable yield ofand its exploitation. Jiangxi Sci, 1990, 8(4): 28–33 (in Chinese).李长春, 李云, 谢钦铭, 等. 鄱阳湖虾类资源最大持续产量及其开发利用的研究. 江西科学, 1990, 8(4): 28–33.
生物学学科核心素养是高中生物学新课标的基本宗旨与培养目标,它集中体现了生物学学科的育人价值和实践取向,是学生在生物学知识的学习过程中,逐渐形成的正确价值观念、必备品格和关键能力。然而,生物学知识并不是一座“符号”的孤岛,它产生于特定的历史背景和社会情境,与个体和种系的实践经验相关联,依存于生物学学科的逻辑体系之中。这就为开展关联性教学奠定了基础,也为发展和培育生物学核心素养创造了条件。关联性教学注重与学生的社会生活经验的联系,强调新旧知识间的衔接,倡导在生命科学史的背景中体悟科学方法和精神,在跨学科的协同探究中培养科学思维和探究能力。
[6] Shi WG, Yan XM, Bing XW. Studies on biology and diet of Taihu Lake prawns. J Lake Sci, 1995, 7(1): 69–76 (in Chinese).施炜钢, 严小梅, 邴旭文. 太湖秀丽白虾生物学与食性的研究. 湖泊科学, 1995, 7(1): 69–76.
[7] Jiang H, Xiao KY, He YL, et al. A preliminary survey of Hunan Yuanjiang southern Dongting Lake shrimp and crab resources. Res Fish, 2006, 26(5): 72–73 (in Chinese).江辉, 肖克宇, 何燕林, 等. 湖南沅江南洞庭湖虾蟹资源的初步调查. 水利渔业, 2006, 26(5): 72–73.
[8] Fishery Bureau of Ministry of Agriculture. China fishery yearbook. Beijing: Chin Agric Press, 2010: 37 (in Chinese).农业部渔业局. 中国渔业年鉴. 北京: 中国农业出版社, 2010: 37.
[9] Xu Y, Shen JY, Yao JY, et al. Studies on pathogen of main diseases ofi in the Yangtze River Delta. Freshwater Fish, 2012(5): 27–32 (in Chinese).徐洋, 沈锦玉, 姚嘉赟, 等. 长三角地区罗氏沼虾成虾主要疾病的病原研究. 淡水渔业, 2012(5): 27–32.
[10] Deng YH, Xiong GG, Zhou ZY, et al.prevention and treatment of common diseases and technology. Jiangxi Fish Sci Technol, 2002(2): 44–45 (in Chinese).邓勇辉, 熊国根, 周智勇, 等. 罗氏沼虾常见病及其防治技术. 江西水产科技, 2002(2): 44–45.
[11] Wu HX, Xue JZ, Tang LY. Pathologicalblack branchiae disease study. Bull Sci Technol, 2002(1): 73–75 (in Chinese).吴惠仙, 薛俊增, 唐柳娅. 日本沼虾黑鳃病的组织病理学研究. 科技通报, 2002(1): 73–75.
[12] Kang L.drop star disease symptoms and prevention and control measures. Chin Fish Rep, 2015-08-24B02 (in Chinese).康乐. 罗氏沼虾滴星病症状及防治措施. 中国渔业报, 2015-08-24B02.
[13] Dai JY. Study on the invasion routes of white spot syndrome virus (WSSV) into shrimp [D]. Xiamen: Third Inst Oceanogr, State Oceanic Adm, 2012 (in Chinese).戴俊逸. 白斑综合症病毒 (WSSV) 侵染对虾途径的研究[D]. 厦门: 国家海洋局第三海洋研究所, 2012.
[14] Lightner DV. A hand book of shrimp pathology and diagnostic procedures for disease of cultured penaeid shrimp. Baton Rouge: Louisiana State Univ Press, 1996.
[15] Corbel V, Zuprisal Z, Shi Z, et al. Experimental infection of European crustaceans with white spot syndrome virus (WSSV). J Fish Dis, 2001, 24(7): 377–382.
[16] Lo CF, Ho CH, Peng SE, et al. White spot syndrome baculovirus (WSBV) detected in cultured and captured shrimp, crabs and other arthropods. Dis Aquat Org, 1996, 27(3): 215–225.
[17] Escobedo-Bonilla CM, Alday-Sanz V, Wille M, et al. A review on the morphology, molecular characterization, morphogenesis and pathogenesis of white spot syndrome virus. J Fish Dis, 2008, 31(1): 1–18.
[18] Lei ZW, Huang J, Shi CY, et al. White spot syndrome virus (WSSV) of the host. Oceanol Limnol Sin, 2002, 3(3): 250–258 (in Chinese).雷质文, 黄倢, 史成银, 等. 白斑综合症病毒 (WSSV) 的宿主调查. 海洋与湖沼, 2002, 33(3): 250–258.
[19] Lo CF, Ho CH, Peng SE, et al. White spot syndrome baculovirus (WSBV) detected in cultured and captured shrimp, crabs and other arthropods. Dis Aquat Organ, 1996, 27(3): 215–225.
[20] Nakano H, Koube H. Mass mortalities of cultured Kuruma shrimp,, in Japan in 1993: epizootiological survey and infection trials. Fish Pathol, 1994, 29(2): 135–139.
[21] Soowannayan C, Phanthura M. Horizontal transmission of white spot syndrome virus (WSSV) between red claw crayfish () and the giant tiger shrimp (). Aquaculture, 2011, 319(1/2): 5–10.
[22] Rajendran KV, Vijayan KK, Santiago TC, et al. Experimental host range and histopathology of white spot syndrome virus (WSSV) infection in shrimp, prawns, crabs and lobsters from India. J Fish Dis, 1999, 22(3): 183–191.
[23] Huang J, Yu J, Wang XH, et al. Detection of monoclonal antibody ELISA technique for hypodermal and hematopoietic necrosis disease pathogeny. Mar Fish Res, 1995, 16(1): 40–50 (in Chinese).黄倢, 于佳, 王秀华, 等. 单克隆抗体酶联免疫技术检测对虾皮下及造血器官组织坏死病的病及其传播途径. 海洋水产研究, 1995, 16(1): 40–50.
[24] He JG, Zhou HM, Yao B, et al. Infection route and host species of white spot syndrome baculovirus. J Sun Yat-sen Univ: Nat Sci Ed, 1999, 38(2): 65–69 (in Chinese).何建国, 周化民, 姚伯, 等. 白斑综合症杆状病毒的感染途径和宿主种类. 中山大学学报: 自然科学版, 1999, 38(2): 65–69.
[25] Sahul Hameed AS, Yoganandhan K, Sathish S, et al. white spot syndrome virus (WSSV) in two species of freshwater crabs (and). Aquaculture, 2001, 201(3/4): 179–186.
[26] Wang YC, Lo CF, Chang PS, et al. Experimental infection of white spot baculovirus in some cultured and wild decapods in Taiwan. Aquaculture, 1998, 164(1/4): 221–231.
[27] Chang PS, Chen HC, Wang YC. Detection of white spot syndrome associated baculovirus in experimentally infected wild shrimp, crab and lobsters by in situ hybridization. Aquaculture, 1998, 164(1/4): 233–242.
[28] Sahul Hameed AS, Murthi BLM, Rasheed M, et al. An investigation of Artemia as a possible vector for white spot syndrome virus (WSSV) transmission to. Aquaculture, 2002, 204(1/2): 1–10.
[29] Xie XX, Li HY, Xu XM, et al. A simple and efficient method for purification of intact white spot syndrome virus syndrome virus (WSSV) viral particles. Virus Res, 2005, 108(1/2): 63–67.
[30] Sun Y, Li F, Xiang J. Analysis on the dynamic changes of the amount of WSSV in Chinese shrimpduring infection. Aquaculture, 2013, s376–379(6): 124–132.
[31] Qin CT, Yang F. A simple and rapid method for the determination of white spot syndrome virus in Chinese white shrimp. Chin Agric Sci Bull, 2014, 30(20): 30–34 (in Chinese).秦崇涛, 杨丰. 一种简单快速测定对虾白斑综合症病毒浓度方法的建立. 中国农学通报, 2014, 30(20): 30–34.
[32] Brett F, Edgerton. Susceptibility of the Australian freshwater crayfish Cherax destructor albidus to white spot syndrome virus (WSSV). Dis Aquat Org, 2004, 59(3): 187–193.
[33] Cheng XY, Liu QH, Huang J. Real time fluorescence quantitative PCR detection of white spot syndrome virus. Anhui Agric Sci, 2010, 38 (26): 14265–14267 (in Chinese).程晓艳, 刘庆慧, 黄倢. 实时荧光定量PCR检测对虾白斑综合症病毒方法的建立. 安徽农业科学, 2010, 38(26): 14265–14267.
[34] Mendoza-Cano F, Sanchez-Paz A. Development and validation of a quantitative real-time polymerase chain assay for universal detection of the white spot syndrome virus in marine crustaceans. Virol J, 2013, 10(1): 186.
[35] Sun RY. Quantitative Pharmacology. Beijing: People’s Med Publ House, 1987: 184–208 (in Chinese).孙瑞元. 定量药理学. 北京:人民卫生出版社, 1987: 184–208.
[36] Chou HY, Huang CY, Kou GH, et al. Studies on transmission of white spot syndrome associated baculovirus (WSBV) inandvia waterborne contact and oral ingestion. Aquaculture, 1998, 16(1/4): 263–276.
[37] Zheng SJ. Study on water quality regularity ofin desalination culture[D]. Qingdao: Ocean University of China, 2006 (in Chinese).郑善坚. 凡纳滨对虾淡化养殖水质规律研究[D]. 青岛: 中国海洋大学, 2006.
[38] Liu CL, Hu F. Serrata desalination culture test. Sci Fish, 2005(7): 29 (in Chinese).刘春玲, 胡方. 锯缘青蟹淡化养殖试验. 科学养鱼, 2005(7): 29.
[39] Dai JY, Li WT, Yang F. Studies on the invasion routes of white spot syndrome virus (WSSV) into shrimp and virus titer. J Appl Oceanogra, 2013, 32(1): 67–72 (in Chinese).戴俊逸, 李文婷, 杨丰. 白斑综合症病毒(WSSV) 感染对虾的途径及滴度研究. 应用海洋学学报, 2013, 32(1): 67–72.
[40] Phuoc LH, Corteel M, Thanh NC, et al. Effect of dose and challenge routes ofspp. on coinfection with white spot syndrome virus in. Aquaculture, 2009, 290(1/2): 61–68.
[41] Zhu F, Quan HZ. A new method for quantifying white spot syndrome virus: Experimental challenge dose using TaqMan real-time PCR assay. J Virol Methods, 2012, 184(1/2): 121–124.
[42] Dai JY. White spot syndrome virus (WSSV) infection of shrimp pathway[D]. Xiamen: Third Institute of Oceanography, State Oceanic Administration, 2012 (in Chinese).戴俊逸. 白斑综合症病毒 (WSSV) 侵染对虾途径的研究[D]. 厦门: 国家海洋局第三海洋研究所, 2012.
[43] Zhang L, Tang XQ, Sheng XZ, et al. Analysis on dynamic changes of WSSV amount inthrough Quantitative Real-time PCR. Chin Anim Health Insp, 2015(6): 69–74 (in Chinese).张玲, 唐小千, 绳秀珍, 等. 实时荧光定量PCR检测克氏原螯虾体内白斑症病毒(WSSV) 的动态变化. 中国动物检疫, 2015(6): 69–74.
[44] Prior S, Browdy CL, Shepard EF, et al. Controlled bioassay systems for determination of lethal infective doses of tissue homogenates containing Taura syndrome or white spot syndrome virus. Dis Aquat Organ, 2003, 54: 89–96.
[45] Zhang MY. The pathogenesis and prevention of white spot syndrome in shrimp. J Aquac, 2013(2): 55 (in Chinese).张忙友. 对虾白斑综合症的发病规律及防治方法. 水产养殖, 2013(2): 55.
[46] Wu JW. Study on prevention and treatment of white spot syndrome of. Agric Jilin, 2011(3): 259 (in Chinese).吴俊文. 南美白对虾白斑综合症防治技术探讨. 吉林农业, 2011(3): 259.
[47] Xie KL. How to control the white spot syndrome of crawfish? Fish Guide to be Rich, 2016(14): 50–51 (in Chinese).谢康乐. 怎样防治小龙虾白斑综合症? 渔业致富指南, 2016(14): 50–51.
[48] Di Leonardo VA, Bonnichon V, Roch P, et al. Comparative WSSV infection routes in the shrimp generaand. J Fish Dis, 2005, 28(9): 565–569.
[49] Deng D, Liu P, Kong J. Medium mediators in the transmission of WSSV virus disease. Prog Fish Sci, 2004, 25(5): 35–41 (in Chinese).
[50] 邓灯, 刘萍, 孔杰. 卤虫在WSSV病毒病传播中的媒介作用. 渔业科学进展. 2004, 25(5): 35–41.
[51] Kulkarni A, Rombout JH, Singh IS, et al. Truncated VP28 as oral vaccine candidate against WSSV infection in shrimp: an uptake and processing study in the midgut of. Fish Shellfish Immunol, 2013, 34(1): 159–166.
[52] Valdez A, Yepiz-Plascencia G, Ricca E, et al. FirstWSSV 100% oral vaccination protection using CotC: Vp26 fusion protein displayed onspores surface. J Appl Microbiol, 2014, 117(2): 347–357.
(本文责编 陈宏宇)
Pathogenicity of white-spot syndrome virus invia different infection routes
Rong Yin1, 2, Yuanyuan Guo1, 2, Zhangliang Wei3, Dingji Shi4, Peimin He1, 2, and Rui Jia1, 2
1,,201306,2,201306,3,,,510301,,Institute of BotanyChinese Academy of SciencesBeijingChina
is delicious and has high economic value, but its susceptibility to white-spot syndrome virus (WSSV) is unknown. Susceptibility, morbidity, and multiplication of WSSV in.were studied by epidemiological survey, infection experiment and qPCR..was the natural host of WSSV, and the natural carrying rate was about 8.33%..could be infected with WSSV via oral administration, muscle injection and immersion, and the cumulative infection rate of 10 d exposure was 100%, and the cumulative mortality rates were 100%, 75% and 0%, respectively. The infection of WSSV is fast by muscle injection. The virus content after 5 day’s injection is 1 000 times higher than that of the first day of infection, and the mortality rate reached 100% after 8 days. The median lethal dose (LD50) measured as the mortality of infected.via injection indicated the LD50in the concentration ofWSSV of 2.71×105virions/µL. In shrimp farming,.can be infected by ingesting WSSV infected shrimp or dead shrimp, and also by soaking in WSSV-containing water and thus become a vector, consequently affecting the spread and pathogenicity of WSSV.
, river prawn, white spot syndrome virus (WSSV), proliferation, median lethal dose
10.13345/j.cjb.170005
January 6, 2017; Accepted:March 23, 2017
Rui Jia. Tel: +86-21-61900449; E-mail: rjia@shou.edu.cn
Supported by:National High Technology Research and Development Program of China (863 Program) (No. 2014AA093506), Shanghai Science and Technology Committee (No. 16391903500).
国家高技术研究发展计划 (863计划) (No. 2014AA093506),上海市科委项目 (No. 16391903500) 资助。
网络出版时间:2017-04-18
http://kns.cnki.net/kcms/detail/11.1998.Q.20170418.1111.002.html

