柱后衍生—HPLC测定与分析沉香中黄曲霉毒素
唐健新+区桂姗+苏章轩+徐万帮+梁生旺
【摘要】目的:对沉香中黄曲霉毒素进行测定。方法:采用柱后衍生-HPLC联用技术,测定沉香中黄曲霉毒素的含量,了解所获沉香中黄曲霉毒素污染情况。结果:按照《中国药典》2015版的要求与指导原则, 69批次沉香样品均未检出黄曲霉毒素。结论:柱后衍生-HPLC联用技术测定沉香中黄曲霉毒素方法可行,我国沉香黄曲霉毒素未受到黄曲霉毒素污染。
【关键词】沉香;黄曲霉;柱后衍生-HPLC
【中图分类号】R284.1【文献标志码】 A【文章编号】1007-8517(2017)11-0031-05
黄曲霉毒素是真菌毒素中毒性最强的一种真菌毒素,具有极强的毒性和致癌性。在自然界中,无论是土壤、腐烂有机质物品与植物纤维、农产品或者其他食品上都有黄曲霉毒素存在。黄曲霉最适宜生存在相对湿度 85%左右的热带、亚热带地区并产生黄曲霉毒素。我国地域十分辽阔以及气候的多样性和复杂性导致我国中药材和中药饮片在加工、贮藏、运输的过程中,很容易发生霉变而导致被黄曲霉毒素污染。因此,检测中药材中黄曲霉毒素具有极其重要的意义[1-4]。
目前2015版《中国药典》仅仅对少数几种中药材规定有关黄曲霉毒素含量的限度标准,如陈皮,胖大海等。沉香是我国的名贵中药材之一,2016年广东省通过立法保护广东八种道地中药材,沉香为其中之一。由于沉香主产越南、海南和广东等热带和亚热带地区,该地区的环境条件极易被黄曲霉等真菌类污染而产生黄曲霉毒素。因此,笔者拟采用柱后衍生与高效液相色谱联用技术[5-8],通过对沉香进行黄曲霉毒素测定,建立沉香中黄曲霉毒素含量测定的方法,为监管部门提供技术支持。
1仪器与材料
11仪器Waters 2695/2475高效液相色谱仪及柱后衍生系统;色谱柱:Shim-pack CLC-ODS C18(150mm×6mm,5μm)、phenomenex gemini C18(250mm×46mm,5μm)、Thermo ODS-2 HYERSIL(200mm×46mm,5μm)、Agilent Zorbax SB-C18(250mm×46mm,5μm); 离心机:Thermo Scientific Multifuge X1R
12材料黄曲霉素混合对照品(批号:46304-U LB8422,B1、B2、G1、G2纯度分别为990%、990%、997%、995% ,Supelco Analitical)。甲醇、乙腈均为色谱纯;水为试验室自制去离子水。005%碘溶液:取05g碘,溶解在100mL甲醇中,用水稀释至1000mL(现配现用)。样品:69批沉香样品,来源于国家评价性抽验,所有样品均经过本单位教授鉴定。
2方法与结果
21色谱条件以甲醇-乙腈-水(22∶18∶60)为流动相,流速为10mL/min;衍生溶液为005%的碘溶液,衍生化泵流速03mL/min,衍生化温度70℃。荧光检测器激发波长360nm,发射波长450nm。供试品溶液进样量50μL。
22样品的制备
221對照品溶液的制备精密量取黄曲霉素混合对照品(B1、B2、G1、G2浓度分别为10μg/mL、03μg/mL、10μg/mL、03μg/mL)05mL,用甲醇定容至10mL,作为储备液。精密量取储备液1mL,用70%甲醇定容至25mL,摇匀,即得。
222供试品溶液的制备取沉香药材粉末2份,每份10g,于锥形瓶中,精密称定,加入氯化钠3g,精密加入70%甲醇75mL,超声20min,离心5min(10000rpm),精密量取上清液15mL,于50mL量瓶中,用水稀释至刻度,摇匀。离心5min(10000rpm),用045μm孔径的滤膜过滤,精密量取续滤液20mL,通过免疫亲和层析柱,流速2d/s,用20mL水分2次洗脱,弃去洗脱液,并通过约2mL空气。用15mL甲醇分次洗脱,收集洗脱液,置2mL量瓶中,用水稀释至刻度,摇匀。
223回收溶液的制备取沉香药材粉末6份(批号:120921YF03),每份10g,于锥形瓶中,精密称定,加入02mL黄曲霉素混合对照品储备液(B1、B2、G1、G2浓度分别为00495μg/mL、001485μg/mL、004985μg/mL、0014925μg/mL)外,其余同试验供试品溶液的制备方法。
224空白溶液的制备精密量取2份经检验无黄曲霉毒素的沉香样品,每份10g,于锥形瓶中,其余同试验供试品溶液的制备方法,制备空白溶液。
225测定按2015版《中国药典》四部中,黄曲霉毒素测定法项下所述内容进行操作和检测。
23方法学验证
231加样回收率试验根据《中国药典》四部有关要求可知:
y回收率=测得量-样品中本底含量对照品加入量×100%
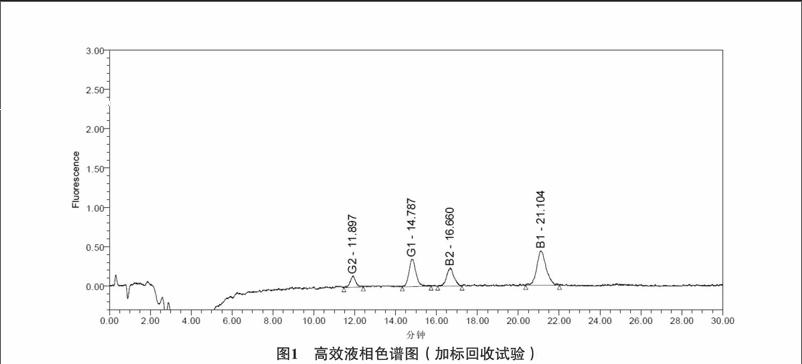
试验将133中所获得的回收溶液注入高效液相色谱仪,记录色谱图,根据标准曲线法获得沉香中黄曲霉毒素加样回收率。如图1所示。
从表1可知,黄曲霉毒素B1、G1回收率在70%~110%之间,黄曲霉毒素B2、G2回收率在75%~110%之间,符合2015版《中国药典》四部中黄曲霉毒素测定法项下规定的要求。
232精密度以混合对照黄曲霉毒素B1、B2、G1、G2溶液为参照指标,对其进行精密度考察,精密吸取对照品溶液25μL,注入液相色谱仪,重复测定6次,即得。结果见表2。
从表2可知,黄曲霉毒素B1、B2、G1、G2在上述色谱条件下精密度良好,相关的RSD为分别为101%、087%、109%和092%,符合2015版《中国药典》四部中黄曲霉毒素测定法项下规定的要求。
233专属性考察以制备的空白溶液为参照指标,对其进行专属性考察,分别精密吸取空白溶液、对照品溶液和样品溶液25μL,注入液相色谱仪,记录色谱图。如图2~4所示。
从图2~4可知,黄曲霉毒素B1、B2、G1、G2在上述色谱条件下空白无干扰,四种有效成分的分离度良好符合2015版《中国药典》四部中黄曲霉毒素测定法项下规定的要求。
234线性关系采用逐步稀释法,获取系列不同浓度的黄曲霉毒素B1、B2、G1、G2的混合对照溶液25μL,分别注入液相色谱仪,记录色谱图。根据色谱峰面积和相应的稀释倍数(浓度),根据waters高效液相色谱仪自带的处理程序,获得相应的线性关系。见表3。
从表3可知,黄曲霉毒素B1、B2、G1、G2在指定的浓度范围内,线性关系良好,相关系数均大于099,符合2015版《中国药典》四部中黄曲霉毒素测定法项下规定的要求。
24耐用性的考察
241不同色谱柱的考察由于在测定的沉香样品中没有发现阳性样品,故采用对照溶液对不同色谱柱进行考察。照含量测定项下方法操作,采用四根不同规格的色谱柱测定对照溶液中黄曲霉毒素B1、B2、G1、G2的含量,为了更好的体现色谱柱的性能比较,本次试验以黄曲霉毒素B1为代表,分别从测定的含量、理论塔板数、分离度以及对称因子四个方面对色谱柱进行比较,结果见表4。
可知,四根不同的色谱柱均能有效分离与准确测定黄曲霉毒素B1。说明该方法的色谱柱要求不高,大部分色谱柱均能满足对沉香样品中黄曲霉毒素的测定。
242稳定性试验取精密吸取黄曲霉毒素B1浓度为00198μg/mL的对照溶液25μL注入液相色谱仪,分别在0、8、13、18、25、30小时测定其含量,结果表明,样品在30h内稳定。
243方法检出限取对照品溶液(黄曲霉毒素B1浓度为000198μg/mL),采用逐步稀释法,并将逐步稀释后的溶液,精密量取25μL注入色谱仪,记录色谱图。如图5所示。
试验以黄曲霉毒素B1的值为基准,用仪器自带的计算软件,当黄曲霉毒素B1信噪比约33:1,以此计算方法检出限,符合仪器分析中仪器检测限的相关要求。此时,以黄曲霉毒素B1计,沉香中黄曲霉毒素的检测限约为02μg/kg。
25样品中黄曲霉毒素含量测定采用上述方法,分别对所有69批次的沉香样品进行黄曲霉毒素B1、B2、G1、G2的含量测定,结果均没有发现沉香样品被黄曲霉毒素污染。
3结论
建立柱后衍生法测定沉香中黄曲霉毒素的方法,并对其进行方法学验证,结果该表明方法良好。分别对所获得的69批沉香样品进行黄曲霉毒素B1、B2、G1、G2的含量测定,均没有发现沉香样品被黄曲霉毒素污染,说明我国沉香药材受到黄曲霉毒素污染的风险较小。
参考文献
[1]Congcong Ran, Dan Chen, Haiyan Ma, et al.Graphene oxide adsorbent based dispersive solid phase extraction coupled with multi-pretreatment clean-up for analysis of trace aflatoxins in traditional proprietary Chinese?medicines[J]. Journal of Chromatography B, 2017,s1044-1045:120-126.
[2]Lili Wang, Weijun Kong, Meihua Yang, et al.Safety issues and new rapid detection methods in traditional Chinese medicinal materials[J].Acta Pharmaceutica Sinica B,2015, 5(1): 38-46.
[3]Wu J C, Hseu Y C, Chen C H, et al. Comparative investigations of genotoxic activity of five nitriles in the comet assay and the Ames test [J]. J Hazard Mater. 2009(169): 492-497.
[4]Siu-Po Ip, Chun-Tao Che.Determination of aflatoxins in Chinese medicinal herbs by high-performance liquid chromatography using immunoaffinity column cleanup: Improvement of recovery[J].Journal of Chromatography A,2006, 1135 (2):241-244.
[5]Recep L, Dilek A, Yasin E, Muhsin K. Testing of the mutagenicity and genotoxicity of metolcarb by using both Ames/Salmonella and Allium test [J]. Chemosphere, 2010, 80(9): 1056-1061.
[6]Arimoto-Kobayashi S, Kayoko S, Masaki M, et al. UVA activation of N-dialkylnitrosamines releasing nitric oxide, producing strand breaks as well as oxidative damages in DNA, and inducing mutations in the Ames test [J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis, 2010, 691(1/2): 47-54.
[7]L.K. Lee, K.Y. Foo.Recent advances on the beneficial use and health implications of Pu-Erh tea[J].Food Research International,2013(53):619-628.
[8]Cancer I AFO. Some naturally occurring substances: food items and constituents, heterocyclic aromatic amines and mycotoxins. [J]. Carcinógenos ,1993.
(收稿日期:2017-03-24編辑:梁志庆)

