牛磺酸与抗生素复合剂对猪精液常温保存效果的影响
谢东淇,刘 琦,苏泽智,卫帅毅,梅军四,王 健,万 露,杨公社,胡建宏
(西北农林科技大学 动物科技学院,陕西杨凌 712100)
牛磺酸与抗生素复合剂对猪精液常温保存效果的影响
谢东淇,刘 琦,苏泽智,卫帅毅,梅军四,王 健,万 露,杨公社,胡建宏
(西北农林科技大学 动物科技学院,陕西杨凌 712100)
牛磺酸(Tau)具有良好的抗氧化性,为研究Tau与抗生素联合使用对猪精液常温保存效果的影响,以不含抗生素Modena稀释液为对照基础液设计3组试验,设Modena稀释液+ 庆大霉素(2×105IU)+复方新诺明(2.5×104IU)为处理 1,Modena基础液上分别添加0.5、1、5和10 mmol/L的Tau 为处理 2,处理 1配伍处理 2则为处理 3,每24 h检测精子活率、顶体完整率、丙二醛(MDA)浓度以及总抗氧化能力(T-AOC),分析Tau与抗生素复合剂对猪精液常温保存效果的影响。结果表明,处理3效果最好,处理 2 次之,处理 1最差,各处理间差异显著,当处理 3中Tau的添加量为5 mmol/L时,猪精液保存5 d后,精子活率为64.11%,顶体完整率为72.10%,T-AOC活性和MDA浓度分别为4.76 U/mL和1.42 nmol/mL。因此,Tau与抗生素复合剂可以提高猪精液的常温保存效果,最适添加浓度为5 mmol/L。
牛磺酸;抗生素;猪精液;常温保存
猪精液常温液态保存与冷冻精液相比,具有输精后母猪繁殖成绩好(受胎率、分娩率和窝产仔数高)、所需费用低、操作程序简单等优点;从精液的保存效果考虑,常温液态保存的精液更有利于猪的繁殖,能够产生更大的经济效益[1]。近年来,有关猪精液常温保存稀释粉的研究不断取得新进展,但是相关技术仍然不成熟[2],有待完善。
牛磺酸(taurine,Tau)是一种含巯基氨基酸,主要为中枢神经系统提供营养,与胚胎发育、提高视力和保护肝脏等有关。有研究[3]表明,牛磺酸可通过双向调节细胞膜上Ca2+,调节细胞膜对阳离子的通透性,保护膜上磷脂层完整性,降低细胞内氧自由基水平,增强抗氧化酶活性,对细胞起保护作用,所以Tau不仅具有保护细胞质膜通透性、维持渗透压、消除自由基的作用,也能够保护细胞膜完整率。抗氧化剂在猪精液保存方面起到清除自由基、防止精子氧化损伤的作用,但目前对于Tau的抗氧化研究主要在羊和犬的精液冷冻保护[4-5],而对于猪精液常温保存尤其是与抗生素联合使用方面鲜有报道,本研究通过检测精子活率、顶体完整率、T-AOC和MDA指标,分析Tau与抗生素联合使用对猪精液常温保存效果的影响。
1 材料与方法
1.1 试验材料
牛磺酸(w≥98%)购自上海源叶生物技术有限公司,硫酸庆大霉素(针剂型,5 mL/支,8×104IU)由陕西必康制药有限公司生产;复方新诺明(粉剂,25 g/100 g,20×105IU),上海骑骠动物保健品公司。
1.2 精液的采集
试验精液来源于武功县山佳种猪场 20 月龄健康成年杜洛克种公猪,通过手握法采精,收集中段富含精子部分,过滤后保存于保温杯中,迅速带回实验室。选取色泽和气味正常、精子活率在80%以上、密度为3×108~5×108mL-1的精液,备用。
1.3 精液稀释与保存
将合格精液分成 3 组,稀释液配置:对照组为Modena基础液,处理 1 在Modena基础液中加入庆大霉素(2×105IU)和复方新诺明(2.5×104IU),处理 2 在Modena基础液的基础上加入不同浓度Tau,处理 3 为处理 1 和处理 2 的配伍,待精液温度与稀释液温度一致时,对 3 个处理分别进行1∶5倍数稀释,再将其包裹于 5 层干毛巾内,待其逐渐降温至室温后放入 17 ℃ 恒温箱,每 12 h轻微翻转精液 1 次,防止精子沉淀。
1.4 测定指标
每隔 24 h检测 1 次各指标,每个指标重复 3 次。
1.4.1 精子活率 检测前轻微翻动精液瓶,使沉淀精子混匀,采用 1 000 μL移液枪吸取 1 mL精液于 2 mL离心管中,再将离心管置于 17 ℃水浴锅缓慢升温至 37 ℃后水浴 1 min,吸取 10 μL精液于 37 ℃恒温加热板的载玻片上,盖好盖玻片后 40 倍显微镜观察 5 个视野下精子直线运动情况,记录数据。
1.4.2 顶体完整率、T-AOC与MDA浓度 试验操作分别遵照南京建成生物工程研究所所售精子快速染色试剂盒、总抗氧化能力(T-AOC)试剂盒与丙二醛(MDA)试剂盒的操作说明。
1.4.3 有效存活时间 以精子活率≥60%的最长保存时间为准。
1.5 数据分析
所有试验数据用SPSS 19.0软件进行方差分析(One-way ANOVA),用Duncan’s多重比较分析差异显著性。数据用“平均数±标准差”表示。
2 结果与分析2.1 不同处理对猪精液常温保存精子活率的影响
由表 1 可知,当精液保存 5 d后,处理 3 中精子活率均大于处理 1 和2,但组内差异不显著(P>0.05);从图 1 可以看出,处理 3 中,随着Tau的添加量增加,5 d内精子活率呈现先升高后降低的不规律变化,当Tau的添加量为 5 mmol/L时,其精子活率显著高于其他组(P<0.05),效果最佳。
2.2 不同处理对猪精液常温保存精子顶体完整率的影响
由表 2 可知,当保存 3 d后,相同浓度下处理 3 精子顶体完整率大于其他 2 个处理,差异不显著(P>0.05);从图 2可以看出,处理 3 中Tau添加量为 1和 5 mmol/L时,Tau能有效提高精子顶体完整率,其中添加量为 5 mmol/L时效果最好。
2.3 不同处理对猪精液常温保存精液T-AOC浓度的影响
由图 3 可知,随着Tau添加量逐渐增大,T-AOC活性先显著增大(P<0.05),后急剧下降(P<0.05),添加量为0.5、1、5 mmol/L的处理 3 以及添加量为1、5 mmol/L的处理 2 T-AOC活性均显著高于不含Tau的处理 1(P<0.05),其中 5 mmol/L Tau的效果最佳(P<0.01),而同时添加抗生素和Tau的处理 3 效果显著优于单独添加Tau的处理 2(P<0.05),添加 10 mmol/L的处理组效果最差。

表1 不同处理组常温保存后的猪精子活率Table 1 Boar sperm motility under different treatments %
注:同列不同小写字母表示差异显著(P<0.05).下同。
Note:Different lowercase letters in the same column indicate significant difference atP<0.05.The same as below.

图1 处理3中不同浓度Tau常温保存后的猪精子活率Fig.1 Boar sperm motility under different concentrations of Tau in group 3

图2 处理 3 中不同浓度Tau常温保存后的猪精子顶体完整率Fig.2 Boar sperm acrosome integrity under different concentrations of Tau in group 3

Table 2 Boar sperm motility under different treatments %

图3 精液保存 5 d各处理组中T-AOC活性Fig.3 T-AOC activity of treatments measured in 5 days during semen preservation
2.4 不同处理对猪精液常温保存精液MDA浓度的影响
如图 4 可知,添加 0.5 mmol/L Tau不能有效地降低保存5 d的精液MDA浓度(P>0.05),而当Tau的添加量达到 1和 5 mmol/L时,配合抗生素组显著降低精液中的MDA浓度(P<0.05),其中 5 mmol/L为最适添加量,效果明显好于其他处理组(P<0.01),当添加量达到 10 mmol/L时,精液中的MDA浓度显著高于其他处理组(P<0.05)。
3 讨 论
3.1 不同浓度Tau对猪精液常温保存精子活率和顶体完整率的影响
活率是评价精子质量的最直观标准,而顶体完整率在一定程度上反应精子的质量。Vasco[6]研究发现,由于精液在常温保存中不可避免地受到空气中氧气的影响,精子代谢产生高浓度的活性氧(ROS)。正常生理状况下,猪精液中含有自身的抗氧化体系,能去除部分ROS造成的氧化损伤,当ROS的产生速度与其去除速度不平衡时,氧化应激也由此产生[7],发生一系列的脂质过氧化等有害反应,导致精子的质膜、顶体以及其他结构功能受到损伤[8-9]。因此,添加抗氧化剂理论上可以抑制脂质过氧化的发生,提高精子活率。Cerolini等[10]通过添加维生素E发现,精液稀释剂中添加抗氧化剂能够抑制精子质膜的脂质过氧化,提高活率。近年来,Tau不断地被用于羊及牛的精液冷冻保存中[11-12]。Sanchez-Partida等[13]研究认为,Tau具有调节渗透压和抗氧化的作用,精液中添加抗氧化物质能够起到很好的延长精子保存时间的效果。本试验结果表明,5 mmol/L的Tau可以延长精子的保存时间及提高顶体完整率,且配合抗生素处理 3 效果更显著,分别单独添加抗生素组和Tau组效果较差,其中单独添加抗生素组效果最差。其原因可能是由于牛磺酸与 2 种抗生素联合使用对精子具有某种良性调节作用。庆大霉素属于氨基糖苷类抗生素,为强极性阳离子,不被生物体代谢,在抑制细菌的同时对细胞也有一定毒害,庆大霉素和新霉素可明显抑制钙离子内流,牛磺酸能调节钙离子的稳定性,既能抑制钙离子内流,也能在某种情况下促进钙离子内流,两者一定程度上存在拮抗作用[14],刘海瑛[15]研究证实牛磺酸能拮抗庆大霉素的耳毒性,可能正由于牛磺酸对抗生素的一定拮抗作用而减轻对精子的毒害。同时,牛磺酸与抗生素可能在一定程度上能协调精子膜内外的Ca2+和Na2+平衡,有利于精子细胞膜完整。Tau具有抗氧化功能,是一种很有前景的细胞保护剂[16],Sanchez-Partida[13]等认为 25~50 mmol/L Tau能提高冷冻精子的运动性,陈宠霞等[17]认为10 mmol/L Tau不仅能够提高冷冻兔精子的运动性,还可以显著提高兔精子的顶体完整率,与本试验结果类似。但是本试验Tau添加量达到 10 mmol/L时,精子活率和顶体完整率显著降低,这可能是一方面因为不同物种精子的代谢产物产量和抗氧化酶含量不同,并且不同保存方式对Tau的需求量不一样导致[18-19],而 10 mmol/L在本试验中已超过猪精液的耐受范围,反而对精子造成额外损伤,过量的Tau可能对稀释液的渗透压造成影响,导致精子的不正常损伤。胡琦等[20]研究认为,当牛磺酸浓度过大(100 mmol/L)时,能抑制细胞的增值和移行;葛健等[21]研究添加牛磺酸对体外兔角膜内皮细胞生长的影响时发现,当浓度超过 6%时部分细胞出现死亡,这与本研究结果基本一致。
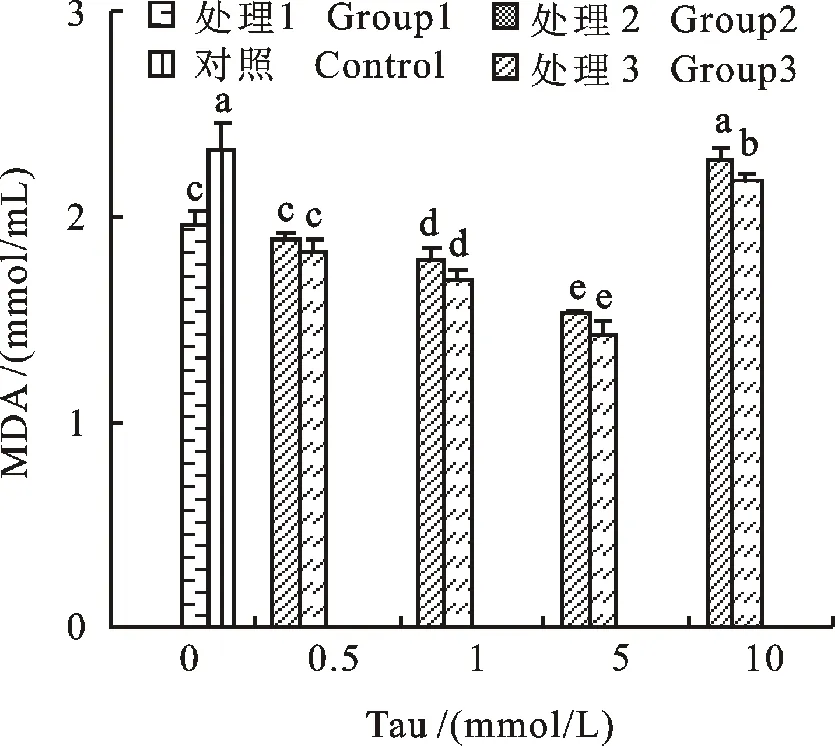
图4 精液保存5 d各处理组中MDA浓度Fig.4 MDA content of treatments measured in 5 days during semen preservation
3.2 不同浓度Tau对猪常温保存精液T-AOC与MDA含量的影响
MDA是精子膜脂质过氧化反应的产物之一,可以反映精子过氧化反应的程度[22],而T-AOC是反应体系中总抗氧化能力的指标,可以直接反映出精子抗氧化水平即精子对抗自由基攻击的能力[23]。Motlagh等[24]和Chanapiwat等[25]分别在精液中添加迷迭香和生育酚2种抗氧化物质,发现精子存活时间得到延长,ROS反应和MDA含量得到控制,说明抗氧化剂能很好的抑制精子氧化反应。本试验结果表明,在精液稀释液中添加 5 mmol/L的Tau能显著降低MDA的含量,同时提高精液中T-AOC的浓度,符合Tau的抗氧化特性。Aly等[26]研究表明,Tau可以减少硫丹对大鼠造成的精子活力降低,提高精液的抗氧化能力。朱宇旌等[27]发现,在公猪日粮中添加Tau可以有效地降低精液中MDA含量,提高SOD、GSH-PX活性。彭杰等[28]在大鼠胰岛细胞外液培养基中添加Tau也发现Tau处理组能够显著提高T-AOC并降低MDA含量,与本研究结果一致。本研究中,当Tau添加量为 10 mmol/L时,T-AOC和MDA同样出现较大的浮动,这与精子活率及顶体完整率变化基本一致,可能是由于添加Tau过量引起。
本试验结果表明,当Tau配合抗生素时效果明显好于单独使用抗生素或者Tau的处理,原因可能有以下两方面。一方面,精液中很难避免微生物[29],而常温条件(17 ℃)加上稀释液含有葡萄糖等营养物质,为细菌的生存提供条件,尤其是诸如大肠杆菌等细菌可以短时间内对精子产生巨大伤害[30-31],因此抗生素的添加可以大幅度提升精子保存效果,本试验中处理 3 的效果好于处理 2 符合此原理,但是处理 1 效果不如处理 2 这可能是因为精液样品中细菌含量较少,抑制细菌而延长精液保存时间的效果不如抗氧化剂明显,因为抗氧化剂在精液保存中起到至关重要的作用,抗氧化剂不仅可以加强精液中的抗氧化能力,作为猪精液冷冻保护剂,还可以保护精子的染色体等内在物质,延长精液保存时间[32],这可能也是造成两组差异的原因之一。另一方面,抗生素能抑制氧化反应,Priuska等[33]证明庆大霉素是铁的螯合剂,铁作为生物氧化剂在自由基反应中起催化作用,庆大霉素的螯合一定程度能降低脂质过氧化产生MDA等副产物,与牛磺酸在抗氧化方面起到协同作用。
4 结 论
当Tau添加浓度为 5 mmol/L时,配合 2×105IU 庆大霉素与 2.5×104IU 复方新诺明在猪精液常温保存时,顶体完整率和T-AOC的提高及MDA的降低效果最为显著,说明适量的Tau可以提高猪精液常温保存效果,而对于Tau与抗生素协同作用的具体机制有待进一步研究。
Reference:
[1] 高建明,虞桂平,邵世义,等.不同稀释液对猪精液常温保存效果的影响[J].中国畜牧杂志,2007,43(13):12-14.
GAO J M,YU G P,SHAO SH Y,etal.Effect of different diluent on boar semen of normal temperature preservation[J].ChineseJournalofAnimalScience,2007,43(13):12-14 (in Chinese with English abstract).
[2] 丑武江,王世银,杨力伟,等.猪精液常温保存稀释液的应用研究[J].家畜生态学报,2014,35(4):49-53.
CHOU W J,WANG SH Y,YANG L W,etal.Research on design,sifting and application of swine semen diluent[J].ActaEcologiaeAnimalisDomastici,2014,35(4):49-53(in Chinese with English abstract).
[3] 刘维平.海藻糖和亚牛磺酸对小鼠无透明带胚胎体外发育的影响[D].陕西杨凌:西北农林科技大学,2010.
LIU W P.Effect of trehalose and hypotaurine on development of zona-free mouse embryos in vitro[D].Yangling Shaanxi:Northwest A&F University,2010(in Chinese with English abstract).
[4] MEMON A A,WAHID H,ROSNINA Y,etal.Effect of hypotaurine and cysteine on sperm cytological parameters of cooled and post thaw boer goat semen [J].ElixirInternationalJournal,2011,38:4100-4104.
[5] MARTINS-BESSA A,ROCHA A,MAYENCO-AGUIRRE A.Effects of taurine and hypotaurine supplementation and ionophore concentrations on post-thaw acrosome reaction of dog spermatozoa[J].Theriogenology,2009,71(2):248-253.
[6] VASCO D,HEMANDEZ M,VAZQOEZ J M,etal.Generation of reactive oxygen species (ROS) by frozen-thawed boar spermatozoa[J].ReproductioninDomesticAnimals,2007,42(2):89-90.
[7] WU D,CEDERBAUM A I.Alcohol,oxidative stress and free radical damage[J].ProceedingsoftheNutritionSociety,2006,65(3):277-284.
[8] BILODEAU J F,BLANCHETTE S,GAGNON C,etal.Thiols prevent H2O2-mediated loss of sperm motility in cryopreserved bull semen[J].Theriogenology,2001,56(2):275-286.
[9] JANG H Y,KIM Y H,CHEONG H T,etal.Curcumin attenuates hydrogen peroxide induced oxidative stress on semen characteristics duringin vitro storage of boar semen[J].ReproductionandDevelop-mentBiology,2009,33(2):99-105.
[10] CEROLINI S,MALDJIAN A,SURAI P,etal.Viability,susceptibility to peroxidation and fatty acid composition of boar semen during liquid storage 1[J].AnimalReproductionScience,2000,58(1/2):99-111.
[11] ZHAO B T,XU C L.Effect of glucose,fructose,PVA,taurine on the storage of goat semen[J].HeilongjiangJournalofAnimalReproduction,2007,15(5):9-10.
[12] AHMED M A E.Amelioration of nandrolone decanoate-induced testicular and sperm toxicity in rats by taurine:effects on steroidogenesis,redox and inflammatory cascades,and intrinsic apoptotic pathway[J].ToxicologyandAppliedPharmacology,2015,282(3):285-296.
[13] SANCHEZ-PARTIDA L G,SETCHELL B P,MAXWELL W M.Epididymal compounds and antioxidants in diluents for the frozen storage of ram spermatozoa[J].ReproductionFertilityandDevelopment,1997,9(7):689-696.
[14] BKAILY G,JAALOUK D,HADDAD G,etal.Modulation of cytosolic and nuclear Ca2+and Na+transport by taurine in heart cells[J].MolecularandCellularBiochemistry,1997,170(1/2):1-8.
[15] 刘海瑛.牛磺酸拮抗庆大霉素耳毒性及对耳蜗单离外毛细胞、螺旋神经节细胞的钙调控及机制[D].上海:第二军医大学,2006.
LIU H Y.Taurine antagonizes the ototoxicity of gentamycin and modulates calcium homeostasis of the isolated outer hair cells and spiral ganglion cells[D].Shanghai:The Second Military Medical University,2006(in Chinese with English abstract).
[16] 孙长勉,栾新红.牛磺酸的生理功能及在畜牧生产中的应用[J].饲料研究,2005(5):24-25.
SUN CH M,LUAN X H.The physiological functions of Taurine and in the application of livestock production[J].FeedResearch,2005(5):24-25(in Chinese).
[17] 陈宠霞,金 一.添加牛磺酸对兔精液液态保存质量参数的影响[J].畜牧与兽医,2006,38(8):25-27.
CHEN CH X,JIN Y.Effects of Taurine on the quality parameters of rabbit semen on liquid storage[J].AnimalHusbandryandVeterinaryMedicine,2006,38(8):25-27(in Chinese).
[18] BAUMBER J,BALL B A.Determination of glutathione peroxidase and superoxide dismutase-like activities in equine spermatozoa,seminal plasma,and reproductive tissues[J].AmericanJournalofVeterinaryResearch,2005,66(66):1415-1419.
[19] BAUMBER J,BALL B A,LINFOR J J,etal.Reactive oxygen species and cryopreservation promote DNA fragmentation in equine spermatozoa[J].JournalofAndrology,2003,24(4):77-82.
[20] 胡 琦,杨宝峰,周文艳,等.牛磺酸对体外培养的兔角膜基质细胞增殖的影响[J].哈尔滨医科大学学报,2006,39(4):327-330.
HU Q,YANG B F,ZHOU W Y,etal.Effect of Taurine on the proliferation of cultured rabbit corneal keratocytes[J].JournalofHarbinMedicalUniversity,2006,39(4):327-330(in Chinese with English abstract).
[21] 葛 健,项 行,徐建敏.不同浓度牛磺酸对兔角膜内皮细胞的影响[J].上海交通大学学报(医学版),2009,29(7):825.
GE J,XIANG X,XU J M.Effect of different concentrations of Taurine on rabbit corneal endothelial cells[J].JournalofShanghaiJiaotongUniversity(MedicalScience),2009,29(7):825(in Chinese with English abstract).
[22] 刘 冰,马 栋,毛鹏飞,等.氧化应激损伤在男性不育症中的影响[J].中华男科学杂志,2014,20(10):927-931.
LIU B,MA D,MAO P F,etal.Role of oxidative stress injury in male infertility[J].NationalJournalofAndrology,2014,20(10):927-931(in Chinese with English abstract).
[23] ORZOL A,MIETELSKA K,WYSOCKI P.Function of the antioxidant system in boar semen[J].MedycynaWeterynaryjna,2016,72(5):291-297.
[24] MOTLAGH M K,SHARAFI M,ZHANDI M,etal.Antioxidant effect of rosemary (RosmarinusofficinalisL.) extract in soybean lecithin-based semen extender following freeze-thawing process of ram sperm[J].Cryobiology,2014,69(2):217-222.
[25] CHANAPIWAT P,KAEOKET K.The effect ofCurcumalongaextracted (curcumin) on the quality of cryopreserved boar semen[J].AnimalScienceJournal,2015,86(9):863-868.
[26] ALY H A A,KHAFAGY R M.Taurine reverses endosulfan-induced oxidative stress and apoptosis in adult rat testis[J].FoodandChemicalToxicology,2014,64:1-9.
[27] 朱宇旌,朱广楠,李方方,等.N-氨甲酰谷氨酸与牛磺酸对公猪精液品质、血清激素指标及精浆抗氧化能力的影响[J].动物营养学报,2015,27(10):3125-3133.
ZHU Y J,ZHU G N,LI F F,etal.Effects of N-Carbamyl glutamate and Taurine on semen quality,serum hormone parameters and antioxidant[J].ChineseJournalofAnimalNutrition,2015,27(10):3125-3133(in Chinese with English abstract).
[28] 彭 杰,林树梅,胡建民.牛磺酸对STZ诱导大鼠胰岛细胞外液中SOD、GSH-P_X、MDA及T-AOC含量的影响[J].中国畜牧兽医,2011,38(7):58-62.
PENG J,LIN SH M,HU J M.The impact of Tautrine on SOD,GSH-PX,MDA and T-AOC in extracellular fluid of STZ-induced islet cell[J].ChinaAnimalHusbandryandVeterinaryMedicine,2011,38(7):58-62(in Chinese with English abstract).
[29] SCHULZE M,AMMON C,RUDIGER K,etal.Analysis of hygienic critical control points in boar semen production[J].Theriogenology,2015,83(3):430-437.
[30] PRIETO-MARTINEZ N,BUSSALLEU E,GARCIA-BONAVILA E,etal.Effects of Enterobacter cloacae on boar sperm quality during liquid storage at 17 ℃[J].AnimalReproductionScience,2014,148(1/2):72-82.
[31] MCPHERSON F J,NIELSEN S G,CHENOWETH P J.Seminal factors influencing return to estrus in female pigs following artificial insemination[J].AnimalReproduction,2014,11(1):24-31.
[32] BATHGATE R.Antioxidant mechanisms and their benefit on post-thaw boar sperm quality[J].ReproductioninDomesticAnimals,2011,46(S2):23-25.
[33] PRIUSKA E M,SCHACHT J.Formation of free radicals by gentamicin and iron and evidence for an iron/gentamicin complex[J].BiochemicalPharmacology,1995,50(11):1749-1752.
(责任编辑:顾玉兰 Responsible editor:GU Yulan)
Effect of Taurine and Antibiotics Compounding Agent on Quality of Boar Semen Stored at Normal Temperature
XIE Dongqi, LIU Qi,SU Zezhi, WEI Shuaiyi,MEI Junsi,WANG Jian, WAN Lu, YANG Gongshe and HU Jianhong
(College of Animal Science and Technology, Northwest A&F University, Yangling Shaanxi 712100, China)
Tau has good oxidation resistance.In order to investigate the effect of compatibility of Tau and antibiotic on boar semen stored at room temperature, Modena without antibiotic as control,three groups were designed,Modena with gentamicin(2×105IU) and Cotrimoxazole(2.5×104IU) as group1, Modena with Tau (0.5 mmol/L,1 mmol/L,5 mmol/L,10 mmol/L) as group 2, and the group3 was diluted with Modena containing both Tau and antibiotic, and sperm motility, acrosome integrity, total antioxidative capacity (T-AOC)activity and malondialdehyde (MDA) content were measured and analyzed.The result showed that Modena supplemented with 5 mmol/L Tau could improve boar sperm motility, effective survival time and acrosome integrity, decrease MDA content and T-AOC activity.The results showed that group 3 was the best, group 2 comes second, and group 1 the worst, the effect had significant difference among them.After 5 days preservation, the group 3 showed that sperm motility, acrosome integrity were 64.11, 72.10%, respectively, T-AOC activity and MDA content were 4.76 U/mL and 1.46 nmol/mL, respectively.In conclusion, Modena supplemented with Tau and antibiotic reduced the oxidative stress and improved the sperm quality of boar semen during liquid storage at normal temperature, and 5 mmol/L Tau was the optimum concentration.
Taurine; Antibiotics; Boar sperm; Room temperature preservation
2016-01-20 Returned 2016-04-12
The National Technology System of Pig Industry of China (No.CARS-36); the Yangling Science and Technology Planning Project of China (No.2014NY-22); the Experimental Demonstration Station and Technology Achievement Promotion Project of Northwest A&F University(No.TGZX2015-18).
XIE Dongqi, male,master student.Research area: animal reproductive physiology.E-mail: axdqxdq@126.com
HU Jianhong, male,Ph.D,professor.Research area:animal reproductive physiology.E-mail: hjh19732008@126.com
日期:2017-06-05
2016-01-20
2016-04-12
国家生猪产业技术体系(CARS-36);杨凌示范区科技计划(2014NY-22);西北农林科技大学试验示范站(基地)科技成果推广(TGZX2015-18)。
谢东淇,男,硕士研究生,从事动物生殖生理研究。E-mail: axdqxdq@126.com
胡建宏,男,博士,教授,主要从事家畜生殖生理调控研究。E-mail:hjh19732008@126.com
S814.3
A
1004-1389(2017)06-0820-07
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170605.1714.006.html

