慢病毒介导的EphrinB2基因转染大鼠骨髓间充质干细胞表达的实验研究
朱 敏, 徐 运, 张 跃, 汤 健, 华 裕, 赵晓科, 杜森杰
慢病毒介导的EphrinB2基因转染大鼠骨髓间充质干细胞表达的实验研究
朱 敏1, 徐 运2, 张 跃1, 汤 健1, 华 裕1, 赵晓科1, 杜森杰1
目的 将携带EphrinB2基因慢病毒转染至骨髓间充质干细胞(BMSCs),检测其过表达水平及细胞形态学变化,并探讨EphB4/EphrinB2是否具有促进大鼠BMSCs体外迁移活性的作用。方法 单纯贴壁法分离大鼠BMSCs,倒置显微镜观察细胞生长形态。携带EphrinB2慢病毒以感染复数3和10感染BMSCs分为低浓度转染组(MOI=3)和高浓度转染组(MOI=10),对照组采用未转染组、阴性转染组,利用qPCR检测EphrinB2基因表达及Western blot检测EphrinB2蛋白水平。观察EphrinB2基因转染后BMSCs形态学变化。15 d后通过免疫荧光检测MAP2表达了解细胞分化。进一步Transwell实验检测细胞迁移能力来了解EphB4/EphrinB2在调节干细胞迁移的作用。结果 培养BMSCs为多角形或棱形呈漩涡状排列生长。EphrinB2-BMSCs经qPCR和Western blot检测证实有外源性EphrinB2表达。EphrinB2基因转染后BMSCs 24 h,BMSCs胞体开始收缩细胞有突起伸出,72 h后可见典型的神经样细胞形态改变。15 d后,BMSCs分化成为MAP2神经元,与阴性转染组相比,低浓度转染组和高浓度转染组MAP2表达率上升(P< 0.05)。Transwell实验结果显示:低浓度转染组与高浓度转染组较未转染组及阴性转染组穿膜细胞数量明显增加(P<0.05)。结论 慢病毒介导EphrinB2能高效感染BMSCs,并随着时间延长分化成神经样细胞,同时EphB4/EphrinB2在调节BMSCs迁移具有重要作用。
EphrinB2; EphB4; 骨髓间充质干细胞; 神经干细胞; 迁移
骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSCs)是存在于骨髓中明显有别于造血干细胞的一类前体细胞。体内外研究发现,在特定环境下BMSCs在适宜诱导剂、细胞因子等作用下可被诱导分化为神经元样细胞等;而且与胚胎神经发生、神经干细胞成熟、迁移方式一致,趋向游走定位性准确[1,2]。最新研究发现红细胞生成素肝细胞受体(erythropoietin-producing hepatocelluar receptor,Eph受体)是最大酪氨酸激酶受体家族,其配体主要表达于细胞表面,被命名为ephrin(eph family receptor interacting protein)。两者均为膜结合蛋白,相互依赖进行信号转导,具有神经轴突导向、细胞粘附、促进干细胞增殖、迁移和血管新生,已成为国际上干细胞研究的热点。Eph受体可分为两类:Eph A (Eph A1-10)和Eph B(Eph B1-Eph B6),与Eph受体结合的配体称为Ephrin,也分为两类:Ephrin A(Ephrin A1-6)和EphrinB(Ephrin B1-B3)[3]。但关于EphB4/EphrinB2在干细胞中的作用及其机制目前国内外报道均较少。有别于其他酪氨酸激酶受体,EphB4和EphrinB2之间的信号转导途径是双向的,在信号转导过程中二者均可被对方激活,产生“正向信号”和“反向信号”。以EphB4为配体结合EphrinB2后,快速募集SFKs(Src-family kinases)到EphrinB2附近,将EphrinB2酪氨酸残基磷酸化,然后与接头蛋白Grb4的SH2结构域相结合激活下游信号通路,为反向信号通路[4,5]。研究表明,激活的反向信号产生促内皮细胞黏附、迁移和促血管出芽等促进血管新生的作用[6]。因此本研究通过体外实验培养BMSCs,构建过表达EphrinB2慢病毒载体,慢病毒感染 BMSCs,使EphrinB2目的基因在BMSCs中持续表达,通过体外实验观察转染EphrinB2后其对BMSCs迁移能力的影响,旨在为转染EphrinB2增效干细胞应用于临床提供新的理论依据。
1 材料和方法
1.1 材料 (1)实验动物健康雄性无特定病原体(specific pathogen free,SPF)级Sprague-Dawley(SD)大鼠10只,均由南京医科大学实验动物中心提供;(2)主要试剂包括Trizol试剂(美国Invitrogen公司产),病毒包装3质粒:LV重组载体系列(过表达大鼠EphrinB2慢病毒载体)和绿色荧光蛋白EGFP(上海吉凯基因化学有限公司),胎牛血清和DEME高糖培养基(美国Gibco公司),EphrinB2多克隆抗体(英国abcam公司),兔抗微管相关蛋白2(MAP2)多克隆抗体(Proteintech 公司);Transwell小室(美国Millipore公司),Cy3标记山羊抗小鼠IgG(H+L),RNA提取试剂盒(康为),RT-PCR试剂盒(Oligo公司), L-多聚赖氨酸和噻唑蓝(美国Sigma公司)。
1.2 方法
1.2.1 大鼠BMSCs分离、纯化及扩增 单纯贴壁法分离大鼠BMSCs分离获取BMSCs,具体步骤见参考文献[2]。
1.2.2 EphrinB2慢病毒载体的构建 构建过表达大鼠EphrinB2慢病毒载体,含有EGFP 标记。产生病毒液并采用孔稀法测定滴度。最后将制备好慢病毒载体放至-80 ℃冰箱冻存备用。
1.2.3 转染复数值测定 取培养3代以上的大鼠BMSCs,以1×105/孔的密度接种至24孔板。培养2~3 d,直至细胞融合度达50%左右,按2个不同MOI值为(3、10)添加病毒液和终质量浓度为5 mg/L的聚凝胺。阴性转染组只添加含有EGFP空病毒上清,转染组添加MOI值为3.0和10.0 EphrinB2慢病毒载体上清和EGFP,终质量浓度为5 mg/L的Polybrane被添加到以上3组,而未转染组不做处理。共转染12 h后更换新鲜培养基。转染后每天在倒置荧光显微镜下观察各组细胞绿色荧光蛋白表达情况,评估转染效率,筛选最适转染复数值。
1.2.4 大鼠BMSCs转染及实验分组 根据转染情况将同时点的大鼠BMSCs分为4组:未转染组(不进行转染,其他培养条件同各转染组);阴性转染组(转染空白慢病毒);低浓度转染组(转染LV-rno- EphrinB2-3moi,含EphrinB2-3moi慢病毒);高浓度转染组(转染LV-rno- EphrinB2-10moi,含EphrinB2-10moi慢病毒),每组设3个重复孔。在倒置荧光显微镜下观察转染24 h、48 h、72 h EGFP荧光表达情况。
1.2.5 采用qPCR检测BMSCs EphrinB2mRNA水平 用Triol试剂提取细胞总RNA,逆转录采用cDNA合成试剂盒,具体操作参照说明书完成。用美国Bio-Rad公司生产的MJ Mini Opticon型实时PCR仪进行荧光定量PCR扩增。结果由分析软件自动进行统计和计算。引物序列:GAPDH mRNA F的序列为5’-gtgaggtgaccgcatcttct-3’,GAPDH 的序列mRNAR的序列为5’-cttgccgtgggtagagtcat-3’,PCR产物大小为353 bp;EphrinB2 mRNA F的序列为5’-gacgtccagaactagaagctgg-3’,EphrinB2 mRNA R的序列为5’-caccatccaatggaagcctgg-3’,PCR产物大小为257 bp。
1.2.6 采用Western blotting检测BMSCs EphrinB2蛋白水平 电转移100 min至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),于5%脱脂奶粉封闭测定BMSCs EphrinB2的蛋白表达水平,取等量的细胞裂解液(含细胞蛋白70 μg)上样行电泳。电泳条件:浓缩胶恒压80 V,约30 min分离胶恒压100 V,约90 min。恒流200 mA液中封闭(室温,4 h),加入封闭液和适量EphrinB2抗体孵育过夜。用含5%脱脂奶粉的洗涤液(tris-buffered saline and tween,TBST)漂洗后,将膜与辣根过氧化酶标记的二抗于室温下摇荡孵育2 h,经TBST充分洗膜后,利用增强化学发光法(enhanced chemiluminescence,ECL)显色成像。相应蛋白表达值-条带的灰度值/actin。
1.2.7 体外诱导BMSCs诱导分化为神经干细胞 取各组细胞进行诱导实验,取传至第3代BMSCs,待其长满后加入0.25%胰蛋白酶消化10 min,清弃胰酶,按 5×107L-1接种于含60 g/L葡萄糖、20 μg/L碱性成纤维细胞生长因子、20 μg/L表皮生长因子、2%B27的DMEM/F12(1∶1)诱导培养液进行诱导,根据细胞生长情况换液,传代,倒置相差显微镜下观察。
1.2.8 BMSCs分化为神经元样细胞的鉴定 加入培养15 d后,对 BMSCs进行免疫细胞荧光染色检测。所使用抗体及抗体稀释浓度为: MAP2 (1∶500)、4, 6 二氨 - 苯基吲哚(DAPI)稀释浓度为(1∶1000)。
1.2.9 迁移实验 Transwell实验检测细胞迁移能力来了解EphB4/EphrinB2在调节干细胞迁移的作用。取出小室,用棉签擦去上室内的细胞,用无水乙醇固定细胞30 min,风干。用0.1%结晶紫染色10 min,于倒置显微镜下观察。随机选取10个视野,进行细胞计数。
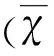
2 结 果
2.1 EphrinB2过表达慢病毒载体的构建 EphrinB2上调慢病毒阳性重组克隆均通过测序,证明载体构建成功。LV-rno-EphrinB2病毒滴度为1×109TU/ml,阴性对照病毒滴度为1×109TU/ml。
2.2 EphrinB2过表达慢病毒转染 通过倒置荧光显微镜观察绿色荧光蛋白表达情况评价细胞转染率。慢病毒转染BMSCs 24 h,均可见绿色荧光蛋白阳性细胞但数量较少,且胞浆内荧光较弱,间隔1 d重复感染,72 h后见绿色荧光蛋白EGFP阳性细胞增多,荧光增强,此时表达最佳,其中MOI=3时阳性细胞数量及荧光强度最优,且对BMSCs的细胞形态无明显影响。低浓度转染组和高浓度转染组与阴性转染组EGFP转染率无明显差异(见图1)。
2.3 对BMSCsEphrinB2 mRNA转录的影响 qPCR结果显示,阴性转染组EphrinB2 mRNA转录水平与未转染组比较,差异无统计学意义(P>0.05)。低浓度转染组和高浓度转染组EphrinB2 mRNA转录水平高于阴性转染组与未转染组(P<0.05),低浓度转染组EphrinB2 mRNA的转录水平高于高浓度转染组(P<0.05)(见图2)。
2.4 BMSCs EphrinB2蛋白水平的影响 Western blotting结果显示阴性转染组EphrinB2蛋白与未转染组相比较,差异无统计学意义(P>0.05)。低浓度转染组和高浓度转染组EphrinB2蛋白水平高于阴性转染组与未转染组(P<0.05),低浓度转染组EphrinB2蛋白表达水平高于高浓度转染组(P<0.05)(见图3)。
2.5 免疫荧光检测 加入5 μg/L FGF、EGF15 d后,低浓度转染组和高浓度转染组MAP2蛋白表达显著上调,高于阴性转染组与未转染组(P<0.05),低浓度转染组与高浓度转染组MAP2的蛋白表达水平两者间没有明显的统计学差异(P>0.05)(见图 4)。
2.6 Transwell实验检测 采用Transwell实验研究EphrinB2基因对干细胞迁移能力的影响,实验结果显示:低浓度转染组穿膜细胞数量(134±6.53)与高浓度转染组(130±4.57)和较未转染组(101±4.32)及阴性转染组(102±5.08)显著减少(P<0.05),而未转染组与阴性转染组两组间相比较无显著差异(P>0.05)(见图 5)。

A:未转染组;B:阴性转染组;C:低浓度转染组;D:高浓度转染组
图1 倒置荧光显微镜观察绿色荧光蛋白

与未转染组与阴性转染组相比*P<0.05;与低浓度转染组相比#P<0.05
图2 RT-PCR 检测 EphrinB2 mRNA 表达水平

图3 Western blot检测EphrinB2蛋白的表达水平

A:未转染组;B:阴性转染组;C:低浓度转染组;D:高浓度转染组
图4 免疫荧光检测 MAP2的表达

与未转染组与阴性转染组相比*P<0.05
图5 慢病毒介导的EphrinB2基因对BMSCs细胞迁移能力的影响
3 讨 论
BMSCs具备明显的自我复制更新和多分化潜能,且因其在体外容易获得和扩增,相较于胚胎干细胞、脐血干细胞,伦理学限制较少,易于实验室工作的大范围展开。体外研究发现,在特定环境下,BMSCs能被诱导分化为成骨细胞、神经细胞、血管内皮细胞[7]。
新近研究发现,EphB4/EphrinB2系统和其特异双向信号传导在神经细胞粘附和迁移的作用显得尤为重要,而且与干细胞移植密切相关。Ephrin B2来自于受体酪氨酸激酶家族(RTKs)中最大的亚族Eph家族。EphB4/EphrinB2均为跨膜蛋白,Eph包含3个部分:含一个N端球样配体结构域、一个富含半胱氨酸的区域和两个Ⅲ型纤维连接蛋白的胞外区,胞膜区,含一个分布酪氨酸激酶的结构域、高度保守的SAM结构域和一个 PDZ结构域的胞内区,Ephrin B2也包含3个部分:含一个保守的C端尾(含酪氨酸激酶结合位点)和PDZ结构域胞内区、胞膜区、由GPI 联接的与受体结合的胞外区,Ephrin B2通过其胞外部分与Eph受体相结合使Eph胞内酪氨酸激酶结合位点发生磷酸化激活下游通路,同时自身胞内部分也发生酪氨酸激酶的磷酸化而游活下游通路形成Eph-ephrin系统特有双向信号传导通路,EphB4/EphrinB2的双向信号通路使它们在细胞排斥和粘附具有重要地位和作用[8]。Sentarkz在Nature杂志上报道关于EphrinB2基因在胚胎期诱导血管内皮细胞迁移方面的作用[9]。还有相关文献报道能在胚胎期诱导神经脊细胞的目的迁移,促进嗅觉和听觉等诸多器官的胚胎发育。Kemmerling发现γ分泌酶通过刺激反向EphrinB2信号通路在小鼠胚胎干细胞衍生的小胶质细胞促进迁移[10]。目前关于EphrinB2在血管生成和迁移地位和作用存在一定争议,但是大多数研究倾向于经EphrinB2介导反向信号传导通路促进血管内皮细胞侵袭、迁移和管腔形成,产生促进血管生成效应,而且与干细胞移植密切相关。Conover 等报道,EphrinB2信号传导可能在突触水平对这一过程进行调控,EphrinB2在侧脑室旁具有分化功能的神经干细胞上表达,用EphB4或EphrinB2灌注侧脑室3 d可打破神经干细胞的迁移和细胞增殖。这一切证明EphrinB2基因可能直接或间接调节着侧脑室下区神经干细胞的增殖、分化和迁移[11]。我们用qPCR和Western blot检测4组细胞EphrinB2 mRNA和蛋白表达水平结果显示:与未转染组、阴性转染组比较低浓度转染组和高浓度转染组EphrinB2 mRNA与蛋白表达水平均明显增加,提示我们筛选建立稳定表达细胞株。
我们用FGF、EGF诱导BMSCs能显著增加向神经元方向的分化。并且发现低浓度转染组和高浓度转染组MAP2蛋白表达显著上调,高于阴性转染组与未转染组,提示EphrinB2基因在神经干细胞向神经元分化和迁移过程中的早期中起到正调控作用。为了进一步研究EphrinB2基因在调节干细胞迁移的作用中,我们用Transwell实验检测各组细胞迁移情况。低浓度转染组和高浓度转染组较阴性转染组及未转染组明显增加,而阴性转染组及未转染组两组间相比较差异无统计学意义,综合上述实验结果提示: EphrinB2基因使其体外迁移能力显著增加,证实EphrinB2基因对在调节BMSCs迁移具有重要作用。
综上所述:利用慢病毒过表达EphrinB2基因可在体外促进大鼠BMSCs分化和迁移,本实验研究提示EphB4/EphrinB2在调节BMSCs迁移具有重要作用。这为深入研究EphB4/EphrinB2在调节BMSCs分子生物学机制具有重要的生物学作用,为寻找基因治疗的有效靶点提供了理论依据和实验基础。
[1]Li M,Yu A,Zhan Kodera Y.Recent advances of transplantation from bone marrow derived stem cells[J].Nihon Rinsho,2011,69(12):2179-2185.
[2]Borlongan CV,Glover LE,Tajiri N,et al.The great migration of bone marrow-derived stem cells toward the ischemic brain:therapeutic implications for stroke and other neurological disorders[J].Prog Neurobiol,2011,95(2):213-228.
[3]Boyd AW,Ward LD,Wicks IP,et al.Isolation and characterization of a novel receptor-type protein tyrosine kinase(hek) from a human pre-B cell line[J].J Biol Chem,1992,267(5):3262-3267.
[4]Genander M,Frisen J.Ephrins and Eph receptors in stem cells and cancer[J].Curr Opin Cell Biol,2010,22(5):611-616.
[5]Lu Q,Sun EE,Klein RS,et al.Ephrin-B reverse signaling is mediated by a novel PDZ-RGS protein and selectively inhibits G protein-coupled chemoattraction[J].Cell,2001,105(1):69-79.
[6]Alam SM,Fujimoto J,Jahan l,et al.Coexpression of EphB4 and EphrinB2 in tumor advancement of ovarian cancer[J].The British Journal of Cancer,2008,98(4):845-851.
[7]Li M,Yu A,Zhang F,et al.Treatment of one case of cerebral palsy combined with posterior visual pathway injury using autologous bone marrow mesenchymal stem cells[J].J Transl Med,2012,18(10):100.
[8]Pasquale EB.Eph-ephrin bidirectional signaling in physiology and disease[J].Cell,2008,133(1):38-52.
[9]Sentark A,Pfennig S,Weiss A,et al.Ephrin Bs are essential components of the Reelin pathway to regulate neuronal migration [J].Nature,2011,472(7343):356-360.
[10]Kemmerling N,Wunderlich P,Theil S,et al.Intramembranous processing by γ-secretase regulates reverse signaling of ephrin-B2 in migration of microglia[J].Glia,2017,3.doi:10.1002/glia.23147.
[11]Conover JC,Doetsch F,Garcia-Verdugo JM,et al.Disruption of Eph/ephrin signaling affects migration and proliferation in the adult subventricular zone[J].Nat Neurosci,2000,3(11):1091-1097.
Experimental study of lentiviral vector-mediated EphrinB2 gene transfection rat bone marrow mesenchymal stem cells
ZHUMin,XUYun,ZHANGYue,etal.
(DepartmentofNeurologyandRehabilitation,NanjingChildren’sHospitalofNanjingMedicalUniversity,Nanjing210008,China)
Objective To detect the over-expression and morphological changes after EphrinB2 gene transfected to BMSCs and study the effect of EphB4/EphrinB2 on rat BMSCs in vitro.Methods The simple adherent method was adopted in isolating and culturing experiments of BMSCs.The inverted microscope was used to observe cells.Lentivirus carrying EphrinB2 infected BMSCs(MOI=10) and (MOI=3),using qPCR and Western blot to detect mRNA and protein’s expression of EphrinB2 after transfection.Morphological changes of BMSCs after differentiation was observed.In 15 days,the cell differentiation was determined by MAP2 immunofluorescent staining.The migration rate was assessed to study the role of EphB4/EphrinB2 pathway in the stem cells migration by transwell chambers.Results The morphological characteristics of major of the BMSCs were unified into polygonal or fusiform,germinated into a spiral shape.We confirmed exogenous EphrinB2 expression in EphrinB2-BMSCs by qPCR and Western blot.3 days after EphrinB2 gene transfection,BMSCs cell body began to shrink,refraction enhanced cell protrusions,and differentiate into the typical neuron-like cell,qPCR and Western blot detection of nestin positive expression.In 15 days,expression levels of MAP2 in the low and high concertration transfected group were significantly higher than those in the negative control group (P<0.05).Transwell assay showed the cell number of Transmembrane in the low and high concertration transfected group were obviously higher compared to non-transfected group and negative control group (P<0.05).Conclusion Lentiviral-mediated EphrinB2 can efficiently infect BMSCs,and differentiate into neuron-like cells.EphB4/EphrinB2 pathway can play the role of migration in bone mrrow mesenchymal stem cells.
EphrinB2; EphB4; Bone mrrow mesenchymal stem cells; Neural stem cell; Migration; BMSCs
1003-2754(2017)06-0508-04
2017-02-18;
2017-05-25
国家自然科学基金青年基金(No.81401864);南京医科大学科学基金重点项目(No.2013NJMU097)
(1.南京医科大学附属儿童医院康复科,江苏 南京 210008;2.南京大学医学院附属鼓楼医院神经内科,江苏 南京 210008)
朱 敏,E-mail:1553526445@qq.com
R741
A

