山羊痘病毒P32基因的克隆与序列分析
唐 豪白雅琴陈伯祥陈冬梅杨 明郭慧琳袁 勇
(1.甘肃省动物疫病预防控制中心,甘肃兰州 730046;2.甘肃省畜牧产业管理局,甘肃兰州 730000;3.甘肃省畜牧兽医研究所,甘肃平凉 744000;4.甘肃省农牧厅机关后勤服务中心,甘肃兰州 730000)
山羊痘病毒P32基因的克隆与序列分析
唐 豪1白雅琴2*陈伯祥3陈冬梅4杨 明3郭慧琳1袁 勇2
(1.甘肃省动物疫病预防控制中心,甘肃兰州 730046;2.甘肃省畜牧产业管理局,甘肃兰州 730000;3.甘肃省畜牧兽医研究所,甘肃平凉 744000;4.甘肃省农牧厅机关后勤服务中心,甘肃兰州 730000)
山羊痘是由山羊痘病毒(Goat pox virus,GTPV)引起的一种急性、热性、接触性传染病,病羊以发热、全身起痘、呼吸道和消化道损伤以及淋巴结肿大为特征。该病的暴发和流行不仅对当地养羊业和农村经济造成巨大的损失,还可严重影响国际贸易,因此被OIE列为必须报告的疫病,也列为我国动物疫病一类。近年随着山羊痘疫情在世界各地尤其东亚地区的暴发流行,国内外学者加大了对山羊痘病毒编码蛋白的研究力度,以期研制出更为敏感特异的新型诊断试剂和安全高效的新型疫苗。
山羊痘基因组大小为143~147 kb,P32基因位于GTPV基因组的64~65kb处。P32具有抗原特异性,P32是含有一个抗原决定簇,由319~324个氨基酸组成的囊膜蛋白,羧基端有一个跨膜结构域,对细胞有毒害作用。山羊痘病毒P32的结构蛋白,具有免疫原性,免疫羊等动物后可产生具有保护性的抗体。目前,我国缺乏高效准确的山羊痘病毒的检测方法或试剂盒,使该病难以控制。为此,我们开展了山羊痘病毒P32基因的克隆与序列分析,为下一步建立敏感、快速、准确简单易行的GTPV检测方法和P32蛋白的后续研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1 毒株
山羊痘毒株(GTPV-Shan-1)由甘肃省畜牧兽医研究所保存,并在原代绵羊睾丸细胞中培养。
1.1.2 主要试剂与载体
T4 DNA连接酶、PCR试剂、TaKaPa DNA Fragment Purification Kit Ver.2.0试剂盒、pMD18 - T载体购自宝生生物工程(大连)有限公司,SE.DNA kit(OMEGA bio-tek)购自OMEGA 公司;大肠杆菌DH5α菌种购自Solarbio。
1.2 方法
1.2.1 P32基因的PCR扩增
根据Genbank中收录的GTPV基因序列,遵循引物设计原则,应用在线软件分析P32,设计一对引物用于扩增P32基因,上游引物P1 5’-AACTAATTATCAAAAATGGCAG-3’;下游引物P2:5’-TGGATGGGATACATAGTAAGAA-3’,预期扩增目的片段大小846bp。引物由宝生生物工程(大连)有限公司合成。
取200μl病毒细胞培养物,用病毒DNA提取试剂盒提取病毒基因组DNA,然后取5μl病毒基因组DNA为模板,加入4μl dNTP混合物,5μl 10×PCR buffer、上下游引物各1μl、0.25μl EX Taq酶,最后补水至50μl。PCR反应条件:94℃5min;94℃50s;55℃50s,72℃60s,35个循环;最后72℃延伸10min,4℃终止反应。PCR产物在10g/L的琼脂糖凝胶中进行电泳检测。
1.2.2 连接及转化
按照TaKaPa DNA Fragment Purification Kit Ver.2.0的说明书操作,对PCR产物进行纯化,与pMD18-T载体相连接,转化感受态细胞DH5α。在涂有氨苄西林的LB琼脂平板上,挑选单个菌落接入含氨苄西林的LB培养液中,提取质粒DNA样本经PCR扩增检测后将重组质粒送大连宝生物工程有限公司测序。
1.2.3 序列分析
应用DNAStar、BLAST(NCB I)软件与GenBank登录的相应序列进行比较,分析不同来源山羊痘病毒株P32 基因核苷酸序列和推导的氨基酸序列的同源性。
2 结果
2.1 PCR扩增及初步鉴定
采用P1 /P2引物进行PCR扩增,从山羊痘病毒感染细胞培养物的核酸样本中扩增出1 条约846 bp大小的DNA带,而正常细胞显现阴性反应,与预期大小相符合(图1)。
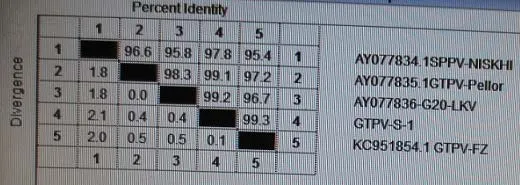
表1 P32基因核苷酸序列的同源性比对

图1 P32基因PCR扩增产物琼脂糖凝胶电泳分析

图3.2 P32重组质粒扩增鉴定
2.2 PCR产物克隆与重组质粒鉴定
从琼脂糖凝胶中回收PCR产物,与pMD18-T载体相连接,转化感受态细胞DH5α。挑选抗Amp+菌落进行摇振培养,提取质粒DNA样本进行PCR扩增,琼脂糖电泳,得到两条带,与预期结果一致。
2.3 P32基因核苷酸序列测定及同源性分析
将鉴定的重组质粒送大连宝生物工程有限公司测序,山羊痘病毒(GTPV-Shan-1)的P32基因为1032bp。将此P32基因核苷酸序列及推导的氨基酸序列与国内外不同来源山羊痘病毒株的相应序列进行比对并构建了系统进化树,结果见表1和图1。

图1 P32基因序列构建的系统进化树
结果表明,山羊痘病毒株S-1株的P32 基因序列与山羊痘毒FZ株和G20-LKV株核苷酸序列的同源性分别达到99.3%和99.2%。与国内外不同来源的山羊痘病毒分离株相比较,P32基因核苷酸序列的同源性达到97.8%以上。同源性分析结果表明,山羊痘病毒的P32基因具有高度保守性。
3 讨论与分析
2002年,Tulman等对山羊痘病毒的全基因组序列测定工作完成,P32 基因定位于病毒基因组的64~65 kb处,全长969个核苷酸,编码323个氨基酸;羊痘病毒的P32 基因具有高度保守性,世界各地不同分离株的P32 基因核苷酸序列同源性达到97%。
本试验对山羊痘shan-1株进行PCR扩增、连接、转化并测序,其核苷酸序列与国内分离病毒FZ 株和G20-LKV株的P32基因的同源性达到99.2%以上,与印度、哈萨克斯坦分离株的同源性达到97.8%~99.1%,显示了山羊痘病毒P32基因的高度保守性。从P32基因的核苷酸序列构建的系统进化树显示,山羊痘S-1株与这为进一步研究山羊痘病毒P32基因表达产物免疫学活性、结构与功能奠定了良好的工作基础。
[1] Heine H G,StevensM P,Foord A J.A cap ripoxvirus detection PCR and antibody ELISA based on the major antigen P32,the homolog of the vaccine virus H3L gene[J].J ImmunMethods,1999,(227):187-196.
[2] 康文玉,徐自忠,花群义,等.羊痘病毒P32蛋白编码基因的克隆及表达[J].中国兽医科学,2006,36(6):454-459.
[3] HosamaniM,Mondal B,Tembhurne P A,et al.Differentiation of sheep pox and goat poxviruses by sequence analysis and PCR-RFLP of P32 gene[J].Virus Genes,2004,29(1):73-80.
[4] 殷震,刘景华.动物病毒学[M].北京:科学出版社,1997:960-963.
[5] Tulman E R,Afonso C L,Lu Z,et al.The genomes of sheeppox and goatpox viruses[J].J Virol,2002,76(12):6054-6061.
甘肃省科技支撑计划-农业类,项目编号:1104NKCL097
唐豪(1983-),男,大学学历,助理兽医师,主要从事动物疫病的防控技术的研究与推广工作。
白雅琴(1969-),女,大学学历,高级畜牧师,主要从事家畜的改良与新品种的推广工作。

