Yes相关蛋白在肝细胞癌与胆管细胞癌中的表达特征及其与预后的关系
王 春, 邬 昊, 刘 彦, 丁 雄, 李泽民
(1 重庆永川区中医院 外科, 重庆 402160; 2 重庆医科大学附属第二医院 肝胆外科, 重庆 400010;3 重庆市彭水县人民医院 外科, 重庆 409600)
Yes相关蛋白在肝细胞癌与胆管细胞癌中的表达特征及其与预后的关系
王 春1, 邬 昊2, 刘 彦2, 丁 雄2, 李泽民3
(1 重庆永川区中医院 外科, 重庆 402160; 2 重庆医科大学附属第二医院 肝胆外科, 重庆 400010;3 重庆市彭水县人民医院 外科, 重庆 409600)
目的 探讨Yes相关蛋白(YAP蛋白)在肝细胞癌与胆管细胞癌中的表达与患者临床预后的相关性。方法 收集2004年7月-2009年7月重庆医科大学附属第二医院收治的190例肝癌患者标本,其中肝细胞癌110例,胆管细胞癌80例。分析不同组别YAP蛋白表达水平的差异,比较不同组别患者的预后情况。YAP蛋白的表达与肝细胞癌、胆管细胞癌患者临床病理特征之间关系比较采用χ2检验。采用Kaplan-Meier与log-rank检验分析患者的无瘤生存率与总生存率。采用Cox回归分析YAP蛋白的表达对肝细胞癌与胆管细胞癌患者预后的影响。结果 YAP蛋白在胆管细胞癌中的高表达率为68.7%,比肝细胞癌中的高表达率(56.3%)高。在肝细胞癌与胆管细胞癌中,YAP蛋白的高表达在不同肿瘤大小(P值分别为<0.001、0.024)、不同AFP水平(P值分别为0.009、0.034)、是否有肝硬化(P值分别为0.032、0.006)、是否存在血管侵犯(P值分别为0.011、0.028)和肝内转移(P值分别为0.049、0.030)的患者间,差异均有统计学意义。在肝细胞癌与胆管细胞癌患者中,YAP蛋白高表达者无瘤生存率和总生存率显著低于YAP蛋白低表达者(P值均<0.05)。多因素结果显示,YAP蛋白高表达均为影响肝细胞癌和胆管细胞癌患者无瘤生存率和总生存率的危险因素(P值均<0.05)。结论 肝细胞癌与胆管细胞癌中可发现较高水平的YAP蛋白表达,且YAP蛋白的高表达与患者的低生存率有关。
肝肿瘤, 实验性; Yes相关蛋白; 预后
原发性肝癌每年导致约745 000例患者死亡[1]。肝细胞癌与胆管细胞癌是原发性肝癌的2种不同的病理类型,既往研究[2-3]表明后者预后较前者更差。目前,虽然如AFP、血管内皮生长因子和转化生长因子β等指标能够对原发性肝癌的预后进行预测,但大量的基础和临床研究显示,上述指标无法准确预测原发性肝癌患者的生存率[4-5]。因此,寻找一种有效的生物标志物来判断原发性肝癌患者的高复发风险与转移十分必要。
早期研究人员在果蝇中发现Hippo信号转导路径是调节细胞大小和器官体积的主要信号通路[6-7]。在哺乳动物中,Hippo信号通路的核心模块包括:STE20-蛋白激酶1/2(MST1/2)、WW域支架蛋白SAV1、大肿瘤抑制基因1/2(LATS1/2)、接头蛋白MOB1A/B和Yes相关蛋白(YAP蛋白)。YAP蛋白作为转录共激活因子调控PPXY相关蛋白[8-9],在Hippo信号通路中未受抑制,且存在于细胞核中,如果YAP蛋白与TEADs相结合,可同时激活多个基因,如:CTGF、ErbB-4、ITGB2[7-12]。因此,YAP蛋白可影响组织的生长平衡与器官大小,并在调节细胞增殖和肿瘤的发展中发挥举足轻重的作用[13]。近年的一些功能性研究已经阐明,YAP蛋白在致癌信号通路网络中发挥着关键的作用[13-15]。然而,对肝细胞癌与胆管细胞癌中YAP蛋白的相关研究尚不清楚。因此,本研究通过免疫组化检测YAP蛋白在肝细胞癌与胆管细胞癌中的表达情况,探讨YAP蛋白作为原发性肝癌预后指标的可能性。
1 资料与方法
1.1 标本收集 收集2004年7月-2009年7月重庆医科大学附属第二医院收治的190例肝癌患者标本,其中肝细胞癌110例、胆管细胞癌80例。所有患者的组织样本在肿瘤手术切除后立即进行处理,4%福尔马林液(pH=7)固定,24 h后石蜡包埋。由重庆医科大学附属第二医院病理科2名资深的病理学专家完成组织学诊断(根据HE染色片检验法)。同时收集所有研究对象完整的临床资料与随访信息,内容包括:诊断时的年龄、性别、肿瘤大小、有无肿瘤远处转移、有无肝硬化、有无HBV感染和血清甲胎蛋白水平。截至2015年5月完成所有研究对象的随访与调查。本研究严格遵守赫尔辛基宣言和重庆医科大学附属第二医院伦理审查委员会的指导方针。
1.2 免疫组化 为确定YAP蛋白在原发性肝癌中的表达情况,采用免疫组化染色检测石蜡包埋切片(4 μm)。方法:二甲苯被用于脱蜡和水化,在梯度的酒精系列中脱水,在100 ℃,10 mmol/L枸橼酸钠溶液(pH 6.0) 中加热10 min进行抗原修复,沸腾后冷却20 min,反复3次。PBS(pH 7.2)洗涤后,室温下在3%过氧化氢与山羊血清中分别封闭15 min以避免非特异性蛋白结合。在切片上滴加YAP蛋白单克隆抗体(1∶100),并在4 ℃下孵育过夜。然后用生物素标记的二抗体37 °C孵育30 min,再与亲和素辣根酶在37 °C孵育20 min。采用DAB对切片进行显色,显色后用流水冲洗15 min,切片使用1%苏木精复染,梯度乙醇脱水,最后中性胶封闭。
1.3 评分系统 采用半定量评价方法判断YAP蛋白的表达情况,评分参数包括染色强度(0分,无;1分,弱;2分,中;3分,强)和阳性细胞百分比(0分,0或<5%;1分,5%~<25%;2分,25%~<50%;3分, 50%~<75%;4分,75%~100%)。染色强度分数+阳性细胞百分比分数=总染色分数,总染色分数≤4定义为YAP蛋白低表达,总染色分数>4定义为YAP蛋白高表达。
1.4 统计学方法 采用SPSS17.0统计软件进行数据分析,YAP蛋白的表达与临床病理特征之间关系采用χ2检验。无瘤生存率定义为从尽可能切除肿瘤后到肿瘤复发之间的时间。总生存率定义为从患者发病到死亡或者随访结束之间的时间。采用Kaplan-Meier与log-rank检验分析患者的无瘤生存率与总生存率。使用Cox回归分析YAP蛋白的表达对肝细胞癌和胆管细胞癌患者预后的影响。P<0.05为差异有统计学意义。
2 结果
2.1 YAP蛋白的表达情况 YAP蛋白主要表达在癌组织与癌旁组织的细胞核和胞浆中的部分区域。在肝细胞癌中YAP蛋白的高表达率为56.3%(62/110)(图1a,b),胆管细胞癌中YAP蛋白的高表达率为68.7%(55/80)(图1c,d)。
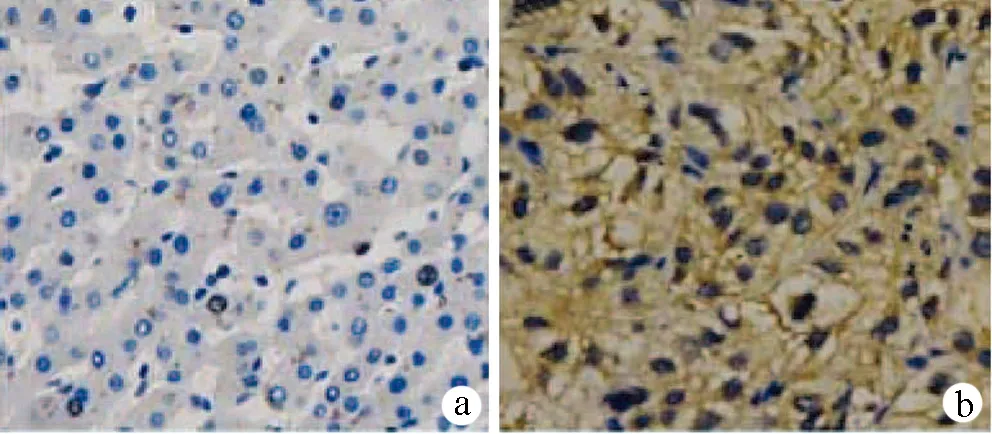
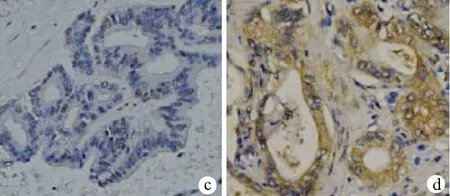
图1 YAP蛋白在肝细胞癌与胆管细胞癌中的表达(免疫组化,×200) a. 肝细胞癌YAP蛋白低表达;b. 肝细胞癌YAP蛋白高表达; c. 胆管细胞癌YAP蛋白低表达; d. 胆管细胞癌YAP蛋白高表达
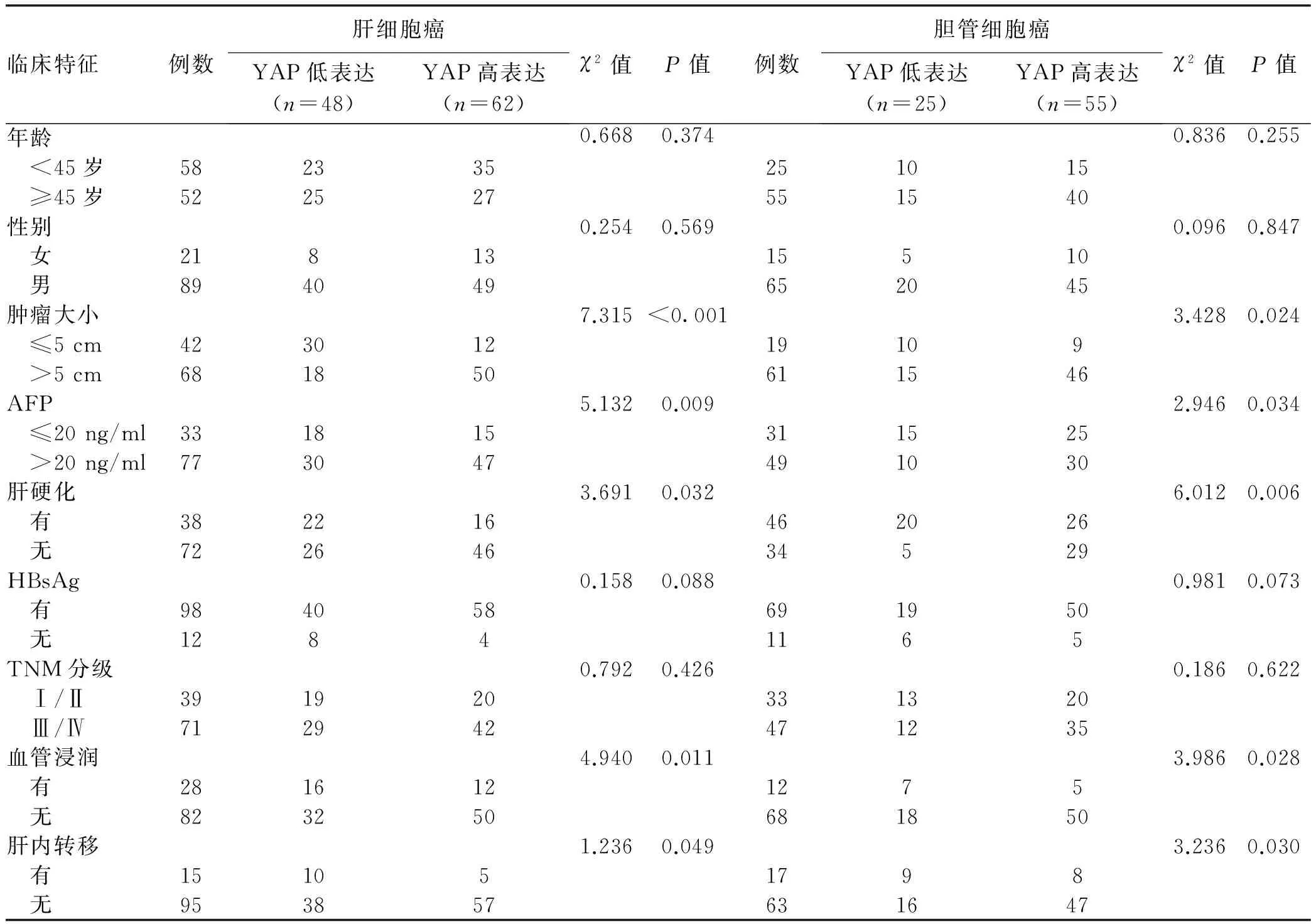
表1 不同程度YAP蛋白表达患者的临床特征(例)
2.2 YAP蛋白表达与临床特征的关系 在肝细胞癌与胆管细胞癌中YAP蛋白的高表达在肿瘤大小、AFP、肝硬化、血管浸润、肝内转移等方面比较,差异均有统计学意义(P值均<0.05)。然而,YAP蛋白的表达在性别、年龄、HBsAg和TNM分期方面比较,差异均无统计学意义(P值均>0.05)(表1)。
2.3 YAP蛋白表达与患者无瘤生存率的关系 肝细胞癌和胆管细胞癌YAP蛋白低表达组的1年无瘤生存率分别为87.4%、66.2%,3年无瘤生存率分别为56.3%、33.4%;YAP蛋白高表达组1年无瘤生存率分别为56.4%、37.3%,3年无瘤生存率分别为34.9%、17.4%。结果表明,肝细胞癌和胆管细胞癌患者YAP蛋白低表达组和YAP蛋白高表达组的无瘤生存率变化差异均有统计学意义(χ2值分别为12.312、10.342,P值分别为0.001、0.002)(图2,3)。
研究变量的赋值表见表2。单因素分析显示,肝内转移、血管浸润和YAP蛋白的表达可能是肝细胞癌患者无瘤生存率的影响因素(P值均<0.01);肝硬化、肿瘤大小、肝内转移、血管浸润和YAP蛋白的表达可能是胆管细胞癌患者无瘤生存率的影响因素(P值均<0.05)(表3)。

表2 变量赋值表
多因素分析显示,存在肝内转移、血管浸润和YAP蛋白高表达为影响肝细胞癌患者无瘤生存率的危险因素(P值均<0.01);存在肝硬化、肝内转移、血管浸润、肿瘤>5 cm和YAP蛋白高表达为影响胆管细胞癌患者无瘤生存率的危险因素(P值均<0.05)(表4)。
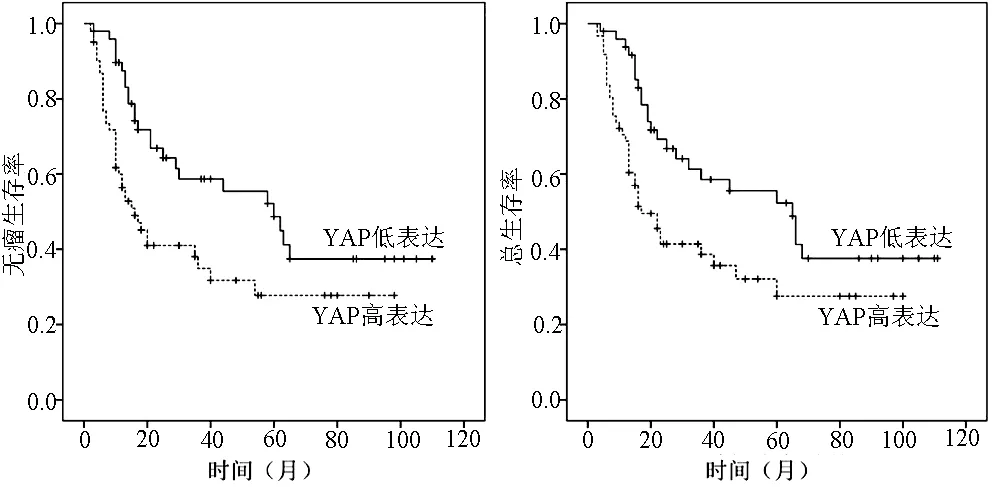
图2 不同YAP蛋白表达程度的肝细胞癌患者无瘤生存率与总生存率比较
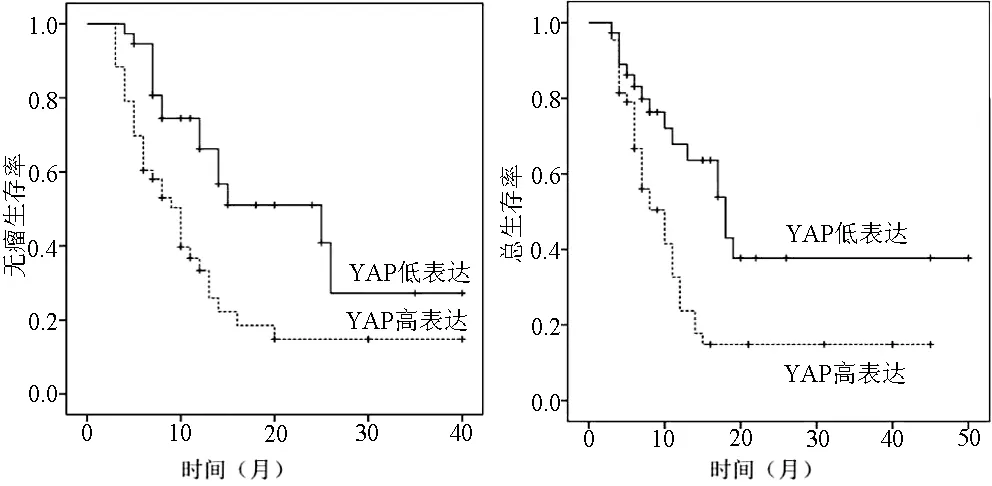
图3 不同YAP蛋白表达程度的胆管细胞癌患者无瘤生存率与总生存率比较
2.4 YAP蛋白表达与患者总生存率的关系 YAP蛋白在肝细胞癌与胆管细胞癌中低表达组的1年总生存率分别为90.1%、69.1%,3年总生存率分别为58.5%、33.2%。但YAP蛋白在肝细胞癌与胆管细胞癌高表达组的1年总生存率分别为58.8%、29.7%,3年总生存率分别为38.7%、14.4%。结果表明,肝细胞癌和胆管细胞癌患者YAP蛋白低表达组与YAP蛋白高表达组的总生存率变化差异均有统计学意义(χ2值分别为5.321、9.642,P值分别为0.008、0.003)(图2,3)。
单因素分析显示,肝内转移、血管浸润和YAP蛋白的表达可能是肝细胞癌患者总生存率的影响因素(P值均<0.01);肝硬化、肿瘤大小、肝内转移、血管浸润和YAP蛋白的表达可能是胆管细胞癌患者总生存率的影响因素(P值均<0.05)(表5)。
多因素分析显示,存在肝内转移、血管浸润和YAP蛋白高表达为影响肝细胞癌患者总生存率的危险因素(P值均<0.01);存在肝硬化、肝内转移、血管浸润、肿瘤>5 cm和YAP蛋白高表达为影响胆管细胞癌患者总生存率的危险因素(P值均<0.05)(表6)。
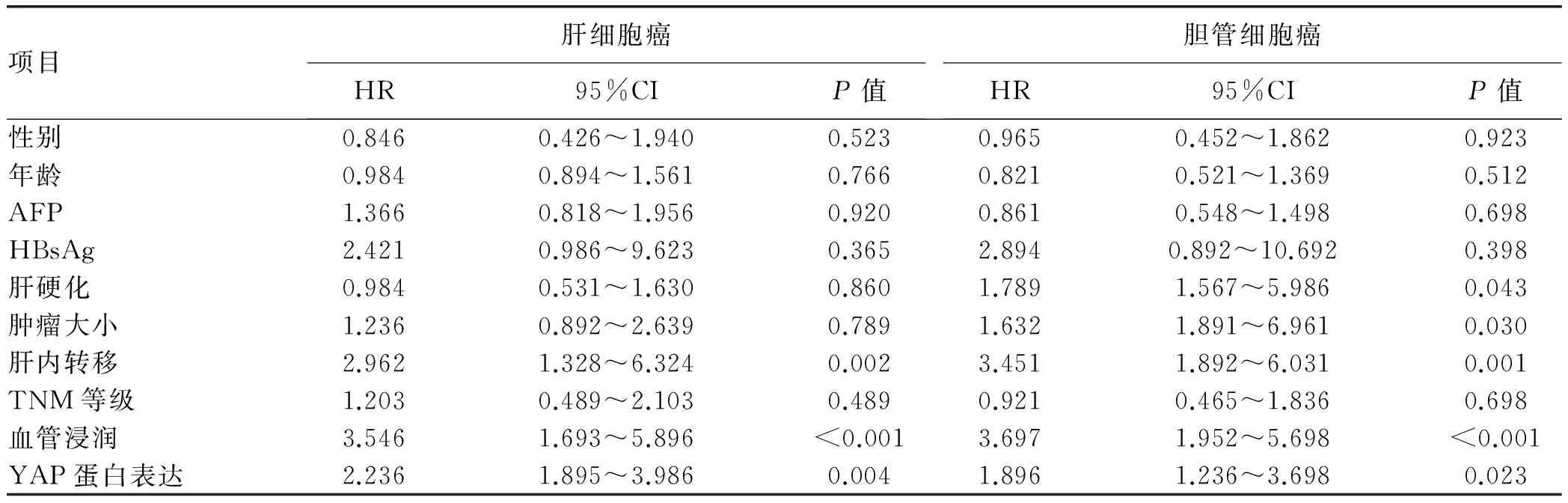
表3 肝细胞癌与胆管细胞癌患者无瘤生存率的单因素分析
注:HR,风险比;95%CI,95%可信区间
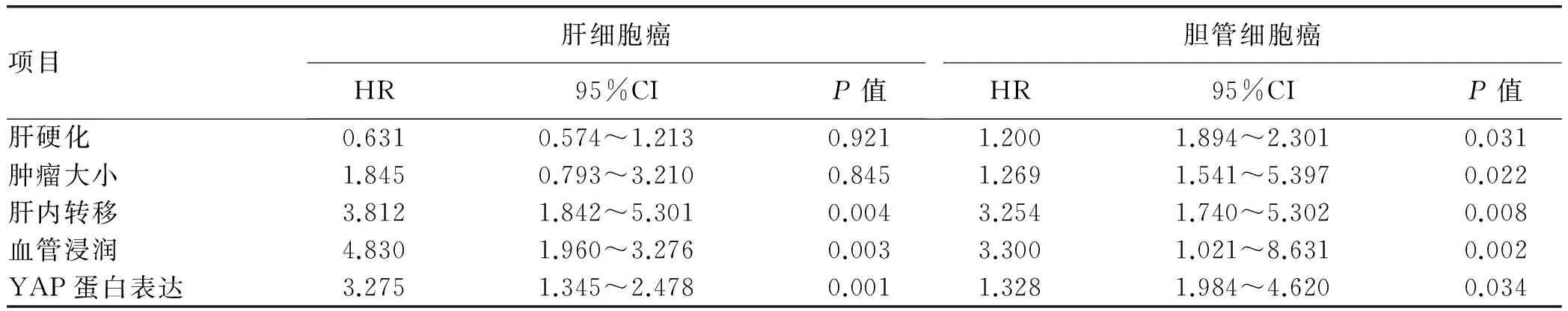
表4 肝细胞癌与胆管细胞癌患者无瘤生存率的多因素分析
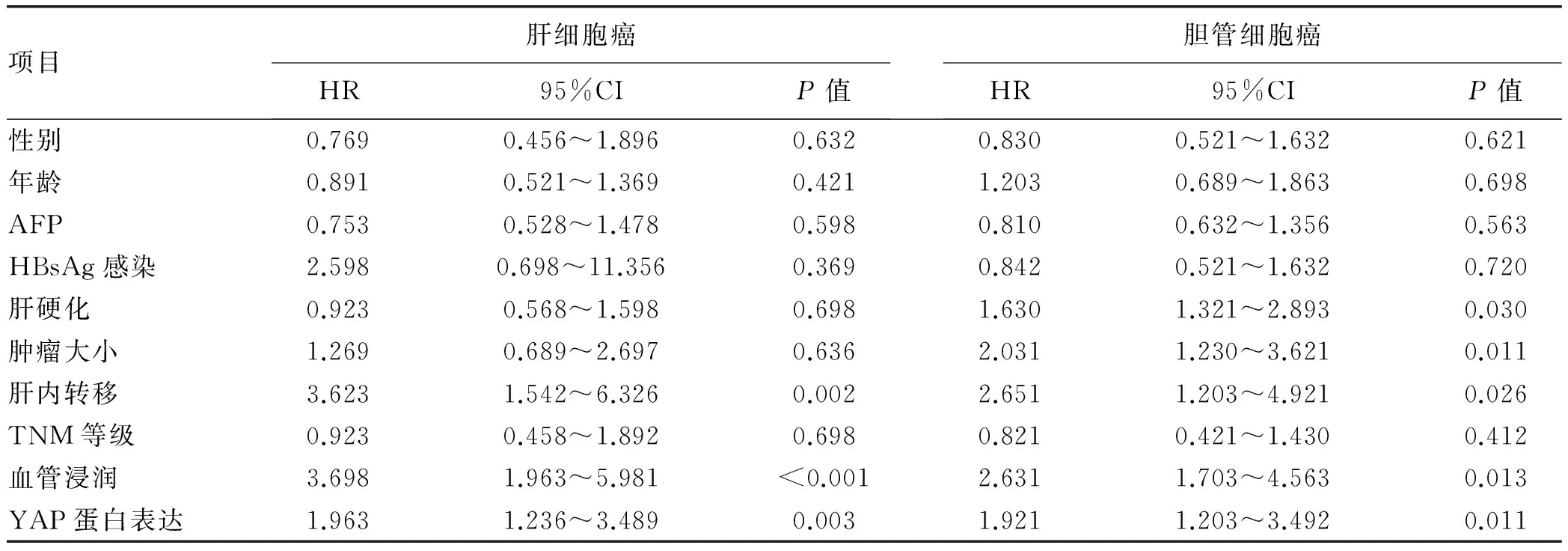
表5 肝细胞癌与胆管细胞癌患者总生存率的单因素分析
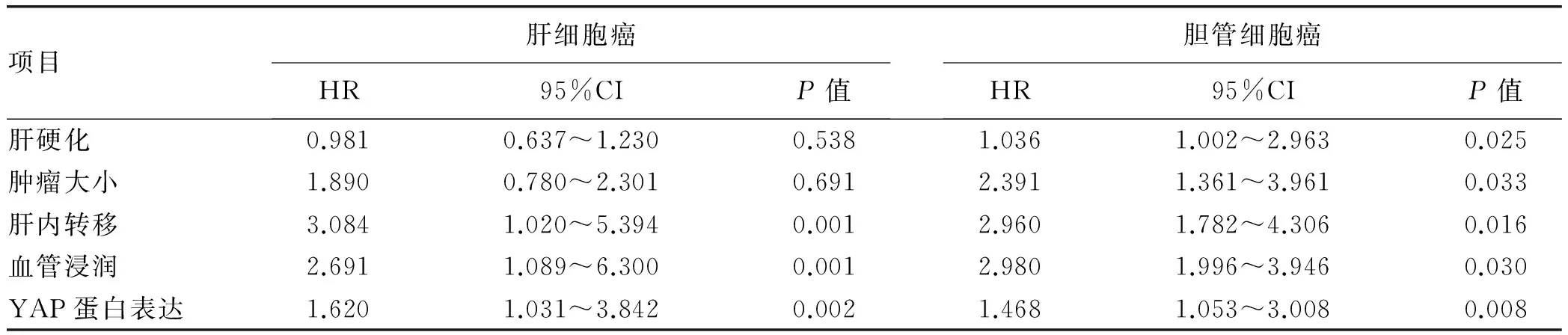
表6 肝细胞癌与胆管细胞癌患者总生存率的多因素分析
3 讨论
最近研究[16-19]结果显示,YAP蛋白作为癌基因高表达于人类原发性肿瘤,包括乳腺癌、肺癌、胃癌和结肠癌等。YAP蛋白在肿瘤发展和转移中发挥着重要作用,高表达的YAP蛋白与患者的较差生存预后有密切关系。YAP蛋白是一种在Hippo信号通路中的重要潜在致癌性转录共激活因子,YAP蛋白的活化可抑制大量抑癌基因的表达,其中包括DNA损伤诱导转录因子4和肿瘤坏死因子相关凋亡诱导配体,导致癌细胞行为改变,从而促进癌细胞增殖,增加侵袭、刺激新生血管生成能力[20]。
有研究[21]显示54%肝癌患者中的YAP蛋白呈高表达,而正常肝组织中YAP蛋白的表达则非常弱。另有研究[22]在139例大肠癌组织中检测YAP蛋白的阳性表达率为52.5%。在对177例肝癌患者的研究[23]发现,YAP蛋白是患者生存率和无瘤生存率的一个独立预测指标,与本研究结论一致。更为重要的是,本研究证实了胆管细胞癌较肝细胞癌有更高的YAP蛋白阳性表达率。上述结果表明,YAP蛋白作为重要的原癌基因在肿瘤恶化、复发过程中发挥着重要作用。
YAP蛋白作为Hippo下游的信号通路的效应基因,能够与TEAD转录因子结合,YAP蛋白的过表达能够异常激活一些负责细胞增殖、抗凋亡、存活和迁移的基因(如CTGF、CCND1、ITGB2和BCL2L1等)[24-27],特别是TEAD1、4,往往与癌症的发展、增殖相关。YAP蛋白可促进与细胞增殖相关的许多基因的转录表达,如Ki-67、c-myc、SOX4、H19和AFP等。此外,YAP蛋白还可调节细胞凋亡数的负调节因子的表达,如IAP家族基因survivin、BIRC2、cIAP1和BCL2家族基因MCL1[28]。值得注意的是,本研究结果显示YAP蛋白的高表达在不同肿瘤大小、有无血管浸润和肝内转移患者间均存在显著差异,提示YAP蛋白可能在促进肿瘤细胞增殖和转移,促进癌细胞迁移方面起重要作用。
本研究发现YAP蛋白在原发性肝癌中的高表达率为61.6%,存在肝硬化、肝内转移、血管侵犯、肿瘤>5 cm和YAP蛋白高表达等为影响肝细胞癌与胆管细胞癌患者无瘤生存率和总生存率的危险因素,通过分析在肝细胞癌与胆管细胞癌中YAP蛋白高表达患者的生存率发现,YAP蛋白高表达组表现出较低的1年和3年无瘤生存率与总生存率。同时,YAP蛋白高表达与肝细胞癌与胆管细胞癌患者的不良预后有密切关系。
综上所述,YAP蛋白高表达与肿瘤大小、AFP水平、肝硬化、血管侵犯及肝内转移有关,可能会增加肿瘤的恶性程度。YAP蛋白在胆管细胞癌中更易表达。YAP蛋白高表达患者的无瘤生存率与总生存率差。本研究尚存局限之处,在未来的研究中,笔者将更多地探讨YAP蛋白影响原发性肝癌发生发展的具体机制以及针对YAP蛋白基因靶向治疗。
[1] MEDIA CENTRE. Title of subordinate document. In: Cancer, 2015[EB/OL]. (2015-02-18) http//www.who.int/mediacentre/factsheets/fs297/en/.
[2] KOH KC, LEE H, CHOI MS, et al. Clinicopathologic features and prognosis of combined hepatocellular cholangiocarcinoma[J].Am J Surg, 2005, 189(1): 120-125.
[3] WANG J, WANG F, KESSINGER A. Outcome of combined hepatocellular and cholangiocarcinoma of the liver[J]. J Oncol, 2010, 2010: 917356.
[4] ERTLE JM, HEIDER D, WICHERT M, et al. A combination of alpha-fetoprotein and des-gamma-carboxy prothrombin is superior in detection of hepatocellular carcinoma[J]. Digestion, 2013, 87(2): 121-131.
[5] YANG H, ZHAI G, JI X, et al. LAPTM4B allele *2 is a marker of poor prognosis following hepatic tumor resection for hepatocellular carcinoma[J]. PLoS One, 2012, 7(4): e34984.
[6] JOHNSON R, HALDER G. The two faces of Hippo: targeting the Hippo pathway for regenerative medicine and cancer treatment[J]. Nat Rev Drug Discov, 2014, 13(1): 63-79.
[7] HARVEY KF, ZHANG X, THOMAS DM. The Hippo pathway and human cancer[J]. Nat Rev Cancer, 2013, 13: 246-257.[8] MENG Z, MOROISHI T, GUAN KL. et al. Mechanisms of Hippo pathway regulation[J]. Genes Dev, 2016, 30(1): 1-17.
[9] DING R, KEVIN W, TORSTEN B. The Hippo signalling pathway maintains quiescence in Drosophila neural stem cells[J]. Nat Commun, 2016, 7: 10510.
[10] KIM JE, FINLAY GJ, BAGULEY BC. The role of the hippo pathway in melanocytes and melanoma[J].Front Oncol, 2013, 3: 123.
[11] KOMURO A, NAGAI M, NAVIN NE et al. WW domain-containing protein YAP ssociateswith ErbB-4 and acts as a co-transcriptional activator for the carboxyl-terminal ragment of ErbB-4 that translocates to the nucleus[J]. J Biol Chem, 2003, 278: 33334-33341.
[12] NALLET-STAUB F, MARSAUD V, LI L, et al. Pro-invasive activity of the Hippo pathway effectors YAP and TAZ in cutaneous melanoma[J]. J Invest Dermatol, 2014, 134(1): 123.
[13] MORVARIDI S, DHALL D, GREENE M, et al. Role of YAP and TAZ in pancreatic ductal adenocarcinoma and in stellate cells associated with cancer and chronic pancreatitis[J]. Sci Rep, 2015, 16(5): 16759.
[14] ZENDER L, SPECTOR MS, XUE W, et al. Identification and validation of oncogenes in liver cancer using an integrative oncogenomic approach[J]. Cell, 2006, 125: 1253-1267.
[15] CHUNBO HE, DAGAN MAO, GUOHUA HUA, et al. The Hippo/YAP pathway interacts with EGFR signaling and HPV oncoproteins to regulate cervical cancer progression[J].EMBO Mol Med, 2015, 7(11): 1426-1449.[16] MAUGERI-SACCM, BARBA M, PIZZUTI L, et al. The Hippo transducers TAZ and YAP in reast cancer: oncogenic activities and clinical implications[J]. Expert Rev Mol Med, 2015, 17: e14.
[17] WANG Y, DONG Q, ZHANG Q, et al. Overexpression of yesassociated protein contributes to progression and poor prognosis of nonsmall-cell lung cancer[J]. Cancer Sci, 2010, 101(5): 1279-1285.
[18] KANG W, TONG JH, CHAN AW. Yes-associated protein 1 exhibits oncogenic property in gastric cancer and its nuclear accumulation associates with poor prognosis[J]. Clin Cancer Res, 2011, 17(8): 2130-2139.
[19] AVRUCH J, ZHOU D, BARDEESY N .YAP oncogene overexpression supercharges colon cancer proliferation[J]. Cell Cycle, 2012, 11(6): 1090-1096.
[20] KIM M, KIM T, JOHNSON RL, et al .Transcriptional co-repressor function of the hippo pathway transducers YAP and TAZ[J]. Cell Rep, 2015, 11(2): 270-282.
[21] WANG Y, XIE C, LI Q, et al. Clinical and prognostic significance of Yes-associated protein in colorectal cancer[J]. Tumor Biol, 2013, 34(4): 2169-2174.
[22] ZHAO B, WEI X, LI W, et al. Inactivation of YAP oncoprotein by the Hippo pathway is involved in cell contact inhibition and tissue growth control[J]. Genes Dev, 2007, 21: 2747-2761.[23] XU MZ, YAO TJ, LEE NP, et al. Yes-associated protein is an independent prognostic marker in hepatocellular carcinoma[J]. Cancer, 2009, 115(9): 4576-4585.
[24] DONG J, FELDMANN G, HUANG J, et al. Elucidation of a universal size-control mechanism in Drosophila and mammals[J]. Cell, 2007, 130(6): 1120-1133.
[25] ZHAO B, YE X, YU J, et al. TEAD mediates YAP-dependent gene induction and growth control[J]. Genes Dev, 2008, 22: 1962-1971.
[26] HEN L, LOH PG, SONG H. Structural and functional insights into the TEAD-YAP complex in the Hippo signaling pathway[J]. Protein Cell, 2010, 1(12): 1073-1083.
[27] VISSERGRIEVE S, ZHOU Z, SHE YM, et al. LATS1 tumor suppressor is a novel actin-binding protein and negative regulator of actin polymerization[J]. Cell Res, 2011, 21(10): 1513-1516.
[28] DONG J, FELDMANN G, HUANG J, et al. Elucidation of a universal size-control mechanism in Drosophila and mammals[J]. Cell, 2007, 130(6): 1120-1123.
引证本文:WANG C, WU H, LIU Y, et al. Expression features and prognostic significance of Yes-associated protein in hepatocellular carcinoma and cholangiocellular carcinoma[J]. J Clin Hepatol, 2017, 33(7): 1310-1315. (in Chinese) 王春, 邬昊, 刘彦, 等. Yes相关蛋白在肝细胞癌与胆管细胞癌中的表达特征及其与预后的关系[J]. 临床肝胆病杂志, 2017, 33(7): 1310-1315.
(本文编辑:邢翔宇)
Expression features and prognostic significance of Yes-associated protein in hepatocellular carcinoma and cholangiocellular carcinoma
WANGChun,WUHao,LIUYan,etal.
(DepartmentofSurgery,YongchuanHospitalofTraditionalChineseMedicine,Chongqing402160,China)
Objective To investigate the expression of Yes-associated protein (YAP) in hepatocellular carcinoma (HCC) and cholangiocellular carcinoma (CC) and its association with clinical prognosis. Methods Samples were collected from 190 patients who were treated in The Second Hospital Affiliated to Chongqing Medical University from July 2004 to July 2009, among whom 110 had HCC and 80 had CC. The difference in YAP expression and its association were analyzed in both groups, and patients′ prognosis was compared between the two groups. The chi-square test was used to investigate the association between YAP expression and clinicopathological features of HCC and CC, and the Kaplan-Meier method and the log-rank test were used to assess tumor-free survival rate and overall survival rate. A univariate Cox regression analysis was used to evaluate the influence of YAP expression on the prognosis of patients with HCC and CC. Results The CC group had higher expression of YAP than the HCC group (68.7% vs 56.3%,P=0.036). High YAP expression in HCC and CC was significantly associated with tumor size (P<0.001 andP=0.024), alpha fetoprotein (P=0.009 and 0.034), liver cirrhosis (P=0.032 and 0.006), vascular invasion (P=0.011 and 0.028), and intrahepatic metastasis (P=0.049 and 0.030). In both groups, the patients with high YAP expression had significantly lower tumor-free survival rate and overall survival rate than those with low YAP expression(allP<0.05). Multivariate analysis showed that high YAP expression is an adverse prognostic factor for tumor-free survival and overall survival in both groups (allP<0.05). Conclusion High YAP expression is frequently found in patients with HCC and CC, and high YAP expression is associated with low survival rate.
liver neoplasms, experimenal; Yes-associated protein; prognosis
10.3969/j.issn.1001-5256.2017.07.021
2017-01-06;
2017-03-10。
重庆市卫计委重点项目资助(2015ZDXM012);重庆市卫计委科研资助项目(2016MSXM206)
王春(1973-),男,副主任医师,主要从事普外科的诊治,尤其擅长肝胆胰脾疾病方面的诊治。
李泽民,电子信箱:whwh1hero@163.com。
R735.7
A
1001-5256(2017)07-1310-06

