新疆某规模化牛场牛病毒性腹泻/黏膜病的诊断
阮东,剡根强
(石子河大学动物科技学院,石河子 832003)
新疆某规模化牛场牛病毒性腹泻/黏膜病的诊断
阮东,剡根强
(石子河大学动物科技学院,石河子 832003)
本试验采用现场流行病学调查、临床检查、病理剖检、病料细菌学检测及PCR检测对新疆石河子市某规模化牛场成年牛与犊牛的死亡病因进行了诊断。结果表明,该场2016年3~5月份共有67头牛发病,死亡14头,其中成年怀孕牛41头,死亡8头,病死率为19.51%;2~8周龄犊牛发病26头,死亡6头,病死率为23.07%。成年牛与犊牛均表现出体温升高、口腔溃疡、腹泻,部分成年牛表现流产、产死胎、跛行等;剖检可见病死牛肠黏膜溃疡、脱落、出血等;无菌采集病死牛心血及肝组织接种于LB肉汤培养,但未检测到相关病原菌;采用BVDV特异性引物对气管拭子和肠内容物拭子进行RT-PCR检测,得到预期286bp目的条带,与Genbank登录的部分BVDV参考株的同源性为90.6%~92.6%。最终确诊,该规模化牛场成年牛与犊牛的死亡病因主要是BVDV感染。
牛BVDV;诊断;RT-PCR;序列分析
牛病毒性腹泻/黏膜病(BVD)是由牛病毒性腹泻病毒(BVDV)经多种途径感染引起的一种急性高度接触性传染病[1]。临床上以体温升高、口腔及胃肠溃疡、黏性腹泻及蹄叶炎为特征[2]。BVDV不仅导致怀孕母牛流产、死胎及初生犊牛急性死亡、育成牛发病死亡外,还可造成牛群的持续性感染及感染牛的免疫抑制,给牛群的健康带来严重威胁[3],被OIE定为B类及进出口检疫的疾病[4]。近年来,新疆地区牛养殖数量不断增加,BVD出现了新的流行趋势,已从牛场隐性感染和散发性临床病例转变为地方性流行和暴发。2016年3~5月,石河子某规模化牛场陆续发生怀孕母牛流产、死胎、死亡和初生犊牛急性死亡病例,本试验采用现场流行病学调查、临床检查、病理剖检、病料细菌学检测及PCR检测对发病原因进行了诊断分析,最终确诊为BVDV感染。
1 材料与方法
1.1 病料采集
用灭菌棉拭子采集1头病死成年母牛及2头死亡犊牛的食道黏液、肠内容物及6头体温升高、口腔溃疡并表现腹泻的发病犊牛的直肠内容物,放入收集管,于-80℃保存备用;无菌采集死亡成年牛和犊牛的肝脏、心血、肠系膜淋巴结,于4℃保存备用。
1.2 试验仪器与试剂Trizol:美国Invitrogen生命技术有限公司;反转录试剂盒:宝生物(Takara)工程大连公司;引物合成:北京华大基因科技有限公司;2×PCR.MIX、DNA. Marker:广州东盛生物科技有限公司;PCR产物回收试剂盒:诺维森(北京)生物科技有限公司;pMD19-T克隆载体:宝生物工程大连公司(Takara);DH5α感受态细胞:北京全式金生物科技有限公司。TC-512.PCR扩增仪:英国Bibby科技有限公司;凝胶图像处理系统:美国伯乐(BIO-RAD)科技有限公司;DYY-6B电泳仪:杭州雷琪实验器材有限公司。
1.3 试验设计
1.3.1.流行病学调查
现场调查了解该牛场的发病情况,包括发病时间、发病数、发病日龄、主要临床表现及病理解剖变化等。
1.3.2.细菌学检测
无菌取病死牛心血、肝脏及肠系膜淋巴结涂片,瑞氏染色镜检并接种于LB培养基,置37℃培养24h,涂片革兰氏染色镜检;将培养液再接种于血平板,置培养箱37℃培养24h后,革兰氏染色镜检。
1.3.3.PCR检测
1.3.3.1.食道黏液及肠内容物样品处理
将病样棉签置于5mL冻存管中并加入2mL的生理盐水,充分振荡摇匀,吸取1.2mL悬液于1.5mL的离心管中,8.000r/min.4℃离心15min,吸取上清置于灭菌的1.5mL离心管,加入50µL的双抗(青、链霉素),-80℃保存。
1.3.3.2.总RNA的提取
按照试剂盒说明书提取样品总RNA。
1.3.3.3.引物设计
参照文献[6]设计5′-UTR基因的引物:上游引物F2:5′-ATGCCCTTAGTAGGACTAGCA-3.′,下游引物R2:5′-CAACTCCA.TGTGCCATGTACAGCAG-3′。
1.3.3.4.RT-PCR
采用反转录试剂盒进行反转录反应;PCR体系:PCR.MIX10µL,上下游引物各0.75µL,DNA模板2µL,超纯水6.5µL;反应条件为:94℃预变性5min,35个循环(94℃变性45s,58℃退火50s,72℃延伸30s),最后72℃延伸10min,4℃保存;PCR产物经1%的琼脂糖凝胶电泳分析,切胶后用凝胶回收试剂盒回收并纯化。
1.3.3.5.克隆与鉴定
将纯化的目的DNA片段与PMD19-T载体4℃连接过夜,按常规方法[5]将连接产物转化至DH.5α感受态细胞,在含氨苄的LB固体培养基中37℃培养12h。选择单个菌落进行重组质粒的菌液PCR验证,提取质粒后进行PCR鉴定,大量培养后提取质粒。
1.3.3.6.序列测定与分析
将提取的质粒送至生工生物工程(上海)股份有限公司测序。使用DNAMAN、DNAStar软件进行序列分析,将测序结果与Genbank中登录的BVDV参考株进行序列比对和同源性比较。牛病毒性腹泻/黏膜病毒参考株5′-UTR基因序列见表1。

表1 5′-UTR基因序列参考株
2 结果与分析
2.1 流行病学调查及临床检查结果
2016年3~5月,该牛场48头牛体温升高至40.5~41℃,其中成年母牛33头,均为怀孕牛,犊牛15头,2~8周龄;23头牛出现口腔溃疡,其中成年牛14头,犊牛9头;54头牛出现腹泻,其中成年牛33头,犊牛21头。总计共有67头牛发病,14头牛死亡,其中成年牛8头,病死率为19.51%(8/41),犊牛6头,病死率为23.07%(6/26);流产母牛16头,产死胎母牛3头;4头成年牛表现跛行。
剖检2头死亡成年牛,均可见牙龈黏膜红肿且有多处溃疡,食道、真胃及肠黏膜脱落并有条状出血,其中1头成年牛的整个小肠严重出血,引发肠梗阻,肝脏、肺脏、心脏正常。
剖检2头死亡犊牛,死前体温为40.7℃,黏液性腹泻,口腔及牙龈出现溃疡。剖检可见肠壁变薄,肠黏膜出现坏死脱落。
2.2 细菌学检测
无菌取死亡牛心血、肝、肠系膜淋巴结涂片,瑞氏染色后镜检未发现细菌;病料接种LB培养基置37℃培养48h,未见可疑细菌生长,革兰氏染色后镜检也未发现细菌;培养物接种血平板未见菌落生长。
2.3 RT-PCR结果
样品经RT-PCR,电泳结果显示扩增基因片段大小为286bp(图1)。.

图1 样品RT-PCR电泳图
2.4 重组质粒的菌液PCR鉴定
将PCR的阳性产物切胶回收后,将来自成年牛2205与犊牛YN的样品连接载体,转化后随机挑选单克隆菌落,经培养后,菌液PCR结果验证筛选的单克隆菌落为阳性克隆。
2.5 序列分析与同源性比较
使用DNAStar.MegAlign软件,将此次克隆的2株牛病毒性腹泻/黏膜病毒的5′-UTR基因序列与部分BVDV参考株进行核苷酸序列对比(图2),此次克隆的2株牛病毒性腹泻/黏膜病毒株同源性为90.1%,成年牛2205株与参考株NADL的同源性最高,为92.0%,属BVDV-1a型;犊牛YN标与参考株g-1703的同源性最高,为92.6%,属BVDV-1f型。
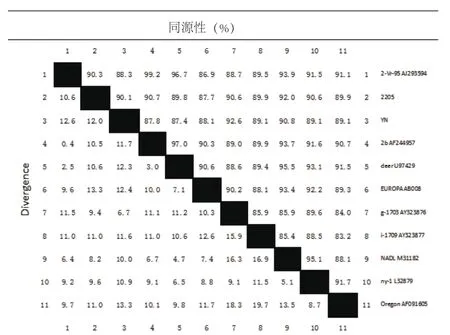
图2 YN、2205株与BVDV参考株的5′-UTR基因同源性比较
3 讨论
自1946年Olafson首先在美国纽约州发现BVD以来,该病已在世界各地广泛流行和传播。20世纪80~90年代,美国、加拿大、法国、德国、瑞典、芬兰、波兰、澳大利亚、新西兰、日本等养牛发达国家牛群BVDV感染率为50%~89%[6~8]。在我国,李佑民等[9]首次从国外引进牛的流产胎儿脾脏中分离并鉴定出BVDV。此后,刘世杰等[10]、高双娣等[11]、周继章等[12]、张光辉等[13]、冯诺飞等[14]、魏伟[15]、刘亚刚[16]等分别报道了四川、西南五省、安徽、江苏、河南、陕西、黑龙江、新疆等地区牦牛、肉牛、奶牛的BVDV感染情况,表明在我国多数地区牛群感染BVDV已十分普遍并呈上升趋势,成为影响牛群健康的重要疫病之一。
James等[17]研究表明,随着BVDV与宿主之间的相互作用,BVDV对宿主的易感性、流行趋势、发病日龄及临床特征呈现一定的变化特点。美国70年代BVD发病特征表现为临床症状的牛以6月龄牛为主,而胎儿感染率不到5%,但到2000年,BVDV感染情况发生了很大的变化,胎儿感染率达25%,只有35%6月龄感染牛出现临床症状。在本次调查中,所有牛场均以怀孕母牛及2~8周龄犊牛发病为主,且表现典型临床症状,同场内3月龄以上犊牛未见发病,这也初步表明BVDV的感染及发病、易感日龄及临床特征呈现新的变化趋势。
关于该病的防控,目前尚无行之有效的方法和措施。欧洲一些国家普遍实施牛群检测、阳性者淘汰、卫生保障及健康认证为主的BVDV净化措施与根除计划,虽然付出了较长时间及巨大成本,但也获得了良好的防控效果[18]。我国多数牛场普遍采用猪瘟疫苗进行防治,虽也取得了一些成效,但BVDV常以持续感染的形式存在于牛群中,猪瘟弱毒疫苗免疫所产生的抗体水平仍不足以抵抗BVDV的感染,一些猪瘟疫苗免疫牛群也发生BVD,反而因猪瘟弱毒疫苗的使用而给该病的检测带来一定难度。同时,因产前注射猪瘟弱毒疫苗造成胎儿的速发型超敏反应而引起子宫破裂的病例也时有发生。因此,建议规模化牛场采用以检测为前提,淘汰阳性低产奶牛及持续感染牛只,逐步减少带毒牛只数量,健康牛只实施牛病毒性腹泻/黏膜病灭活疫苗免疫,以降低牛群BVD发生的风险,再结合隔离饲养、消毒及卫生措施,以实现有效控制。
4 小结
目前国内有关牛群BVDV感染的调查报道较多,但有关临床发病的确诊,尤其是同一牛场中怀孕母牛与犊牛同时发生BVD的报道并不多见。此次通过对石河子某牛场发病牛现场调查、临床检查、病理解剖表明该牛场怀孕母牛及犊牛的死亡原因为BVDV感染,但不排除可能存在其他病毒的混合感染。该诊断结果为该规模化牛场BVDV的免疫预防提供了依据。
[1] 王新平,任文陟,朱维正,等. 双抗体夹心ELISA检测牛病毒性腹泻病毒的研究[J]. 中国兽医学报,1995,03:246-249.
[2] 殷震,刘景华.动物病毒学[M].第2版.北京:科学出版社,1997,631-645.
[3] 金宁一,胡仲明,冯书章.新编人兽共患病学[M].北京:科学出版社,2007,399-417.
[4] OIE.Manual of Standards for Diagnostic Tests and Vaccines for Terrestrial Animals[M/OL]http; //www.oie.int/eng/normes/ mmanual/a - 00035.htm.
[5] 萨姆布鲁克 J, 拉塞尔 DW(黄培堂等译).分子克隆实验指南(第三版)[M].北京:北京科学出版社,2002.96-99.
[6] Taylor L F.Donkersgoed J V.Dubovi E J,et al.The prevalence of bovine viral diarrhea virus infection in a population of feedlot calves in western Canada[J].Can J Vet Res,1995,59(2):87-93.
[7] Yamamoto T,Kozasa T,Aoki H,et al.Genomic analyses of bovine viral diarrhea virus isolated frrom cattle imported into Japan between 1991 and 2005[J].Vet Microbiol,2008,127(3):386-391.
[8] Mishra N, Rajukumar K, Tiwari A,et al. Prevalence of Bovine viral diarrhoea virus(BVDV)antibodies among sheep and goats in India[J]. Trop Anim Health Prod,2009,1:21.
[9] 李佑民,刘振润,武银莲. 牛病毒性腹泻—粘膜病病毒株(长春184)的分离与鉴定[J]. 兽医大学学报,1983,02:113-120.
[10] 刘世杰. 牦牛病毒性腹泻/粘膜病的研究[J]. 西南民族学院学报(畜牧兽医版),1984,04:1-5.
[11] 高双娣,邱昌庆,周继章,等. 西北和西南五省(区)部分地区黄牛、牦牛牛病毒性腹泻/粘膜病血清学监测[J].中国兽医科技,1999,07:17-18.
[12] 邱昌庆,郭慧琛,程淑敏,等. 安徽、江苏、广西部分地区水牛牛病毒性腹泻/粘膜病血清学监测[J].中国预防兽医学报,2000,06:54-55.
[13] 张光辉,王富晓. 河南省牛病毒性腹泻病毒地方株的分离及鉴定[J]. 河南畜牧兽医,2005,05:8-10.
[14] 冯若飞,马忠仁,乔自林,等. 西安市宝鸡市新生荷斯坦小牛BVDMD血清学调查[J]. 中国兽医杂志,2006,05:33-34.
[15] 魏伟,李岩,刘长军,等. 黑龙江省部分奶牛场牛病毒性腹泻病毒感染的血清学调查[J]. 中国兽医科学,2009,06:561-563.
[16] 刘亚刚,刘娣琴,杨晓农,等. 四川省部分牛病毒性腹泻/粘膜病血清中和抗体检测[J]. 四川动物,2009,03:435-436.
[17] Mahony T J,McCarthy F M,Gravel J L,et al.Genentic analysia of bovine viral diarrhea viruses from Australia[J]. Vet Microbiol,2005,106(1-2):1-6.
[18] Andrews A H,Boyd H,Eddy R G,牛病学-疾病与管理.韩博,苏敬良,吴培福等译[M].北京:中国农业大学出版社,2006,176-186.
Diagnosis of Bovine Viral Diarrhea(BVD) in a Large-scale Cattle Farm in Xinjiang
RUAN Dong, SHAN Gen-qiang
(College of Animal Science and Technology, Shihezi University, Shihezhi 832003)
To determine the cause of death of adult cows and calves in a large-scale dairy farm in Shihezi Xinjiang. Field epidemiological investigation, clinical examination, pathologic examination, bacteriological examination and PCR detection were carried out. Sequence analysis of PCR products was carried out. After field investigation and laboratory diagnosis, 67 cows were killed and 14 cows were killed in March to May, of which 41 cows were pregnant and 8 died. The fatality rate was 19.51%, 26 calves of 2 ~ 8 weeks were killed and 6 calves died. The fatality rate was 23.07%. Adult cows and calves are showing elevated body temperature, mouth ulcers, diarrhea, some adult cattle performance miscarriage, stillbirth, limp, etc. Necropsy can be seen dead intestinal ulcer, shedding, bleeding, etc. The results of RT-PCR showed that the expected band of 286bp was obtained by tracheal swab and intestine swabs, which were different from those of the BVDV reference strains registered in Genbank.There were no detectable bacteria in the liver tissue after inoculation of LB broth. The homology was 90.6%~92.6%. It is indicated that the death of adult cows and calves was caused by BVDV in the scale cattle farm.
Bovine BVDV; Diagnosis; RT - PCR; Sequence analysis
S858.23
A
1004-4264(2017)06-0034-04
10.19305/j.cnki.11-3009/s.2017.06.008
2017-01-13
阮东(1992-),男,汉族,硕士研究生,研究方向为兽医技术服务。
剡根强(1958-),男,教授,博士生导师,主要从事动物传染病诊断与防治工作。

