鸭病毒性肝炎活疫苗的耐热冻干工艺策略设计
赵艳红,吕 芳,潘孝青,邓碧华,3,张金秋,3,卢 宇,3*,侯继波,3*
(1.江苏省农业科学院国家兽用生物制品工程技术研究中心, 江苏 南京 210014;2.江苏省农业科学院畜牧研究所,江苏 南京 210014;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
鸭病毒性肝炎活疫苗的耐热冻干工艺策略设计
赵艳红1,吕 芳1,潘孝青2,邓碧华1,3,张金秋1,3,卢 宇1,3*,侯继波1,3*
(1.江苏省农业科学院国家兽用生物制品工程技术研究中心, 江苏 南京 210014;2.江苏省农业科学院畜牧研究所,江苏 南京 210014;3.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏 扬州 225009)
【目的】为了提高鸭病毒性肝炎弱毒(DHV)活疫苗的耐热性能。【方法】选用蔗糖、普鲁兰糖、明胶、甘油、磷酸盐等成分设计耐热保护剂组方,根据配方的共晶点、塌陷温度科学设计冻干程序,并比较了不同预冻方式对鸭病毒性肝炎活疫苗的效价影响。【结果】耐热保护剂配方A在37 ℃10 d、15 d病毒损失分别为0.35、0.61 Lg;对快冻、慢冻以及退火3种不同的冻干方式进行比较,发现对鸭肝炎病毒耐热损失由大到小依次为:退火>慢冻>快冻;疫苗长期保存期试验结果表明,可在2~8 ℃可保存2年;采用10倍剂量免疫2日龄雏鸭均未出现死亡,且精神饮食体重增长均正常。【结论】采用A配方与快速冻干冻方式的耐热性能最好,延长保存期并且提高了耐热性能,为动物疫苗耐热新剂型的研发提供技术支撑。
鸭肝炎病毒;耐热保护剂;冻干工艺;耐老化试验
【研究意义】鸭病毒性肝炎(Duck Viral Hepatitis, DHV)是由鸭肝炎病毒((Duck Viral Hepatitis,DHV;属于小核糖核酸病毒)引起的雏鸭的一种以肝脏出血性炎症为特征的急性、烈性、高度致死性传染病。临床表现为痉挛、抽搐和角弓反张等神经症状,以肝脏肿胀、出血为特征性病变。雏鸭感染后的死亡率可达90 %~95 %,该病是目前危害养鸭业的主要疾病之一,给养鸭业造成了巨大的经济损失[1]。许多地区频频出现DHV免疫鸭群爆发鸭肝炎的报道,严重制约了养鸭业的健康发展[2]。世界动物卫生组织(OIE,1996)已将其划为B类传染病[1]。目前对该病的防控主要以疫苗接种为主[3],但鸭肝炎病毒属于小RNA病毒,无脂蛋白包膜,一般不耐受冷冻干燥[4],所以鸭病毒性肝炎活疫苗在2~8 ℃条件下的保存期只有3~6个月,大多需要在-15 ℃以下保存[5]。疫苗耐热性能差,使得免疫效果大大降低。【前人研究进展】长期以来,国内的兽用活疫苗大多采用传统的冻干工艺制备,国内主要采用蔗糖、明胶、脱脂乳等简单的组方,冻干的疫苗大多在-15 ℃以下储存;国外采用低聚糖、多元醇、蛋白、抗氧化剂、缓冲剂、填充剂等复合组方配伍而成,制备的冻干疫苗2~8 ℃可保存2年[6]。近年来,国内很多致力于疫苗制造技术的研究人员主要集中在耐热保护剂配伍和筛选研究上,例如陈生雷[7]成功筛选出以PVP K30、山梨醇、乳酸钙和硫脲为主要成分的耐热保护剂,对鸡新城疫、传染性支气管炎二联活疫苗(La Sota株+H120株)有较好的耐热效果,37 ℃保存10 d病毒含量下降0.4个滴度;王颖[8]用响应面法优化猪伪狂犬病毒耐热保护剂最优配方为谷氨酸钠2 %、L-精氨酸盐酸盐2 %、D-山梨醇2 %、酶解酪蛋白7.6 %、海藻糖1 %、明胶4 %、蔗糖15.2 %、牛血清白蛋白2 %。但是对于疫苗冻干工艺的研究鲜有报道。事实上,尽管冻干技术应用广泛历史悠久,但在实际冻干中,仍然依赖于人员技术能力和经验[9]。耐热保护剂和冻干程序是相互配套的工艺,预冻方式、预冻温度和干燥温度的不合理,容易导致冻干制品冻形不合格,例如塌陷、萎缩、熔融等,甚至大大降低冻干疫苗的效价[10]。在药物制剂领域,早已有根据药品的热参数来确定预冻温度和干燥温度,再进一步科学优化冻干程序的策略。【本研究切入点】因此,本研究针对目前国内鸭肝炎活疫苗耐热性能差的问题,以蔗糖、普鲁兰糖、明胶、甘油、磷酸盐等成分设计耐热保护剂组方,根据配方的共晶点、塌陷温度科学设计冻干程序,以37 ℃加速耐老化试验、残余水分为筛选指标。【拟解决的关键问题】获得耐热性能好的组方与冻干工艺,以期为动物疫苗耐热新剂型的研发提供技术支撑。
1 材料与方法
1.1 材料
毒株:本实验室邓碧华自行分离并鉴定的鸭病毒性肝炎病毒1型DHV-JS株(微生物保藏号:CGMCC NO. 8159)[11]。
鸭胚:用于本试验的11~12日龄鸭胚和1~7日龄雏鸭来源于无鸭肝炎病史、DHV 抗体效价阴性的健康种鸭群,品种为樱桃谷鸭。
蔗糖、普鲁兰糖、明胶、甘油、磷酸盐等(北京鼎国昌盛生物技术有限责任公司),DHV液由国家兽用生物制品工程技术研究中心自行分离[8];2日龄雏鸭来源于无鸭肝炎病史、DHV抗体效价阴性的健康种鸭群,品种为樱桃鸭。
1.2 仪器
0.15 m2冷冻干燥机(美国VirTis,型号Advantage Plus)、DSC热分析仪(美国PerKinElmer公司)、低温冻干显微镜(型号FDCS196,英国林肯)、37 ℃恒温干燥箱(上海博迅实业有限公司医疗设备厂)、2~8 ℃冷藏冰箱(中国,Haier)、磁力搅拌器(金坛荣华仪器制造有限公司)。
1.3 鸭病毒性肝炎病毒液的制备
按照文献[12]的方法进行:取鸭病毒性肝炎病毒1型的病毒样本,用灭菌生理盐水做100倍稀释,接种11~13日龄鸭胚,每胚0.2 mL,封孔后,37 ℃培养,弃去24 h内死亡的鸭胚,培养96 h后,收取尿囊液和胚体。将胚体去除胆囊,均质后与尿囊液混合,作为鸭病毒性肝炎病毒液。
1.4 鸭病毒性肝炎耐热保护剂活疫苗具体制备方法
用蔗糖、普鲁兰糖、明胶、甘油和磷酸盐等成分,按照不同比例组成3组保护剂A、B、C。其中,不耐热成分采用过滤除菌方法,耐热成分采用高温高压灭菌方法[10]。将3种保护剂与鸭病毒性肝炎病毒液按照体积比为1∶1混合,分装至7 mL西林瓶中,1 mL/瓶,用丁基胶塞半加塞后,置入冻干机箱体内并进行冷冻干燥,通过冻形、色泽、质地、水分含量、真空度、冻干前后病毒损失等指标的比较进行耐热保护剂的初步筛选。
1.5 加速热稳定性试验
将冻干品分别置37 ℃ 10、15 d,观察其外形, 测定疫苗病毒效价ELD50以及疫苗残余水分、真空度(具体方法参考文献[13]),以病毒滴度下降差值≤1.0 Lg为判定标准筛选配方[14]。
1.6 耐热配方热参数的测定
将1.4方法中冻干的成品疫苗,经1.5加速热稳定试验进行筛选,确定耐热性能较好的一组配方,对其进行共晶点、塌陷温度的测定。共晶点采用电阻法,塌陷温度采用低温冻干显微镜测定,检测条件为:Temp-40 ℃,Vac 20.0 Pa,Ramp Row 3 Rate 3 ℃/min,Limit -40 ℃。具体由山东新华医疗器械股份有限公司进行检测。
1.7 疫苗冻干程序的筛选
根据1.6测定的耐热配方热参数,确定预冻温度以及主干燥温度;并设计快速冷冻、慢速冷冻以及退火3种方式对鸭病毒性肝炎耐热疫苗进行冻干,采用1.5方法筛选最佳的冻干程序。
1.8 鸭病毒性肝炎耐热活疫苗的保存期测定
将耐老化实验筛选得到的冻干疫苗制备3批次,将冻干疫苗于2~8 ℃、37 ℃条件下保存,在不同时间点取出测定其ELD50,以保存期内病毒滴度下降1.0 Lg为判定终点,得到耐热冻干保护剂疫苗在不同温度下的保存期[14]。
1.9 鸭病毒性肝炎耐热活疫苗安全性检验
根据参考文献[15]所述方法进行。选用2日龄雏鸭,实验组取鸭病毒性肝炎耐热活疫苗疫苗分别经过滴鼻/点眼、肌肉注射2种途径进行免疫(10个使用剂量),每组20只,对照组不免疫。接种后隔离观察14 d,主要观察疫苗接种后雏鸭的精神、采食、饮水、生长、增重等临床情况。
2 结果与分析
2.1 DHV耐热保护剂筛选
2.1.1 3组配方的筛选 用含蔗糖、普鲁兰糖、明胶、甘油和磷酸盐等成分配伍的3组耐热保护剂配方A、B、C与鸭肝炎病毒混合冻干后,疫苗置于37 ℃进行加速耐老化试验,结果表明,A、B、C 3组配方制备的冷冻干燥疫苗在37 ℃保存10、15 d后,病毒滴度损失均小于1.0 Lg,但其中保护剂A滴度损失最小,10、15 d病毒损失分别为0.35、0.61 Lg。因此选定保护剂A为鸭病毒性肝炎活疫苗的耐热保护剂进行相关试验(图1)。
2.1.2 耐热冻干保护剂最佳pH值筛选 试验参照相关文献[16-17]考虑不同pH值对鸭肝炎病毒会产生影响,因此选取一定的pH值,对耐热冻干保护剂A进行适合DHV最佳pH值的筛选,ELD50测定结果见表1, 通过不同pH值的对比试验结果显示,当保护剂pH为6.7时病毒的耐热损失最低,为0.42 Lg,因此确定耐热保护剂A的pH值6.7为最佳。

图1 37 ℃保存期样品耐老化损失Fig.1 The aging loss of the sample at 37 ℃ aging loss
2.2 耐热配方热参数测定
根据2.1中筛选出耐热性能较好配方A,对其进行热参数测定。结果表明,配方A共晶点为-25.4 ℃,塌陷温度-36.6 ℃(表2)。
2.3 疫苗冻干程序的设计和筛选
根据冻干程序设计原则[18],提示在预冻时样品温度需低于共晶点以下8~10 ℃方能完全冻实,主干燥温度不能超过塌陷温度样品才能保持良好的冻形,根据2.2测定的结果,设定预冻温度为-42 ℃、主干燥温度为-25 ℃。分别采用快速冷冻Cycle 1、慢速冷冻Cycle 2以及退火Cycle 3种方式对配方A进行冻干(图2),冻干全程时长为40~42 h。
采用3种冻干程序冻干后,观察疫苗外观(图3),发现快冻和退火方式疫苗外观为干燥的圆饼状,而慢冻方式冻干后疫苗有皱缩。将疫苗置于37 ℃保存10 d进行加速热稳定性评价(图4)。结果表明,3种冻干方式后疫苗耐热损失均小于1.0 Lg,其中快冻程序Cycle 1耐热损失最小为0.35 Lg,而退火程序Cycle 3产生的耐热损失最大为1.0 Lg;采用慢冻程序Cycle 2耐热损失居中0.88 Lg。综合疫苗外观以及耐热性能,选择耐热损失最小的快冻方式(Cycle 1)作为配方A的干燥程序。
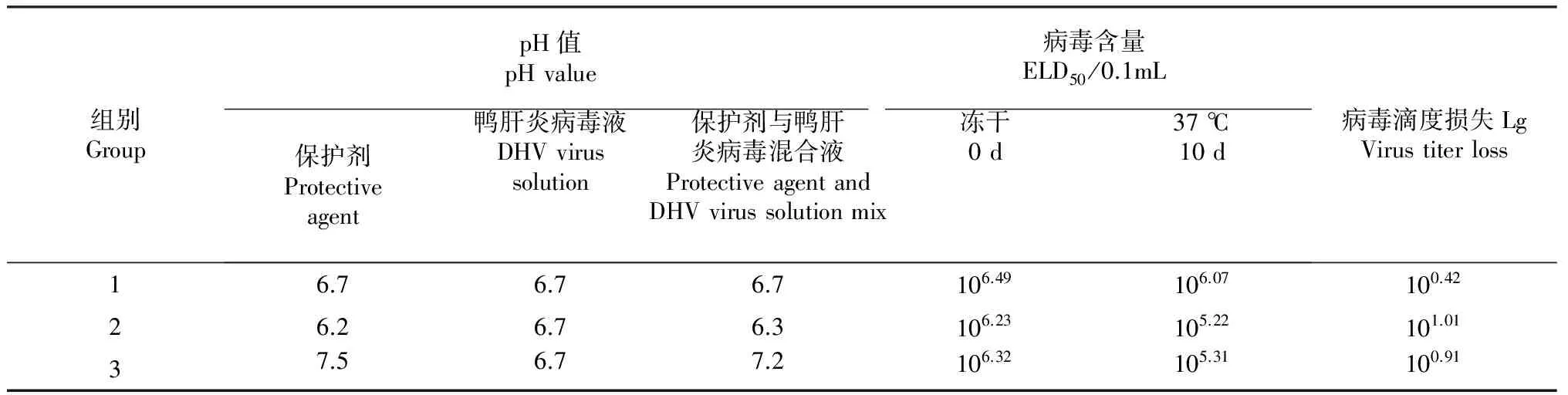
表1 保护剂最佳pH值对比试验结果

表2 配方A的热参数

Cycle 1-快冻(隔板提前预冷至-42 ℃后样品进仓);Cycle 2-慢冻(隔板预冷4 ℃,样品进仓后在150 min内缓慢降温至-42 ℃);Cycle 3-退火(样品快冻后升温至-25 ℃维持60 min后再降温至-42 ℃冻实)图2 3种不同预冻方式的冻干曲线Fig.2 The cycles of three different freeze drying
2.4 耐热冻干保护剂产品的相关理化检验结果
将筛选后的保护剂A(pH 6.7)与鸭肝炎病毒混匀后按照优化最佳工艺Cycle 1重复冻干3批次,并检验3批次疫苗的物理性状、真空度检测、冻干剩余水测定结果均符合《中华人民共和国兽药典》[19](表3)。
2.5 鸭病毒性肝炎耐热活疫苗保存期测定
将2.4中重复冻干的3批次疫苗于2~8 ℃进行长期保存,分别在保存第3、6、9、12、18、24个月测定疫苗效价(图5),并以病毒滴度损失1.0 Lg作为疫苗的保存终点。鸭病毒性肝炎活疫苗A 3批次在2~8 ℃保存24个月病毒含量损失为0.53~0.61 Lg,有效保护了鸭病毒性肝炎病毒的损失。
2.6 鸭病毒性肝炎耐热活疫苗的安全性
取耐热冻干保护剂疫苗A进行安全性动物试验:试验共分为3组,免疫后,隔离观察14 d,主要观察疫苗接种后雏鸭的精神、采食、饮水、生长、增重等临床情况, 如表4可见:大剂量(10倍推荐免疫剂量)分2种免疫途径注射免疫后鸭只无死亡;对照组与免疫组相比,鸭只增重差异不显著(P>0.05)。

图3 不同冻干程序冻干后疫苗外观Fig.3 The appearance after freeze drying by cycle 1-cycle 3

疫苗冻干批次Vaccinebatchlots物理性状Physicalproperties残余水份Remainingmoisture(﹤4%,n=4)真空度Thedegreeofvacuum批次1Batch11.66±0.08合格Compliance批次2Batch2疏松海绵状,易于脱壁,加稀释液后迅速溶解,溶解后呈淡粉红色液体Loosespongy,easyoffthewall,plusDissolverapidlyafterdilution,dissolvedwaspalepinkliquid1.71±0.02合格Compliance批次3Batch31.56±0.06合格Compliance
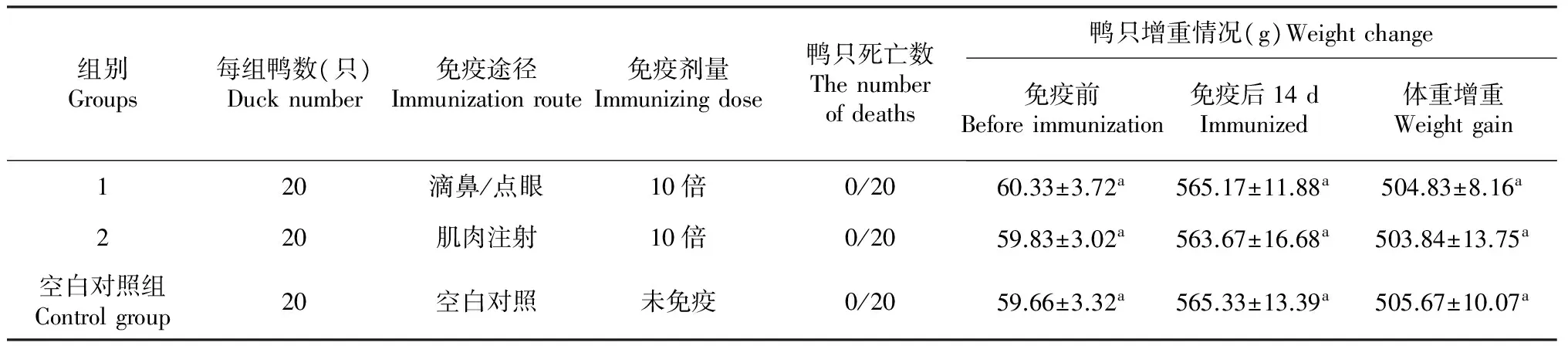
表4 耐热冻干保护剂的安全性动物试验
注:“a”表示差异不显著。

图4 鸭肝炎疫苗不同预冻方式冻干后37 ℃10 d耐热损失Fig.4 The DHV vaccine titer loss of different freeze drying cycles

图5 鸭病毒性肝炎活疫苗2~8 ℃保存期测定Fig.5 Storage stability for DHV vaccine stored at 2-8 ℃
3 讨 论
耐热冻干保护剂比常规冻干保护剂更周到地考虑了具有生物活性的制品在较高温度和较长保存时间的情况下,冻干物质可能产生的物理和化学变化对活疫苗存活的影响。因此耐热冻干保护剂的组成配方和比例与冻干曲线选择对于冻干活疫苗的质量相当重要,根据冻干保护剂的种类和作用机制[20],在保护剂筛选,选择了蔗糖、普鲁兰糖、明胶、甘油等几类物质作为保护剂的主要成分。蔗糖、甘油在保护剂中作为防冻剂,主要是防止和减少冷冻过程结晶水的形成;普鲁兰糖具有较好的耐热性能,选择普鲁兰糖作为稳定剂能够较好的解决鸭肝炎病毒不耐热的情况;明胶作为赋形剂,能防止有效物质随水蒸气一起升华,赋予产品一定外型;虽然试验中保护剂的最佳pH值为6.7时病毒滴度损失最低,但对冻干过程的影响还需进一步的深入研究。
冻干工艺往往是兽用疫苗中容易忽略的环节。在制定冻干曲线时,应充分考虑耐热疫苗的共晶点、塌陷温度等热参数,然后进行科学合理的设计冻干程序。此外,预冻方式不同、冰晶颗粒的大小对微生物的机械性损伤程度也不同,快速冷冻会形成细小的冰晶颗粒,慢速冷冻形成大冰晶,退火则会使制品二次结晶并提高冻干制品的玻璃化转变温度[21]。因此,本研究通过测定配方的热参数进行科学设计冻干曲线,同时考虑不同的预冻方式对病毒产生的不同影响,尝试了快冻、慢冻和退火3种冻干工艺,采用快冻冻干的疫苗耐热性能最好,而慢冻以及退火的疫苗耐热性能均较大,其原因可能是快速冷冻产生的冰晶颗粒小,对病毒的机械性损伤小,而慢冻形成的大冰晶对病毒的损伤大,退火过程中由于二次结晶导致熔融,对病毒的机械性损伤更大。
鸭病毒性肝炎活疫苗3批次冻干产品于2~8 ℃保存不同时间并测定其物理性状、真空度、剩余水分以及病毒损失,结果表明,在2~8 ℃条件下可以保存24个月且病毒损失仅在0.53~0.61 Lg,重复性好;37 ℃保存15 d加速耐老化试验表明,病毒损失仅0.61 Lg;通过滴鼻/点眼、肌肉注射对2日龄雏鸭接种10个剂量疫苗后14 d鸭只均安全。本研究较好地解决了鸭肝炎病毒耐热保护剂以及配套的冻干工艺科学设计的问题,优化了预冻方式,为兽用耐热活疫苗冷冻干燥工艺的科学设计提供了重要的数据支持。
4 结 论
本研究通过配方筛选、缓冲液不同pH值对比确定保护剂A与快速冻干方式为鸭病毒性肝炎病毒的最佳保护与冻干工艺;能使鸭病毒性肝炎活疫苗在2~8 ℃条件下可以保存24个月;且37 ℃保存15 d病毒损失仅在0.53~0.61 Lg;较好地解决了鸭肝炎病毒耐热保护剂以及配套的冻干工艺科学设计的问题,优化了预冻方式,为兽用耐热活疫苗冷冻干燥工艺的科学设计提供了重要的数据支持。
[1]Wen Xiong, Xia Ma. Determine the structure of phosphorylated modification of icariin and its antiviral activity against duck hepatitis virus A[J].BMC Veterinary Research,2015(11):205.
[2]Jiming Gao, Junhao Chen. Genetic Variation of the VP1 Gene of the Virulent Duck Hepatitis A Virus Type 1 (DHAV-1) Isolates in Shandong Province of China [J]. Virologica Sinica, 2012, 27 (4):248-253.
[3]Shao-Li Lin, Ri-Chao Cong, et al. Circulation and in vivo distribution of duck hepatitis A virus types1 and 3 in infected ducklings [J]. Arch Virol,2016,161:405-416.
[4]Zhong Zou, Yong Hu. Efficient strategy for constructing duck enteritis virus-based live attenuated vaccine against homologous and heterologous H5N1 avian influenza virus and duck enteritis virus infection [J]. Veterinary Research,2015,46:42
[5]何庆雄.鸭病毒性肝炎弱毒活疫苗临床免疫试验研究[D].2010.6.
[6]O’Neil Wiggan, Livengooda, Shawn J,et al. Novel formulations enhance the thermal stability of live-attenuated favivirus vaccines[J]. Vaccine,2011(29):7456-7462.
[7]陈生雷, 李凤艳, 高洪霞, 等. 鸡新城疫、传染性支气管炎二联活疫苗耐热保护剂筛选和优化[J]. 现代畜牧兽医, 2014(8):1-4.
[8]王 颖, 王 栋, 伏小平. 响应面法优化猪伪狂犬病病毒耐热保护剂的研究[J]. 中国预防兽医学报, 2014, 36(5):391-384.
[9]朱明文. 生物制品冷冻干燥技术与策略[J]. 现代科学仪器, 2012, 8(4):19-23.
[10]李伟杰, 蒋桃珍, 魏财文 等. 微生物冷冻干燥保藏技术的影响因素分析[J]. 中国兽药杂志, 2014, 48(6):12-14.
[11]邓碧华, 王凯民, 卢 宇 等. 一株江苏新型鸭肝炎病毒的鉴定[J]. 浙江农业学报, 2014, 26(6):1431-1436.
[12]邓碧华.一株鸭病毒性肝炎病毒及其应用[P].20131048972.0.
[13]中华人民共和国农业部. 中华人民共和国兽用生物制品规程(2000版)[M].北京:化学工业出版社, 2000.
[14]中华人民共和国农业部. 兽用生物制品质量标准汇编 上册(2006-2008年)[M]. 北京:中国农业出版社,2009.
[15]张小飞.鸭病毒性肝炎弱毒疫苗(A66株)的研制[D]. 南京农业大学,2010.
[16]Sedigheh Asada, Seyed-Fakhreddin Torabi, Mehrnoosh Fathi-Roudsari,er al. Phosphate buffer effects on thermal stability and H2O2-resistance of horseradish peroxidase[J]. International Journal of Biological Macromolecules, 2011,48:566-570.
[17]陈果亮. 新城疫(ND-C30)活疫苗耐热保护剂的筛选[D].扬州大学,2007.
[18]华泽钊. 冷冻干燥新技术[M].北京:科学出版社, 2005:214-216.
[19]中国兽药典委员会.中华人民共和国兽药典(二OO五年版)[M].北京:中国农业出版社,2006.
[20]赖 志, 漆世华, 高俊峰. 一种猪伪狂犬病毒天然弱毒株C株及其耐热保存方法[P]. C N102399755. 2012,4,4.
[21]钱应璞. 制剂药品的冻结真空干燥技术[J]. 机电信息, 2005, 15:3-11.
(责任编辑 李 洁)
Heat Resistant Formulation Screening and Freeze-drying ProcessStrategy Design of Duck Virus Hepatitis Vaccine
ZHAO Yan-hong1, LV Fang1,PAN Xiao-qing2,DENG Bi-hua1,3, ZHANG Jin-qiu1,3,LU Yu1,3*, HOU Ji-bo1,3*
(1. National Research Center of Veterinary Biologicals Engineering and Technology, Jiangsu academy of Agricultural Sciences, Jiangsu Nanjing 210014,China; 2. Livestock Research Institute ,Jiangsu Academy of Agricultural Sciences, Jiangsu Nanjing 210014,China; 3.Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Jiangsu Yangzhou 225009,China)
【Objective】In order to improve the heat resistance of attenuated DHV (DHV) live vaccine.【Method】Selection sucrose, pullulan, gelatin, glycerin, phosphates and other ingredients designed heat-protective agent prescriptions, according to the eutectic point formula, the collapse temperature of the scientific design lyophilization process, and compared the potency of the effects of different ways of pre-frozen duck hepatitis vaccine live.【Result】A better heat protection formulations heat resistance, 37 ℃ 10d, 15 d, respectively, for the viral loss 0.35Lg, 0.61Lg; For quick freezing, slow freezing and freeze-drying annealing three different ways to compare, find the heat loss duck hepatitis virus descending order: Annealing> slow freezing> Fast freeze; Vaccine trial results showed that long-term storage, can be stored at 2-8 ℃ 2 years; 10-fold dose of 2-day-old ducklings were not immune of death, and spiritual diet weight gain were normal, living proof of duck hepatitis heat ducklings safe vaccine, no side effects. 【Conclusion】The use of A formula and the rapid freeze-drying method of the best heat resistance, extend the shelf life and improve the heat resistance for animal vaccine heat the development of new formulations to provide technical support.
DHV; Heat-protective agent; Freeze-drying;Aging test
1001-4829(2017)7-1680-06
10.16213/j.cnki.scjas.2017.7.038
2016-08-17
江苏省农业科技自主创新资金项目[cx(14)2085];公益性行业(农业)科研专项(201303046)
赵艳红(1987-),女,硕士研究生,研究方向兽用疫苗耐热新剂型, E-mail:18260080269@163.com,*为通讯作者:卢 宇,E-mail:luyu@jaas.ac.cn。
S834
A

