全人工繁殖达氏鲟胚胎发育的形态学和组织学观察
刘 亚,龚 全,李 强,杜 军,赵 刚
(四川省农业科学院水产研究所,四川 成都 611730)
全人工繁殖达氏鲟胚胎发育的形态学和组织学观察
刘 亚,龚 全,李 强,杜 军,赵 刚
(四川省农业科学院水产研究所,四川 成都 611730)
【目的】为探讨达氏鲟胚胎在各阶段的形态学特征和发育过程。【方法】用Leica EZ4 HD体视显微镜和 Leica DM2500正置荧光显微成像系统分别对全人工繁殖达氏鲟受精卵的胚胎发育过程和组织切片进行了观察和描述。【结果】全人工繁殖达氏鲟受精卵呈球形、灰褐色或淡黄色、不透明,卵径2.6~3.2 mm。受精卵在水温为16~18 ℃下历时159 h后开始出膜,整个发育过程可人为地划分为受精卵、卵裂、囊胚、原肠胚、神经胚、器官发生和出膜7个阶段,34个发育时期。整个胚胎发育过程所需总积温为2322~2544 ℃*h。【结论】总体而言,达氏鲟胚胎发育阶段经历鲟形目鱼类普遍存在的辐射状卵裂方式,与其它鲟鱼胚胎发育早期阶段有较高的相似性。
达氏鲟;全人工繁殖;胚胎发育;形态学;组织学
【研究意义】达氏鲟(AcipenserdabryanusDumeril),隶属于鲟形目(Acipenseriformes),鲟科(Acipenseridae),鲟属(Acipenser),又称长江鲟、沙腊子,属于国家一级重点保护动物,为我国特有种。达氏鲟主要分布在长江干流和金沙江下游,在嘉陵江和沱江流域也有分布[1],曾经是长江上游干流和主要支流的渔业捕捞对象之一。由于过度捕捞、生存环境的破坏、水利水电工程建设和环境污染等因素的影响, 20世纪中后期其资源量急剧下降。按照世界自然保护联盟(IUCN)1994年评估标准和1996年的评估结果,达氏鲟处于极危级(CR)[1]。【前人研究进展】目前,对达氏鲟的研究主要集中于资源调查、池塘养殖、疾病防治及生长特性等方面[2-8],而其发育生物学研究仅有零星报道。据资料记载,前人[9]在1976年对野生达氏鲟亲鱼开展了拴养繁殖,并进行了胚胎发育的形态学观察,获得部分图片,但由于研究条件的限制,早期图示资料有限,且缺乏系统性研究。【本研究切入点】本研究首次对全人工繁殖子一代达氏鲟的胚胎发育进行形态学并结合组织学观察,并比较正常和异常发育的受精卵形态学特征。通过讨论野生拴养繁殖和全人工繁殖条件下胚胎发育的差异以及达氏鲟与其近缘种胚胎发育的异同。【拟解决的关键问题】旨在掌握和揭示达氏鲟胚胎发育规律,丰富达氏鲟发育生物学的基础资料,为人工繁殖、养殖生产以及育种研究等提供科学依据,从而促进该资源的保护和合理利用。
1 材料与方法
1.1 亲鱼来源及性腺发育基本情况
实验用亲鱼雌雄各5尾,为四川省农业科学院水产研究所在长江宜宾段捕获野生子一代个体,于2006年进行内塘驯养。雌鱼体长:104~126 cm,体重:9.2~17 kg,年龄7~9龄,性腺发育Ⅳ期,均为初产鱼。雄鱼体长:102~118 cm,体重:8.9~14.5 kg,年龄7~9龄,性腺发育Ⅳ期。
1.2 催产和孵化
通过注射LHRH-A2及鲤鱼脑垂体进行人工催产,采用半干法人工授精,得到受精卵。受精后的鱼卵用20 %的滑石粉脱粘,经清洗后转入孵化器中流水孵化,孵化水温16~18 ℃。
1.3 胚胎发育过程观察
用解剖针去除外膜,经清水冲洗,采用Leica EZ4 HD体视显微镜观察并拍照,同时取部分样品固定于10 %甲醛溶液中以供后期复查和作为组织切片样品备用。胚胎发育前期每0.5 h观察1次,到达囊胚期后每2 h观察1次,每次观察取样30粒以上,观察时间从刚受精开始至全部出膜结束。各发育阶段的起始时间以发育过程中50 %以上个体达到该时期为准。
1.4 组织切片及HE染色
将胚胎发育各阶段的受精卵用10 %甲醛固定24 h后转移至70 %酒精中保存。经梯度乙醇脱水,二甲苯透明,石蜡包埋。纵切胚胎动物极和植物极,切片制好后置于37 ℃恒温箱中烘干。将烘干后的切片进行HE染色,在Leica DM2500正置荧光显微成像系统下观察组织学形态结构,拍照记录。
2 结果与分析
2.1 达氏鲟胚胎发育时序
根据达氏鲟胚胎发育各阶段形态和组织学特点,参考其他学者[10-17]的研究工作,对达氏鲟的胚胎发育过程进行分期和描述。在16~18 ℃温度条件下,达氏鲟胚胎从受精开始至发育至出膜耗时129 h,人为可划分7个阶段,包括:受精卵、卵裂、囊胚、原肠胚、神经胚、器官发生和出膜。根据胚胎发育时序及形态特征变化,将7个阶段划分为34个时期(表1)。整个胚胎发育过程所需总积温为:2322~2544 ℃*h。
2.2 各阶段发育特征
2.2.1 受精卵阶段 成熟达氏鲟卵呈球形、灰褐色或淡黄色、不透明;卵径2.6~3.2 mm,卵膜紧贴于卵的表面(图2-1);卵为粘性、沉性卵。刚受精的卵,动物极集中多数细胞质,中央出现暗色的色素环包围着明亮的极性斑,植物极色素均匀(图1-1),卵膜开始吸水,并逐渐开始形成卵周系(图2-2)。受精后约25 min,受精卵吸水膨胀,卵径约3.2~3.8 mm,形成较大的卵周隙,此时受精卵具有较强黏性;动物极朝上,植物极朝下,细胞质从植物极向动物极流动,在动物极中心形成一个暗斑,暗斑周围有一宽的明亮带(图1-2);受精后大约1 h,色素在偏心的动物极积累形成褐色带(图1-3),胚盘形成期,胚盘隆起不明显(图2-3)。
2.2.2 卵裂阶段 达氏鲟的卵裂为特殊的辐射裂。受精后4 h,动物极出现一纵向分裂沟,为经裂,将动物极分裂成大小相似的2个分裂球,此时胚胎进入2细胞期(图1-4)。受精后5 h,第2次分裂开始,为经裂;此时卵裂沟与第1次卵裂沟垂直,受精卵被分割成 4 个大小基本相同的分裂球,胚胎进入4细胞期(图1-5)。受精后6 h,第3次卵裂开始,仍然为经裂,受精卵被分裂成8个大小不等的分裂球(图1-6);进入8细胞期。同时第1次分裂沟在植物极闭合,植物极被分为两部分。受精后7 h,第4次卵裂开始,出现横向分裂沟,为纬裂,此时,胚胎被分成16个大小不等的分裂球(图1-7);进入16细胞期。同时第2次分裂沟延伸至赤道下方,但大多数并未在植物极形成完全闭合。受精后8 h,第5次卵裂开始,第 2 次的纵向分裂沟在植物极闭合,胚胎被分成 32 个大小不等的分裂球(图1-8),进入32细胞期。受精8.8 h后,动物极分成越来越小的不规则细胞,进入多细胞期。此时,动物极中心出现较深的色素,植物极完全分裂(图1-9)。
2.2.3 囊胚阶段 受精后9 h 30 min,胚胎进入囊胚早期,动物极色素变浅并逐渐变得明亮,植物极色素较深。动物极分裂球变小,单个细胞可辨认(图1-10);植物极分裂球仍较大。受精后 11 h,胚胎进入囊胚中期,分裂球更小,动物极细胞核分裂出现不同步,整个受精卵的分裂球之间有明显的间隙(图1-11)。受精后16 h,进入囊胚晚期,动物极、植物极分裂球均不断变小,动物极细胞间的界线变得模糊,单个细胞难以辨认,动物极开始往植物极下包(图1-12),形成囊胚腔(图2-4、2-5)。
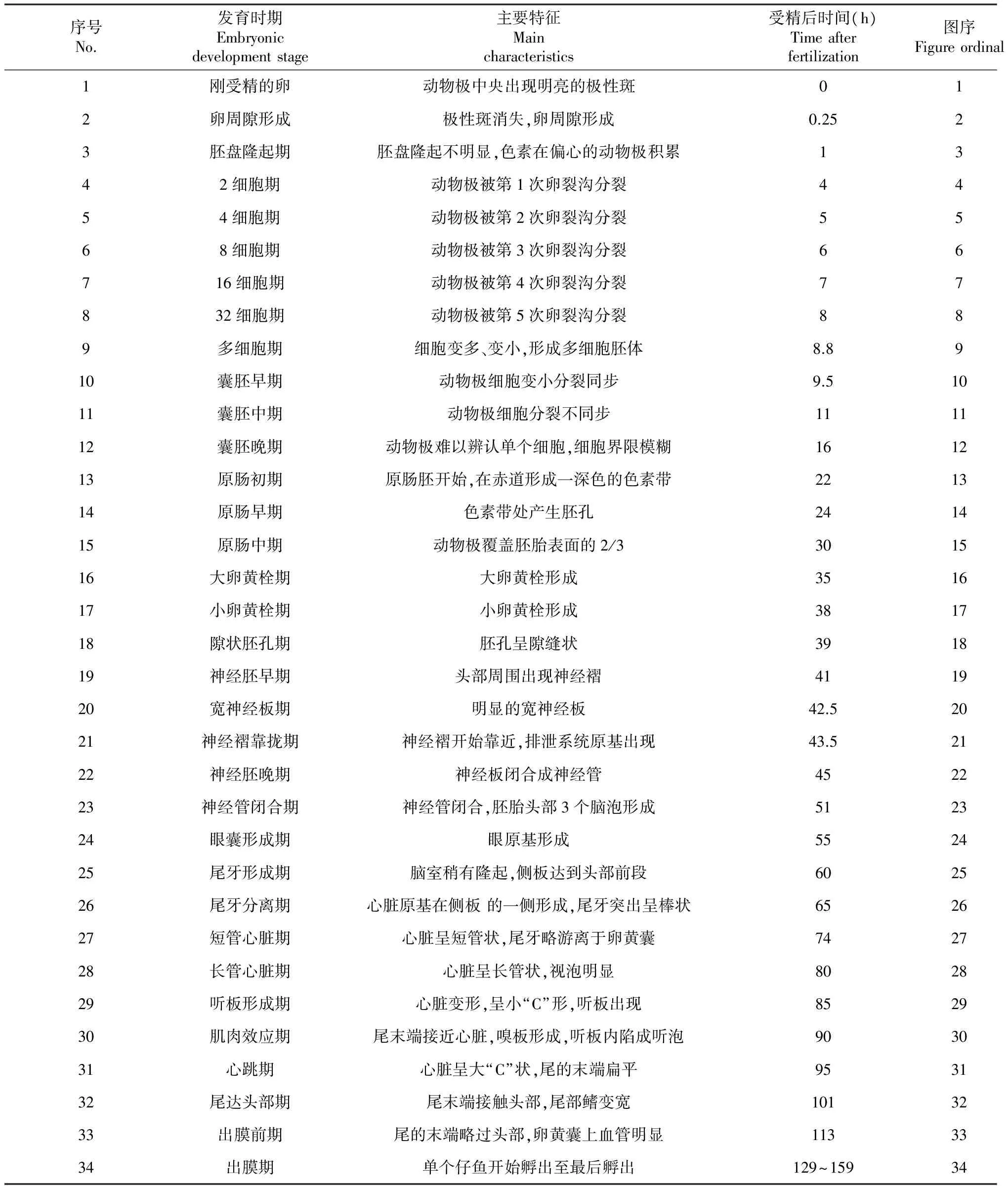
表1 全人工繁殖达氏鲟胚胎发育过程
2.2.4 原肠胚阶段 受精后约22 h,原肠初期开始,一深色的色素带出现在赤道附近形成(图1-13)。受精后 22 h,胚胎进入原肠初期,色素带处产生一个短而不深的狭缝状胚孔(图1-14)。受精后约30 h,原肠中期开始,此时侧唇和腹唇形成,外胚层细胞通过侧唇和腹唇继续内卷,形成胚环;动物极覆盖胚胎表面的 2/3,植物极、动物极界限明显(图1-15)。受精后约35 h,内胚层细胞仍然暴露在植物极外面,形似栓状,故称为“卵黄栓”。较大的卵黄栓像一个大塞子嵌在胚环内,进入大卵黄栓期,动物极和植物极界限很清晰(图1-16)。受精后约38 h,进入小黄栓期,植物极仅有一个很小的卵黄栓,动物极几乎覆盖整个卵(图1-17)。在原肠早期可见包被层EVL及深层细胞DC(图2-6),原肠中期和后期,原肠胚明显(图2-7、2-8);上胚层Ep,内胚层 En,下胚层 Hy可见(图2-9)。
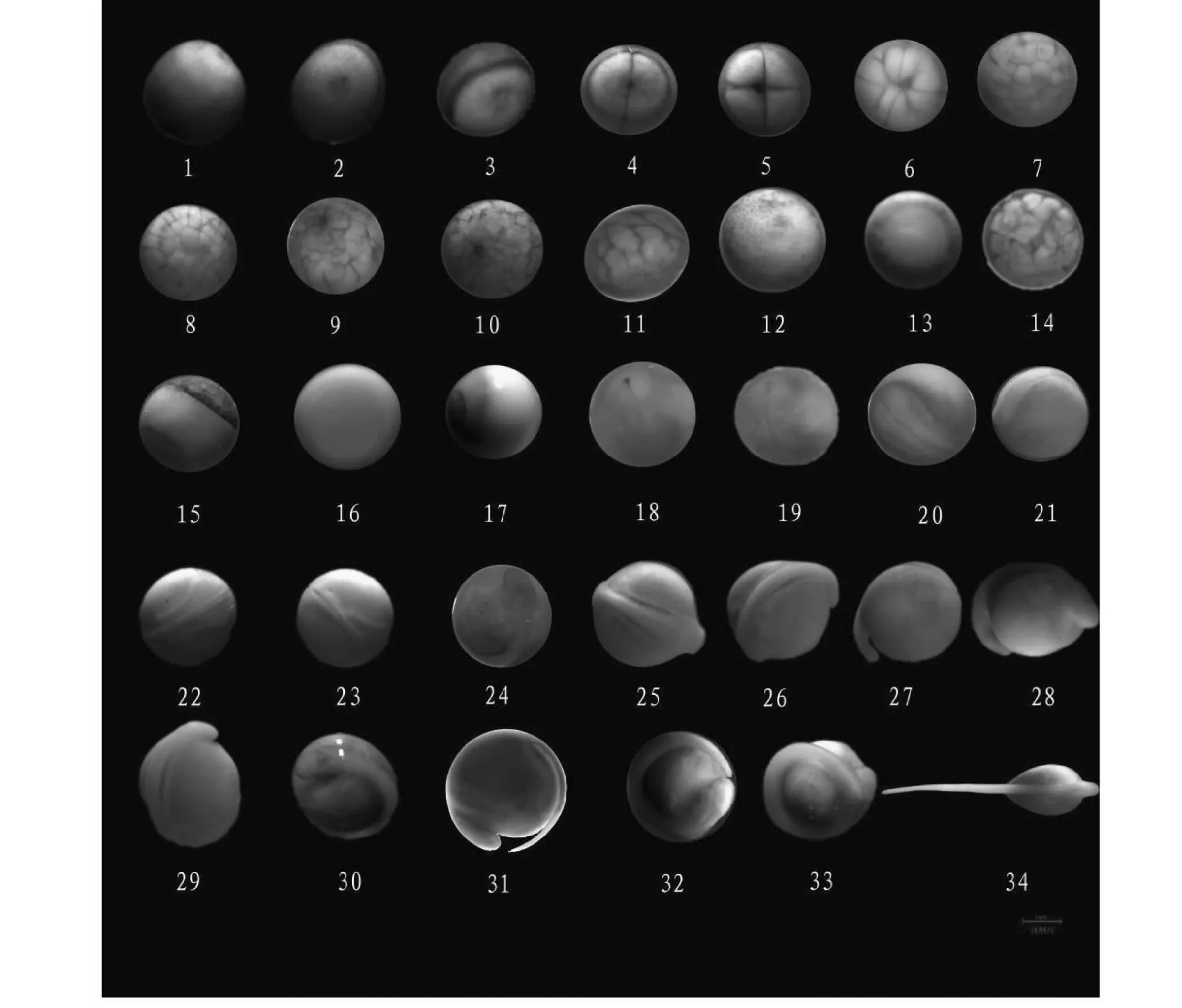
1.刚受精的卵;2.卵周隙形成;3.胚盘隆起期;4.2细胞期;5.4细胞期;6.8细胞期;7.16细胞期;8.32细胞期;9.多细胞期;10.囊胚早期;11.囊胚中期;12.囊胚晚期;13.原肠初期;14.原肠早期;15.原肠中期;16.大卵黄栓期;17.小卵黄栓期;18.隙状胚孔期;19.神经胚早期;20.宽神经板期;21.神经褶靠拢期;22.神经胚晚期;23.神经管闭合期;24.眼囊形成期;25.尾牙形成期;26.尾牙分离期;27.短管心脏期;28.长管心脏期;29.听板形成期;30.肌肉效应期;31.心跳期;32.尾达头部期;33.出膜前期;34.出膜期图1 全人工繁殖达氏鲟胚胎发育Fig.1 Embryonic development of artificially-bred A. dabryanus Dumeril
2.2.5 神经胚阶段 受精后约39 h,卵黄栓逐渐消失,胚孔的二侧唇相互靠拢,胚孔边缘接近闭合,只留下极其狭窄的裂隙,进入隙状胚孔期(图1-18)。受精后约 41 h,胚胎背部开始形成马蹄状的神经板,随后,神经板增厚,并在周围神经板脑部周围出现神经褶(图1-19)。受精后约42.5 h,进入宽板神经期,在头部神经板周围有清楚的呈马蹄形的神经褶(图1-20);神经板中央有向下增长的呈纵行的神经沟。受精后43.5 h,脑部处的神经褶边缘升高、增厚并逐渐靠拢。神经板下陷、变窄,在躯干部的两侧出现排泄系统原基(图1-21)。受精后45h,脑部神经褶继续靠拢,神经板最后闭合成神经管(图1-22);躯干部的神经褶也开始靠近,排泄系统原基加长。受精后51 h,神经管闭合,沿神经褶融合线的联合清晰可见;头部逐渐膨大加长,胚胎头部形成为前、中、后 3 个脑泡(图1-23);胚胎的头和尾部已很明显,胚体位于背面,卵黄囊位于腹面;排泄系统原基也显著加长,但没有达到神经管末端。该阶段神经板形成(图2-10、2-11),视泡开始出现(图2-12),神经管NT及脊索NO形成(图2-13、2-14、2-15、2-16),此后肌节So也可见(图2-17)。

表2 全人工繁殖达氏鲟与其它鲟科鱼类胚胎发育情况的比较
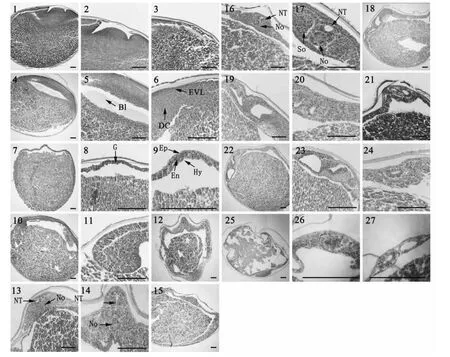
1.未受精;2.刚授精3 min;3.胚盘形成期;4.囊胚期;5.囊胚腔 Bl;6.原肠早期 包被层 EVL,深层细胞 DC;7.原肠中期;8.原肠胚 9.上胚层 Ep,内胚层 En,下胚层 Hy;10.神经胚期;11.神经板形成;12.视泡出现期;13.神经管 NT,脊索 No形成;14.神经管 NT,脊索 No.;15. 神经胚期(神经管闭合);16.神经管 NT,脊索 No.;17.神经管 NT,脊索 No.,肌节So ;18、19.体节出现;20.眼囊期;21.听囊期;22.脑分化期;23.围心腔形成期;24.消化管形成;25.尾芽游离期;26、27.出膜前期 图中比例尺大小均为200 μm图2 全人工繁殖达氏鲟胚胎发育的组织学观察Fig.2 Histological observations of embryonic development in artificially-bred A. dabryanus Dumeril

达氏鲟A.dabryanus发育水温(℃)Watertemperatureofembryonicdevelopment总孵育时间(h)Timeofembryonicdevelopment积温(℃∗h)Accumulatedtemperature平均卵径(mm)Averageeggdiameter全人工繁殖16.0~18.0129~1592322~25442.85野生拴养催产繁殖[9]17.0~18.0115~1172012~20473.00
2.2.6 器官发生阶段 胚胎发育至55 h进入视泡形成期,2个眼突形成于前脑泡处,眼原基形成(图1-24)。受精后约60 h,侧板达到头部前端,排泄系统原基前部增厚,肾小管原基形成,此时胚胎尾部扁平(图1-25)。受精后65 h,侧板从接近到完全联合,排泄系统从身体中部一直延伸至尾端;胚体向上隆起,高出球面,尾芽呈棒状并突出(图1-26)。受精后约74 h,心脏开始呈短管状,位于头部的前下方(图1-27);头部开始抬起,尾芽开始逐渐变长变窄。受精后约80 h,心脏原基呈长管状(图1-28),头明显抬高,视泡明显。受精后约 85 h,头部继续抬高,心脏呈“C”形;听板在脑的第三膨大部分的两侧出现(图1-29)。受精后约 90 h,胚胎尾向腹面弯曲加长,并逐渐接近心脏,肌肉也开始颤动,听泡形成(图1-30)。受精后约95 h,心脏呈大“C”状,尾的末端扁平(图1-31)。受精后约 101 h,尾末端继续伸长并接触头部,胚胎在卵内转动(图1-32)。该阶段组织切片图可见体节的出现(图2-18、2-19),眼囊期(图2-20)、听囊期(图2-21)、脑分化期(图2-22)以及围心腔和消化管形成(图2-23、2-24)。

1.刚受精的卵;2.卵裂期,形成3细胞;3.卵裂期,形成6细胞;4.卵裂期,形成7细胞;5~9.卵裂期,动物极细胞分裂不均等;10.胚孔闭合不完全;11.神经管闭合异常;12.头部发育异常;13~15.尾牙发育异常;16~18.头部、肌节、尾牙的发育异常;19.胚胎死亡图3 全人工繁殖达氏鲟胚胎异常发育Fig.3 Abnormality of embryonic development on artificially-bred A. dabryanus Dumeril
2.2.7 出膜阶段 受精后113 h,尾的末端略过头部,尾部鳍褶变宽;尾牙游离(图2-25)。卵黄囊上血管明显,心跳搏动加快;胚体在膜内自由地扭动 (图1-33)。受精后大约在 129 h,尾的末端达到间脑,进入出膜前期(图2-26、2-27),随后仔鱼开始孵出(图1-34),至159 h同批次鱼卵全部孵出。刚孵出的仔鱼全长9.0~1.02 mm。
3 讨 论
3.1 胚胎发育特征
达氏鲟的卵裂方式为特殊的辐射状卵裂,这种卵裂方式与真骨鱼类的端黄卵不同,其表现在前3次卵裂均为经裂,第4次卵裂为纬裂,这种卵裂方式可能是鲟形目鱼类普遍存在的卵裂方式[10-14,18]。与其它鲟形目鱼类胚胎发育过程中所不同的是,在达氏鲟胚胎发育过程中细胞分裂8细胞期,同时能够观察到第一次卵裂沟仅达到赤道下方和在植物极闭合;而西伯利亚鲟[10]、匙吻鲟[18]、施氏鲟[13]在细胞分裂8细胞期观察到第一次卵裂沟在植物极闭合,中华鲟[11]在细胞分裂8细胞期观察到第一次分裂沟越过卵的赤道,扩展到植物极。在心跳期,达氏鲟的心脏呈“C”型,尾牙变扁平,而施氏鲟与中华鲟心脏呈“S”型,尾牙分离变细。总体而言,鲟鱼胚胎发育过程早期阶段有较高的相似性。
成熟达氏鲟卵呈球形、灰褐色或淡黄色、不透明、鱼卵受精后数分钟出现粘性,与前人[9]报道的一致。全人工繁殖的达氏鲟鱼卵与其它鲟鱼鱼卵相比较小(表2)且全人工繁殖的达氏鲟鱼卵卵径小于与野生拴养繁殖[9]的(表3),这与王丙乾[19]等对人工培育与野生史氏鲟的胚胎发育结果一致,均显示出人工培育卵径较小,这可能与初产鱼、营养物质积累量有关。
3.2 胚胎发育时间和积温
全人工繁殖的达氏鲟胚胎发育所需积温较其它鲟鱼高(表2),且高于野生拴养繁殖[9]的(表3)。这个结果与王丙乾等[19]比较人工培育与野生史氏鲟胚胎发育结果相似,均表现出人工培育卵的胚胎发育时间较野生卵的发育时间长,积温也较高。这可能与亲鱼培育过程中的营养需求和卵黄沉积度有一定的关系。
3.3 胚胎异常发育现象
在胚胎发育过程中,还观察到部分受精卵在刚受精、卵裂期、神经胚阶段及器官形成时期等阶段均异常发育。刚受精的卵,有的偏移动物极中央而在一侧集中多数细胞质(图3-1);卵裂期,部分胚胎从第二次分裂期至多细胞期形成,动物极分裂不均等,出现3细胞(图3-2),6细胞、10细胞(图3-3至3-9)。在卵裂期,部分胚胎形成的卵裂沟也异常,有的卵裂沟不明显,有的仅在动物极形成卵裂,植物极未分裂。在神经胚阶段,观察到少量胚胎的胚孔闭合不完全(图3-10、3-11),神经管闭合异常;器官形成期,头部、尾牙以及肌节的发育异常均有观察到(图3-12至3-18)。连续观察上述异常发育的受精卵,发现均无一例外的在后期停止发育,胚胎死亡(图3-19)。造成这种异常发育的原因还有待进一步研究。
致 谢:在研究过程中受到四川农业大学赵柳兰、杨淞老师、 肖青同学,西南大学蒲德永老师的帮助,特此感谢。
[1]陈细华. 鲟形目鱼类生物学与资源现状[M]. 北京:海洋出版社,2007:53-57.
[2]鲁雪报,倪 勇,饶 军,等. 达氏鲟的资源现状及研究进展[J]. 水产科技情报,2012,39(5):251-257.
[3]杜 军,赵 刚,龚 全,等. 达氏鲟亲鱼池塘人工培育试验[J]. 西南农业学报,2009,22(3):824-827.
[4]何 斌,陈先均,杜 军,等. 人工养殖条件下达氏鲟生长特性的研究[J]. 西南农业学报,2011,24(1):335-339.
[5]刘 涛. 达氏鲟子二代全人工繁殖首获成功[J]. 水产科技情报,2007,3(4):139-139.
[6]鲁雪报,倪 勇,饶 军,等. 达氏鲟的资源现状及研究进展[J]. 水产科技情报,2012,39(5):251-257.
[7]Zhuang Ping, Ke Fu’en, Wei Qiwei, et al. Biology and life history of Dabry’s sturgeon,Acipenserdabryanus, in the Yangtze River[J]. Environmental Biology of Fishes, 1997,48(1-4): 257-264.
[8]Kynard Boyd, Zhuang Ping, Zhang Tao, et al. Ontogenetic behavior and migration of Dabry’s sturgeon,Acipenserdabryanus, from the Yangtze River, with notes on body color and development rate[J]. Environmental Biology of Fishes, 2003,66(1): 27-36.
[9]四川省长江水产资源调查组. 长江鲟鱼类生物学及人工繁殖研究[C]. 成都:四川科学技术出版社, 1988:232-247.
[10]宋 炜,宋佳坤,范纯新,等. 全人工繁殖西伯利亚鲟的早期胚胎发育[J]. 水产学报,2010,34(5):777-785.
[11]陈细华. 中华鲟胚胎发育和性腺早期发育的研究[D]. 广州:中山大学博士论文,2004:27-102.
[12]杰特拉弗T A,金兹堡A C. 鲟鱼类的胚胎发育与其养殖问题[M]. 北京:科学出版社,1958:68-168.
[13]刘洪柏,宋苏祥,孙大江,等. 施氏鲟的胚胎及胚后发育研究[J]. 中国水产科学,2000(3):5-10.
[14]吴兴兵,朱永久,陈建武,等. 小体鲟胚胎发育特征观察[J]. 淡水渔业,2012,42(6):61-67.
[15]佟学红,马道远,徐世宏,等. 大菱鲆胚胎发育的形态学和组织学研究[J]. 海洋与湖沼,2011,42(6):844-849.
[16]刘 美,李凤超,穆淑梅,等. 半滑舌鳎胚胎发育组织学观察[J]. 四川动物,2008,27(5):737-739.
[17]薛俊增,堵南山,赖 伟. 三疣梭子蟹胚胎发育早期的组织学研究[J]. 动物学研究,2001,22(1):69-73.
[18]杨华莲,何 川,马立鸣,等. 匙吻鲟受精卵胚胎发育的研究[J]. 西南农业学报,2012,25(4):1489-1494.
[19]王丙乾,曲秋芝,邱岭泉,等. 人工培育与野生史氏鲟精、卵生物学及胚胎发育的比较分析[J]. 大连水产学院学报,2003,18(4):246-251.
[20]唐国盘. 中华鲟胚胎发育和早期生活史阶段耗氧量的研究[D]. 武汉:华中农业大学硕士论文,2005:19-26.
(责任编辑 陈 虹)
Morphological and Histological Observation of Embryonic Developmentof Artificially-bredAcipenserdabryanusDumeril
LIU Ya,GONG Quan,LI Qiang,DU Jun,ZHAO Gang
(Fishery Institute of Sichuan Academy of Agricultural Sciences,Sichuan Chengdu 611730,China)
【Objective】The present study was conducted to investigate the morphological characteristics and embryonic development schedule of artificially-bredA.dabryanusDumeril.【Method】The morphological and embryonic histological of fertilized eggs of artificially-bredAcipenserdabryanusDumeril were observed by Leica EZ4 HD and Leica DM2500.【Result】The mature eggs were spherical, beige or pale yellow, opaque and 2.6-3.2 mm in diameter. Under the temperature of 16-18 ℃, its embryonic development lasted for 159 hours. The whole embryonic development of it could be divided into seven stages, including fertilized egg stage, cell division stage, blastula stage, gastrula stage, neurula stage, organ formation stage and hatching stage, and contained thirty four developing phases. The total accumulated temperature of its embryonic development required was 2322-2544 ℃·h.【Conclusion】 In general, the cleavage way ofA.dabryanusDumeril was radial cleavage which was common in sturgeon, indicating that its embryo development in early stage had a high similarity with other sturgeon.
AcipenserdabryanusDumeril;Reproduction;Embryonic development;Morphology;Histology
1001-4829(2017)7-1686-07
10.16213/j.cnki.scjas.2017.7.039
2016-07-10
四川省科技支撑计划项目(2016NYZ0047);四川省重点研发项目(2017SZ0083)
刘 亚(1982-),女,硕士研究生,助理研究员,主要从事水产养殖和分子生物学方面研究,E-mail:liuya2343@163.com,Tel:18080812343。
S917
A

