QuEChERS—液质联用法测定水果蔬菜中氯吡脲残留
胡江涛 俞凌云 帅培强 于刚 何开蓉
摘要[目的]采用快速提取-高效液相色谱-串联质谱法(QuEChERS-HPLC-MS/MS)建立水果蔬菜中氯吡脲残留的检测方法。[方法]样品经含0.1%乙酸的乙腈溶液提取,经QuEChERS法净化后采用HPLC-MS/MS法测定其氯吡脲残留量。[结果]该方法下氯吡脲在水果蔬菜中的检出限(LOD)为1.0 μg/kg,定量限(LOQ)为5.0 μg/kg。在2.0~1000 μg/L范围内线性关系良好(R2>0.999)。在100~5000 μg/kg的添加水平上,方法的平均回收率介于72.0%~115.0%,方法的相对标准偏差为1.5%~9.8%。[结论]该方法适用于水果蔬菜中氯吡脲的测定。
关键词检测;氯吡脲;水果蔬菜;高效液相色谱-串联质谱法
中图分类号TS207.5+3文献标识码A文章编号0517-6611(2017)17-0071-05
Abstract[Objective] A quick extraction method QuEChERSHPLCMS/MS was established to determine forechlorfenuron in fruits and vegetables. [Method] Fruits and vegetables were extracted with 0.1% acetic acid of acetonitrile solution and purified by QuEChERS, then forechlorfenuron residues were determined by HPLCMS/MS. [Result] The limits of detection (LODs) and low determination limit (LOQ) for the forechlorfenuron was 1.0 μg/kg and 5.0 μg/kg in fruits and vegetables, respectively. Regression equations of these hormones had a good linear relationship (R2>0.999) within 2.0-100.0 μg/L. The average recoveries of forechlorfenuron was in the range of 72.0%-115.0% with the coefficients of variation between 1.5% and 9.8% at the spiked levels of 10.0-500.0 μg/kg. [Conclusion] The method can be applied for the determination of the forechlorfenuron in fruits and vegetables.
Key wordsDetermination;Forechlorfenuron;Fruits and vegetables;HPLCMS/MS
基金項目四川省科技支撑计划项目(2015GZ0084,SK0604);四川省卫生厅项目(2012-001)。
作者简介胡江涛(1974—),男,四川遂宁人,高级工程师,硕士,从事食品理化检验研究。
收稿日期2017-03-29
氯吡脲(Forechlorfenuron)是一种高效植物生长调节剂,商品名吡效隆,又称为调吡脲、吡效隆醇、施特优。现代农业生产大多受益于植物生长调节剂(植物生長激素),但这些激素的应用虽然可以改善水果外观、提高其产量,但其内在质量明显下降[1],更重要的是摄入过量激素可能对人体带来潜在健康危害。
欧盟、日本等国家对氯吡脲的残留量作出了限定。欧盟要求其成员国常规监测环境中的氯吡脲,防止其对环境可能产生的危害。日本“肯定列表”对果蔬中氯吡脲的限定,规定在香瓜、葡萄、梨、猕猴桃等水果蔬菜中的残留限量值暂定为0.1 mg/kg;以色列规定梨、猕猴桃、葡萄中氯吡脲的残留限量为0.01 mg/kg;韩国规定瓜类中氯吡脲的残留限量值为005 mg/kg。我国在2009年农业部NY 1500.75.1—2009中规定了西瓜、黄瓜、猕猴桃和葡萄中氯吡脲的残留限量分别为0.1、0.1、0.05和0.05 mg/kg。查阅我国有关植物生长调节剂的规定发现,目前还没有相关的检测国家标准,相关产品说明多借鉴国外标准。
随着仪器分析的不断发展,液质联用分析法在农兽残留分析检测中占据了重要的地位,特别是三重四极杆质谱的出现,相比传统的高效液相色谱法,液相色谱-三重四极杆串联质谱在农药残留的检测中具有一定的优势[2-3]。多年来,液相色谱法[4-7]广泛地用于各种药物的检测,但方法的前处理较复杂,检测器的灵敏度也不能达到目前各国限量要求,且每个样品通常需要过一次甚至几次固相萃取小柱,不能适应于大量样品的快速检测。
该研究建立了一种QuEChERS提取,高效液相色谱-串联质谱法测定水果蔬菜中氯吡脲的方法。该方法操作简单、经济、快速,同时净化效果好,回收率稳定,易于掌握。
1材料与方法
1.1材料
供试蔬菜水果样品:葡萄、猕猴桃、水蜜桃、黄瓜、草莓、枇杷、西瓜、西红柿、西芹、苦瓜、茄子、苹果、樱桃,市售。
氯吡脲标准品,纯度≥96%,美国Sigma公司;乙腈,色谱纯,德国CNW技术有限公司;正己烷、冰乙酸、无水乙酸钠、氯化钠、无水硫酸钠和无水硫酸镁,分析纯,成都科龙化工有限公司;氯化钠:450 ℃灼烧4 h,密封备用;无水硫酸钠和无水硫酸镁:650 ℃灼烧4 h,贮藏干燥器中备用;
N-丙基乙二胺(PSA,粒度40 μm)、十八烷基硅烷键合相(C18,粒度50 μm),购于北京迪马欧泰科技发展中心。
主要仪器设备:
超高效液相色谱(Waters ACQUITY UPLC)-三重四极杆串联质谱(Aglient 6510)联用仪,配有电喷雾离子源(ESI);涡旋混合器,上海精宏;超声波清洗器;J2-21离心机、样品粉碎机、组织捣碎机,美国贝克曼库尔特;高速组织匀浆机,日本TAITEC。
1.2标准溶液配制
1.0 mg/mL氯吡脲标准储备溶液:准确称取氯吡脲标准品10 mg,用乙腈溶解并定容至10 mL,置-18 ℃冰箱中保存。根据需要用乙腈将标准储备液稀释成适当浓度的标准工作液,临用现配。
1.3仪器条件
1.3.1色谱条件。
色谱柱:MG-II C18柱(2.1 mm×150.0 mm ×5.0 μm);柱温:30 ℃;进样量:10 μL;流速:0.2 mL/min;流动相:A(乙腈),B(0.1%乙酸水溶液)。等度洗脱条件为乙腈∶0.1%乙酸水溶液(V/V)=6∶4。
1.3.2质谱条件。
离子源:电喷雾离子源(ESI);扫描方式:正离子扫描;检测方式:多反应监测(MRM);定量离子对308.9/288.9(m/z);定性离子对为308.9/288.9(m/z)和308.9/92.9(m/z)。
1.4样品处理
样品进行粉碎提取,获得提取液。
称取005 g N-丙基乙二胺(PSA),0.1 g C18,0.15 g无水硫酸镁置于10 mL具塞玻璃离心管中,准确加入2.0 mL样品提取液至离心管中,涡旋振荡1 min,以5 000 r/min的转速离心2 min。取上清液1 mL过0.22 μm有机微孔滤膜,供液相色谱-质谱测定。
2结果与分析
2.1净化方法的优化
2.1.1提取液的选择。
乙腈是一种良好的提取剂,在现代的农兽残留检测中常用来作为提取剂。乙腈可以与水任意比混溶,可与样品组织细胞中待测物有效接触,当加入盐后又能迅速与水分层,且乙腈本身对样品中的糖、脂肪和蛋白质的溶解性较小,对蛋白有沉淀作用。该研究考察了含有01%乙酸的乙腈和乙腈作为提取剂的提取效率,发现两者并没有多大差别。氯吡脲在弱酸性至中性条件下是非常稳定的,在碱性环境下易分解,为保持氯吡脲在样品前处理中的稳定,方法在提取液乙腈中加了0.1%乙酸,以保护待测物在提取过程中和检测过程中的稳定态。
2.1.2提取方式及温度的选择。
该试验比较了超声提取和机械振荡提取,发现超声提取的回收率要稍微高一些。原因是超声提取中超声波可以破坏细胞壁,使乙腈能更好地渗透进入细胞内部进行萃取,而机械振荡无法破坏细胞壁。因此该方法选择用超声提取的方式。
超声提取的水浴温度对回收率也有影响,如果温度过低,不利于溶剂渗透到样品内部提取,特别是畜禽产品,油脂在低温下要凝固,不利于提取。因此要保持适当的提取温度,该方法选择超声提取温度为30 ℃。
2.1.3净化方法选择。
QuEChERS是近年来国际上兴起的快速高效多残留检测前处理技术。2003年,美国农业部专家Steven博士提出了QuEChERS( quick,easy,cheap,effective,rugged and safe)快速多农残检测方法,它是一种快速、简便、价格低廉、适用面广的样品前处理方法。在该方法出现后的几年间,欧盟每年已有超过100个实验室参加此方法的验证试验,证明这种方法在实验室间取得成功。目前,该方法已被很多国家列为农药残留分析标准分析方法,如AOAC Official method 2007(01)、英国标准方法BS EN 155662:2008等[8-10]。研究过程中在总结多年的应用基础上对该方法进行了一些改进,加入了C18固相吸附剂,对试样中的蛋白质、脂肪酸、色素有一定的吸附。
C18固相吸附剂是一种非极性吸附剂,可以吸附高分子量的非极性干扰物质,特别适用于低脂类水果蔬菜的净化,对样品中的蛋白、脂质物质、部分维生素、色素和甾醇等杂质也有一定的吸附作用。
PSA是一类性质与氨基柱固相萃取小柱填料相同的固相吸附剂,不同的是PSA有2个氨基,它们的主要作用力是极性和阴离子交换作用。它常用来消除各种有机酸、部分色素以及蛋白质、糖类和脂肪酸。
石墨化碳黑(GCB)主要是用来去除类甾体、叶绿素等色素。该研究考察了NH2类填料和GCB的实际效果,发现NH2可去除90%以上的脂肪酸和50%左右的色素;GCB可去除90%以上的色素,但对脂肪酸的净化能力仅有10%左右。笔者考察GCB对氯吡脲的吸附情况时,发现GCB对氯吡脲有较强的吸附作用,故在该试验中放弃了加入GCB来进行净化的手段。
2.1.4吸附剂用量的影响。
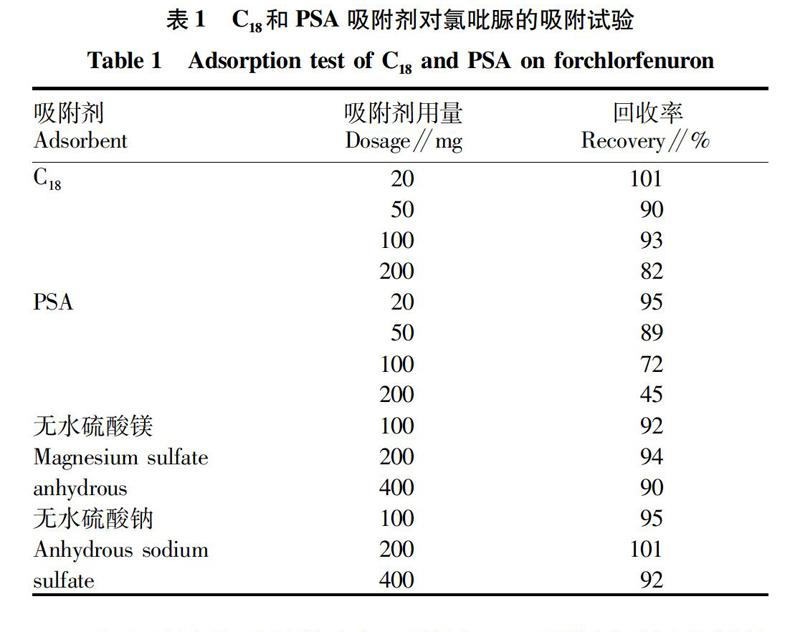
该试验考查了C18和PSA吸附剂对氯吡脲的吸留作用。吸取浓度为100 μg/L的氯吡脲标准液分别用2种固相吸附剂净化。测定结果见表1。
由上述试验可以得出如下结论,C18吸附剂对氯吡脲基本无吸附,用量200 mg时回收率仍在80%以上,而PSA对氯吡脲吸附有影响,PSA增大到100 mg以上回收率下降得較快。无水硫酸钠和无水硫酸镁对待测物基本无吸附。因此该试验方法选择用2 mL提取液,加入50 mg PSA、100 mg C18和200 mg无水硫酸镁。
2.1.5涡旋振荡时间的影响。
C18吸附剂和PSA吸附剂与样液接触时间也有影响。该试验考察了对加标样品涡旋振荡1、2、3、4和5 min时,吸附剂对氯吡脲的吸留作用。测定结果表明,回收率的变化不大,在10%内波动。因此涡旋振荡时间对氯吡脲影响不大,但为了规范统一操作,规定提取液中加入吸附剂后,每份试样净化时涡旋的时间准确定为1 min。处理好的試样液应尽快离心,过滤膜上机测定。
2.2儀器條件的优化
2.2.1色谱条件的优化。
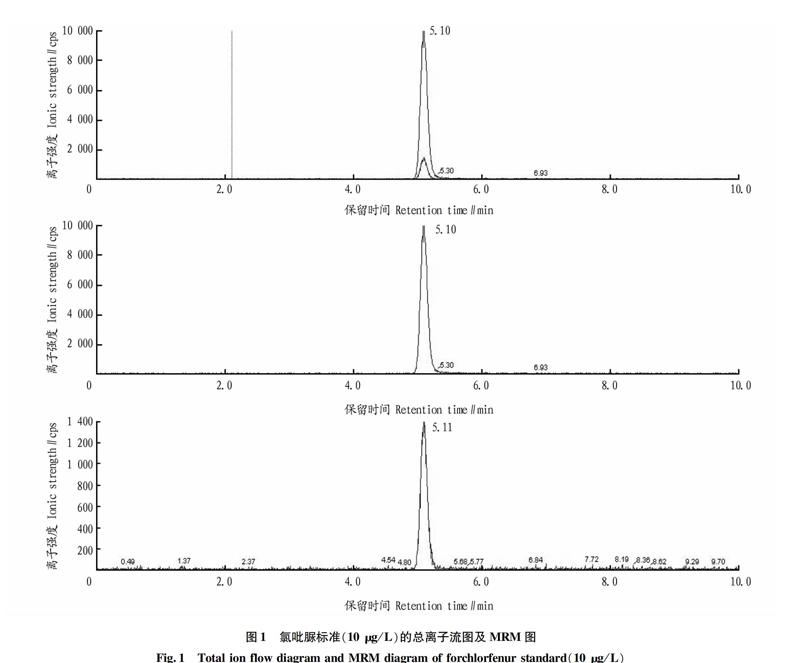
在液相色谱-串联质谱测定时,在流动相中加入低浓度的甲酸或乙酸胺溶液,有利于目标化合物离子化,可以提高灵敏度和分离度,使色谱峰形对称、尖锐。通过试验验证选择乙腈+0.1%乙酸水溶液作为流动相。等度洗脱条件为乙腈∶0.1%乙酸水溶液(V/V)=6∶4。氯吡脲标准(10 μg/L)的总离子流图及MRM图如图1所示。
2.2.1质谱条件的优化。
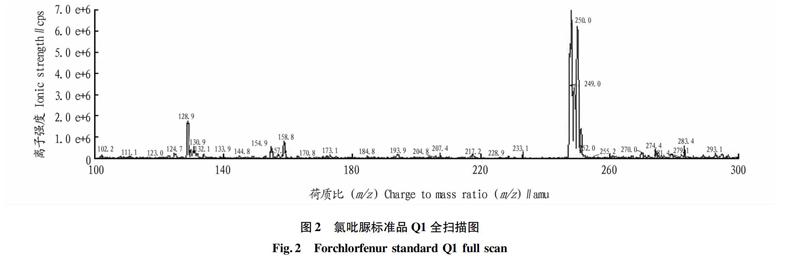
采用注射泵直接进样方式,以10 μL/min流速将氯吡脲标准溶液注入离子源中,在正离子检测方式下对目标化合物进行一级质谱分析(Q1扫描),得到分子离子峰,对该分子离子峰进行二级质谱分析(子离子扫描),得到碎片离子信息,获得该物质的二级质谱图,见图2和图3。然后对去簇电压(DP)、碰撞气能量(CE)进行优化,使分子离子和特征碎片离子对强度达到最佳。并优化雾化气、气帘气、辅助加热器、离子源温度、电喷雾电压,使目标化合物的离子化效率达到最佳。得到的质谱条件如下:
离子源为电喷雾离子源(ESI);正离子扫描方式多反应监测(MRM);电喷雾电压(IS)5 200 V,离子源温度(TEM)450 ℃;碰撞气压力(CAD)20.68 kPa;雾化气压力(GS1)68.95 kPa;气帘气压力(CUR)62.05 kPa;其他质谱参数见表2。
2.3分析方法的评价
2.3.1线性范围和测定低限。
根据氯吡脲的灵敏度,分别配成2.0、5.0、10.0、20.0、50.0、100.0 μg/L一系列标准工作溶液,在选定的色谱条件和质谱条件下进行测定,进样量10 μL,峰保留时间和子离子峰度比定性,用峰面积对其定量,其线性范围2.0~100.0 μg/L、线性方程Y=1 210X+893(其中X为氯吡脲顶量浓度,Y为峰面积),线性相关系数为0.999 9,方法的检出限(LOD)为1.0 μg/kg,定量限(LOQ)为5.0 μg/kg。
2.3.2方法的回收率和精密度。
分别按试样中氯吡脲限量水平进行加标5.0~50 μg/kg含量水平标准液,每一添加浓度重复10份样品,按上述试验方法测定,得到添加浓度范围的回收率见表3。测定回收率和室内精密度,方法的总体平均回收率72.0%~115.0%,方法的相对标准偏差为1.5%~9.8%。
3结论
该试验建立了高效快速提取-高效液相色谱-串联质谱法(QuEChERS-HPLC-MS/MS)测定水果蔬菜中氯吡脲残留的检测方法。试验选择有代表性的13种水果蔬菜进行了方法研究,方法的测定低限(LOD)为1.0 μg/kg,方法的总体平均回收率为72.0%~115.0%,方法的相对标准偏差为1.5%~9.8%。该方法操作简单、经济、快速,同时净化效果好,回收率稳定,适用于水果蔬菜中氯吡脲的测定。
参考文献
[1] MIYAHARA M,SUZUKI T,SAITO Y.Multiresidue method for some pesticides in lanolin by capillary gas chromatography with detection by electron capture,flame photometric,mass spectrometric,and atomic emission techniques[J].J Agric Food Chem,1992,40:64-69.
[2] 李芳,张静,杨中,等.QuEChERS/液质联用法测定蔬菜中17种农药残留[J].吉林农业科学,2013,38(3):93-96.
[3] 张璇,姜敏,何锦惠,等.高效液相色谱-质谱联用仪测定韭菜中多菌灵、吡虫啉等7种农药残留量[J].农药科学与管理,2016,37(4):42-47.
[4] 高斌富,金秀华,方赤光,等.高效液相色谱法同时测定食品中除虫脲、灭幼脲和杀蛉脲残留量[J].分析化学,1996,24(7):865.
[5] 许祯毅,衷兴旺,姜咸彪.高效液相色谱法测定武夷岩茶中除虫脲残留量[J].福建茶叶,2014(1):22-23.
[6] 厚生劳动省医药食品局食品安全部.食品中农业化学品残留检测方法:食安发第1129002号[S].东京:厚生劳动省医药食品局食品安全部,2005.
[7] 吉林省卫生防疫站.植物性食品中除虫脲残留量的测定:GB/T 5009.147—2003[S].北京:中国质检出版社,2003.
[8] Foods of plant origin:Determination of pesticide residues using GCMS and/or LCMS/MS following acetonitrile extraction/partitioning and cleanup by dispersive SPE(QuEChERSmethod):BS EN 15662:2008[S].London:BSI,2008.
[9] AOAC.AOAC Official Method 2007.01.Pesticide Residues in Foods by Acetonitrile Extraction and Partitioning with Magnesium Sulfate[S].AOAC,2007.
[10] SCHENCK F J,BROWN A N,PODHORNIAK L V,et al.A rapid multiresidue method for determination of pesticides in fruits and vegetables by using acetonitrile extraction/partitioning and solidphase extraction column cleanup[J].Journal of AOAC international,2008,91(2):422-438.

