LRIG1在卵巢浆液性囊腺癌细胞对依托泊苷敏感性中的作用研究*
阳华,叶元,肖胜军,雷小妹,罗小红
(1.桂林医学院第二附属医院 妇科,广西 桂林 541199;2.桂林医学院附属医院 妇科,广西 桂林 541001;3.桂林医学院第二附属医院 病理科,广西 桂林 541199;4.桂林医学院附属医院 统计室,广西 桂林 541001)
基础研究·论著
LRIG1在卵巢浆液性囊腺癌细胞对依托泊苷敏感性中的作用研究*
阳华1,叶元2,肖胜军3,雷小妹1,罗小红4
(1.桂林医学院第二附属医院 妇科,广西 桂林 541199;2.桂林医学院附属医院 妇科,广西 桂林 541001;3.桂林医学院第二附属医院 病理科,广西 桂林 541199;4.桂林医学院附属医院 统计室,广西 桂林 541001)
目的 探讨亮氨酸重复序列免疫球蛋白样结构域基因-1(LRIG1)在卵巢浆液性囊腺癌(SKOV3)细胞株中对依托泊苷敏感性的可能机制。方法 噻唑蓝比色法(MMT)检测不同浓度VP16干预下48 h的SKOV3细胞组、siRNA LRIG1转染SKOV3细胞组、SKOV3/VP16细胞组和siRNA LRIG1转染SKOV3/VP16细胞组的增殖。平板克隆检测细胞增殖,流式检测细胞凋亡情况,实时荧光定量聚合酶链反应(qRT-PCR)检测LRIG1 mRNA表达。结果 半抑制浓度(IC50)分别为62.90、115.49、156.50和195.42μg/L,siRNALRIG1转染SKOV3、SKOV3/VP16和siRNA LRIG1转染SKOV3/VP16的耐药指数分别为1.8、2.5和3.1。SKOV3、siRNA LRIG1转染SKOV3、SKOV3/VP16和siRNA LRIG1转染SKOV3/VP16细胞组的克隆率(F=39.338,P=0.000),细胞的LRIG1 mRNA(F=63.095,P=0.000)和凋亡细胞(F=230.046,P=0.000)明显不同,与 SKOV3 比较,siRNA LRIG1转染SKOV3、SKOV3/VP16和siRNA LRIG1转染SKOV3/VP16细胞的克隆率增加(t=0.026、0.0710和0.125,P=0.042、0.000和 0.000),细胞的 LRIG1 mRNA 降低(t=0.130、0.525和 0.825,均 P=0.000),凋亡细胞减少(t=12.350、35.506和 44.412,均 P=0.000),与 siRNA LRIG1转染 SKOV3比较,SKOV3/VP16和 siRNA LRIG1转染SKOV3/VP16细胞的克隆率增加(t=0.044和0.099,P=0.001和0.000),LRIG1 mRNA降低(t=0.395和0.695,均 P=0.000),凋亡细胞减少(t=23.156 和 32063,均 P<0.05),与 SKOV3/VP16 比较,siRNA LRIG1 转染SKOV3/VP16细胞的克隆率增加(t=0.055,P=0.000),细胞的 LRIG1 mRNA降低(t=0.300,P=0.000),凋亡细胞减少(t=8.906,P=0.000)。结论 LRIG1 mRNA影响SKOV3细胞对药物的敏感性,沉默LRIG1的耐药细胞可抑制SKOV3细胞凋亡。
卵巢癌;耐药;亮氨酸重复序列免疫球蛋白样结构域基因-1
当今,卵巢癌的发生率已经呈现出不断上升的趋势,成为危害女性的重要杀手,发病率仅次于子宫颈癌和子宫体癌而列居第3位,卵巢肿瘤中的卵巢上皮癌的死亡为女性各种肿瘤死亡之首,可见卵巢肿瘤已严重危害女性生命健康。随着化疗药物使用的增加,卵巢癌细胞的耐药性也逐渐受到了人们的关注。富含亮氨酸重复序列免疫球蛋白样结构域基因 -1(leucine-rich repeats and immunoglobulinlike domains-1,LRIG-1)及其家族分子LRIG-2和LRIG-3是一类新兴的肿瘤抑制分子,在多种恶性肿瘤如乳腺癌[1-2]、子宫颈癌[3-5]、头部和颈部癌[6-8]、胶质瘤[9-10]、前列腺癌[11]与皮肤鳞状细胞癌等[12]均有异常表达,与肿瘤的形成及多药耐药密切相关。近年来,RNAi技术的出现,给人类治疗癌症带来巨大福音,可用来研究与癌症相关基因的变化机制,成为可代替临床治疗,改变多药耐药机制的一种新方法。双链核糖核酸(ribonucleic acid,RNA)经酶切后会形成很多小片段,称为小干扰核糖核酸(small interfering ribonucleic acid,siRNA)。siRNA 与信使核糖核酸(messenger ribonucleic acid,mRNA)中的同源序列发生互补结合,导致mRNA失去功能,不能翻译产生蛋白质,使基因“沉默”。本研究中LRIG-1是治疗卵巢肿瘤的新靶点,在多种癌症中的siRNA沉默LRIG-1将为一种新的高选择性LRIGs开发提供可靠的科学依据。本研究在既往研究基础上,进一步探讨LRIG-1分子在卵巢癌及其耐药细胞株中的作用。
1 材料与方法
1.1 材料和试剂
卵巢浆液性囊腺癌(SKOV3)细胞株(北京大学人民医院),依托泊苷(VP16)(江苏省连云港市恒瑞医药股份有限公司),SKOV3/VP16(选取SKOV3以浓度为300μg/ml的VP16反复大剂量冲击用药,培养8个月建立VP16耐药细胞株,反复传代>3个月),胎牛血清(fetal bovine serum,FBS)(美国 Thermo Fisher Scientific公司,No:10099-141),高糖培养基(dulbecco's modified eagle medium,DMEM)(美国Hyclone公司,No:SH30022.01B),青链霉素、磷酸盐缓冲溶液(phosphate buffer saline,PBS)及CCK-8试剂盒 (cell counting Kit-8)(日本 Dojindo,No:CK04),LipofectamineTM2000(美国 Thermo Fisher Scientific 公司,No:52887),Annexin V/PI apoptosis kit(浙江省杭州市联科生物公司,AP101),结晶紫染色液(自配),Trizol(日本TaKaRa株式会社),焦碳酸二乙酯(diethy pyrocarbonate,DEPC)(美国 Sigma公司),聚合酶链反应仪(丹麦DBI公司),逆转录试剂盒(DBI公司),RNasin(美国 Promega公司)。
1.2 实验仪器
紫外分光光度计(日本Shimodzu公司),SCR20B型冷冻离心机(日本Hitachi公司),低温高速离心机(德国Hermle公司),凝胶扫描系统(德国UVP公司),Stratagene Mx 3000P Quantitative RealTime PCR设备(美国Agilent公司),ABI9700PCR扩增仪(美国ABI公司),超净工作台(江苏省苏州净化设备公司),Anke/飞鸽TDL-80-2B低速离心机(上海安亭科学仪器厂),倒置显微镜(德国Motic公司),INC108型二氧化碳CO2细胞培养箱(德国Memmert公司),流式细胞仪和酶联免疫检测仪(美国BD,FACS Calibur Thermo Fisher Scientific公司)。
1.3 SKOV3和SKOV3/VP16细胞培养与计数
将SKOV3和SKOV3/VP16细胞株按常规方法培养于含10%的FBS及青霉素、链霉素的MEM(minimum essential medium)培养基中,在 37℃、5%CO2、恒温、饱和湿度条件下培养,将处于对数生长期的细胞用0.25%胰酶消化,制成单细胞悬液,取出40 μl单细胞悬液,40 μl台盼蓝试剂吹打均匀,放置5 min,取20 μl计数,细胞计数板一共16个小格,合成4个大格,活细胞清晰可现,其中SKOV3呈梭型,SKOV3/VP16呈不规则多边形,算出4大格内的总细胞数。
1.4 siRNA LRIG1转染SKOV3和SKOV3/VP16细胞
①转染前1天,分别将100μl含有1×104个的SKOV3和SKOV3/VP16细胞加入培养基6孔内,令转染过程中细胞密度达到至少50%;②在25 μl的DMEM无血清无抗生素培养基中加入siRNA LRIG1/sh LRIG1,混匀;③在 25 μl的 DMEM 无血清无抗生素培养基中加入LipofectamineTM2000,混匀,室温放置5 min;④将稀释好的siRNA LRIG1/sh LRIG1和LipofectamineTM2000试剂混合,室温放置20 min,将50μl混合液放入内含50μl培养基和细胞的培养孔内,摇晃培养板;⑤把细胞培养板放在CO2培养箱内,孵育4 h,除去复合物,更换培养基,放入培养箱中;⑥转染0、24、48和72 h后,吸去培养液,按每1ml完全培养基加入100μl CCK-8混合,每孔加入100μl CCK-8混合液,将培养板放到培养箱内孵育1 h。
1.5 噻唑蓝比色法测定SKOV3细胞存活率
用96孔板接种细胞,24 h后进行转染,转染后再等待 6 h,加入 VP16,噻唑蓝比色法[3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazoliumromide,MTT]法检测 SKOV3细胞、siRNA LRIG1转染SKOV3细胞、SKOV3/VP16细胞和siRNA LRIG1转染SKOV3/VP16细胞在VP16浓度梯度下的存活率,检测各细胞在490 nm处的吸光值并计算其各自的半抑制浓度(50%inhibitory concentration,IC50)。
1.6 平板克隆形成
将SKOV3细胞、siRNA LRIG1转染SKOV3细胞、SKOV3/VP16细胞和siRNA LRIG1转染SKOV3/VP16细胞每孔200个/2 ml接种于6孔板中,置于培养箱中培养10d,弃培养基,加入PBS洗涤细胞2次,每个孔内加入无水甲醇,室温静置并固定15 min,弃去固定液,加入1%结晶紫染液1ml,室温染色15min,计算克隆形成率,克隆形成率=克隆数面积/接种面积(100%)。
1.7 实时荧光定量聚合酶链反应检测SKOV3细胞、siRNA LRIG1转染SKOV3细胞、SKOV3/VP16细胞和siRNA LRIG1转染SKOV3/VP16细胞的LRIG1 mRNA的表达
1.7.1 RNA提取 ①收集适量细胞,加入1ml Trizol,震荡混匀室温放置5 min;②加入0.2 ml氯仿,剧烈震荡15s,静置 3min;③4℃、12000r/min 离心 10min,取上清转移到新EP管;④加入等体积异丙醇,混匀,静置20min;4℃、12000r/min离心10min,弃去上清液;⑤用1 ml 75%DEPC酒精洗涤;⑥4℃、12 000 r/min离心5 min,弃去液体;⑦室温晾干后,加入30μl DEPC处理过的双蒸水(distillation-distillation H2O,ddH2O),溶解RNA,置入-80℃冰箱冷冻保存备用。
1.7.2 逆转录 以1 μg总RNA视为模板,依照使用说明书内容,对逆转录反应体系加以配置,体系的总含量为20μl。将其合成为DNA第一链,依照下述内容,全面配置反应液:Primer Mix 1.0,RNA 1.0 μg,DEPC 10.0μl,水 1.0μl,共 11 μl。后将其放置到35℃环境中共计300 s,急速冷冻。依照以下体系配置出反应液:5 RT Buffer 4.0 μl;RT Enzyme Mix 1.0 μl,DEPC 11.0 μl,水 4.0μl,共 20 μl。分别在98℃预变性10 min和37℃变性60 min,合成互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA)第一链,再经Sephacryl s2300离心柱离心2 min除去引物等杂质,可获得纯净cDNA分子。
1.7.3 实时荧光定量聚合酶反应(quantitative real time polymerase chain reaction,qRT-PCR)检测 qRTPCR 反应条件:94℃预变性 2 min,94℃变性 20 s,58℃退火 20 s,72℃延伸 20 s,40 个循环,以 GAPDH为内参,通过2-△△CT方法进行相对定量分析LRIG1 mRNA的相对表达。GAPDH,正向引物:5'-TGTTCG TCATGGGTGTGAA-3',反向引物:5'-ATGGCATGGA CTGTGGTCAT-3'。LRIG1 正向引物:5'-GACCCTTTCTGACCGACAA-3',反向引物:5'-CGCTTTCCACGGC TCTTT-3'。
1.8 流式细胞术检测SKOV3细胞、siRNA LRIG1转染SKOV3细胞、SKOV3/VP16细胞和 siRNA LRIG1转染SKOV3/VP16细胞凋亡
①转染前1天将容量为2.5×105的细胞接种在2 ml 6孔培养基,确保密度达到50%~70%;②在250μl的DMEM无血清无抗生素培养基中加入质粒或siRNA,柔和混匀;③在250μl的DMEM无血清无抗生素培养基中加入LipofectamineTM2000,柔和混匀,室温放置5 min;④将稀释好的siRNA和LipofectamineTM2000混合,室温放置20 min,把siRNA/Lipofectamin混合物放到内含有细胞以及培养基的小孔内,混合;⑤把细胞培养板放在CO2培养箱内,孵育4 h,更换完全培养基并放入培养箱;⑥转染后48h,收集细胞进行后续检测;⑦用ddH2O将5×结合缓冲液(Binding Buffer)稀释为 1×Binding Buffer,每0.5 ml 1×Binding Buffer加入5μl Annexin V和10μl PI,配制Annexin V/PI染色工作液;⑧吸去培养板中的培养基,每孔用2 ml PBS轻轻润洗培养板内细胞,吸去PBS,每孔加0.5 ml 0.25%胰酶,孵育,镜下观察,当胞质回缩,细胞之间不再连接成片,吸去胰酶,加入2 ml PBS,制成单细胞悬液,移至流式管,1000r/min离心5min,弃上清液;⑨加入200μl Annexin V/PI染色工作液,重悬细胞;⑩避光孵育15 mim,上机检测。
1.9 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,组间比较用单因素方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度VP16干预SKOV3细胞的存活情况
VP16干预 SKOV3、siRNA LRIG1转染 SKOV3、SKOV3/VP16和siRNA LRIG1转染SKOV3/VP16细胞的存活率及 IC50,0、5、10、20、40、80、100、120、180和 200μg/L的 VP16处理 SKOV3、siRNA LRIG1转 染 SKOV3、SKOV3/VP16和 siRNA LRIG1转染SKOV3/VP16细胞48 h的吸光值逐渐降低,呈剂量依 赖 关 系 ,IC50 分 别 为 62.90、115.49、156.50 和195.42 μg/L,siRNA LRIG1 转染 SKOV3、SKOV3/VP16和siRNA LRIG1转染SKOV3/VP16细胞的耐药指数分别为1.8、2.5和3.1。见附表。
2.2 SKOV3、siRNA LRIG1 转染 SKOV3、SKOV3/VP16和siRNA LRIG1转染SKOV3/VP16细胞增殖情况
SKOV3、siRNALRIG1 转染 SKOV3、SKOV3/VP16和siRNA LRIG1转染SKOV3/VP16细胞进行平板克隆实验,克隆率分别为(0.03±0.02)%、(0.05±0.01)%、(0.10±0.03)%和(0.15±0.04)%,4 组细胞增殖差异有统计学意义(F=39.338,P=0.000),与SKOV3比较,siRNA LRIG1转染 SKOV3、SKOV3/VP16和siRNA LRIG1转染SKOV3/VP16细胞的克隆率增高(t=0.026,0.070和 0.125,P=0.042、0.000 和0.000),与 siRNA LRIG1转染 SKOV3 比较,SKOV3/VP16和siRNA LRIG1转染SKOV3/VP16细胞的克隆率增高(t=0.044和 0.099,P=0.001和 0.000),与SKOV3/VP16比较,siRNA LRIG1转染SKOV3/VP16细胞的克隆率增加(t=0.055,P=0.000)。见图1。
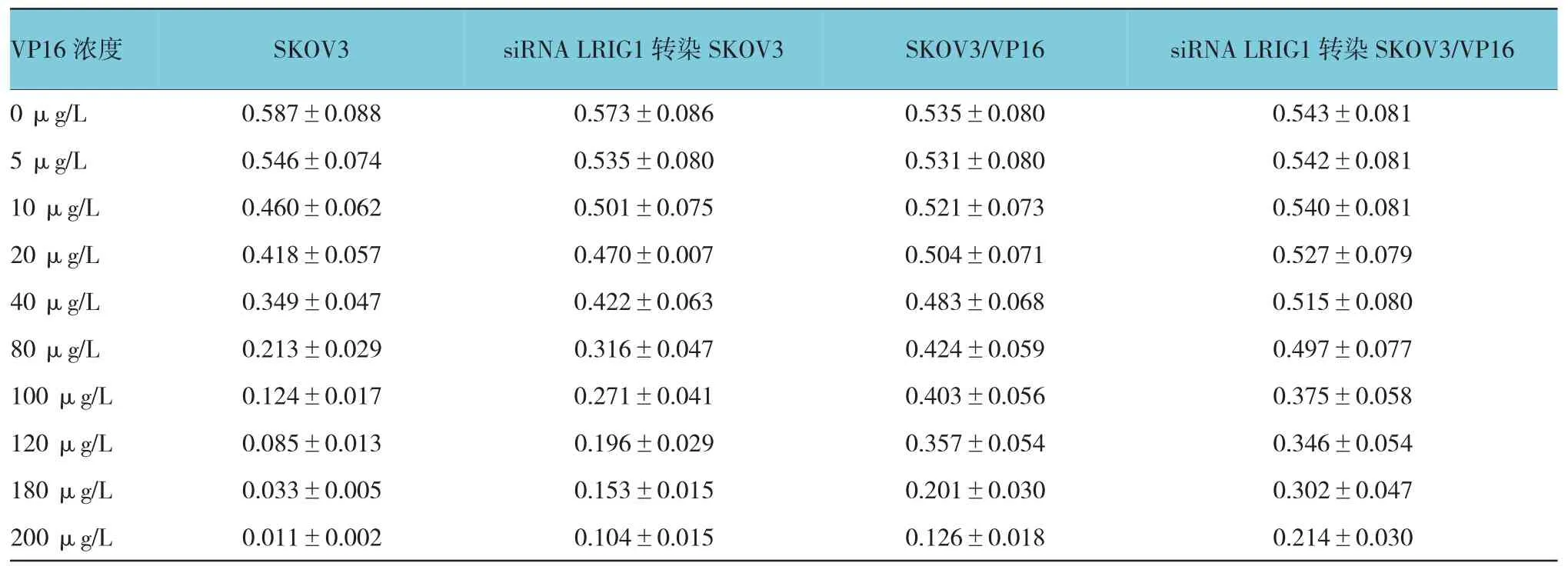
附表 VP16干预SKOV3、siRNA LRIG1转染SKOV3、SKOV3/VP16和siRNA LRIG1转染SKOV3/VP16细胞的吸光值 (n=3)

图1 4组SKOV3/VP16细胞增殖情况
2.3 SKOV3、siRNA LRIG1 转染 SKOV3、SKOV3/VP16和siRNA LRIG1转染SKOV3/VP16细胞中LRIG1 mRNA的表达
SKOV3、siRNALRIG1 转染 SKOV3、SKOV3/VP16和siRNA LRIG1转染SKOV3/VP16细胞的LRIG1 mRNA 分别为 1.05±0.15、0.93±0.16、0.53±0.09 和0.23±0.04,4组的LRIG1 mRNA表达有差异(F=63.095,P=0.000),与 SKOV3 比较,siRNA LRIG1 转染 SKOV3、SKOV3/VP16 和 siRNA LRIG1 转 染SKOV3/VP16细胞的LRIG1 mRNA降低(t=0.130、0.525 和 0.825,均 P=0.000),与 siRNA LRIG1 转染SKOV3比较,SKOV3/VP16和 siRNA LRIG1转染SKOV3/VP16细胞的LRIG1 mRNA降低(t=0.395和 0.695,均 P=0.000),与 SKOV3/VP16 比较,siRNA LRIG1转染SKOV3/VP16细胞的LRIG1 mRNA降低(t=0.300,P=0.000)。见图 2。
2.4 SKOV3、siRNA LRIG1 转染 SKOV3、SKOV3/VP16和siRNA LRIG1转染SKOV3/VP16细胞凋亡情况
4组的凋亡细胞比较,差异有统计学意义(F=230.046,P=0.000),与 siRNA LRIG1 转染 SKOV3 比较,SKOV3/VP16和siRNA LRIG1转染SKOV3/VP16的凋亡细胞减少(t=12.350、35.506和44.412,均P=0.000),与 SKOV3/VP16 比较,siRNA LRIG1 转染SKOV3/VP16凋亡细胞减少(t=23.156和32.063,均P=0.000),与 SKOV3/VP16比较,siRNA LRIG1转染SKOV3/VP16 凋亡细胞减少(t=8.906,P=0.000)。见图3。
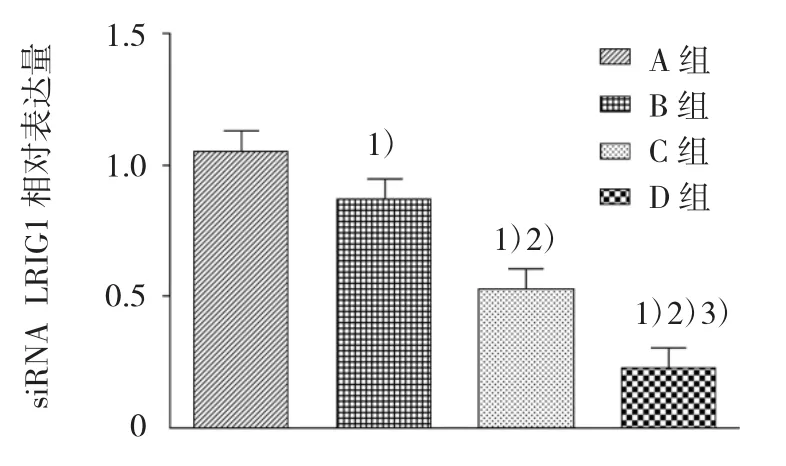
图2 SKOV3、siRNA LRIG1转染SKOV3、SKOV3/VP16和siRNA LRIG1转染SKOV3/VP16细胞LRIG1 mRNA表达
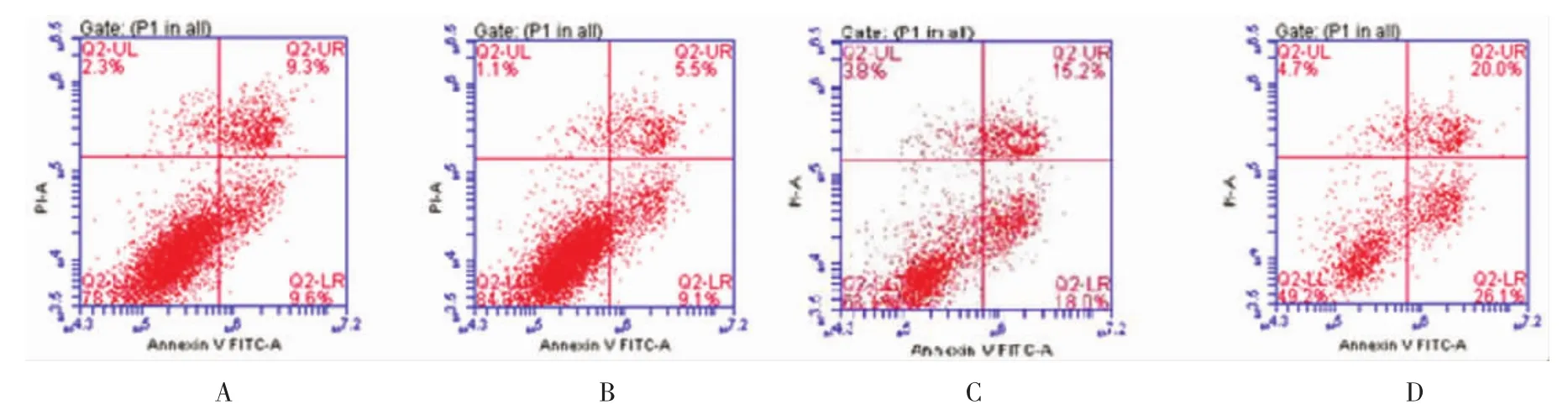
图3 SKOV3、siRNA LRIG1转染SKOV3、SKOV3/VP16和siRNA LRIG1转染SKOV3/VP16细胞凋亡比较
3 讨论
LRIG1发现于10多年前,科学家们开始假设其是一个肿瘤抑制基因[12]。一系列实验和临床数据都支持这一最初假设。此后,越来越多的证据证明,LRIG1可以抑制细胞的正常增殖和分化。LRIG1的增殖抑制作用在包括人胚胎肾细胞[14]、前列腺癌细胞[14]、小鼠成纤维细胞角质形成细胞[15-16]、膀胱癌细胞[17]、乳腺癌细胞[1,18-19]、星形细胞瘤、胶质母细胞瘤细胞[20-21]、非洲绿猴肾细胞[21]、鼻咽癌细胞[7]与肺癌细胞[22]在内一系列组织细胞。在分子水平上,LRIG1可以负性调节由致癌受体酪氨酸激酶介导的生长因子信号:LRIG1可诱导表皮生长因子受体(EGFR)家族成员EGFR、ERBB2、ErbB3 和 ErbB4 的泛素化[14-15],从而破坏MET受体[18],作用于RET受体并抑制RET和下游信号的磷酸化[23-24]。另一方面,在ErbB2阳性的肿瘤细胞系中,过表达ErbB2可以下调雌激素受体,从而抑制雌激素诱导的LRIG1转录[1,19]。
笔者研究发现,LRIG1 mRNA在SKOV3/VP16耐药细胞株中的表达低于野生型SKOV3细胞株,使用siRNA沉默的SKOV3和SKOV3/VP16细胞中的LRIG1 mRNA进一步降低,差异有统计学意义,与之相对的,给予不同浓度的VP16,siRNA LRIG1转染SKOV3细胞、SKOV3/VP16和 siRNA LRIG1转染SKOV3/VP16细胞的IC50依次增高,克隆集落刺激增加和凋亡降低。本结果表明,LRIG1可以抑制卵巢癌细胞的增殖,将其沉默后,细胞增殖能力减弱而凋亡增加。该结论与既往研究基本吻合,该结果提示在卵巢癌的治疗中,可以通过增强LRIG1蛋白的表达而促进肿瘤细胞凋亡,提高卵巢癌细胞放化疗的敏感性。如临床应用天然化合物藤黄酸可用于抗癌,机制在于藤黄酸可以通过AMP激酶的活化而上调LRIG1在胶质瘤细胞中的表达,从而抑制该细胞的增殖[25]。
结合本研究结果,笔者认为,LRIG1影响SKOV3细胞对药物的敏感性,呈剂量相关特点,沉默细胞中的LRIG1后,可以抑制SKOV3细胞凋亡,增强卵巢癌细胞中LRIG1表达以提高卵巢癌细胞放化疗敏感性。
[1]KRIG S R,FRIETZE S,SIMION C,et al.LRIG1 is an estrogen-regulated growth suppressor and correlates with longer relapse-free survival in ER alpha-positive breast cancer[J].Molecular Cancer Research,2011,9(10):1406-1417.
[2]THOMPSON P A,LJUSLINDER I,TSAVACHIDIS S,et al.Loss of LRIG1 locus increases risk of early and late relapse of stageⅠ/Ⅱ breast cancer[J].Cancer Research,2014,74(11):2928-2935.
[3]LINDSTROM A K,EKMAN K,STENDAHL U,et al.LRIG1 and squamous epithelial uterine cervical cancer:Correlation to prognosis,other tumor markers,sex steroid hormones,and smoking[J].International Journal of Gynecological Cancer,2008,18(2):312-317.
[4]HEDMAN H,LINDSTROM A K,TOT T,et al.LRIG2 in contrast to LRIG1 predicts poor survival in early-stage squamous cell carcinoma of the uterine cervix[J].Acta Oncologica,2010,49(4):812-815.
[5]MULLER S,LINDQUIST D,KANTER L,et al.Expression of LRIG1 and LRIG3 correlates with human papillomavirus status and patient survival in cervical adenocarcinoma[J].International Journal of Oncology,2013,42(1):247-252.
[6]SHEU J J,LEE C H,KO J Y,et al.Chromosome 3p12.3-p14.2 and 3q26.2-q26.32 are genomic markers for prognosis of advanced nasopharyngeal carcinoma[J].Cancer Epidemiology Biomarkers&Prevention,2009,18(10):2709-2716.
[7]SHEU J J,LEE C C,HUA C H,et al.LRIG1 modulates aggressiveness of head and neck cancers by regulating EGFR-MAPKSPHK1 signaling and extracellular matrix remodeling[J].Oncogene,2014,33(11):1375-1384.
[8]LINDQUIST D.Expression of LRIG1 is associated with good prognosis and human papillomavirus status in oropharyngeal cancer[J].British Journal of Cancer,2014,110(7):1793-1800.
[9]GUO D,NILSSON J,HAAPASALO H,etal.Perinuclear leucine-rich repeatsand immunoglobulin-like domain proteins(LRIG1-3)as prognostic indicators in astrocytic tumors[J].Acta Neuropathologica,2006,111(3):238-246.
[10]HOLMLUND C,HAAPASALO H,YI W,et al.Cytoplasmic LRIG2 expression is associated with poor oligodendroglioma patient survival[J].Neuropathology,2009,29(3):242-247.
[11]THOMASSON M,WANG B,HAMMARSTEN P,et al.LRIG1 and the liar paradox in prostate cancer:A study of the expression and clinical significance of LRIG1 in prostate cancer[J].International Journal of Cancer,2011,128(12):2843-2852.
[12]TANEMURA A,NAGASAWA T,INUI S,et al.LRIG-1 provides a novel prognostic predictor in squamous cell carcinoma of the skin:Immunohistochemical analysis for 38 cases[J].Dermatologic Surgery,2005,31(4):423-430.
[13]HEDMAN H,NILSSON J,GUO D,et al.Is LRIG1 a tumour suppressorgeneatchromosome3p14.3[J].ActaOncologica,2002,41(4):352-354.
[14]GUR G,RUBIN C,KATZ M,et al.LRIG1 restricts growth factor signaling by enhancing receptor ubiquitylation and degradation[J].Embo Journal.2004,23(16):3270-3281.
[15]LAEDERICH M B,FUNES-DURAN M,YEN L,et al.The leucine-rich repeat protein LRIG1 is a negative regulator of ErbB family receptor tyrosine kinases[J].Journal of Biological Chemistry,2004,279(45):47050-47056.
[16]JENSEN K B,WATT F M.Single-cell expression profiling of human epidermal stem and transit-amplifying cells:Lrig1 is a regulator of stem cell quiescence[J].Proceedings of the NationalAcademy of Sciences of the United States of America,2006,103(32):11958-11963.
[17]YANG W M,YAN Z J,YE Z Q,et al.LRIG1,a candidate tumour-suppressor gene in human bladder cancer cell line BIU87[J].BJU International,2006,98(4):898-902.
[18]SHATTUCK D L,MILLER J K,LAEDERICH M,et al.LRIG1 is a novel negative regulator of the Met receptor and opposes Met and Her2 synergy[J].Molecular&Cellular Biology,2007,27(5):1934-1946.
[19]MILLER J K,SHATTUCK D L,INGALLA E Q,et al.Suppression ofthe negativeregulatorLRIG1 contributesto ErbB2 overexpression in breast cancer[J].Cancer Research,2008,68(20):8286-8294.
[20]NILSSON J,VALLBO C,GUO D,et al.Cloning,characterization,and expression of human LIG1[J].Biochemical&Biophysical Research Communications,2001,284(5):1155-1161.
[21]HOLMLUND C,NILSSON J,GUO D,et al.Characterization and tissue-specific expression of human LRIG2[J].Gene,2004,332(4):35-43.
[22]GUO D,HOLMLUND C,HENRIKSSON R,et al.The LRIG gene family has three vertebrate paralogs widely expressed in human and mouse tissues and a homolog in Ascidiacea[J].Genomics,2004,84(1):157-165.
[23]NILSSON J,STAREFELDT A,HENRIKSSON R,et al.LRIG1 protein in human cells and tissues[J].Cell and Tissue Research,2003,312(1):65-71.
[24]LEDDA F,BIERAUGEL O,FARD S S,et al.LRIG1 is an endogenous inhibitor of Ret receptor tyrosine kinase activation,downstream signaling,and biological responses to GDNF[J].The Journal of Neuroscience,2008,28(1):39-49.
[25]ZHAO B,SHEN H,ZHANG L,et al.Gambogic acid activates AMP-activated protein kinase in mammalian cells[J].Biochem Biophys Res Commun,2012,424(1):100-104.
Role and mechanism of LRIG1 in SKOV3,siRNALRIG1 KOV3,KOV3/VP16 and siRNALRIG1 KOV3/VP16*
Hua Yang1,Yuan Ye2,Sheng-jun Xiao3,Xiao-mei Lei1,Xiao-hong Luo4
(1.Department of Gynaecology,the Second Affiliated Hospital of Guilin Medical University,Guilin,Guangxi 541199,China;2.Department of Gynaecology,Affiliated Hospital of Guilin Medical University,Guilin,Guangxi 541001,China;3.Department of Pathology,the Second Affiliated Hospital of Guilin Medical University,Guilin,Guangxi 541199,China;4.Department of Medical Records,Affiliated Hospital of Guilin Medical University,Guilin,Guangxi 541001,China)
ovarian cancer;drug resistance;leucine-rich repeats and immunoglobulin-like domains-1
Q344.14
A
10.3969/j.issn.1005-8982.2017.11.001
1005-8982(2017)11-0001-07
2016-12-15
桂林市科学研究与技术开发计划项目(No:20130120-3)
叶元,Tel:13517738776
Abstract:ObjectiveTo investigate the role and possible mechanism of LRIG1 in SKOV3,siRNALRIG1 KOV3,KOV3/VP16 and siRNALRIG1 KOV3/VP16.MethodsThe cell proliferation of SKOV3,siRNALRIG1 KOV3,KOV3/VP16 and siRNALRIG1 KOV3/VP16 were detected by MMT at different concentrations of VP16,which had been con-cultured for 48 hours.Cell proliferation was detected by plate cloning.Cell apoptosis was detected by flow cytometry.LRIG1 gene expression was detected by quantitative real-time PCR.ResultsIC50 of SKOV3,siRNALRIG1 KOV3,KOV3/VP16 and siRNALRIG1 KOV3/VP1 were 62.90 μg/L,115.49 μg/L,156.50 μg/L and 195.42 μg/L,respectively,with the drug resistance index of 1.8,2.5 and 3.1 respectively.Compared with SKOV3,the cloning rates had increased (the mean differences were 8.000,37.692 and 72.000,P<0.05),the LRIG1 mRNA (the mean differences were 2.994,88.366 and 279.004,P<0.05)and apoptotic cells(the mean difference were 48.942,63.485 83.659,P<0.05)had decreased significantly in siRNALRIG1 KOV3,SKOV3/VP16 and siRNALRIG1 KOV3/VP16 cells.Compared with siRNALRIG1 KOV3,the cloning rates had increased(the mean differences were 25.000 and 58.824,P<0.05),the LRIG1 mRNA(the mean differences were 47.478 and 180.147,P<0.05)and apoptotic cells (the mean differences were 53.678 and 42.687,P<0.05)had decreased in SKOV3/VP16 and siRNALRIG1 KOV3/VP16 cells (P<0.05).Compared with SKOV3/VP16,the cloning rates had increased (the mean difference was 10.000,P<0.05),the LRIG1 mRNA (the mean difference was 92.784,P<0.05)and apoptotic cells (the mean difference was 37.625,P<0.05)had decreased in siRNA LRIG1 KOV3/VP16 cells(P<0.05).Conclusions The LRIG1 gene can affect drug sensitivity of SKOV3 for lower LRIG1 could decrease the apoptosis of cells.

