C-myc基因表达及细胞凋亡在脂溢性角化病皮损中的意义
杜镇,海艺贝,冯世军,王艳心,王成,李保强
(1.承德医学院附属医院,河北 承德 067000;2.广州中医药大学,广东 广州 510000;3.河北省沧州市中心医院,河北 沧州 061000)
C-myc基因表达及细胞凋亡在脂溢性角化病皮损中的意义
杜镇1,海艺贝2,冯世军3,王艳心1,王成1,李保强1
(1.承德医学院附属医院,河北 承德 067000;2.广州中医药大学,广东 广州 510000;3.河北省沧州市中心医院,河北 沧州 061000)
目的 观察脂溢性角化病(SK)中C-myc基因表达及细胞凋亡情况,探讨脂溢性角化病的发病机制。方法 对66例脂溢性角化病皮损及10例正常皮肤组织采用免疫组织化学法检测C-myc基因表达及原位细胞凋亡检测(TUNEL)法检测细胞凋亡情况。结果 两组性别、年龄差异均无统计学意义(P>0.05);SK组皮损区C-myc基因阳性细胞数百分比(21.94±19.45)%与对照组(0%)相比增加(P<0.05);66例SK皮损中有52例C-myc基因表达阳性,对照组中均无阳性表达,两组阳性率差异有统计学意义(P<0.05);TUNEL凋亡检测中SK组的凋亡指数(53.01±31.97)与对照组(33.50±23.86)比较,差异无统计学意义(P>0.05);Spearman相关性分析显示,C-myc基因在SK皮损中阳性细胞百分比与SK皮损中细胞凋亡指数差异无统计学意义(P>0.05)。结论 C-myc基因参与脂溢性角化病的发生发展,脂溢性角化病皮损中细胞凋亡有所增加。该结果对研究其发病机制有一定的指导意义。
脂溢性角化病;免疫组织化学;C-myc基因;脱氧核糖核苷酸末端转移酶介导的缺口末端标记
1 资料与方法
1.1 临床资料
选取2013年1月-2014年12月本院皮肤科就诊的66例脂溢性角化病患者,经临床表现及病理学确诊为SK。其中,男性39例,女性27例;平均(55.83±12.91)岁。正常组织10例。男性4例,女性6例;平均(48.00±12.61)岁。两组性别、年龄比较差异无统计学意义(χ2=0.628,P=0.428;t=1.793,P=0.077)。
1.2 主要试剂与设备
C-myc基因工作液、即用型快捷型免疫组织化学Max VisionTM试剂盒羊抗鼠/兔和二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒(均购于福州迈新生物技术开发有限公司),TUNEL凋亡试剂盒(S7100)(购自美国 Millipore公司),S325石蜡切片机(英国Shandon Finesse公司),Wd750ASL23微波炉(广东省顺德格兰仕集团公司),BX40F4显微镜(日本Olympus公司),置入4℃冰箱保存(山东省青岛海尔集团公司),粘附载玻片(江苏省海门世泰实验器材有限公司)。
1.3 实验方法
1.3.1 免疫组织化学染色法 组织切片脱蜡至水,自来水冲洗,3%的过氧化氢H2O2室温孵育10 min,枸橼酸盐缓冲液热修复,血清封闭,滴加一抗,4℃过夜,滴加二抗,DAB显色,苏木素复染,1%盐酸酒精分化,氨水返蓝,吹干,中性树胶封片,镜检。以磷酸盐缓冲溶液(phosphate buffer saline,PBS)代替一抗作为阴性对照,已知阳性组织切片作为阳性对照组。
1.3.2 脂溢性角化病组织标本的凋亡检测 石蜡切片常规脱蜡至水,按TUNEL试剂盒说明书进行操作,采用DAB显色,苏木素复染,1%盐酸酒精分化,氨水返蓝,吹干,封片,镜检。用在配制末端转移酶(terminal deoxynucleotidyl transferase,TDT) 反应液中不加TDT进行标记的组织切片作为阴性对照,用脱氧核糖核酸酶 I(Deoxyribonuclease I,DNase I)处理的组织切片作为阳性对照组。
1.4 结果判定
1.4.1 免疫组织化学结果判定 每张切片随机选取5个高倍镜视野(×400倍),阳性着色为棕黄色颗粒,不着色为阴性。计算5个视野中的阳性细胞数百分比。结果评估根据Fromowitz[3]的综合计分法进行。在高倍镜下(10×40)作如下评分:①阳性程度:无着色为0分;淡黄色为1分;棕黄色为2分;棕褐色为3分。②阳性细胞百分比:<5%为0分;5%~25%为1分;26%~50%为 2分;51%~75%为 3分;>76%为4分。两项结果相加<2分为阴性(-);2~3分为弱阳性(+);4~5分为中度阳性(++);6~7分为强阳性(+++)。
其次,农村化学品企业在中国农村地区发展存在“污染天堂效应”。在技术、市场以及资源等其他条件相同的情况下,环境规制对农村化学品企业发展存在显著的负向影响。此外,农村招商引资优惠、工业资本存量对农村化学品企业的发展有显著正向影响,技术因素对农村化学品企业发展有显著负向影响。
1.4.2 TUNEL凋亡检测结果判定 正常细胞核呈蓝黑色,凋亡细胞呈不同程度的棕褐色。每张切片在凋亡细胞区域取5个高倍视野,计算平均每100个细胞中凋亡细胞数,并以百分数(%)表示凋亡指数(apoptosis index,AI)。
1.5 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,比较用两独立样本t检验,计数资料以率(%)表示,用χ2检验,相关性分析用Spearman法,P<0.05为差异有统计学意义。
2 结果
2.1 C-myc基因在SK皮损中的阳性表达
C-myc基因主要在角质形成细胞的细胞核,广泛分布于棘细胞层及基底层,表现为棕黄色(阳性表达和阴性对照,见图1、2),正常皮肤组织无表达(见图3)。SK皮损区C-myc基因阳性细胞数百分比(21.94±19.45)%与正常皮肤组织0%比较增高,差异有统计学意义(P<0.05)。C-myc基因在SK皮损区-、+、++ 及 +++ 阳性细胞例数分别为 14、28、22 和2,其阳性率78.79%高于正常皮肤组织0%,差异有统计学意义(χ2=21.436,P=0.000)。
2.2 细胞凋亡情况
TUNEL凋亡检测中SK皮损组的凋亡指数(53.01±31.97)%与正常皮肤组织(33.50±23.86)%比较,差异无统计学意义(t=1.849,P=0.068)(见图4、6),阴性对照组(见图 5、7)。

图1 C-myc基因在SK皮损中阳性表达(Max Vision×100)

图2 PBS代替一抗在SK皮损中阴性表达(Max Vision×100)
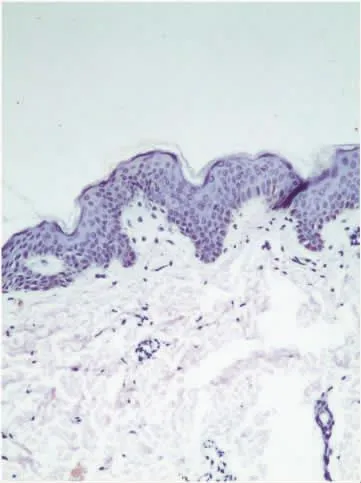
图3 C-myc基因在正常皮肤组织中阴性表达(Max Vision×100)

图4 SK皮损中细胞凋亡情况 (TUNEL×100)

图5 反应液中不加TDT时SK皮损中细胞凋亡情况(TUNEL×100)
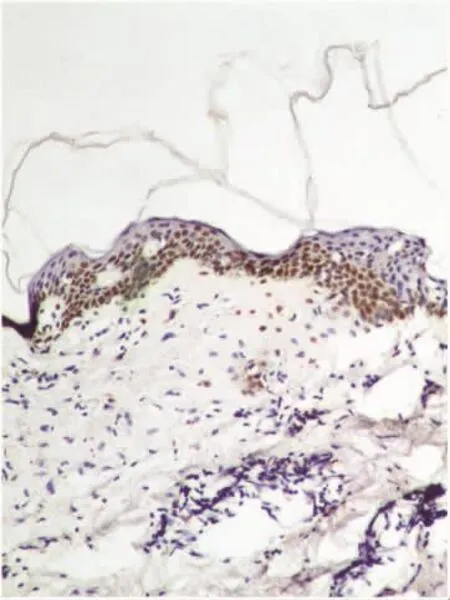
图6 正常皮肤组织中细胞凋亡情况 (TUNEL×100)
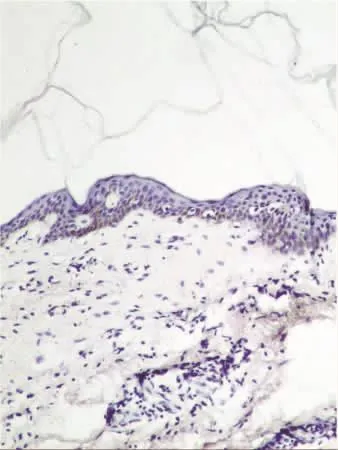
图7 反应液中不加TDT时正常组织中细胞凋亡情况(TUNEL×100)
2.3 相关性分析
C-myc基因在SK皮损中阳性细胞百分比与SK皮损中细胞凋亡指数相关性差异无统计学意义(r=-0.098,P=0.436)。
3 讨论
myc基因家族在许多肿瘤发展中处于重要地位,尤其是C-myc基因作为其中一员在许多恶性肿瘤的增殖与凋亡中发挥着重要的作用。目前,已知C-myc基因在胃癌及食管癌等肿瘤中高表达[4-5]。脂溢性角化病虽为常见的良性皮肤肿瘤,其病理表现为角化过度,角化不全,棘层肥厚,乳头瘤样增生,但临床中也有恶变的报道[6-7]。因此,检测C-myc基因在脂溢性角化病组织病损中的表达情况,有助于为脂溢性角化病的发病机制提供依据。
实验结果表明,C-myc基因在SK皮损与正常皮肤组织中差异有统计学意义,这与国外相关报道一致[8]。细胞增殖失控将导致尤其是恶性肿瘤的发生,显然SK作为良性肿瘤其增殖并非无限,因此实验采用TUNEL法检测SK细胞的凋亡情况,研究发现SK细胞凋亡指数与对照组比较差异无统计学意义[9],但整体发现SK皮损细胞凋亡程度较对照组有所增加。与PESCE等[10]研究较一致,且其认为凋亡增加可能是由于表皮生长因子受体(epithelial growth factor receptor,EGFR)及125I-EGF 联合下调的结果。另外,张春玲等[11]发现,凋亡基因Fas在SK中的表达较正常表皮细胞早,虽然两者差异无统计学意义,但作为Fas的配体FasL在SK中比正常表皮表达更明显。也有不同的报道,AHMED等[12]认为SK的发病机制可能与细胞凋亡受阻有关。有研究证实,作为凋亡抑制蛋白Survivin在SK 病损中高表达[8-9,13],从本实验结果推测,SK细胞的凋亡轻度增加与细胞增殖间的相互作用可能是其良性表现的原因。也有研究推测肿瘤抑制基因PTEN部分拮抗Survivin蛋白活性使得SK表现出良性过程[13]。细胞凋亡指数与C-myc基因在SK皮损中阳性细胞百分比相关性无显著意义。因此,不能表明C-myc基因的表达增加对脂溢性角化病细胞凋亡产生怎样的影响,但研究发现C-myc基因不仅在SK,而且在原位鳞状细胞癌(Bowen病)、鳞状细胞癌中高表达[8]。可见其对肿瘤细胞的增殖可能发挥着重要的作用。虽然脂溢性角化病的发病机制尚不明确,但C-myc基因作为双向调节肿瘤增殖与凋亡基因在SK皮损中的高表达,必然对该病的发生、发展产生不可忽视的作用。
[1]李福伦,邓辉,李建伟,等.慢性难愈性皮肤溃疡β-catenin,c-myc,K6蛋白的表达及意义[J].中国皮肤性病学杂志,2010,24(12):1092-1094.
[2]徐丽敏,毛舒和,陈学荣,等.寻常性银屑病皮损bcl-2和c-myc基因表达及意义[J].中国皮肤性病学杂志,2000,14(5):131-132.
[3]FROMOWITZ F B,VIOLA M V,CHAO S,et al.Ras p21 expression in the progression of breast cancer[J].Human Pathology,1987,18(12):1268-1275.
[4]李良庆,宋俊,潘敦.胃癌组织中LIN28B和c-myc的表达及其临床意义[J].胃肠病学和肝病学杂志,2015,24(2):176-181.
[5]李秀梅,郭琼,姜孝芳,等.新疆哈萨克族食管癌中Survivin、c-myc、NF-κB的表达及其与临床因素的相关性研究[J].中国现代学杂志,2013,23(27):62-66.
[6]李云飞,陈晓红,熊琦,等.面部脂溢性角化病并发原位黑素瘤1例[J].中国皮肤性病学杂志,2013,27(5):511-512.
[7]ANAN T,FUKUMOTO T,KIMURA T.Two cases of seborrheic keratosis with basal clear cells[J].Journal of Dermatology,2016,61(4):443-445.
[8]LINING X,UCHI H,HAYASHIDA S,et al.Expression of hypoxia-inducible factor-1alpha and hypoxia-inducible factor-2alpha with progression of keratinocytic neoplasms[J].Journal of Dermatological Science,2009,56(2):135-136.
[9]BOWEN A R,HANKS A N,MURPHY K J,et al.Proliferation,apoptosis,and survivin expression in keratinocytic neoplasms and hyperplasias[J].American Journal of Dermatopathology,2004,26(3):177-181.
[10]PESCE C,SCANLORA S.Apoptosis in the area of squamous differentiation irritated seborrheic keratosis[J].Journal of Cutaneous Pathology,2000,27(3):121-123.
[11]张春玲,葛蒙梁.细胞凋亡在脂溢性角化病中的作用 [J].中国麻风皮肤病杂志,2004,20(4):336-337.
[12]AHMED N U,UEDA M,LCHIHASHI M.P21 WAFl/CIPl expression in nonlllelsnonla skin tumon[J].Journal of Cutaneous Pathology,1997,24(4):223-227.
[13]李美州,刘江惠,郭建文,等.Survivin和PTEN在脂溢性角化病中的表达及其意义[J].临床肿瘤学杂志,2009,14(2):157-161.
Significance of C-myc expression and cell apoptosis in seborrheic keratosis
Zhen Du1,Yi-bei Hai2,Shi-jun Feng3,Yan-xin Wang1,Cheng Wang1,Bao-qiang Li1
(1.The Affiliated Hospital of Chengde Medical University,Chengde,Hebei 067000,China;2.Guangzhou University of Chinese Medicine,Guangzhou,Guangdong 510000,China;3.Cangzhou Central Hospital,Cangzhou,Hebei 061000,China)
ObjectiveTo observe the expression of C-myc and apoptosis in seborrheic keratosis (SK)and investigate the pathogenesis of SK.MethodsImunohistochemistry was used to detect the expression of C-myc,and the apoptosis of cell were detected by TUNEL in 66 SK lesions and 10 normal controls.ResultsThere was no significant difference in gender and age between the two groups(P>0.05).The percentage of C-myc positive cells(21.94±19.45)%in SK lesions were significantly higher than that in the control groups(0)(P <0.05).The protein of C-myc was positively expressed in 52 cases of the 66 SK lesions while none was expressed in the control groups (P<0.05).There was no significant difference in apoptotic index between SK lesions(53.01±31.97)and the control groups(33.50±23.86)by TUNEL(P>0.05).There were no significant correlation between the percentage of C-myc protein positive cells and the apoptosis index in SK lesions by spearman analysis (P>0.05).Conclusions C-myc protein is involved in the occurrence and development of SK,and the apoptosis of SK is increased.
seborrheic keratosis;immunohistochemistry;C-myc;TUNEL
R739.5
A
10.3969/j.issn.1005-8982.2017.11.008
1005-8982(2017)11-0041-04
2017-02-03
李保强,E-mail:dermlbq@126.com

