供/受体体表面积比值在儿童供肾移植中的作用及应用
彭志谭,成柯,赵于军,刘炼,王强,叶启发
(中南大学湘雅三医院,湖南 长沙 410013)
供/受体体表面积比值在儿童供肾移植中的作用及应用
彭志谭,成柯,赵于军,刘炼,王强,叶启发
(中南大学湘雅三医院,湖南 长沙 410013)
目的 研究供/受体体表面积比值(D/R BSA)在心脏死亡儿童供体单肾移植中的作用,并对其应用进行初步探讨。方法 回顾性研究该中心自2010~2014年开展的13例供体年龄为2~18岁的心脏死亡儿童供体单肾移植。根据D/RBSA比值将患者分成两组:A组D/R BSA<0.8;B组D/R BSA≥0.8。比较不同分组间供受体基本资料、术后早期并发症、术后1年内肾小球滤过率(e-GFR)及移植肾存活情况的差异。结果 两组间供体性别、年龄、体重、身高、体表面积、原发病及术前肌酐等差异无统计学意义(P>0.05)。两组受者术后早期并发症的发生率比较差异无统计意义(P>0.05)。两组术后1、3、6及12个月的肾小球滤过率的平均值分别为(63.2±5.0)vs(74.0±7.6)(P=0.008);(66.2±4.9)vs(75.8±5.9)(P=0.004);(69.0±4.8)vs(79.0±6.3)(P=0.004);(69.4±7.9)vs(79.2±8.4)(P=0.033)。A组术后1年移植肾存活率为62.5%,B组移植肾存活率为94.4%;B组高于A组,差异有统计学意义(P=0.042)。结论 当儿童供体的年龄>2岁时,D/R BSA比值>0.8有利于心脏死亡儿童供体单肾移植术后移植肾功能的恢复,并且有助于受者的合理选择。
心脏死亡;捐献;儿童供体;肾移植;体表面积
对终末期肾病患者而言,肾移植无疑是最好的选择[1]。然而,随着每年新发尿毒症患者数量的逐年累加,供肾的来源却相对有限,器官短缺问题越来越严重。国内外各研究中心努力尝试从多方面扩大器官来源以缓解器官严重短缺局面。比如心脏死亡老年供体>65岁,心脏死亡儿童供体<18岁等一些边缘供体的应用,其临床疗效已得到移植界的广泛认可[2]。然而,由于有功能的肾单位数量相对不足,这类边缘供体肾移植术后出现急性肾小管坏死、蛋白尿及血栓等并发症的可能性显著增加,术后移植肾功能丧失的风险也远大于标准供体肾移植[3-5]。
此外,在实验动物及肾移植患者中均可出现因有功能肾单位不足而引起的肾单位代偿性增生及高血流灌注,进而导致慢性进展性肾损伤[6-8]。因此,一些学者建议体重<15 kg或年龄<3岁的儿童供体肾脏应分配给体重低、年龄小的受体以确保移植肾有功能的肾单位能满足受体日常代谢的需要[9]。
供/受体体表面积(donor/recipient body surface area,D/R BSA)比值可作为预测有功能肾单位数量是否充足的一项重要指标,已有研究表明,D/R BSA与肾移植术后肾功能及移植肾存活息息相关[10-11]。目前国外文献报道,D/R BSA应用于亲属活体肾移植中供体选择中,而其在儿童供肾移植尤其是儿童供肾成人肾移植方面的应用鲜有报道。本研究旨在研究D/R BSA在心脏死亡儿童供体单肾移植中的作用,并对其应用进行初步探讨。
1 资料与方法
1.1 一般资料
选取2010~2014年本中心13例心脏死亡儿童供体纳入本研究。其中,男女比例为3∶10。受体26例,男女比例为13∶13;所有受体术后密切随访1年。
1.2 供、受体体表面积的计算
在获取供体器官前,本中心器官获取组织(organ procurement organizations,OPO)组织成员详细记录供体的相关信息,其中包括供体的身高及体重;测量并记录肾移植受者术前的身高及体重;根据Mosteller公式[12][BSA/m2=(体重 /kg×身高 /cm/3600)1/2]计算供体和受体的BSA。
1.3 移植肾功能延迟恢复及急性排斥反应的定义
本研究中,移植肾功能延迟恢复(delayed graft function,DGF)定义为肾移植术后移植肾功能恢复差,需行血液透析治疗,或术后第7天血肌酐水平仍然在>400 μmol/L[13]。肾穿刺活检是目前国际上公认用于确诊急性排斥反应(acute rejection,AR)的金标准,本院采用肾穿刺及临床学诊断共同判定AR。
1.4 肾小球率过滤的计算
肾小球率过滤估计值(estimated glomerular filtration rate,e-GFR)的计算采用简化MDRD公式:e-GFR[ml/(min·1.73 m2)]=186×[血肌酐(mg/dl)]-1.154×(年龄/岁)-0.203×(女性×0.742),1 mg/dl=88.4 μmol/L[14]。
1.5 患者分组及结果分析
以D/R BSA相差20%作为本研究的分组依据[10],将所有患者分为两组:A组D/R BSA<0.8,B组D/R BSA≥0.8。比较两组供/受体基本资料和受者术后1年内e-GFR及移植肾存活情况。
1.6 统计学方法
数据分析采用SPSS 19.0统计软件,用Fisher精确概率法对分类变量进行检验分析,连续变量的比较则用独立样本t检验,用Kaplan-Meier生存曲线和Log-rank法对供/受体的生存情况进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 分组后供/受体基本资料比较
两组供体的性别、年龄、体重、身高、BSA、术前肌酐、原发病及受体的性别、身高、体重、BSA、是否再次移植、HLA错配及免疫诱导等基本数据比较差异无统计学意义(P>0.05)。见表1。
2.2 术后早期并发症的比较
两组受体术后DGF、AR、尿漏、移植肾输尿管狭窄、血栓形成以及肺部感染等可能影响早期肾功能及其存活的并发症的发生率间的差异,发现两组受体术后早期并发症的发生率差异无统计学意义(P >0.05)。见表2。
2.3 两组受体术后e-GFR比较
两组儿童供肾移植受体术后1、3、6及12个月的肾小球滤过率的平均值分别为(63.2±5.0)vs(74.0±7.6)(P=0.008);(66.2±4.9)vs(75.8±5.9)(P=0.004);(69.0±4.8)vs(79.0±6.3)(P=0.004);(69.4±7.9)vs(79.2±8.4)(P=0.033)。见图 1。
2.4 两组术后移植肾存活比较
A组术后1年内移植肾肾功能丧失3例,移植肾存活率为62.5%,其中2例由急性排斥反应引起,1例由移植肾动脉破裂引起;B组术后仅有1例因转移性肾肿瘤形成导致移植肾破裂而肾功能丧失,移植肾存活率为94.4%;B组高于A组,差异有统计学意义(P=0.042)。见图2。
表1 两组的基本资料 (±s)

表1 两组的基本资料 (±s)
注:人类白细胞表面抗原(human leukocyte antigen,HLA)
项目D/R BSA<0.8D/R BSA≥0.8t/χ2值P值供体基本资料男/女/供肾数 1/7 5/13 - 0.358年龄/(岁,±s)11.60±2.80 13.70±2.80 -1.775 0.089身高/(cm,±s)146.90±9.00 153.50±9.0 -1.727 0.097体重/(kg,±s)1.31±0.12 1.410±0.15 -1.838 0.078术前肌酐/(μmol/L,±s)41.80±5.00 46.90±7.20 -1.831 0.080 BSA/(m2,±s)67.50±8.90 63.70±8.60 -1.039 0.309死亡原因/供肾数3.10±1.70 3.30±1.80 -0.270 0.789热缺血时间/(min,±s)脑缺氧 1/8 1/18脑血管意外 1/8 1/18脑创伤 3/8 5/18 - 0.083脑肿瘤 2/8 4/18其他 1/8 7/18冷缺血时间/(h,±s)22.40±3.00 23.10±3.30 -0.501 0.621受体基本资料男 /女 /例 4/4 9/9 - 1.000年龄/(岁,±s)41.10±8.20 38.90±11.20-0.505 0.618身高/(cm,±s)166.50±7.20 158.80±16.00-1.284 0.211体重/(kg,±s)58.40±12.10 50.60±14.30-1.331 0.196BSA/(m2,±s)1.64±0.20 1.49±0.28 -1.330 0.196是否再次移植/例 1/8 3/18 - 1.000HLA 错配(±s)2.30±1.00 2.50±0.70 -0.721 0.478免疫诱导/例 2/8 7/18 - 0.667

表2 术后早期并发症的比较 例

图1 两组受体术后e-GFR比较
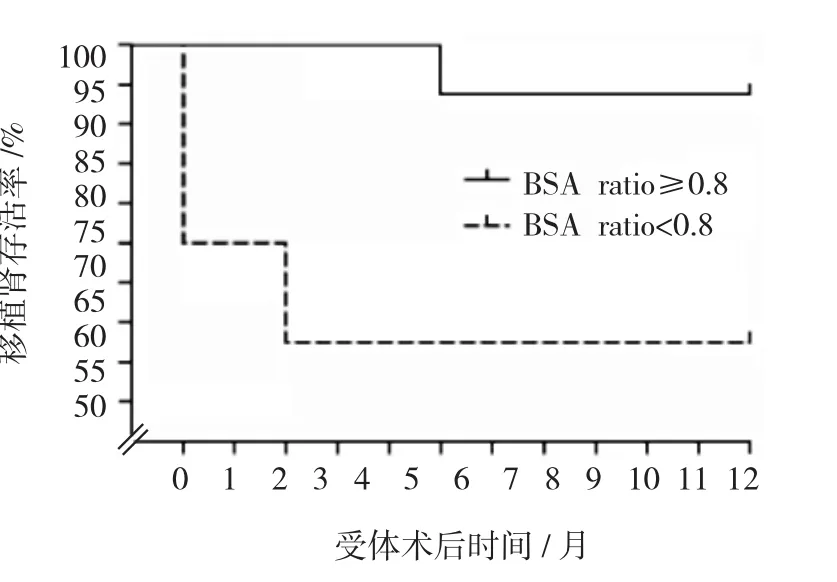
图2 两组术后移植肾短期存活率比较
3 讨论
儿童供肾的不合理分配及手术技术的不成熟可能导致术后移植肾功能欠佳,甚至出现移植肾功能丧失。目前,儿童供肾肾移植的手术方式主要有整体移植、双肾移植及单肾移植3种[15]。第1种和第2种类似,是将供体的2个肾脏同时移植到受者体内,其优点在于解决儿童供体单侧肾脏无法满足受者日常代谢需求的问题,但手术难度大、时间长,术后发生血管及输尿管并发症的风险增加,且不利于扩大器官来源。研究发现,当心脏死亡儿童供体的年龄>2岁时,单肾移植手术的远期效果与心脏死亡标准供体肾移植比较差异无统计学意义,但当供体的年龄为2岁时,其疗效变差,并建议该类小儿供体应采用整体移植作为其基本术式[16-17]。为排除年龄该关键因素对本研究的干扰,本研究的纳入标准为供体年龄为2~18岁。本研究中所有受体采用单肾移植,有助于提高儿童供肾的利用率。
目前,已了解到的影响儿童供肾移植临床疗效的主要因素包括免疫相关因素与非免疫相关因素[18-19],而非免疫相关因素中有功能移植肾单位数目的多寡将直接决定术后移植肾功能的好坏和移植肾存活时间的长短[20]。有研究表明,在预测有功能移植肾单位数目的指标中,供体的BSA比供体的年龄、性别及体重等更具代表性[11]。BSA不仅能反应有功能肾单位数目的多少,也能反应机体代谢的强弱,因此D/R BSA是评估有功能的移植肾单位能否满足受体日常代谢需求的一项重要指标[10-11]。笔者通过研究D/R BSA在心脏死亡儿童供体单肾移植中的作用,对D/R BSA在儿童供肾肾移植中的应用进行探讨。
本研究中发现,两组供体性别、年龄、体重、身高、BSA、原发病、术前肌酐、术后早期并发症以及受体相关资料等差异无统计学意义(P>0.05),基本可排除这些因素对本研究结果的影响。D/R BSA是预测有功能移植肾单位是否充足的一项重要指标,而充足的有功能移植肾单位直接决定术后移植肾功能的强弱[11]。根据本研究中两组e-GFR的比较结果,B组术后1年内各时间点的e-GFR水平均优于A组(P<0.05),由此推测,当儿童供体的年龄>2岁时,D/R BSA>0.8有利于提高心脏死亡儿童供体单肾移植术后移植肾功能的恢复。
在对比两组术后移植肾的存活率时,发现D/R BSA值较小组移植肾1年存活率低于D/R BSA值较大组(P<0.05)。但本研究中,术后移植肾肾功能丧失主要发生在术后<6个月,此后移植肾均良好存活。且临床上在给移植肾肾功能丧失的患者作病因分析时发现,A组肾功能丧失的3例移植肾中有2例明确诊断为急性排斥反应,2例患者的移植肾脏均因破裂大出血而分别在术后第5天和第10天被摘除;另外1例则是由移植肾动脉吻合口破裂导致的移植肾肾功能丧失;B组1例移植肾肾功能丧失则主要是由转移性肾肿瘤形成导致移植肾破裂造成。
GIULIANI等在研究中发现,D/R BSA值减小是儿童供肾移植术后影响移植肾长期存活的危险因素,并指出D/R BSA值增加有利于降低术后急性排斥反应的发生率[10]。在本研究中,虽然B组移植肾存活率高于A组,但两组移植肾肾功能丧失主要与术后早期并发症相关,D/R BSA对心脏死亡儿童供体单肾移植术后移植肾近期存活的影响有待进一步研究。
综上所述,当儿童供体的年龄>2岁时,D/R BSA>0.8有利于提高心脏死亡儿童供体单肾移植术后移植肾功能的恢复。同时,笔者建议BSA小的儿童供体肾脏应尽量分配给BSA较小的受体,使得D/R BSA≥0.8,一方面可避免因单肾移植造成的移植肾有功能肾单位不足,从而提高术后近期移植肾的功能;另一方面有助于受体的合理选择。
[1]WOLFE R A,ASHBY V B,MILFORD E L,et al.Comparison of mortality in all patients on dialysis,patients on dialysis awaiting transplantation,and recipients of a first cadaver transplant[J].New England Journal of Medicine,1999,341(23):1725-1730.
[2]PELLETIER S J,GUIDINGER M K,MERION R M,et al.Recovery and utilization of deceased donor kidneys from small pediatric donors[J].American Journal of Transplantation,2006,6(7):1646-1652.
[3]SMITH A Y,VAN BUREN C T,LEWIS R M,et al.Short-term and long-term function ofcadaveric kidneys from pediatric donors in recipients treated with cyclosporine[J].Transplantation,1988,45(2):360-367.
[4]ARBUS G S,ROCHON J,THOMPSON D.Survival of cadaveric renal transplant grafts from young donors and in young recipients[J].Pediatric Nephrology,1991,5(1):152-157.
[5]CREAGH T A,MCLEAN P A,SPENCER S,et al.Transplantation of kidneys from pediatric cadaver donors to adult recipients[J].Journal of Urology,1991,146(4):951-952.
[6]BRENNER B M.Nephron adaptation to renal injury or ablation[J].The American Journal of Physiology,1985,249(3 Pt 2):324-337.
[7]HOSTETTER T H,OLSON J L,RENNKE H G,et al.Hyperfiltration in remnant nephrons:a potentially adverse response to renal ablation[J].American Journal of Physiology,2001,12(6):1315-1325.
[8]HAYES J M,STEINMULLER D R,STREEM S B,et al.The development of proteinuria and focal-segmental glomerulosclerosis in recipients of pediatric donor kidneys[J].Transplantation,1991,52(5):813-817.
[9]BAR-DAYAN A,BAR-NATHAN N,SHAHARABANI E,et al.Kidney transplantation from pediatric donors:size-match-based allocation[J].Pediatric Transplantation,2008,12(12):469-473.
[10]GIULIANI S,GAMBA P G,CHOKSHI N K,et al.The effect of donor/recipient body surface area ratio on outcomes in pediatric kidney transplantation[J].Pediatric Transplantation,2008,13(3):290-299.
[11]DICK A A S,MERCER L D,SMITH J M,et al.Donor and recipient size mismatch in adolescents undergoing living-donor renal transplantation affect long-term graft survival[J].Transplantation,2013,96(6):555-559.
[12]MOSTELLER R D.Simplified calculation of body-surface area[M].Radiation protection procedures:international Atomic Energy A-gency,1973:320-327.
[13]TEJAN A,CORTES L,STABLEIN D.Clinical correlates of chronic rejection in pediatric renal transplantation[J].Transplantation,1996,61(7):1054-1058.
[14]LEVEY A S,GREENE T,KUSEK J W,et al.A simplified equation to predict glomerular filtration rate from serum creatinine[J].Am Soc Nephrol,2000,11:A0828.
[15]吴轲,昌盛,陈忠华.儿童遗体供肾肾移植(综述)[C].全国器官捐献与移植学术研讨会,2009.
[16]WRIGHT F H,BANOWSKY L H,et al.Single pediatric kidneys for adult recipients:Optimal use of a cadaver donor resource[J].Transplantation Reviews,1999,13(3):148-156.
[17]DHARNIDHARKA V R,STEVENS G,HOWARD R J.En-bloc kidney transplantation in the United states:an analysis of unit-ed network of organ sharing (UNOS)data from 1987 to 2003[J].Am J Transplant 2005;5(6):1513-1517.
[18]TEJANI A,CORTES L,STABLEIN D.Clinical correlates of chronic rejection in pediatric renal transplantation[J].Transplantation,1996,61(7):1054-1058.
[19]SUCIU-FOCA N,REED E,D’AGATI V D,et al.Soluble HLA antigens,anti-HLA antibodies,and antiidiotypic antibodies in the circulation of renal transplant recipients[J].Transplantation,1991,51(3):593.
[20]KASISKE B L,SNYDER J J,GILBERTSON D.Inadequate donor size in cadaveric kidney transplantation[J].Journal of the American Society of Nephrology Jasn,2002,13(8):2152-2159.
Impact and application of donor/recipient body surface area on kidney transplantation from pediatric donors
Zhi-tan Peng,Ke Cheng,Yu-jun Zhao,Lian Liu,Qiang Wang,Qi-fa Ye
(The Third Xiangya Hospital of Central South University,Changsha,Hunan 410013,China)
ObjectiveTo evaluate the utility of donor/recipient body surface area (D/R BSA,BSA of donor/BSA of recipient)by studying the impact of D/R BSA on kidney transplantations from pediatric donors.MethodsWe retrospectively analyzed 26 cases of kidney transplantations from pediatric donors whose age ranged from 2 to 18 years old,which were performed in our center from 2010 to 2014.Patients were divided into two groups based on D/R BSA:group A<0.8,group B≥0.8.All recipients
a single kidney.Demographics of donors and recipients,early postoperative complications,estimated glomerular filtration rate(e-GFR)and short-term graft survival (≤1 year)were compared between each group to evaluate the impact ofD/R BSA on kidney transplantations from pediatric donors.ResultsAlldemographics and early postoperative complications of group A were similar to those of group B (P>0.05).E-GFR in group A and group B at one,three,six and twelve months post transplantation were:(63.2±5.0)vs(74.0±7.6),P=0.008;(66.2±4.9)vs(75.8±5.9),P=0.004;(69.0±4.8)vs(79.0±6.3),P=0.004;(69.4±7.9)vs(79.2±8.4),P=0.033.Short-term graft survival of group A was inferior to that of group B (62.5%vs 94.4%,P=0.042).Conclusions We conclude that recipients with high D/R BSA are more likely to have better graft function when the age of pediatric donor is more than 2 years old.It is possible to make optimal allocation of pediatric donor kidneys on the basis of D/R BSA(≥0.8).
donation after cardiac death;pediatric donor;kidney transplantation;body surface area
R617
A
10.3969/j.issn.1005-8982.2017.11.016
1005-8982(2017)11-0078-05
2016-05-23
叶启发,E-mail:yaf_china@163.com;Tel:13875987051

