芦笋片的质量标准研究
马 静,费小凡,李文尧,宋 毅
(四川大学华西医院临床药学部,四川 成都 610041)
芦笋片的质量标准研究
马 静*,费小凡,李文尧,宋 毅#
(四川大学华西医院临床药学部,四川 成都 610041)
目的:建立芦笋片的质量控制标准。方法:采用薄层色谱法定性鉴别芦笋片中的门冬氨酸。采用反相高效液相色谱法测定芦笋片中门冬氨酸的含量,柱前衍生试剂为2,4-二硝基氟苯,色谱柱为Chromsil ODS柱(250 mm×4.6 mm,5 μm),流速为1.0 ml/min,流动相A为50 mmol/l的醋酸钠溶液(pH=6.4),流动相B为体积分数50%的乙腈溶液,进行梯度洗脱,检测波长为360 nm,柱温为35 ℃。结果:门冬氨酸的线性范围为0.154~2.044 μg,r=0.999 9,平均加样回收率为98.98%,RSD为1.23%。结论:本方法稳定可靠、简便快捷、重复性好,能准确测定芦笋片中门冬氨酸的含量,为芦笋片的质量控制提供了依据。
2,4-二硝基氟苯; 柱前衍生; 门冬氨酸; 薄层色谱法; 反相高效液相色谱法; 芦笋片
芦笋片是由芦笋(AsparagusofficinalisL.)加辅料制成的薄膜衣片,具有益气生津、清热利湿、活血散结的功效,常用于高血压病、心脏病、肾炎水肿、乳腺结节等的治疗。近年来,美国学者发现芦笋还具有防止恶性肿瘤细胞扩散的功能,故临床上将芦笋片用于膀胱癌、肺癌、皮肤癌等恶性肿瘤的辅助治疗。组织蛋白和门冬酰胺是芦笋发挥药用效能的主要成分。相关研究多采用比色法测定芦笋中的总皂苷、总氨基酸的含量[1-3],采用紫外分光光度法[4]和荧光光度法[5]检测总黄酮成分,操作较繁琐,且结果存在误差。彭友舜[8]、安玉会[9]等采用氨基酸自动分析仪来测定氨基酸,其可全面分析各种氨基酸成分,但价格昂贵,普及率较低。此外,关于芦笋含量测定的指标性成分选择,苏亚军等[6]选择芦丁,邵旭等[7]选择门冬氨酸。而本研究以芦笋中门冬酰胺的水解产物门冬氨酸作为指标成分,采用薄层色谱法(thin-layer chromatography,TLC)及反相高效液相色谱法(reversed phase high performance liquid chromatography,RP-HPLC)对其进行定性、定量鉴别,为芦笋片的质量控制提供了依据。
1 材料
1.1 仪器
LC-10AT高效液相泵、SPD-M10Avp紫外检测器、CLASSVP工作站(日本岛津公司);Shim-pack C18色谱柱(250 mm×4.6 mm,5 μm)(日本岛津公司);Phenomenex C18色谱柱(250 mm×4.6 mm,5 μm)(广州菲罗门科学仪器公司);AS3120型超声波清洗器(AUTO SCIENCE公司);HWS24型电热恒温水浴锅(上海一恒科技仪器有限公司); XP205DR十万分之一电子天平(METTLER TOLEDO公司);调温电热套(ZDHW型,北京中兴伟业仪器有限公司);PBQⅠ型薄层自动铺板器(重庆南岸新力实验电器厂);732型阳离子交换树脂柱(廊坊圣泉化工有限公司);自制硅胶G薄层板(取薄层层析硅胶G适量,加入磷酸二氢钾适量,混合物按固定相1份 ∶0.4%羧甲基纤维素钠的水溶液3份混合,用自动薄层制板器制成10 cm×20 cm、厚度0.4 mm、采用0.2 mol/l磷酸二氢钾溶液制备的硅胶G薄层板,晾干后,于105 ℃下烘干1 h,置于干燥器内存放)。
1.2 药品与试剂
乙酸钠、醋酸、氢氧化钠、碳酸氢钠、磷酸二氢钾和2,4-二硝基氟苯(DNFB)、α-萘酚、磷酸二氢钾、茚三酮、正丙醇、硫酸、氨水等为分析纯;N,N-二甲基甲酰胺为优级纯;乙腈(色谱纯,SWELL公司出品);纯净水(娃哈哈集团有限公司);门冬氨酸对照品(中国药品生物制品检定所,批号:140691—200401);芦笋片为实验室自制(批号:160201、160202、160203、160301、160302、160303)。
2 方法与结果
2.1 薄层色谱鉴别
2.1.1 供试品溶液的制备:取样品适量,去薄膜衣研成细粉,混匀,精密称定约5 g,置于圆底瓶中,加水100 ml,加热回流提取1 h,滤过,滤液加在732型阳离子交换树脂柱(内径1 cm,长10 cm)上,用水洗至洗脱液无糖反应(取洗脱液1 ml,加α-萘酚试液3滴,沿管壁加硫酸5滴,两液界面处无红色环产生则为无糖反应),再用2 mol/l氨试液80 ml洗脱,收集洗脱液,蒸干,残渣加正丙醇2 ml使溶解,即得。
2.1.2 对照品溶液的制备:取门冬氨酸对照品适量,加正丙醇制成每1 ml含1 mg的溶液,即得。
2.1.3 阴性对照溶液的制备:取处方中除芦笋主药外的空白辅料,通过相应的制备工艺制成缺芦笋的样品,再按照“2.1.1”项下方法制备,即得。
2.1.4 薄层色谱法:根据《中华人民共和国药典:一部》(2015年版)“通则0502”,吸取对照品溶液5 μl、供试品溶液10 μl,分别点于同一用0.2 mol/l磷酸二氢钾溶液制备的硅胶G薄层板上,以正丁醇-冰醋酸-水(V∶V∶V=8 ∶3 ∶1)为展开剂,展开,取出并晾干,喷茚三酮试液,于105 ℃加热至斑点显色清晰。结果表明,供试品溶液在与对照品溶液相同位置上显相同颜色的斑点,Rf在0.3~0.7之间,斑点的分离度良好。
2.2 薄层鉴别的方法学考察
2.2.1 展开剂的选择:吸取上述对照品溶液5 μl、供试品溶液10 μl,点于同一硅胶G薄层板上,分别以丁酮-吡啶-冰醋酸-水(V∶V∶V∶V=70 ∶15 ∶2 ∶15)[10]、正丁醇-冰醋酸-水(V∶V∶V=4 ∶1 ∶1)[11]、十二烷基硫酸钠-正丁醇-正己烷-水(V∶V∶V∶V=3 ∶14 ∶2 ∶2.2)[12]、正丁醇-冰醋酸-水(V∶V∶V=8 ∶3 ∶1)为展开剂展开,将上述薄层板取出,晾干,喷以茚三酮试液,在105 ℃加热至斑点显色清晰。结果表明,展开剂为前三种时,斑点拖尾严重,分离度差,而展开剂为第四种时,斑点分离度好,Rf适中。故以正丁醇-冰醋酸-水(V∶V∶V=8 ∶3 ∶1)为本研究的展开剂。
2.2.2 点样量的选择:吸取上述对照品溶液、供试品溶液,各2、5、10、20 μl,点于同一用0.2 mol/l磷酸二氢钾溶液制备的硅胶G薄层板上,以“2.1.4”项下的方法展开。根据斑点的清晰度和分离度,表明本研究最佳点样量为供试品溶液10 μl、对照品溶液5 μl。
2.2.3 不同检视条件的考察:取上述对照品溶液5 μl、供试品溶液10 μl,按照“2.1.4”项下方法展开,取出,晾干,分别在不同波长的紫外灯下(254 nm、302 nm、365 nm)检视,或喷茚三酮试液加热至斑点显色后于日光下检视。结果显示,最佳检视条件为喷以茚三酮试液,于105 ℃加热至斑点显色清晰。
2.2.4 专属性考察:吸取对照品溶液5 μl、供试品溶液10 μl、阴性对照溶液10 μl,按照“2.1.4”项下方法检视,见图1。结果显示,阴性对照溶液在与对照品溶液相同位置上无斑点,辅料对主药成分无干扰,本方法的专属性好。
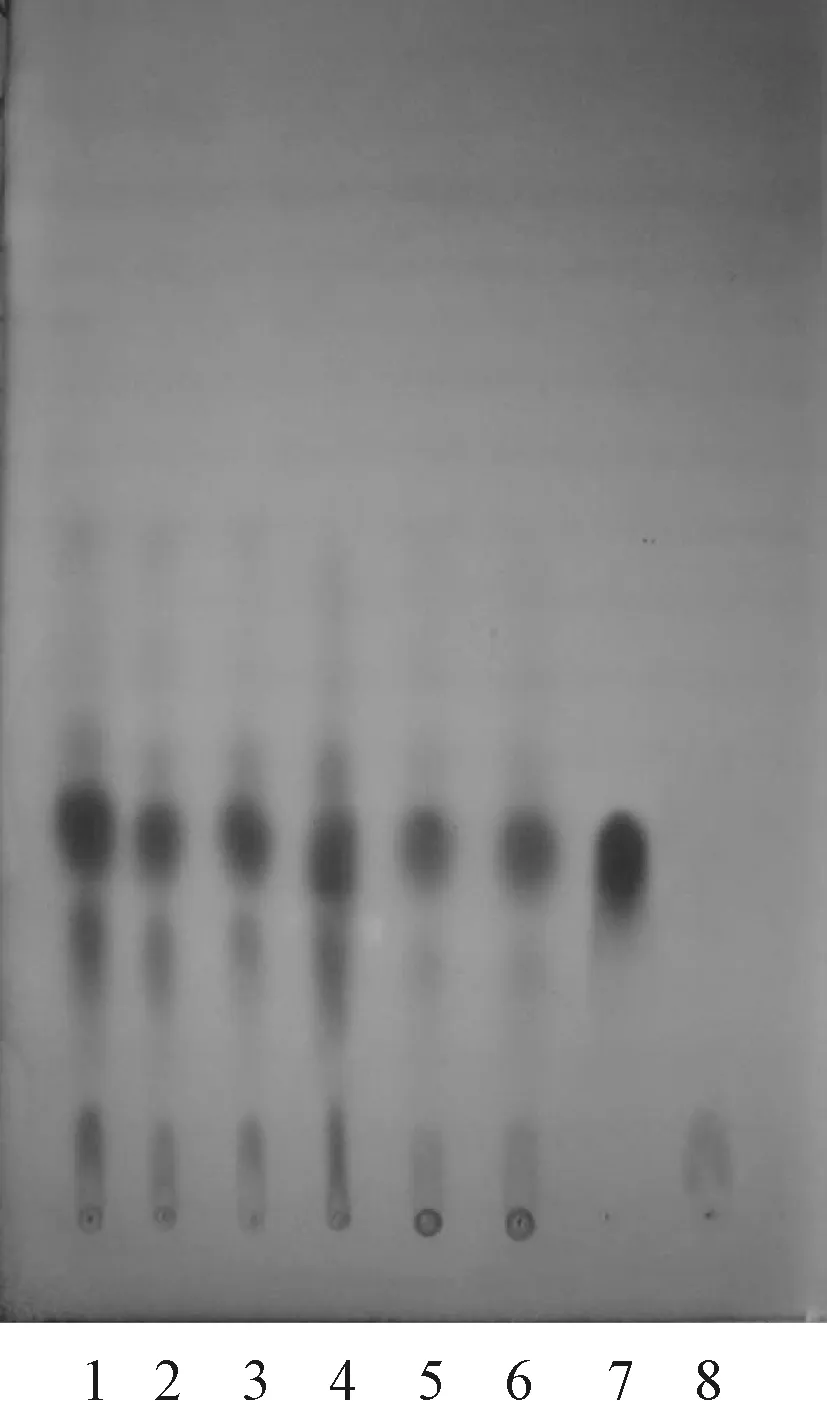
1—6.供试品溶液;7.对照品溶液;8.阴性对照溶液1—6.test solution; 7.control solution; 8.negative control solution图1 薄层色谱图Fig 1 TLC chromatogram
2.2.5 温度、湿度的考察:配置不同浓度的硫酸水溶液置于展开缸的一侧,密闭15 min后,控制其相对湿度;并将装有薄层板的层析缸分别放置在4~10 ℃冰箱中、20 ℃室温空调房中、35 ℃恒温干燥箱中进行不同温度的考察。 取上述2种溶液,按照“2.1.1”项下进行点样,分别在下列条件展开:(1)温度10 ℃、湿度45%;(2)温度10 ℃、湿度65%;(3)温度20 ℃、湿度45%;(4)温度20 ℃、湿度65%;(5)温度20 ℃、湿度85%;(6)温度35 ℃、湿度65%;(7)温度35 ℃、湿度85%,用茚三酮试液,在105 ℃加热至斑点显色清晰后检视。结果表明,在上述不同温度、湿度条件下,供试品色谱在与对照品色谱的相应位置上均有相同颜色的斑点,且分离度良好,Rf值有稍许变化,说明温度在10~35 ℃范围内,湿度在45%~85%范围内,对本品的薄层鉴别影响小,重复性和稳定性好。
2.2.6 薄层板的考察:吸取上述对照品溶液5 μl、供试品溶液10 μl,在不同的薄层板下,按照“2.1.4”项下方法展开。薄层板(1)为青岛海浪硅胶干燥剂有限公司生产的硅胶G薄层板;薄层板(2)为采用0.2 mol/l磷酸二氢钾溶液自制的硅胶G薄层板。结果表明,采用薄层板(1)时,斑点分离度差,拖尾严重;薄层板(2)的特征主斑点分离度达到要求,斑点清晰。
2.3 崩解时限考察
分别取上述6个批号的样品各6片,参照《中华人民共和国药典:一部》(2015年版)通则0921崩解时限[13]中的方法,在盐酸溶液(9→1 000)中进行崩解时限考察。结果表明,6批样品均在1 h内全部崩解,符合相关规定。
2.4 含量测定
2.4.1 衍生缓冲溶液的制备:称取碳酸氢钠4.2 g,置于100 ml容量瓶中,加水溶解并定容至刻度,摇匀,即得。
2.4.2 平衡缓冲溶液的制备:称取磷酸二氢钾0.68 g,置于100 ml容量瓶中,加20 ml水溶解,再加入0.1 mol/l氢氧化钠溶液29.1 ml,用水定容至刻度,摇匀,即得。
2.4.3 衍生化溶液的制备:精密量取2,4-二硝基氟苯0.1 ml,置于10 ml容量瓶中,加乙腈溶解并定容至刻度,摇匀,即得。
2.4.4 对照品溶液的制备:精密称取门冬氨酸对照品10.22 mg,置于10 ml容量瓶中,加水溶解并摇匀,制成浓度为1.022 mg/ml的对照品储备液;精密量取对照品储备液3 ml,置于10 ml容量瓶,加水稀释成浓度为0.307 mg/ml的未衍生化对照品溶液。精密量取未衍生化对照品溶液1 ml,置于10 ml棕色容量瓶中,按照先后顺序加入衍生缓冲溶液1 ml、衍生化溶液1 ml,摇匀后密闭,在60 ℃水浴中避光反应60 min,取出,冷至室温(25 ℃),用平衡缓冲液定容至刻度,放置15 min,用微孔滤膜(0.45 μm)滤过,即得。
2.4.5 供试品溶液的制备:取样品适量,去薄膜衣研成细粉混匀,精密称定约3 g,置于100 ml锥形瓶中。加50 ml水超声处理30 min,重复操作2次,离心,取上清液,合并后蒸干,残渣置于10 ml容量瓶中,加水定容至刻线,摇匀,即得未衍生化供试品溶液。精密量取未衍生化供试品溶液1 ml,置于10 ml棕色容量瓶中,按照先后顺序加入衍生缓冲溶液1 ml、衍生化溶液1 ml,摇匀后密闭,在60 ℃水浴中避光反应60 min,取出,冷至室温,用平衡缓冲液定容至刻度,放置15 min,用微孔滤膜(0.45 μm)滤过,即得。
2.4.6 色谱条件与系统适用性试验:以十八烷基硅烷键合硅胶为填充剂;检测波长为360 nm,柱温为30 ℃,流速为1.0 ml/min;流动相A:取乙酸钠4.1 g,加水约900 ml,用醋酸调节pH至6.4,加N,N-二甲基甲酰胺溶液10 ml,置于1 000 ml容量瓶中,用水定容至刻线,即得;流动相B:乙腈-水(V∶V=1 ∶1),进行梯度洗脱,过程见表1。结果显示,门冬氨酸主峰与其他杂质峰无干扰,各组分均能达到基线分离,理论板数≥3 000;分离度≥1.5,符合规定,见图2。

表1 梯度洗脱程序Tab 1 Gradient elution procedure
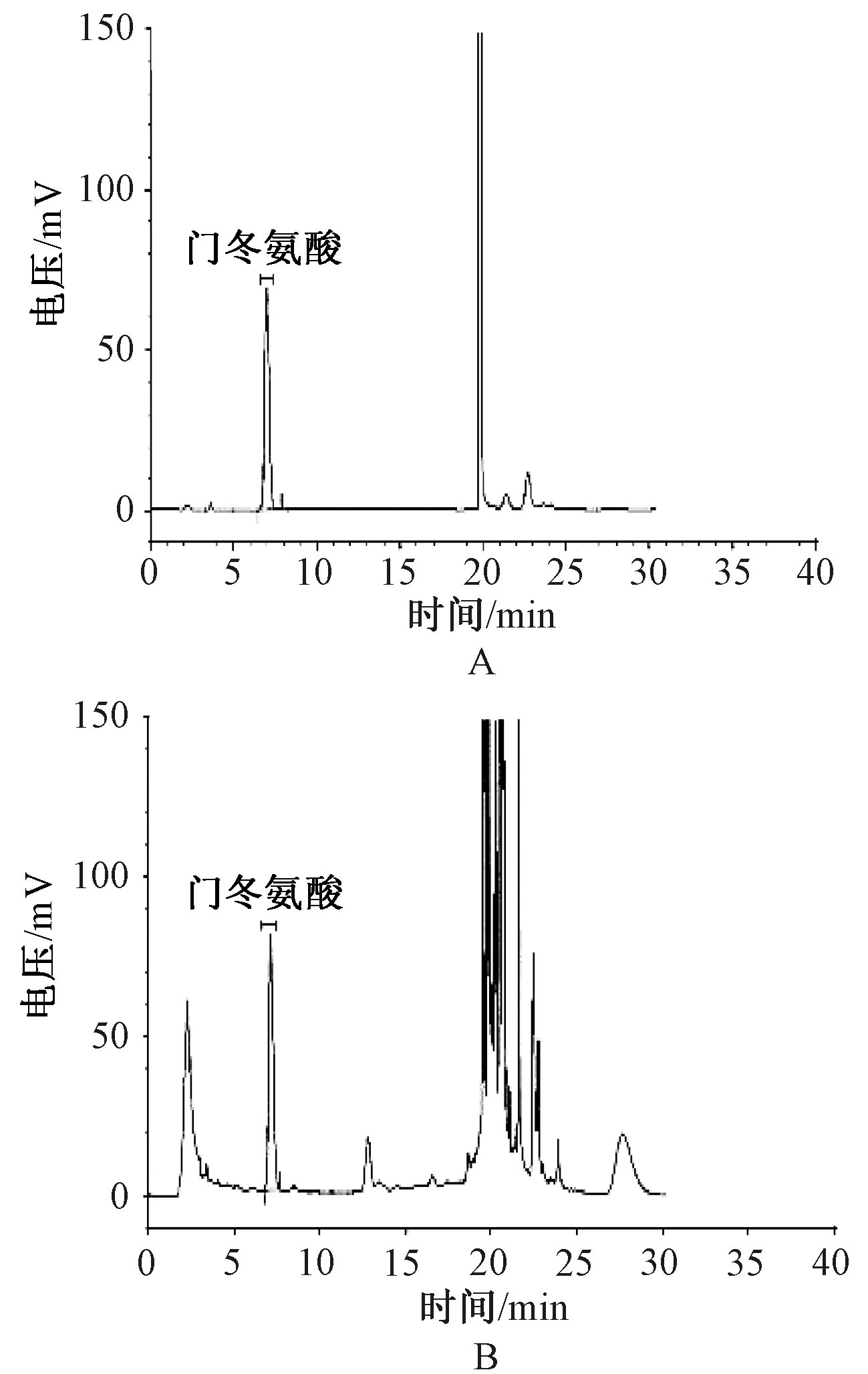
A.对照品溶液;B.供试品溶液A. control solution;B. test solution图2 高效液相色谱图Fig 2 HPLC chromatograms
2.4.7 线性关系考察:精密吸取“2.4.4”项下对照品溶液10 μl,注入高效液相色谱仪,以绝对进样量为横坐标(X),峰面积为纵坐标(Y),进行线性回归,得回归方程:Y=5×106X-73 269,r=0.999 9(n=6)。结果显示,门冬氨酸进样量在0.154~2.044 μg之间呈良好的线性关系。
2.4.8 精密度考察:精密吸取“2.4.4”项下对照品溶液,重复进样6次(进样量10 μl),记录峰面积。结果显示,门冬氨酸峰面积的RSD=0.3%,仪器精密度良好。
2.4.9 稳定性考察:精密吸取“2.4.4”项下对照品溶液、“2.4.5”项下供试品溶液各10 μl,分别于室温下放置0、2、4、6、8、10 h时进样测定,记录峰面积。结果显示,对照品溶液和供试品溶液的RSD分别为0.56%和0.43%,表明对照品溶液、供试品溶液均在10 h内稳定。
2.4.10 重复性试验:取样品6份(批号:160301),按“2.4.5”项下方法制备供试品溶液。精密吸取供试品溶液及“2.4.4”项下对照品溶液各10 μl,注入高效液相色谱仪,记录峰面积。结果显示,门冬氨酸的RSD=1.81%,表明本方法重复性良好。
2.4.11 加样回收率试验:精密称取已知含量的样品(批号:160301)6份,各1.0 g,置于6个100 ml锥形瓶中,分为三组。每组分别精密加入浓度为1.31、1.58、1.89 mg/ml的对照品溶液1.0 ml,按照“2.4.6”项下色谱条件进样测定计算加样回收率,结果见表2。
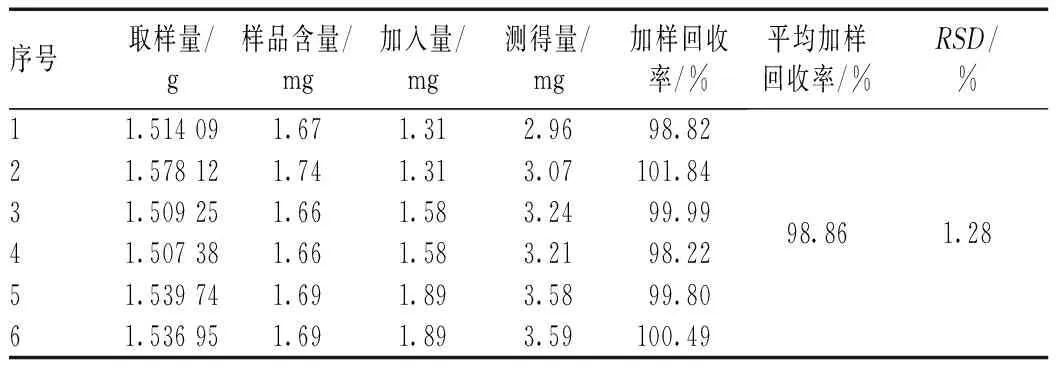
表2 加样回收率试验结果(n=6)Tab 2 Recovery test of Lusun tablets(n=6)
2.4.12 样品含量测定:取6批自制样品,按“2.4.5”项下方法制备供试品溶液,再按“2.4.6”项下色谱条件进样测定并计算样品中门冬氨酸的含量,结果见表3。
3 讨论
氨基酸类成分大部分不含芳香环等紫外吸收基团,故无法检测到紫外和荧光吸收。在一定条件下,加入衍生试剂,氨基酸反应生成有紫外吸收的氨基酸衍生物,使其在360 nm的波长处有紫外吸收。常用的衍生化试剂有异硫氰酸苯酯(PITC)、邻苯二甲醛(OPA)、DNFB和芴甲氧羰酰氯(Fmoc-Cl)等。其中OPA与氨基酸在室温条件下迅速反应,能生成强荧光衍生产物,由于OPA本身无荧光性,不会产生干扰而影响色谱的分离。但OPA只与一级氨基酸反应,且其衍生化产物极不稳定,须在数分钟内完成进样,不便于常规检测。PITC和Fmoc-Cl的适用性较为广泛,能与一级、二级氨基酸发生作用,不会产生多级和不稳定的衍生产物,但PITC衍生过程操作复杂,同时会导致色谱柱耐用性降低;而FMOC-Cl的衍生产物常用于荧光检测分析[14]。而DNFB与氨基酸的衍生化反应简便、适用性广,能与一级、二级氨基酸反应,且反应灵敏度高,在紫外区与可见光区都能进行操作,并能生成稳定单一的衍生产物,现在广泛应用于多种氨基酸的测定。本研究采用DNFB试剂,可避免试剂对测定方法的干扰,衍生法步骤简单,衍生产物稳定、分析更精确。但衍生物对光敏感,故衍生化的操作过程需要避光,应采用棕色容量瓶进行衍生反应及保存溶液。
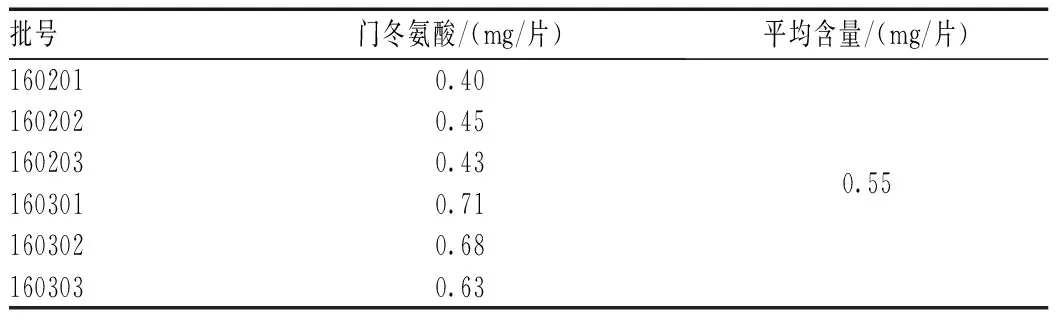
表3 含量测定结果Tab 3 Content determination of aspartic acid
本研究考察了不同的提取条件对芦笋片含量的影响。考察条件包括:提取溶剂为20%乙醇、40%甲醇和水;提取时间45 min、提取1次,60 min、提取1次和30 min、提取2次;提取方法为回流、超声和浸泡。结果表明,提取溶剂为水,超声30 min、提取2次时,门冬氨酸的含量最高。另外,考察了柱温为25、30、35 ℃时对研究的影响。结果表明,柱温30 ℃时的分离度较好,出峰时间适中。
[1]赵建华,宋擎,汪素芳,等.芦笋总皂苷含量测定的比色法研究[J].时珍国医国药,2009,20(8):1962-1964.
[2]王隶书,程东岩,范艳君,等.石刁柏药材及不同提取物中总皂苷含量的测定[J].时珍国医国药,2011,22(3):580-581.
[3]郭玲.石刁柏中总氨基酸的含量测定[J]江西农业学报,2010,22(3):135-136.
[4]付婕,范双喜,谷建田,等.石刁柏中总黄酮含量的测定分析[J].安徽农业科学,2006,34(10):2108-2110.
[5]穆宏磊,郜海燕,陈杭君,等.荧光光度法测定芦笋中总黄酮含量[J].中国食品学报,2010,10(2):201-205.
[6]苏亚军.HPLC测定乳宁片中芦丁的含量[J].海峡药学,2013,25(4):55-57.
[7]邵旭,牛海军,李晓亮,等.柱前衍生RP-HPLC法测定芦笋中门冬氨酸的含量[J].中国实验方剂学杂志,2009,15(1):8-10.
[8]彭友舜,王树元,贾丹丹,等.芦笋茎不同部位氨基酸含量的分析测定[J].安徽农业科学,2011,39(1):129-130.
[9]安玉会,吴铁汉,郑香梅,等.芦笋口服液中氨基酸含量分析[J].河南医科大学学报,1998,33(4):12-13.
[10]唐爱莲,罗朝晖,唐桂兴,等.糯稻根颗粒剂制备及其游离氨基酸的鉴别与含量测定[J].中南药学,2008,6(4):398-400.
[11]黄红兵,朱品业,何丽清,等.青天葵的薄层色谱鉴别与总氨基酸含量测定[J].中国野生植物资源,1999,18(4):40-42.
[12]谭建宁,马雯芳,李耀华.龙脷叶中氨基酸的成分分析[J].广西中医药,2016,39(3):76-78.
[13]国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:6.
[14]赵英莲,牟德华,李艳.2,4-二硝基氟苯柱前衍生HPLC检测树莓中游离氨基酸[J].食品科学,2015,36(6):178-182.
Research on Quality Standard of Lusun Tablets
MA Jing,FEI Xiaofan,LI Wenyao,SONG Yi
(Dept.of Clinical Pharmacy,West China Hospital of Sichuan University,Sichuan Chengdu 610041,China)
OBJECTIVE:To establish a method for quality control of Lusun tablets. METHODS:TLC was used to make a thin-layer qualitative identification for aspartic acid in Lusun tablets. RP-HPLC was adopted to determine the content of aspartic acid in Lusun tablets. The sample was derived with 2,4-dinitrofluorobenzene(DNFB). Aspartic acid was separated on Chromsil ODS (250 mm×4.6 mm,5 μm) column at the flow rate of 1.0 ml/min. The mobile phase used was a mixture of A containing 50 mmol/L sodium acetate buffer(pH=6.4) and phase B containing 50% acetonitrile-water through the gradient elution. The detection wavelength was set at 360 nm and the column temperature was 35 ℃. RESULTS: Aspartic acid had good linearity in the ranges of 0.154 μg-2.044 μg,r=0.999 9. The average recovery was 98.98%,RSDwas 1.23%. CONCLUSIONS: The method is accurate,sensitive,reproducible and credible to determine the content of aspartic acid in Lusun tablets,and provides the oretical basis for the quality control of Lusun tablets.
DNFB; Pre-column derivatization; Aspartic acid; TLC;RP-HPLC; Lusun tablets
R927.11
A
1672-2124(2017)08-1085-04
DOI 10.14009/j.issn.1672-2124.2017.08.030
2017-01-25)
*中药师,执业中药师。研究方向:中药材、中药成方制剂的质量控制和研发工作。E-mail:mandy23@163.com
#通信作者:主任药师。研究方向:中、西药新制剂的研发工作。E-mail: yisong.scu@foxmail.com

