MiRNA-520e对HeLa细胞FOXL2基因的靶向调控作用及细胞迁移增殖的影响
刘悦,王晓雨,曲春安,胡飞,胡亚暖,唐胜建
(潍坊医学院,山东潍坊261041)
MiRNA-520e对HeLa细胞FOXL2基因的靶向调控作用及细胞迁移增殖的影响
刘悦,王晓雨,曲春安,胡飞,胡亚暖,唐胜建
(潍坊医学院,山东潍坊261041)
目的 探讨miRNA-520e对人宫颈癌HeLa细胞FOXL2基因的调控作用及对细胞迁移、增殖的影响。方法 应用生物信息学分析软件(Target Scan Human 7.1)预测miRNA-520e可能结合于FOXL2 mRNA 3′UTR端,以HeLa细胞作为试验研究对象,将细胞随机分为阴性对照组(加入无关序列NC Fam mimics)、正常对照组(不加任何干预)、miRNA-520e组(加入miRNA-520e mimics)。运用脂质体法通过Lipofectamine 3000 Reagent将各miRNA mimics转染各组HeLa细胞,48 h后通过实时荧光定量PCR及Western blotting法检测FOXL2 mRNA及蛋白表达;转染24 h后采用细胞划痕试验检测细胞迁移能力,使用ACEA xCELLigence RTCA DP细胞分析仪检测细胞增殖能力。结果 miRNA-520e组HeLa细胞FOXL2 mRNA和蛋白的表达量较正常对照组及阴性对照组降低,且miRNA-520e组细胞的迁移和增殖能力较正常对照组及阴性对照组增强(P均<0.05)。结论 miRNA-520e可抑制HeLa细胞FOXL2 mRNA和蛋白的表达,促进细胞迁移和增殖。
宫颈癌;HeLa细胞;微小RNA-520e;FOXL2基因;细胞迁移;细胞增殖
FOXL2 基因是一种2.7 kb 大小的单外显子翼状螺旋/叉头转录因子[1],定位于3q23区域[2]。FOXL2因其编码蛋白包含有一个特殊的forkhaed DNA结合区而命名,主要特异性表达于发育的眼睑,显著表达于胎儿的颗粒细胞及成人的卵巢[3,4],在卵巢颗粒细胞分化和卵巢发育、功能维持方面起至关重要作用[5,6]。研究证明,FOXL2发生胚系突变是导致睑裂狭小、倒转型内毗赘皮和上睑下垂综合征(BPES)的主要致病基因[7]。另一方面,FOXL2体细胞突变(402C→G)是成人卵巢颗粒细胞瘤发生发展的关键性因素[8,9]。检测突变的FOXL2可用于及时确诊及长期随访成人卵巢颗粒细胞瘤患者。微小RNA(MiRNA)是一类高度保守的内源性、非编码小RNA,长度在22个核苷酸左右[10],特异性调节转录后基因表达,在细胞增殖、分化及凋亡等多种生物学活动中发挥重要调控作用。miRNA异常表达可导致多种疾病[11,12],广泛参与肿瘤的发生发展及侵袭转移等过程。2016年6月~2017年3月,本研究就miRNA-520e对人宫颈癌HeLa细胞FOXL2基因的靶向调控作用及对细胞迁移增殖的影响进行了探讨。现报告如下。
1 材料与方法
1.1 材料 HeLa细胞株由潍坊医学院整形外科研究所保存,L-DMEM培养液、新生胎牛血清、Lipofectamine 3000 Reagent及Opti-MEM Reduced Serum Medium均购自美国GIBCO(Invrotrigen)公司,0.05% Trypsin-EDTA购于华美生物工程公司,RIPA裂解液购于普利莱基因技术有限公司,BCA蛋白定量试剂盒购于Thermo公司。RT-PCR相关试剂购自日本Takara公司,miRNA-520e mimics购自英潍捷基(上海)贸易有限公司,Western blotting 试验所用抗体、内参均购自北京博奥森生物技术有限公司,E-Plate 16检测板购自艾森生物(杭州)有限公司。
1.2 靶基因预测 应用Target Scan Human 7.1生物信息学软件在线预测以FOXL2为靶基因的miRNA,对比预测结果,最终选取miRNA-520e为本试验目标miRNA。
1.3 细胞培养、分组及转染 HeLa细胞接种于10%胎牛血清L-DMEM培养基,置于37 ℃、饱和湿度、5% CO2恒温培养箱中培养,每48小时(细胞生长约达到90%融合)应用0.05%Trypsin-EDTA消化传代1次。本试验选取传代次数<15次且处于指数生长期的HeLa细胞进行后续试验。将细胞随机分为阴性对照组、正常对照组、miRNA-520e组,阴性对照组加入无关序列NC Fam mimics,正常对照组不加任何干预,miRNA-520e组加入miRNA-520e mimics。在进行转染试验前,预先将miRNA-520e mimics及NC FAM mimics冻干粉离心,以无RNase水溶解(配比遵产品说明书)。转染前24 h将处于指数生长期的HeLa细胞接种于6孔板中,接种细胞浓度为3×105/mL。运用脂质体转染剂Lipofectamine 3000 Reagent按照说明书操作转染各组HeLa细胞,整个试验操作需快速、轻柔完成,以防miRNA受损影响后续试验。将转染后各组细胞放入37 ℃、5% CO2恒温培养箱中培养,每隔12小时取出6孔板于荧光倒置显微镜下观察转染效率。
1.4 HeLa细胞FOXL2 mRNA的检测 采用荧光定量RT-PCR法。根据FOXL2基因信息,使用Primer 5.0设计引物:FOXL2 上游序列:5′-AAG AAGCTCACGCTGTCCG-3′;FOXL2下游序列:5′-CTCGTTGAGGCTGAGGTTGTG-3′;内参基因为β- actin,反应体系为25 μL。收集成功转染48 h后各组细胞,TRIzol法分别提取各组HeLa细胞的总RNA,应用琼脂糖凝胶电泳及分光光度计检测RNA完整度。使用PrimeScript RT reagent Kit With gDNA Eraser严格按照说明书操作进行逆转录反应。在德国Eppendorf实时荧光定量PCR仪上应用SYBR Green Mix 进行扩增与荧光检测。2-ΔΔCt法计算各组FOXL2 mRNA相对表达量。
1.5 HeLa细胞FOXL2 蛋白的检测 采用Western blotting法。成功转染48 h后收集各组细胞,应用蛋白裂解液RIPA提取各组HeLa细胞总蛋白,取各组样本利用BCA蛋白定量试剂盒测得蛋白浓度,其余蛋白及时煮沸变性并调整至统一浓度,之后进行10% SDS-聚丙烯酰胺凝胶电泳分离蛋白(10%分离胶每孔上样量为30 μg),电泳结束后将分离出的蛋白转移至硝酸纤维素膜,利用含5%脱脂牛奶封闭液封闭PVDF膜4 h,加入Rabbit Anti-FOXL2 置于4 ℃孵育过夜(一抗稀释比例1∶1 000),TBST漂洗PVDF膜3次,每次15 min,再以含 HRP标记的二抗封闭液(稀释比例1∶5 000)室温轻摇孵育1 h,TBST漂洗二抗3次,每次15 min。最后利用ECL化学发光试剂盒于暗室中进行化学发光及显影、定影,胶片清水冲洗晾干,获得试验结果。运用Image-Pro Plus 6.0软件对实验结果进行灰度分析,目的蛋白灰度=目的蛋白累积光密度(IOD)值/内参IOD值。本实验以GAPDH为内参。
1.6 细胞迁移能力检测 采用细胞划痕试验。试验前需预先用标记笔在6孔板每个孔的背后横穿孔心均匀、笔直地画横线。按上述步骤接种、转染HeLa细胞,待转染24 h后(HeLa细胞融合度达70%~80%),利用无菌200 μL枪头垂直于预先画好的横线划划痕以制作HeLa细胞伤口模型。PBS小心漂洗细胞3次后将6孔板重新放入细胞培养箱中培养,分别于0、6、12、24 h于倒置显微镜下观察HeLa细胞迁移情况,并拍照保存试验结果,运用Image-Pro Plus 6.0软件测绘细胞迁移平均距离,迁移平均距离=24 h平均宽度-0 h平均宽度。
1.7 细胞增殖能力检测 采用ACEA xCELLigence RTCA DP细胞分析仪检测转染后各组HeLa细胞增殖能力。转染24 h后,收集各组HeLa细胞,分别接种于E-Plate 16检测板中,细胞接种浓度为3×105/mL,将E-Plate 16检测板放入细胞分析仪中,启动检测程序,设置每12小时检测一次细胞指数(CI),CI反映细胞增殖率,共检测72 h。

2 结果
2.1 三组FOXL2 mRNA及蛋白表达比较 正常对照组、阴性对照组、miRNA-520e组FOXL2 mRNA相对表达量分别为1.000 0±0.030 0、0.910 1±0.042 0、0.198 6±0.023 2,FOXL2 蛋白相对表达量分别为0.969 7±0.054 1、0.924 7±0.024 0、0.248 3±0.027 5。与正常对照组、阴性对照组比较,miRNA-520e组FOXL2 mRNA及蛋白表达降低(P均<0.05)。
2.2 三组细胞迁移能力比较 正常对照组、阴性对照组、miRNA-520e组24 h细胞迁移距离分别为(12.255 7±1.487 9)、(13.349 6±1.163 9)、(31.795 2±3.409 5)pixel。miRNA-520e组24 h细胞迁移距离均长于正常对照组及阴性对照组(P均<0.05)。
2.3 三组不同时间细胞增殖能力比较 见表1。miRNA-520e组细胞增殖能力高于正常对照组及阴性对照组(P均<0.05)。
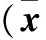
表1 各组不同时间细胞CI值比较±s)
注:与阴性对照组、正常对照组比较,*P<0.05。
3 讨论
20世纪90年代末,Ambros等最先在研究秀丽隐杆线虫时发现了miRNA的存在。如今在miRBase注册的miRNA近30 000个。miRNA是一类长度在20~23个核苷酸之间,由约70个核苷酸的前体miRNA经Dicer酶识别、剪切得来的高保守非编码单链RNA。miRNA广泛存在于真核生物基因中,通过特异性地与靶mRNA 3′UTR结合而发挥翻译抑制或对下游靶基因负性调控作用,影响细胞增殖、分化及凋亡过程。
研究表明,在肿瘤性疾病的发生发展过程中异常的细胞增殖及凋亡往往伴随miRNA表达异常,由此推测miRNA的过表达可能参与肿瘤的形成,作用机理可能是miRNA调控各类癌基因或抑癌基因的异常表达。据相关研究报道,miRNA-520e在肝癌、乳腺癌等疾病的发生发展中起重要调控作用[13,14]。在过往的研究中,miRNA-520e可促进乳腺癌细胞的增殖和迁移能力并抑制凋亡,在肝癌细胞系中低表达,可通过其靶基因NIK抑制肝癌的增殖。但亦有研究发现,miRNA-520e在乳腺癌组织中较癌旁组织中升高,可促进乳腺癌细胞的增殖和迁移能力并抑制凋亡。另有学者通过Microarray芯片技术方法得出miRNA-520e在卵巢功能减退患者卵巢颗粒细胞及血清中较正常人表达下调。
FOXL2参与颅面和女性生殖系统的发生发展,在性别分化、卵巢颗粒细胞分化和卵巢发育、功能维持方面起着不可替代的作用。宫颈癌作为妇科三大常见肿瘤,其病死率位居女性生殖道恶性肿瘤之首。有学者发现,FOXL2在宫颈上皮内瘤变、宫颈炎及宫颈腺癌中不表达,在宫颈鳞癌组织中高表达。并进一步通过相关功能试验得出FOXL2可抑制宫颈癌细胞的增殖、侵袭并促进宫颈癌细胞凋亡的结论。说明FOXL2在宫颈癌的发生发展中可能起抑癌基因的作用[15]。以往对FOXL2基因的研究大多集中在FOXL2的功能研究,针对FOXL2基因的调控则鲜有报道。因已有学者通过试验说明宫颈腺癌HeLa细胞可转录FOXL2的mRNA,本试验直接选取HeLa细胞用于后续试验。为了进一步研究抑癌基因FOXL2的上游调控机制及其在宫颈癌发生发展中的作用,我们通过生物信息学软件分析了FOXL2基因mRNA的3′UTR端,发现了潜在的miRNA-520e的结合位点。本研究结果显示,过表达miRNA-520e可靶向抑制FOXL2基因表达,使FOXL2 mRNA和蛋白表达量下降;细胞迁移试验及细胞增殖试验结果显示,过表达miRNA-520e可通过靶向抑制FOXL2促进HeLa细胞的迁移与增殖。
综上所述,本试验结果表明,在HeLa细胞中过表达miRNA-520e能抑制FOXL2 mRNA及蛋白的表达,且促进HeLa细胞的迁移与增殖。miRNA-520e靶向调控宫颈癌HeLa细胞FOXL2基因为宫颈癌的基因治疗和干预指出了新的研究方向,并提供了理论基础。需要指出的是,miRNA-520e靶向FOXL2促进HeLa细胞增殖与迁移的具体作用机制仍需更深入的探索,miRNA-520e是否对于FOXL2基因缺陷病——BPES具有调控作用尚需后续试验来验证。
[1] Fan JY, Han B, Qiao J, et al. Functional study on a novel missense mutation of the transcription factor FOXL2 causes blepharophimosis-ptosis-epicanthus inversus syndrome (BPES)[J]. Mutagenesis, 2010,26(2):283-289.
[2] Verdin H, De Baere E. FOXL2 impairment in human disease[J]. Horm Res Paediat, 2012,77(1):2-11.
[3] Crisponi L, Deiana M, Loi A, et al. The putative forkhead transcription factor FOXL2 is mutated in blepharophimosis/ptosis/epicanthus inversus syndrome[J]. Nature Genetics, 2001,27(2):159-166.
[4] Schmidt D, Ovitt CE, Anlag K, et al. The murine winged-helix transcription factor Foxl2 is required for granulosa cell differentiation and ovary maintenance[J]. Development, 2004,131(4):933-942.
[5] Ottolenghi C, Omari S, Garcia-Ortiz JE, et al. Foxl2 is required for commitment to ovary differentiation[J]. Hum Mol Genet, 2005,14(14):2053-2062.
[6] Duffin K, Bayne RAL, Childs AJ, et al. The forkhead transcription factor FOXL2 is expressed in somatic cells of the human ovary prior to follicle formation[J]. Mol Hum Reprod, 2009,15(12):771-777.
[7] Hes O, Vanecek T, Petersson F, et al. Mutational analysis (c. 402C> G) of the FOXL2 gene and immunohistochemical expression of the FOXL2 protein in testicular adult type granulosa cell tumors and incompletely differentiated sex cord stromal tumors[J]. Appl Immunohisto MM, 2011,19(4):347-351.
[8] D′angelo E, Mozos A, Nakayama D, et al. Prognostic significance of FOXL2 mutation and mRNA expression in adult and juvenile granulosa cell tumors of the ovary[J]. Modern Pathol, 2011,24(10):1360-1367.
[9] Geiersbach KB, Jarboe EA, Jahromi MS, et al. FOXL2 mutation and large-scale genomic imbalances in adult granulosa cell tumors of the ovary[J]. Cancer Genet, 2011,204(11):596-602.
[10] Crisponi L, Uda M, Deiana M, et al. FOXL2 inactivation by a translocation 171 kb away: analysis of 500 kb of chromosome 3 for candidate long-range regulatory sequences[J]. Genomics, 2004,83(5):757-764.
[11] Maiti M, Nauwelaerts K, Herdewijn P. Pre-microRNA binding aminoglycosides and antitumor drugs as inhibitors of Dicer catalyzed microRNA processing[J]. Bioorg Med Chem Lett, 2012,22(4):1709-1711.
[12] Yao Q, Zhang A, Ma H, et al. Novel molecular beacons to monitor microRNAs in non-small-cell lung cancer[J]. Mol Cell Probe, 2012,26(5):182-187.
[13] Cui W, Zhang Y, Hu N, et al. miRNA-520b and miR-520e sensitize breast cancer cells to complement attack via directly targeting 3′ UTR of CD46[J]. Cancer Biol Ther, 2010,10(3):232-241.
[14] Zhang S, Shan C, Kong G, et al. MicroRNA-520e suppresses growth of hepatoma cells by targeting the NF-κB-inducing kinase (NIK)[J]. Oncogene, 2012,31(31):3607-3620.
[15] Liu XL, Meng YH, Wang JL, et al. FOXL2 suppresses proliferation, invasion and promotes apoptosis of cervical cancer cells[J]. Int J Clin Exp Patho, 2014,7(4):1534-1543.
MicroRNA-520e promotes migration and proliferation of HeLa cells by targeting FOXL2 gene
LIUYue,WANGXiaoyu,QUChun'an,HUYanuan,TANGShengjian
(WeifangMedicalCollege,Weifang261041,China)
Objective To investigate the regulative effects of microRNA-520e on FOXL2 gene of HeLa cells and its influence on the migration and proliferation of HeLa cells. Methods Using bioinformatics (Target Scan Human 7.1) to predict that miRNA-520e may bind to FOXL2 mRNA 3'UTR. HeLa cells were randomly divided into the negative control group (added with NC Fam mimics), control group (no treatment), and miRNA-520e group(added with miRNA-520e mimics). We transfected miRNA mimics into HeLa cells in each group by using Lipofectamine 3000 Reagent. At 48 h after transfection, the FOXL2 mRNA and protein expression was detected by real-time fluorescent quantitative PCR and Western blotting, respectively. Besides, at 24 h, we used Scratch test to detect the cell migration ability, and the ACEA xCELLigence RTCA DP cell analyzer to detect the cell proliferation.Results The expression of FOXL2 mRNA and protein in the miRNA-520e group was lower than that in the control group and negative control group, and the migration and proliferation abilities of the miRNA-520e group were stronger than those of the control group and negative control group (allP<0.05).Conclusion miRNA-520e could inhibit the expression of FOXL2 mRNA and protein in HeLa cells, and promote the migration and proliferation of HeLa cells by targeting FOXL2.
cervical carcinoma; HeLa cells; microRNA-520e; FOXL2 gene; cell migration; cell proliferation
国家自然科学基金资助项目(81272122)。
刘悦(1991-),女,在读硕士,主要研究方向为整形外科。E-mail:farah0607@qq.com
唐胜建(1950-),男,教授,主要研究方向为整形外科。E-mail:tsj3676@163.com
10.3969/j.issn.1002-266X.2017.29.003
R73
A
1002-266X(2017)29-0008-04
2017-06-08)

