SPME—GC—NPD法测定肉制品中挥发性N—亚硝胺的条件优化
张甜+樊晓盼+熊凤娇+王娜+杨华+马俪珍

摘 要:利用固相微萃取(solid-phase microextraction,SPME)結合气相色谱-氮磷检测器(gas chromatography-nitrogen-phosphorus detector,GC-NPD)测定肉制品中9 种挥发性N-亚硝胺。通过优化平衡时间、解析时间、萃取时间、萃取温度、NaCl浓度和转速确定9 种挥发性N-亚硝胺的最佳萃取条件。结果表明:以PDMS/DVB/CAR为萃取头,平衡时间10 min、萃取温度40 ℃、萃取时间30 min、搅拌速率400 r/min、NaCl质量浓度0.36 g/mL、解吸时间3 min时能得到最佳萃取效果。采用SPME结合GC-NPD测定9 种N-亚硝胺的线性相关系数为0.994 9~0.999 7,检出限为0.01~10.00 ng/mL,定量限为0.03~33.00 ng/mL,回收率为50.19%~93.20%,相对标准偏差(relative standard deviation,RSD)为2.29%~9.65%。该方法可以满足肉制品中N-二甲基亚硝胺(N-nitrosodimethylamine,NDMA)、N-二乙基亚硝胺(N-nitrosodiethylamine,NDEA)、N-二丙基亚硝胺(N-nitrosodipropylamine,NDPA)和N-二丁基亚硝胺(N-nitrosodibutylamine,NDBA)这4 种物质含量的测定。
关键词:固相微萃取;肉制品;N-亚硝胺;萃取条件
Optimization of Extraction Conditions for the Determination of Volatile N-Nitrosamines in Meat Products Using Solid-Phase Microextraction Combined with Gas Chromatography with Nitrogen-Phosphorus Detection
ZHANG Tian1, FAN Xiaopan2, XIONG Fengjiao2, WANG Na2,*, YANG Hua2, MA Lizhen2
(1.College of Food Science and Engineering, Shanxi Agricultural University, Taigu 030801, China;
2.College of Food Science and Biotechnology, Tianjin Agricultural University, Tianjin 300384, China)
Abstract: Nine volatile N-nitrosamines in meat products were extracted by solid-phase microextraction (SPME) and determined by gas chromatography with nitrogen-phosphorus detection (GC-NPD). The optimum extraction conditions were established as follows: using PDMS/DVB/CAR fiber, equilibrium time 10 min, extraction time 30 min, extraction temperature 40 ℃, stirring speed 400 r/min, concentration of NaCl 0.36 g/mL, and desorption time 3 min. The linear correlation coefficients for the nine analytes were 0.994 9?0.999 7. The limits of detection were 0.01?10.00 ng/mL,
and the limits of quantification were 0.03?33.00 ng/mL. The recoveries of the presented method were in the range of 50.19%?93.20%, with relative standard deviation (RSD) of 2.29%?9.65%. In conclusion, the method could be used for the determination of N-nitrosodimethylamine (NDMA), N-nitrosodiethylamine (NDEA), N-nitrosodipropylamine (NDPA), and N-nitrosodibutylamine (NDBA) in meat products.
Key words: solid-phase microextraction; meat product; N-nitrosamines; extraction conditions
DOI:10.7506/rlyj1001-8123-201707009
中图分类号:TS251.6 文献标志码:A 文章编号:1001-8123(2017)07-0050-07
引文格式:
张甜, 樊晓盼, 熊凤娇, 等. SPME-GC-NPD法测定肉制品中挥发性N-亚硝胺的条件优化[J]. 肉类研究, 2017, 31(7):
50-56. DOI:10.7506/rlyj1001-8123-201707009. http://www.rlyj.pubendprint
ZHANG Tian, FAN Xiaopan, XIONG Fengjiao, et al. Optimization of extraction conditions for the determination of volatile N-nitrosamines in meat products using solid-phase microextraction combined with gas chromatography with nitrogen-phosphorus detection[J]. Meat Research, 2017, 31(7): 50-56. DOI:10.7506/rlyj1001-8123-201707009. http://www.rlyj.pub
N-亚硝胺是一種N-亚硝基化合物,其化学通式为R1R2N—N=O。它是由二级胺与亚硝化剂反应生成的,例如作为肉制品加工中的亚硝化剂,亚硝酸盐或硝酸盐与其降解产生的二级胺反应就会形成N-亚硝胺[1]。许多动物实验已经证明大部分N-亚硝胺有致癌、致畸和致突变性[2-3]。在日常饮食中,它会在食品的前处理、加工和保存过程中产生[4]。N-亚硝胺不仅可以在外界环境中形成,还可以直接在人体内形成,尤其是在人的胃里[5]。
肉制品的组成成分十分复杂,且待测组分含量很低,因此在分析检测N-亚硝胺前对样品中的N-亚硝胺进行提取和富集至关重要[5]。美国环境保护局规定在残留物分析中要减少或代替有机溶剂的使用,特别是含有卤族元素的有机溶剂[6]。目前提取N-亚硝胺的方法,如水蒸气蒸馏[7-8]、低温真空蒸馏[9]、溶剂液-液萃取[4]和固相萃取[10]等,仍然需要大量的有机溶剂,超临界流体萃取[11]和固相微萃取[12]不需要用到有机溶剂,但是超临界流体萃取设备成本高,提取过程复杂,被提取物的损失率高。N-亚硝胺最普遍的分析方法是气相色谱(gas chromatography,GC)法[13-16]和液相色谱法[17-20],也有采用胶束毛细管电动色谱法[21-22]进行测定的,而由于气相色谱法能够提供良好的分辨率,且很容易耦合具有敏感性和选择性的检测器往往会被作为首选[23-24]。
氮磷检测器(nitrogen-phosphorus detector,NPD)是对氮、磷化合物有选择地进行高灵敏度检测的检测器,可用于药品的代谢分析、聚脲系及磷系农药的残留分析、亚硝基胺、三甲胺、树脂中的丙烯脯等氮、磷化合物的选择微量分析。卢红兵等[25]利用NPD结合GC对烟草中特有的N-亚硝胺进行了测定和分析,杨华等[26]用NPD结合GC测定了肉制品中的3 种挥发性N-亚硝胺。
固相微萃取(solid-phase microextraction,SPME)是一种相对较新的样品前处理技术,集采样、萃取、浓缩、进样于一体[27],且无需溶剂,已在食品分析领域得到了广泛的应用。SPME比溶剂萃取法更快速、简单,容易操作,且不需要有毒、昂贵的有机溶剂。Andrade等[12]利用顶空固相微萃取-气相色谱-热能分析仪(head space-solid-phase microextraction-gas chromatography-thermal analyzer,HS-SPME-GC-TEA),以发酵香肠为基质,对SPME条件进行了优化,结果表明,萃取条件对萃取效果的影响很明显;张秋菊等[28]在用HS-SPME-GC-MS法测定7 种亚硝胺类化合物中的研究也发现萃取条件对实验结果影响很大;杨华等[26]采用SPME结合气相色谱仪测定了肉制品中的3 种N-亚硝胺,结果表明,萃取头的选择和萃取条件对实验结果有较大影响。
为了建立快速、有效测定肉制品中N-亚硝胺的方法,本研究用SPME-GC-NPD法测定肉制品中的N-二甲基亚硝胺(N-nitrosodimethylamine,NDMA)、N-甲乙基亚硝胺(N-nitrosomethylethylamine,NMEA)、N-二乙基亚硝胺(N-nitrosodiethylamine,NDEA)、N-二丙基亚硝胺(N-nitrosodipropylamine,NDPA)、N-亚硝基吡咯烷(N-nitrosopyrrolidine,NPYR)、N-亚硝基哌啶(N-nitrosopiperidin,NPIP)、N-二丁基亚硝胺(N-nitrosodibutylamine,NDBA)、N-亚硝基吗啉(N-nitrosomorpholine,NMOR)、N-二苯基亚硝胺(N-nitrosodiphenylamine,NDpheA)9 种化合物。对平衡时间、解析时间、萃取温度、萃取时间、转速、盐离子浓度等萃取条件以及检测条件进行优化,得到最优条件,并对肉制品中的N-亚硝胺含量进行检测。
1 材料与方法
1.1 材料与试剂
鱼肉类油炸制品16 种,均购自当地超市。
N-亚硝胺混合标准品(含有NDMA、NDEA、NMEA、NDBA、NDPA、NPIP、NPYR、NMOR和NDPheA,质量浓度均为2 mg/mL) 美国Sigma公司;甲醇(色谱纯)、氯化钠(分析纯) 国药集团化学试剂有限公司;实验用水均为超纯水。
1.2 仪器与设备
7890A气相色谱仪(配备NPD)、HP-INNOWax毛细管色谱柱 美国Agilent公司;PC-420D固微相萃取仪 墨西哥Corning公司;50/30 μm灰色PDMS/DVB/CAR萃取头、1 cm磁力搅拌子、15 mL棕色样品瓶 美国Supelco公司;HH数显恒温水浴锅 江苏省金坛市金城国胜实验仪器厂。
1.3 方法
1.3.1 气相色谱条件
进样口温度:250 ℃,氮磷检测器温度:330 ℃,载气(N2)流速10 mL/min,空气流速60 mL/min,H2流速3 mL/min。升温程序:初始温度50 ℃,保持4 min;以10 ℃/min的速率上升至180 ℃,保持2 min;以20 ℃/min的速率上升至220 ℃,保持6 min,运行温度250 ℃,3 min。endprint
在上述条件下,分析不同流速(2、4、6 mL/min)对9 种N-亚硝胺分离效果的影响。利用安捷伦工作站对色谱图进行分析及数据处理,用保留时间定性,外标法定量。
1.3.2 样品前处理
取1 mL液体样品于15 mL样品瓶中,加入9 mL饱和NaCl溶液;固体样品粉碎后取1 g于样品瓶中,加入9 mL饱和NaCl溶液,搅拌均匀、密封后放入恒温水浴锅,平衡一段时间后固定于萃取台上,设定萃取温度和搅拌速率,将萃取针插入样品瓶中,伸出萃取头(至液面以上),以顶空方式萃取一定时间后缩回萃取头。立即插入气相色谱仪进样口中,伸出萃取头,于高温进样口解析一定时间,解析完成后缩回萃取头并拔出萃取针,完成一次进样过程。
1.3.2.1 平衡时间的选择
将1 mL质量浓度为1 μg/mL的N-亚硝胺混合标准溶液置于15 mL样品瓶中,加入9 mL饱和NaCl,置于40 ℃的恒温水浴锅里,N-亚硝胺不断由液相挥发到气相,最后达到在气-液相中的分配平衡,平衡时间会影响采用SPME分析N-亚硝胺的结果。固定萃取温度为35 ℃、萃取时间为45 min、搅拌速率为400 r/min、饱和NaCl作为萃取介质、解析时间为3 min,分析平衡时间分别为0、5、10、15 min对9 种N-亚硝胺萃取效果(N-亚硝胺的峰面积)的影响。
1.3.2.2 萃取條件的优化
在确定平衡时间后,对SPME的萃取条件进行单因素试验。选择萃取温度分别为25、35、40、45、50、55 ℃(萃取时间30 min、搅拌速率400 r/min、饱和NaCl溶液),萃取时间分别为20、30、40、45、50 min(萃取温度35 ℃、搅拌速率400 r/min、饱和NaCl溶液),搅拌速率分别为200、300、400、500、600 r/min(萃取温度40 ℃、萃取时间30 min、饱和NaCl溶液),NaCl质量浓度分别为0、0.20、0.36 g/mL(萃取温度40 ℃、萃取时间30 min、搅拌速率400 r/min),研究各因素对9 种N-亚硝胺的萃取效果。
1.3.2.3 解析时间的选择
以质量浓度为1 μg/mL的混合标准溶液为萃取对象,在平衡时间10 min、萃取温度40 ℃、搅拌速率400 r/min、
饱和NaCl溶液作为萃取介质的条件下萃取30 min,解析时间分别设定为2、3、4、5 min。根据色谱图的出峰面积,确定最佳解析时间。
1.3.3 标准曲线的绘制
9 种N-亚硝胺的混合标准品用甲醇配制成质量浓度为200 μg/mL的标准储备液,置于棕色瓶中,-20 ℃避光保存;取0.5 mL上述标准储备液,用甲醇定容至10 mL棕色容量瓶中,配制成质量浓度为10 μg/mL的混合标准工作液;将N-亚硝胺混合标准工作液进行逐级稀释至质量浓度为0.01、0.02、0.05、0.08、0.10、0.20、0.50、0.80、1.00 μg/mL,于最适分离条件下分别进样,以N-亚硝胺的质量浓度为横坐标,对应峰面积为纵坐标,绘制标准曲线,得到线性回归方程及相关系数。
1.3.4 方法的检出限和定量限
分别将信噪比为3和10时测得的N-亚硝胺的浓度作为方法的检出限(limit of detection,LOD)和定量限(limit of quantitation,LOQ)。
1.3.5 回收率实验
采用空白基质加标的方法测定回收率,准确称取肉样1 g,分别添加1 mL质量浓度为0.8、1.0、2.0 μg/mL的N-亚硝胺混合标准溶液,加入8 mL饱和NaCl溶液,采用优化后的条件进行样品前处理和GC-NPD分析。按照下式计算回收率。
式中:A2为加标后样品中9 种N-亚硝胺的峰面积/pA;
A1为加标前样品中9 种N-亚硝胺的峰面积/pA;A0为混合标准品中9 种N-亚硝胺的峰面积/pA。
1.3.6 精密度实验
计算加标回收率实验中5 次回收率平行测定结果的相对标准偏差(relative sandard deviation,RSD),分析加标回收率实验的精密度。
1.4 数据处理
实验均重复测定3 次,结果用平均值±标准差表示。数据统计及分析采用Statistix 8.1软件包(St Paul,MN)中线性模型程序进行方差分析,采用Tukey HSD程序进行差异显著性分析。
2 结果与分析
2.1 气相色谱条件优化及9 种N-亚硝胺标准品的色谱图
样品不经SPME处理,采用气相色谱结合氮磷检测器,用HP-INNOWax石英毛细管柱对9 种N-亚硝胺进行分离。由图1可知,9 种N-亚硝胺都实现了基线分离,且各峰的峰形尖锐、对称。采用程序升温,50~180 ℃范围内,以10 ℃/min的速率升温,NDMA、NMEA、NDEA、NDPA、NDBA、NPIP、NPYR和NMOR依次出峰,当温度以20 ℃/min升到220 ℃时,NDpheA出峰。在分离过程中,流速分别选择2、4、6 mL/min,当流速为4 mL/min和6 mL/min时,NDBA和NPIP没有实现基线分离,当流速为2 mL/min时,二者实现基线分离。
2.2 样品前处理条件优化
2.2.1 平衡时间的选择
平衡过程,即样品于萃取瓶中在一定的温度、搅拌速率下进行萃取,使溶液中的N-亚硝胺与顶空部分的
N-亚硝胺基本达到动态平衡。本研究选择在40 ℃恒温水浴锅中进行平衡。由表1可知,9 种N-亚硝胺在平衡时间为10 min时的出峰面积最大,且NDMA、NMEA、NDEA、NPIP、NPYR、NMOR的峰面积显著高于其他平衡时间(P<0.05),此结果与Andrade等[12]报道的平衡时间为10 min时腊肠中的NDMA和NDEA的峰面积最大一致,因此选择10 min作为9 种N-亚硝胺的平衡时间。endprint
2.2.2 萃取条件的优化
2.2.2.1 萃取温度的选择
由表2可知,温度为25~40 ℃时,除了NMEA,其他8 種N-亚硝胺的峰面积随温度升高而增加,且NDPA、NDBA、NPIP、NDpheA的峰面积增加显著(P<0.05)。温度为40~45 ℃时,NMEA、NDPA、NDBA、NMOR和NDpheA的峰面积随温度升高而增加,但差异不显著(P>0.05),而NDMA、NDEA、NPIP和NPYR的峰面积随温度升高而减小,其中NDMA、NDEA和NPYR显著降低;温度继续升高到55 ℃时,NMEA的峰面积显著降低,NDPA和NMOR变化不显著,NDBA和NDpheA显著增加。这可能是因为45 ℃时的水蒸气气压增加,造成萃取头在吸附的同时也在进行脱附,当温度升高到55 ℃时,其峰面积变化不显著。考虑到NDMA、NDEA和NPYR是食品中的主要致癌物,且其他N-亚硝胺在45 ℃以上温度的峰面积与40 ℃差异不显著,因此选择40 ℃作为最适萃取温度。
2.2.2.2 萃取时间的选择
由表3可知,除了NDEA,其他8 种N-亚硝胺的峰面积随着萃取时间的增加整体呈增大趋势,萃取50 min后萃取头吸附N-亚硝胺基本上达到平衡,且NMEA、NDEA和NPYR在萃取30 min和50 min时的差异不显著
(P<0.05),而且固相微萃取本身就是一种不完全萃取,考虑到快速萃取操作及进样分析时间的可行性,最终选取30 min作为萃取时间。
2.2.2.3 搅拌速率的选择
由表4可知,搅拌速率对9 种N-亚硝胺的峰面积有显著影响(P<0.05),随着搅拌速率的加快,9 种N-亚硝胺的峰面积并没有明显递增趋势,当搅拌速率为400 r/min
时,出峰面积达到最大。虽然搅拌速率为400 r/min和
300 r/min时,除NDBA、NPYR和NdpheA的峰面积差异显著(P<0.05)外,其他6 种N-亚硝胺的峰面积差异均不显著(P>0.05),但由于搅拌速率较好控制,因此为了使萃取效率达到最大,本研究选择搅拌速率为400 r/min。
2.2.2.4 NaCl质量浓度的选择
在待萃取的样品中加入NaCl是为了降低待分析物在水溶液中的溶解度,促进待分析物的挥发,使水相和空气相中的分析物达到平衡[29]。由表5可知,除NMOR外,其他8 种N-亚硝胺的峰面积随着NaCl质量浓度的增加而增大;除NPYR和NMOR外,其他种类的N-亚硝胺在NaCl溶液饱和时,其出峰面积最大,且显著高于质量浓度为0.00 g/mL和0.20 g/mL的NaCl溶液作为萃取介质时的峰面积(P<0.05)。因此选择饱和NaCl溶液作为萃取介质进行萃取。
2.2.3 解析时间的选择
萃取头吸附的待测物在气相色谱仪进样口解析时间的长短对萃取效果有一定的影响。由表6可知,除NDBA、NPIP和NDpheA外,其他N-亚硝胺在解析时间为3 min时的出峰面积最大;NDEA解析3 min时的出峰面积显著高于其他解析时间(P<0.05);NDBA解析3 min时的出峰面积显著高于解析2 min(P<0.05),与解析4、5 min时的差异不显著(P>0.05);NPIP解析3 min时的出峰面积显著高于解析2、5 min(P<0.05),与解析4 min时的差异不显著(P>0.05);NDpheA解析3 min时的出峰面积与其他解析时间差异不显著(P>0.05)。在对解析3 min后的萃取头进行老化操作时,并没有出现残留峰及杂质峰,3 min的解析时间也确保了萃取头的老化操作,因此选择3 min作为最佳解析时间。
2.3 PDMS/DVB/CAR萃取头萃取9 种N-亚硝胺的色谱图
通过对平衡时间、萃取条件和解析时间进行优化,得到最优条件为平衡时间10 min、萃取温度40 ℃、萃取时间30 min、转速400 r/min、饱和NaCl溶液作为萃取介质,在此条件下将100 ng/mL的9 种N-亚硝胺的混合标准溶液萃取后,进行气相色谱检测。由图2可知,9 种N-亚硝胺全部分离,但响应强度差异较大,这与萃取材料对目标物的吸附强度有关。
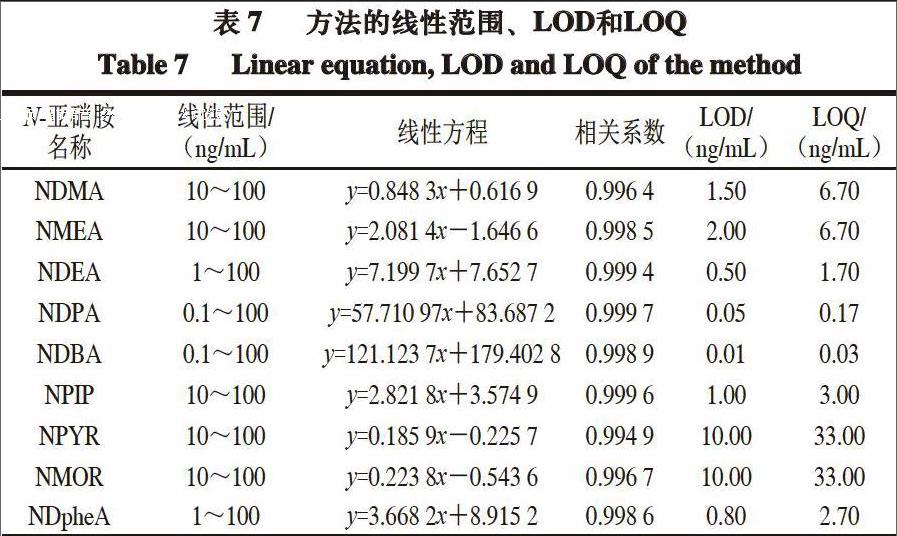
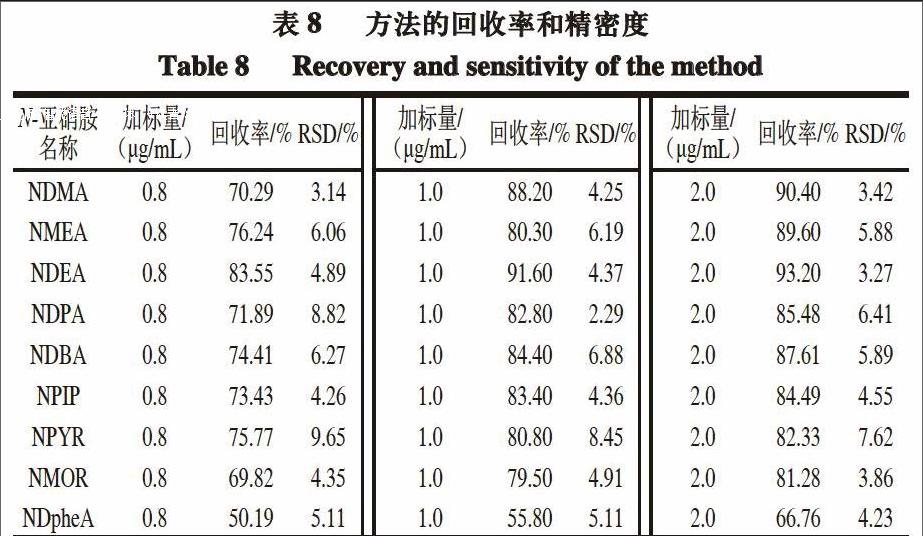
2.4 方法的线性范围、检出限、定量限、回收率和精密度
由表7可知,该方法的线性相关性较好,相关系数均大于0.99。9 种N-亚硝胺的检出限为0.01~10.00 ng/mL,NDMA、NDEA、NDPA、NDBA的检出限较低,可以满足肉制品中这4 种N-亚硝胺的痕量检测,其精密度和准确度均能满足痕量分析的要求。
2.5 实际样品测定
用SPME-GC-NPD方法,采用优化得到的最佳条件测定16 种鱼肉类油炸制品中9 种N-亚硝胺的含量。由表9可知,16 种被测肉制品中存在的N-亚硝胺主要为NDMA、NMEA和NDEA,只有个别样品中含有NDBA和NPIP。目前GB 2762—2012《食品安全国家标准 食品中污染物限量》[30]中只对NDMA有限量规定(3 μg/kg),由本研究的测定结果可知,16 种被测肉制品中的NDMA含量均超过了此限量标准,特别是没有限量规定的NMEA和NDEA的测定值特别高,如有的样品中NMEA的测定值高达48.581 μg/kg。油炸制品中常被报道检出的NPYR在本研究的样品中并未检出,主要原因是N-亚硝胺的检测采用固微相萃取仪进行前处理,采用PDMS/DVB/CAR萃取头,对NPYR的吸附力较差,因此NPYR含量较低的产品检测不出来。N-亚硝胺是一种致癌性很强的化合物,应该予以重视。今后的研究应分析造成产品中N-亚硝胺含量较高的原因及N-亚硝胺形成的影响因素,跟踪产品的加工过程,寻找控制措施。endprint
3 結 论
本研究建立了SPME结合GC-NPD测定肉制品中
9种N-亚硝胺的方法,该方法简单、快速、不使用有机溶剂、易操作。以PDMS/DVB/CAR为萃取头,解析时间3 min、平衡时间10 min、萃取温度40 ℃、搅拌速率400 r/min、萃取时间30 min、饱和NaCl溶液作为萃取介质时,9 种N-亚硝胺的峰面积最大。9 种N-亚硝胺的质量浓度与对应峰面积间的线性关系良好,相关系数为0.994 9~0.999 7,检出限为0.01~10.00 ng/mL,定量限为0.03~33.00 ng/mL,回收率为50.19%~93.20%,RSD为2.29%~9.65%。由于检出限和回收率的限制,本研究中的方法仅可以满足肉制品中NDMA、NDEA、NDPA和NDBA的定量测定。
参考文献:
[1] LISTED N. IARC monographs on the evaluation of the carcinogenic risk of chemicals to humans: some N-nitroso compounds[J]. Biologia Plantarum, 1987, 29(6): 452. DOI:10.1007/BF02882220.
[2] CRADDOCK V M. Nitrosamines, food and cancer: assessment in Lyon[J]. Food and Chemical Toxicology, 1990, 28(1): 63-65. DOI:10.1016/0278-6915(90)90137-C.
[3] HOTCHKISS J H. A review of current literature on N-nitroso compounds in foods[J]. Advances in Food Research, 1988, 31: 53-115. DOI:10.1016/S0065-2628(08)60166-4.
[4] CAMPILLO N, VI?AS P, MART?NEZ-CASTILLO N, et al. Determination of volatile nitrosamines in meat products by microwave-assisted
extraction and dispersive liquid-liquid microextraction coupled to gas chromatography-mass spectrometry[J]. Journal of Chromatography A, 2011, 1218(14): 1815-1821. DOI:10.1016/j.chroma.2011.02.010.
[5] SCANLAN R A. Nitrosamines[J]. Encyclopedia of Food Sciences and Nutrition, 2003: 4142-4147.
[6] United States Environmental Protection Agency. Pollution prevention strategy[Z]. Washington D C: Federal Register, 1991.
[7] DRABIK-MARKIEWICZ G, DEJAEGHER B, DE MEY E, et al.
Influence of putrescine, cadaverine, spermidine or spermine on the formation of N-nitrosamine in heated cured pork meat[J]. Food Chemistry, 2011, 126(4): 1539-1545. DOI:10.1016/j.foodchem.2010.11.149.
[8] WEI Fashan, XU Xinglian, ZHOU Guanghong, et al. Irradiated Chinese rugao ham: changes in volatile N-nitrosamine, biogenic amine and residual nitrite during ripening and post-ripening[J]. Meat Science, 2009, 81(3): 451-455. DOI:10.1016/j.meatsci.2008.09.005.
[9] RAOUL S, GREMAUD E, BIAUDET H, et al. Rapid solid-phase extraction method for the detection of volatile nitrosamines in food[J]. Journal of Agricultural and Food Chemistry, 1997, 45(12): 4706-4713. DOI:10.1021/jf970232q.
[10] YURCHENKO S, M?LDER U. The occurrence of volatile N-nitrosamines in Estonian meat products[J]. Food Chemistry, 2007, 100(4): 1713-1721. DOI:10.1016/j.foodchem.2005.10.017.
[11] PENSABENE J W, FIDDLER W, MAXWELL R J, et al. Supercritical fluid extraction of N-nitrosamines in hams processed in elastic rubber nettings[J]. Journal of Aoac International, 1995, 78(3): 744-748.endprint
[12] ANDRADE R, FELIX G R, RATH S. A method for the determination of volatile N-nitrosamines in food by HS-SPME-GC-TEA[J].
Food Chemistry, 2005, 91(1): 173-179. DOI:10.1016/j.foodchem.2004.08.015.
[13] 李玲, 徐幸莲, 周光宏. 气质联用检测传统中式香肠中的9 种挥发性亚硝胺[J]. 食品科学, 2013, 34(14): 241-244. DOI:10.7506/spkx1002-6630-201314049.
[14] 魏法山, 徐幸莲, 周光宏. 挥发性N-亚硝基化合物的分析方法[J]. 食品科学, 2008, 29(7): 479-484. DOI:10.3321/j.issn:1002-6630.2008.07.109.
[15] 王瑞, 马俪珍, 方长发, 等. 气相色谱法测定熟肉制品中挥发性N-亚硝胺类化合物[J]. 中国食品学报, 2007, 7(2): 124-127. DOI:10.3969/j.issn.1009-7848.2007.02.024.
[16] 何淑娟, 赵丽敏, 李强, 等. 气相色谱-质谱法测定肉制品中的9 种挥发性N-亚硝胺类物质[J]. 肉类研究, 2015, 29(1): 27-30. DOI:10.7506/rlyj1001-8123-201501007.
[17] 杨宁, 陈颖慧, 邓莉, 等. 双填料固相萃取-高效液相色谱-质谱法同时检测腌菜中9 种N-亚硝胺[J]. 分析化学, 2013, 41(7): 1044-1049.
[18] HERRMANN S S, DUEDAHLOLESEN L, GRANBY K. Simultaneous determination of volatile and non-volatile nitrosamines in processed meat products by liquid chromatography tandem mass spectrometry using atmospheric pressure chemical ionisation and electrospray ionisation[J]. Journal of Chromatography A, 2014, 1330(4): 20-29. DOI:10.1016/j.chroma.2014.01.009.
[19] MCDAY J. Ecological method development for detecting N-nitrosodimethylamine in water using HPLC-PDAD[D]. Ypsilanti: Eastern Michigan University, 2010: 1-88.
[20] 蔡鲁峰, 李娜, 杜莎, 等. 固相萃取净化-高效液相色谱法测定肉制品中的9 种N-亚硝基化合物[J]. 食品科学, 2016, 37(12): 217-221. DOI:10.7506/spkx1002-6630-201612039.
[21] FILHO P J S, RIOS A, VALC?RCEL M, et al. Development of a new method for the determination of nitrosamines by micellar electrokinetic capillary chromatography[J]. Water Research, 2003, 37(16): 3837-3842.
[22] YANG Youyou, NIE Honggang, LI Chenchen, et al. On-line concentration and determination of tobacco-specific N-nitrosamines by cation-selective exhaustive injection-sweeping-micellar electrokinetic chromatography[J]. Talanta, 2010, 82(5): 1797-1801. DOI:10.1016/j.talanta.2010.07.075.
[23] BYUN M W, AHN H J, KIM J H, et al. Determination of volatile N-nitrosamines in irradiated fermented sausage by gas chromatography coupled to a thermal energy analyzer[J]. Journal of Chromatography A, 2004, 1054(1/2): 403-407. DOI:10.1016/S0021-9673(04)01302-0.
[24] GREBEL J E, (MEL)SUFFET I H. Nitrogen-phosphorus detection and nitrogen chemiluminescence detection of volatile nitrosamines in water matrices: optimization and performance comparison[J]. Journal of Chromatography A, 2007, 1175(1): 141-144. DOI:10.1016/j.chroma.2007.09.073.
[25] 卢红兵, 钟科军, 毛友安, 等. 毛细管气相色谱-氮磷检测器法测定卷烟烟气中TSNA的研究[J]. 湖南城市学院学报(自然科学版), 2004, 13(4): 55-60. DOI:10.3969/j.issn.1672-7304.2004.04.018.
[26] 杨华, 方长发, 张甜, 等. SPME-GC-NPD法测定肉制品中挥发性N-亚硝胺[J]. 食品研究与开发, 2016, 37(3): 150-155. DOI:10.3969/j.issn.1005-6521.2016.03039.
[27] ALDURADA M D. Solid-phase microextraction: a promising technique for sample preparation in environmental analysis[J]. Journal of Chromatography A, 2000, 889(1/2): 3-14. DOI:10.1016/S0021-9673(00)00453-2.
[28] 张秋菊, 郭祖鹏, 李明珠, 等. 顶空固相微萃取-气相色谱-质谱法测定7 种亚硝胺类化合物[J]. 中国卫生检验杂志, 2009, 19(6): 1234-1236.
[29] GREBEL J E, YOUNG C C, SSUFFET I H. Solid-phase microextraction of N-nitrosamines[J]. Journal of Chromatography A, 2006, 1117(1): 8-11. DOI:10.1016/j.chroma.2006.03.044.
[30] 中華人民共和国卫生部. GB 2762—2012 食品安全国家标准 食品中污染物限量[S]. 北京: 中国标准出版社, 2012.endprint

