盐角草PsaH基因的克隆及生物信息学分析
郝晓燕,李建平,足木热木·吐尔逊,高升旗,黄全生
(新疆农业科学院核技术生物技术研究所,乌鲁木齐 830091)
盐角草PsaH基因的克隆及生物信息学分析
郝晓燕,李建平,足木热木·吐尔逊,高升旗,黄全生
(新疆农业科学院核技术生物技术研究所,乌鲁木齐 830091)
目的从盐生植物盐角草(Salicorniaeuropaea)中克隆得到一个参与光合反应光系统I(PSI)复合蛋白H亚基的PsaH基因,分析该基因进行生物信息学,为研究该基因的作用奠定基础并为改良作物耐盐性分子育种提供候选基因。方法以盐生植物盐角草为实验材料,采用RT-PCR方法克隆PsaH基因,利用NCBI、MEGA、Expasy等生物信息学工具对其核酸序列、编码的氨基酸序列及蛋白质的结构和功能进行分析。结果克隆得到一个与耐盐有关的基因,命名为SePsaH,属于光系统I(PSI)家族H亚基成员,其开放阅读框(ORF)为438 bp,基因编码145个氨基酸,预测蛋白分子量为15.3 kD,等电点9.84,是亲水性蛋白;系统进化树分析表明其与菠菜亲缘关系较近,通过对该蛋白保守性分析发现其含有4个保守性结构域。结论获得盐角草SePsaH基因,为进一步研究该基因耐盐功能及其在盐生植物耐盐机制中的作用提供了基础。
盐角草;SePsaH基因;生物信息
0 引 言
【研究意义】干旱、盐碱、极端温度等非生物胁迫是严重影响植物生长和发育造成农作物减产的主要因素。所有这些胁迫都会引发植物细胞内一系列的生理生化反应来响应对逆境的应答机制。据世界粮农组织的估计,世界上大约有20%的耕地和接近50%的灌溉用地受到土壤盐渍化的严重危害[1-3]。我国大约有0.33×108hm2(5亿亩)盐碱地,并且其面积有不断增加的趋势。盐角草(Salicorniaeuropaea)是藜科(Chenopodiaceae)盐角草属(SaliconiaL)的一年生低矮草本,生于平原荒漠区湖边潮湿盐土上,是典型的盐生植物,是我国最重要的盐土荒漠建群种之一。由于其蛋白质组分良好,且种子脂类含量高,有独特的生物生态学特征和广泛的经济、生态价值[4]。因此,利用现代生物学技术,通过对盐生植物耐盐基因的发掘和功能研究能够为改良作物耐盐性提供理论基础,还将对有效地改良和利用盐渍土提供思路[5]。【前人研究进展】植物耐盐的机制是包含相互关联、相互协调、协同作用的一系列生理生化功能的复杂机制。深入研究盐角草耐盐相关基因及其功能对于了解盐生植物耐盐机理具有重要意义。马金彪[6]等通过RACE技术从盐角草中克隆SeHKT1基因,通过生物信息学方法和qRT-PCR方法研究发现,该基因响应盐胁迫诱导。孙伟民[7]通过转基因烟草证实了盐角草SePEAMT和SeCMO能够提高烟草甜菜碱表达量从而提高烟草的耐盐性。臧洁[8]等利用RACE技术克隆了盐角草中的Cu/Zn-SOD基因,通过对过表达菌株证实其的耐盐功能。【本研究切入点】目前,有关盐生植物的研究工作虽然早已起步[9,10],主要集中在生态学、形态学、生理学及药物化学等几个方面,缺乏系统性研究。利用RT-PCR技术从盐生植物盐角草中获得耐盐相关基因SePsaH全长,并对其进行生物信息学分析[11-13],以便进一步的了解其分子生物学功能。【拟解决的关键问题】研究利用RT-PCR克隆了盐角草SePsaH基因,并对其推导的氨基酸序列进行生物信息学分析,有助于进一步研究SePsaH基因在提高植物耐盐性功能方面奠定基础。
1 材料与方法
1.1 材 料
1.1.1 植物材料
盐角草(Salicorniaeuropaea)种子收获与阜康水库盐碱地,生长4周大小的盐角草,以400 mM NaCl胁迫处理48 h取样,迅速置于液氮中冷冻,-70℃冰箱保存备用。
1.1.2 质粒、菌株、试剂
大肠杆菌(Escherichiacoli)Trans-T1感受态细胞、DNA Marker、TaqDNA聚合酶、pEASY-Blunt Zero Cloning Kit购自TransGen Biotech;;PowerScriptTMII 反转录试剂盒、限制性内切酶均购自NEB公司,DNase 酶Ⅰ、LATaq酶、ExTaq酶、dNTP均购自TaKaRa 公司,T4DNA 连接酶购自Promega 公司,DNA 回收试剂盒购自于OMEGA,引物由北京华大生物科技有限公司合成。
1.2 方 法
1.2.1 RNA的提取与纯化
材料的总RNA提取按照Invitrogen公司Triozol 试剂说明书进行。以DNaseⅠ纯化处理后,取适量进行甲醛变性胶电泳检测,判断RNA 完整性和纯度。另外,取适量RNA 用紫外分光光度计测定RNA 浓度。
1.2.2 cDNA的合成
第一链cDNA的合成按照Fermentas公司的First Strand cDNA Synthesis Kit操作说明进行,采用的反转录引物为Oligo(dT)15。取1 μg 总RNA 作为模板进行RT-PCR,20 μL体系中总RNA 1 μg,DEPC水6 μL,Oligo(dT)151 μL,65℃ 5 min,冰上放置5 min,RNase inhibitor 1.0 μL,5×Reaction buffer 4 μL,dNTP(10 mmol/L)2 μL 和M-MLV(200 U/μL)1 μL,42℃温育60 min,70℃变性5 min,冰上5 min,-70℃保存备用。
1.2.3 SePsaH基因的克隆
使用Primer Primer 5.0软件在开放阅读框两侧设计一对能有效扩增SePsaH的特异引物(SePsaH-ORF-F:5’-ATGGCTTCTCTAGCAACCTTTGCC-3’;SePsaH-ORF-R:5’-TTAGATCTTGCCACGAGGTCCG-3’,扩增片段长度为438 bp)。以合成的第一链cDNA为模板,进行PCR扩增。反应体系为50 μL:cDNA 1 μL,引物各1 μL,ExTaq酶0.5 μL,10×PCR Buffer (Mg2+plus)5 μL,dNTP Mixture 4 μL,加ddH2O至50 μL。PCR程序:94℃预变性 3 min;94℃ 变性30 s,60℃ 复性30 s,72℃ 延伸30 s,30个循环;72℃延伸10 min; 4℃保存。琼脂糖凝胶电泳检测后用DNA回收试剂盒回收目的片段连接到pEASY-Blunt Zero载体进行克隆,阳性克隆经酶切鉴定后送北京华大基因科技有限公司完成DNA测序。
1.2.4 SePsaH基因的生物信息学
SePsaH基因的核苷酸和氨基酸序列分别用NCBI的BLASTn和BLASTp(http://bladt.ncbi.nlm.nih.gov/Blast.cgi)进行相似性分析;用ClustalX1.8对SePsaH与GenBank数据库中登录的相似基因进行多序列比对,用MEGA5.0通过邻接算(Neighbor-Joining)法完成进化树绘制。利用在线软件Protparam (htpp://www.expasy.org/protparam/)分析蛋白的理化性质;用TMHMM软件(http://www.cbs.dtu.dk/services/TMHMM/预测蛋白的跨膜区。
2 结果与分析
2.1 SePsaH基因的克隆
以400 mM NaCl胁迫处理48 h的盐角草cDNA为模板,SePsaH-ORF全长引物用RT-PCR 法扩增得到预期长度为438 bp的产物。经连接克隆载体、酶切鉴定、测序分析后,得到完整的开放阅读框438 bp,编码145个氨基酸。BLASTP分析发现,该序列与菠菜有高度同源的序列,且长度接近。因此,将其命名为SePsaH。用在线软件ExPasy预测SePsaH基因所编码的蛋白质理化性质。预测结果表明,SePsaH蛋白分子量为15.4kD,等电点为9.84,分子式为C699H1109N183O204S1,蛋白质的半衰期为30 h,不稳定指数为47.81,为不稳定蛋白。SePsaH蛋白有8个负电荷氨基酸残基 (Asp+Glu),16个正电荷氨基酸残基 (Arg+Lys)。图1
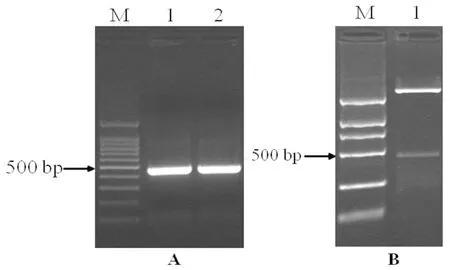
A, M:100 bp Marker;1和2:以cDNA为模板的扩增产物; B, M:DL2000 Marker;1:pEASY-Blunt Zero-SePsaH双酶切鉴定
A, M:100 bp Marker;1 and 2:the products of cDNA by RT-PCR; B, M:DL2000 Marker;1:pEASY-Blunt Zero-SePsaHdigested byEcoRI and KpnI
图1 SePsaH基因的扩增和双酶切鉴定
Fig.1 RT-PCR products of SePsaH gene full-length cDNA sequence from Salicornia europaea and identification by double-enzyme digestion
2.2SePsaH基因的结构域及同源性
通过NCBI在线预测SePsaH蛋白功能结构域,发现该蛋白属于光系统I H亚基。利用NCBI的Blast在线分析SePsaH蛋白序列。分析结果表明,SePsaH蛋白与菠菜(Spinaciaoleracea) 同源性最高,相似性为92%,与木薯(Manihotesculenta)、蓖麻(Ricinuscommunis) 相似性为85%,与毛果杨(Populustrichocarpa)的相似性为84%,与等其它植物的氨基酸有着高度保守性。该结果表明,研究所克隆的SePsaH基因是光系统I(PSI) H亚基成员。图2
对包含SePsaH基因在内的6种植物的同源蛋白进行保守区分析发现,他们包含4个保守的结构功能域:1个N端的高酸性富集结构域,1个转移肽,1个中心疏水结构域和1个C端的保守结构域。这些分析表明该基因编码的氨基酸具有跨膜的功能。图3

图2 蛋白保守区预测
Fig.2 Prediction of SePsaH conserved domains

AhPsaH (花生Arachishypogaea,AB184258);NsPsaH (烟草樟子松Nicotianasylvestris, BAA04634); RcPsaH (蓖麻Ricinuscommunis, XP002516025);PtPsaH (毛果杨Populustrichocarpa, XP002304206); AtPsaH (Arabidopsisthaliana拟南芥,NP175633);SePsaH(盐角草Salicorniaeuropaea)
图3 SePsaH基因与其它植物PsaH基因的氨基酸序列比对分析
Fig.3 Comparison of amino acid sequences homology of SePsaH with different plant PsaH
2.3 SePsaH基因系统进化树
将盐角草SePsaH氨基酸序列与NCBI数据库中其他植物中的同源基因的氨基酸序列利用MEGA5.0软件,用相邻连接法构建系统进化树。进化树分析表明,SePsaH在植物中普遍存在,具有较强的保守性,整体可分为三组:大豆、花生、红三叶、毛果杨、蓖麻、烟草樟子松聚为一组,其中杨毛果和蓖麻聚为一亚组,其余聚为一亚组。葡萄、玉米聚为一组,盐角草、菠菜和拟南芥聚为一组。由此可以看出盐角草与菠菜和拟南芥同类基因的亲缘关系较近,推测其在结构和功能上也可能有一定的相似性。图4
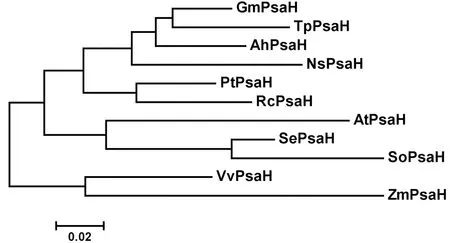
NsPsaH (烟草樟子松Nicotianasylvestris, BAA04634); AhPsaH (花生Arachishypogaea,AB184258); GmPsaH (大豆Glycinemax, ACU13848);TpPsaH (红三叶Trifoliumpretense, AAQ21121); PtPsaH (毛果杨Populustrichocarpa, XP002304206);RcPsaH (蓖麻Ricinuscommunis, XP002516025);AtPsaH (Arabidopsisthaliana拟南芥,NP175633); SoPsaH (菠菜Spinaciaoleracea, CAA34749);VvPsaH (葡萄Vitisvinifera,XP002284496);ZmPsaH (玉米Zeamays,NP010104905)
图4 SePsaH系统进化树
Fig.4 Phylogenetic tree analysis of SePsaH
2.4 SePsaH基因疏水性及跨膜性预测
用ExPasy软件在线预测SePsaH蛋白的疏水性,研究表明,SePsaH蛋白的最高值为2.44,在第105和106个氨基酸处,疏水性强,总平均疏水性指数(GRAVY)-0.148;在第134个氨基酸处的低值为-2.3,亲水性强,可知该蛋白是亲水性蛋白;通过TMHMM分析SePsaH蛋白的跨膜性预测,该蛋白具有1个跨膜结构域,位于101~211位氨基酸。图5,图6
2.5 SePsaH基因编码蛋白的高级结构预测
通过PredictProtein预测SePsaH蛋白质的二级结构发现Helix(螺旋)占18.6%,Strand(延伸链)占21.4%,Loop(环)占60%。用SWISS-MODEL对SePsaH和SoPsaH蛋白质的三级结构进行了建模预测,从结果可以看出两个同源性最高的蛋白自三级结构预测结果是十分相似的,与二级结构预测结果也相符。同时,亚细胞定位预测结果显示SePsaH是定位在真核细胞中叶绿体膜上,与蛋白质功能预测结果相符。图7
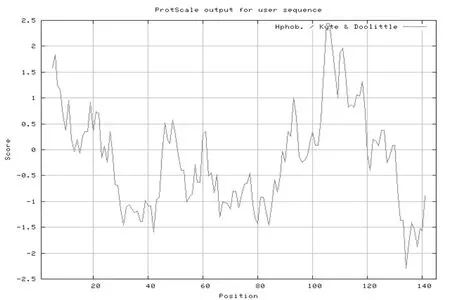
图5 SePsaH蛋白的疏水性预测
Fig.5 Prediction of the SePsaH protein hydrophobicity
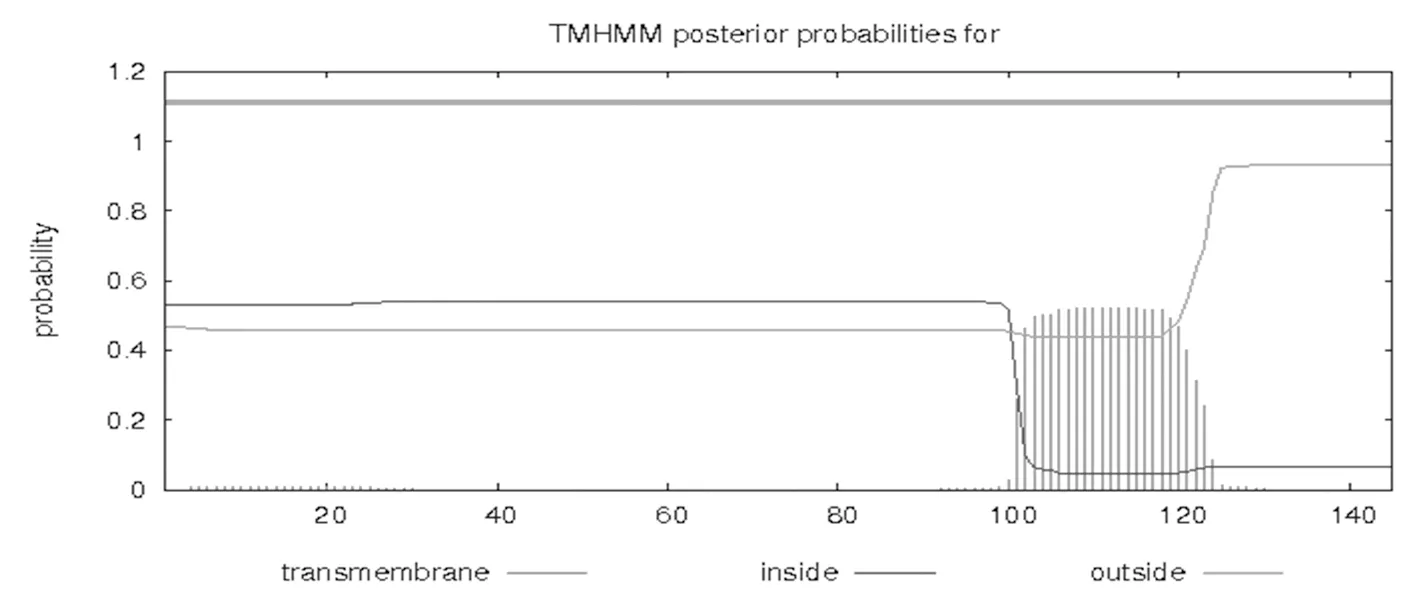
图6 SePsaH蛋白的跨膜性预测
Fig.6 The transmembrane prediction of the SePsaH protein

图7 A:SePsaH 编码蛋白质的三级结构预测;B:SoPsaH编码蛋白质的三级结构预测
Fig.7 A:Predicted tertiary structure of SePsaH protein; B: Predicted tertiary structure of SoPsaH protein
3 讨 论
植物的生长发育会受到各种非生物和生物胁迫的影响,如盐碱、高温、干旱等极端环境和病原菌的侵染等[13,14]。相对于生物胁迫、盐碱、干旱、极端温度等非生物胁迫对植物生长发育的影响极大,是引起农作物减产的首要原因。在这些胁迫下,植物的光合作用会受到严重的抑制,使蛋白质代谢异常[15,16],从而造成植物体内生理干旱[17],进一步抑制植物的生长和发育。但盐生植物盐角草适应盐渍环境的一个特殊方式就是叶片的肉质化,从而在逆境条件下储存水分,保证叶片进行光合作用,完成正常的生理功能[18]。光合作用(Photosynthesis)是绿色植物、藻类和某些细菌在可见光照射下,经过光反应和碳反应,利用叶绿素,将二氧化碳和水转化为有机物(主要是淀粉),并释放出氧气的生化过程。光合作用是一系列复杂的代谢反应的总和,是生物界赖以生存的基础。在盐胁迫下,植物要生存和适应逆境的生态条件,往往要合成相容性的物质,以提高原生质和叶绿体等重要细胞器中有机质的浓度[19],来维持其存在大量盐分的液泡之间的渗透平衡[20,21],防止原生质和叶绿体等细胞器脱水使植物受到破坏。
在盐胁迫下,随着盐浓度的提高光合电子传递速度明显下降。盐角草叶片和角质膜厚,气孔器下陷,具表皮毛,栅栏组织发达,叶片极度肉质化,利用同化枝执行光合功能,且同化枝内部具有粘液和含晶细胞,贮水组织发达。盐角草是通过这些生理结构的改变来适应旱生和盐生环境的[22,23]。光合系统蛋白复合体的生理功能是吸收光能,进行光化学反应,产生强的氧化剂,使水裂解释放氧气,并把水中的电子传至质体醌[24]。PsaH是编码参与PSI蛋白复合体H亚基的基因,在光合系统组成与反应中心的电子传递中起着重要的作用。研究获得了盐角草的SePsaH基因,对于候选研究PsaH在盐角草中的功能以及探索盐生植物耐盐机制中的作用奠定了基础。
4 结 论
研究利用RT-PCR方法从盐角草中成功分离得到一个参与光合反应光系统的PsaH基因。生物信息学分析得出SePsaH基因具有光合反应PSI_H亚基家族典型的结构特征,属于PsaH基因家族;该基因的开放阅读框为438 bp,编码145个氨基酸,对其蛋白质的亚细胞定位预测结果表明其为定位在叶绿体膜上的稳定蛋白;通过跨膜结构分析,其含有1个跨膜结构域,4个保守结构功能域;系统进化分析表明盐角草的SePsaH基因与菠菜和拟南芥聚为一类,亲缘关系最近,这些都与其蛋白质功能预测的结果相符。蛋白质氨基酸序列同源比对分析结果表明,PsaH蛋白与菠菜同源性达到92%,与木薯和蓖麻相似性为85%,与毛果杨的相似性为84%,不同物种之间的PsaH蛋白还是比较保守的。
References)
[1] 赵可夫,李法曾. 中国盐生植物[M]. 北京:中国科学技术出版社, 2000.
ZHAO Ke-fu, LI Fa-zeng. (2000).HalophytesinChina[M]. Beijing: Science and Technology of China Press. (in Chinese)
[2] 郗金标, 张福锁, 田长彦,等. 新疆盐生植物[M]. 北京: 科学出版社, 2006.
XI Jin-biao, ZHANG Fu-suo, TIAN Chang-yan, et al. (2006).HalophytesinXinjiang[M]. Beijing: Science Press. (in Chinese)
[3] Flower T J, Yeo A R.et al. (1997). Breeding for salinity resistance in crop plants-the role of molecular biology.Acta.PhysiologiaePlantarum, 19(4): 427-433.
[4] 李梅梅, 吴国华, 赵振勇, 等.新疆5种藜科盐生植物的饲用价值[J]. 草业科学, 2017, 34(2):361-368.
LI Mei-mei, WU Guo-hua, ZHAO Zheng-yong, et al. (2017). Feeding value evaluation of Xinjiang five chenopod halophytes [J].PrataculturalScience, 34(2): 361-368. (in Chinese)
[5] Sunkar, R,, Bartels, D., Kirch, HH. (2003). Overexpression of a stress inducible aldehyde dehydrogenase gene from Arabidopsis thaliana in transgenic Plants improves stress tolerance.PlantJournal, (35):452-464.
[6] 马金彪, 张大勇, 张梅茹, 等. 盐角草高亲和钾离子转运蛋白SeHKT1基因的克隆及表达分析[J].生物技术通报, 2015, 31(11):159-165.
MA Jin-biao, ZHANG Da-yong, ZHANG Mei-ru, et al. Clone and Expression Analysis of The High-affinity K+Transporter Gene SeHKT1 from the Halophyte Salicornia europaea [J].BiotechnologyBulletin, 31(11):159-165. (in Chinese)
[7] 孙伟民. 盐角草SeCMO、SePEAMT基因在大肠杆菌中的表达及转双基因烟草耐旱性研究[D]. 大连:大连理工大学硕士学位论文, 2009.
SUN Wei-ming. (2009).ExpressionofSeCMOandSePEAMTgenesinE.coliandDroughtToleranceofTransgenicTobaccowithSePEAMY+SeCMOGene[D]. Mater Thesis. Dalian University of Techonology, Dalian. (in Chinese)
[8] 臧洁, 余梅, 王先磊, 等. 盐角草Cu/Zn-SOD基因的克隆及耐盐性分析[J].农业生物技术学报, 2013, 21(7): 847-854.
ZANG Jie, YU Mei, WANG Xian-lei, et al. Cloning and Salt-tolerance Analysis of the Salicornia europaea Gene Cu/Zn-SOD [J].JournalofAgriculturalBiotechnology, 21(7): 847-854. (in Chinese)
[9] 蔡伦,张富春,马纪,等. 新疆3种藜科盐生植物NHx基因的克隆与序列分析比较[J].植物生理学通讯,2005,41(3):383-387.
CAI Lun, ZHANG Fu-chun, MA Ji, et al. (2005). Cloning and Sequence Analysis of NHX Genes from Three Species of Halophytes from Xinjiang [J].PlantPhysiologyCommunications, 41(3):383-387. (in Chinese)
[10] Shao, Q., Zhao, C., Han, N., & Wang, B. S. (2008). Cloning and expression pattern of sshkt1 encoding a putative cation transporter from halophyte suaeda salsa.DNASequencetheJournalofDNASequencing&Mapping, 19(2):106.
[11] Liu, S., Wang, H., Kebin, W. U., & Xiong, X. (2017). Cloning and bioinformatics analysis of gpdh in rapeseed.ActaAgriculturaeBoreali-Sinica, 32(2):109-116.
[12] 周兴文, 周银慧, 赵英, 等. 金花茶CnBCH基因cDNA全长克隆及生物信息学分析[J].分子植物育种, 2017, 15(1):77-83.
ZHOU Xing-wen, Zhou Yin-hui, Zhao Ying, et al. (2017). Cloning and Bioinformatics Analysis of the Full-length of cDNA Sequence ofCnBCHGene from Golden Camellia (Camellianitidisima) [J].MolecularPlantBreeding, 15(1):77-83. (in Chinese)
[13]路东晔, 贺玉娇, 金娜, 等. 沙柳SpsLAS基因克隆及分子生物信息学分析[J].分子植物育种, 2017, 15(2):483-491.
LU Dong-ye, He Yu-jiao, Jin Na, et al. (2017). Cloning and Bioinformatics Analysis ofSpsLASGene inSalixpsammophila[J].MolecularPlantBreeding, 15 (2):483-491. (in Chinese)
[14] 刘钢, 肖前谷, 段瑞君, 等. 北美海蓬子SbNHX1基因耐盐性及功能结构域分析[J].西北植物学报, 2009, 29(5):867-873.
LIU Gang, XIAO Qian-gu, DUAN Rui-jun, et al. (2009). Functional Domain and Salt-tolerance Analysis ofSbNHX1 Gene fromSalicorniabigeloviiTorr.[J]ActaBotBoreal, 29(5):867-873. (in Chinese)
[15] 刘倩, 高娅妮, 柳旭, 等. 植物对盐碱胁迫的响应机制研究进展[J].生态学报, 2017, 37(16):25-33.
LIU Qian, GAO Ya-ni, LIU Xu, et al. (2017). Review on the mechanisms of the response to salinity-alkalinity stress in plants [J].ActaEcologicaSinica, 37(16): 25-33.
[16] Chen, A. P., Wang, G. L., Qu, Z. L., Lu, C. X., Liu, N., & Wang, F., et al. (2007). Ectopic expression of thcyp1, a stress-responsive cyclophilin gene from thellungiella halophila, confers salt tolerance in fission yeast and tobacco cells.PlantCellReports, 26(2):237-245.
[17] 李焕勇, 杨秀艳, 唐晓倩, 等. 植物响应盐胁迫组学研究进展[J].西北植物学报, 2016, 36(12):2 548-2 557.
LI Huan-yong, YANG Xiu-yan, TANG Xiao-yan, et al. (2016). Omics Research Progress of Plant under Salt Stress [J].ActaBotBoreal, 36 (12): 2,548-2,557. (in Chinese)
[18] 林植芳, 刘楠. 活性氧调控植物生长发育的研究进展[J].植物学报, 2012, (47): 74-86.
LIN Zhi-fang, LIU Nan. (2012). Research Progress in the Control and Regulation of Plant Growth and Development by Reactive Oxygen Species [J].BulletinofBotany, 47(1): 74-86. (in Chinese)
[19] QIU Li-li, Zhao Qi, Zhang Yu-hong, et al. (2017). Research Advances in Stress-responsive Plant Plasma Membrane Proteomic [J].ChineseBulletinofBotany, 52(2): 128-147.
[20] 雍艳华, 张霞, 王绍明, 等. 新疆典型盐生植物营养器官盐分积累与生态化学计量特征[J].植物生态学报, 2016, 40(12): 1 267-1 275.
YONG Yan-hua, ZHANG Xia, WANG Shao-ming, et al. (2016). Salt accumulation in vegetative organs and ecological stoichiometry characteristics in typical halophytes in Xinjiang, China [J].ChineseJournalofPlantEcology, 40 (12): 1,267-1,275. (in Chinese)
[21] Nakashima, K., & Yamaguchi-Shinozaki, K. (2006). Regulons involved in osmotic stress-responsive and cold stress-responsive gene expression in plants.PhysiologiaPlantarum, 126(1): 62-71.
[22] Yoshimura, K., Miyao, K., Gaber, A., Takeda, T., Kanaboshi, H., & Miyasaka, H., et al. (2004). Enhancement of stress tolerance in transgenic tobacco plants overexpressing chlamydomonas glutathione peroxidase in chloroplasts or cytosol.PlantJournal, 37(1):21-33.
[23] Yoshimura K, Miyao K, Gaer A, Takeda T, Kanaboshi H, Miyasaka H,Shigeoka S. (2004) Enhancement of stress tolerance in transgenic tobacco Plants overexpressing Chlamydomonas glutathione peroxidase in chloroplasts or cytosol.PlantJournal, (37):21-33.
[24]Sunkar R, Bartels D, Kirch HH. (2003) Overexpression of a stress inducible aldehyde dehydrogenase gene from Arabidopsis thaliana in transgenic Plants improves stress tolerance.PlantJournal, (35):452-464.
Abstract:【Objective】 To clone a novelPsaHgene fromSalicorniaeuropaea, and analyze its biological information for better understanding its role in function of salt-tolerance.【Method】Salicorniaeuropaeawas used as the plant material to clone the full-length cDNA sequence ofSePsaHby RT-PCR. The encoding region and amino acid sequence ofPsaHgene, and the structure and function of protein encoded by protein were analyzed by NCBI, MEGA and Expasy and other online Bioinformatics bioinformatics software forSePsaHgene.【Result】 Full-length cDNA sequence encoding photosystem I reaction center subunit H was cloned fromSalicorniaeuropaeaand designated by the name ofSePsaH, which was an opening reading frame of 438bp encoding 145 amino acids. The putative protein molecular weight was 15.3kD and its theoretical isoelectric points was 9.84,SePsaHwas a hydrophilic protein; Phylogenetic analysis showed thatSePsaHgene andSpinaciaoleraceawere closely related; Through the conservative analysis of the protein, we found that there were 4 conserved domain structures.【Conclusion】SePsaHgene was cloned, which has laid the foundation for further study on the gene function and the role in salt-tolerance ofSalicorniaeuropaea.
Keywords:Salicorniaeuropaea; photosystem I reaction center subunit H; bioinformatics
CloningandBioinformaticsAnalysisofSalt-toleranceofPsaHGenefromSalicorniaeuropaea
HAO Xiao-yan, LI Jian-ping, Zumuremu Turxun, GAO Sheng-qi, HUANG Quan-sheng
(InstituteofNuclearandBiologicalTechnologies,XinjiangAcademyofAgriculturalSciences,Urumqi830091,China)
10.6048/j.issn.1001-4330.2017.09.006
S188
A
1001-4330(2017)09-1613-08
2017-07-18
新疆维吾尔自治区自然科学基金项目“碱蓬SsPSI基因提高转基因烟草耐旱性的研究”(2015211A028);新疆农业科学院优秀青年科技人才基金“盐生植物盐角草耐盐基因的发掘与功能研究”(xjnky-2012-003)
郝晓燕(1980-),女,新疆人,副研究员,硕士,研究方向为植物抗逆分子生物学,(E-mail)hxy29@126.com
黄全生(1964-),男,新疆乌鲁木齐人,研究员,博士,博士生导师,研究方向为作物耐逆分子生物学,(E-mail)hquansheng@126.com
Supported by: Natural Science Foundation of Xinjiang "Study on Improving Drought Resistance of Transgenic Tobacco by Suaeda Salsa SsPSI Gene" (2015211A028) and Outstanding Young Scientific Talent Foundation of Xinjaing Academy of Agricultural Sciences "Discovery and Function of Salt Tolerant Genes in Halophytes" (xjnky-2012-003)
Corresponding author:HUANG Quan-sheng(1964-),male, Urumqi, Xinjiang, Professor, supervisor, the main research directions for crop adversity molecular biology,(E-mail) hquansheng@126.com

