采用细胞质特异性定位的荧光探针观察细胞多核化现象
吴峰,刘建彬,胡泽斌
采用细胞质特异性定位的荧光探针观察细胞多核化现象
吴峰,刘建彬,胡泽斌
100142 北京,空军航空医学研究所(吴峰);100142 北京,空军总医院临床检验中心(刘建彬);100050 北京,中国食品药品检定研究院体外诊断试剂检定所(胡泽斌)
细胞多核化是指一个细胞的细胞质中同时存在两个或多个细胞核[1-5]。细胞多核化现象的产生通常是由于处于基因组复制中的细胞,其染色体运动发生异常,形成了不同大小的细胞核。这些大小不一的细胞核均被核膜包裹,对于比较小的细胞核,通常称为微核或核片段。细胞多核化现象既存在于病理状态的细胞,也可以存在于生理状态的细胞中。研究发现:细胞多核化现象与多种疾病相关。病理检验中发现多核化的巨型细胞的存在与慢性炎症有关[6-7]。另外,细胞多核化提示细胞染色体的不稳定,所以细胞多核化现象也频繁出现在肿瘤细胞中[8-9]。
目前细胞多核化现象的评估主要是采用细胞核染色的方法[1-2, 5]。对于固定好的细胞,细胞核染料,如吉姆萨、苏木精,可以将细胞核染色,细胞质基本没有着色,从而可以观察到细胞质中是否存在多个细胞核的现象。但是,这种方法观察到的细胞边缘往往模糊不清,难以判断几个细胞核是位于同一个细胞还是相邻细胞中。对于活细胞中多核化现象的观察,则通常采用细胞核荧光染料,如 DAPI、Hoechst,将活细胞细胞核染色。通过细胞核荧光染色的图片与明场中的细胞图像进行叠加,可以确定多个细胞核是否位于一个细胞内。缺点同样是明场中细胞的边界不是很清楚,边缘难以判断[9]。
细胞质特异性定位的荧光探针(cytoplasm localized fluorescent probe,CLFP)是指一类能够特异性聚积在活细胞细胞质中的荧光染料[1, 10-15]。将活细胞与 CLFP 探针进行孵育,在荧光显微镜下能够清晰地观察到细胞质的荧光形态以及细胞质的边缘形态。近年来,CLFP 探针已经被逐步地应用于各种细胞成像研究中。本研究中,我们根据文献设计合成新的 CLFP 探针,并且建立了通过荧光影像方法区分细胞多核化现象。
1 材料与方法
1.1 主要仪器和试剂
色谱用层析硅胶为青岛海洋化工厂产品,其余化学试剂和溶剂购自北京偶合科技有限公司和北京伊诺凯科技有限公司,均为市售分析纯产品。核磁共振仪为 Bruker AVANCEIII 400,中压纯化色谱仪为 Biotage Isolera One,高分辨质谱仪为 Thermo Exactive Orbitrap plus。细胞培养箱购自昆山一恒仪器有限公司。
1.2 方法
1.2.1 CLFP 探针的化学合成 根据文献报道,我们采用常用的荧光母核 Boron-dipyrromethene(BODIPY)设计了一系列细胞质特异性定位的荧光探针,其合成路线如图 1 所示[1, 16-18]。
1.2.1.1 中间体 3 的合成 2,4-二甲基吡咯 1(200 mg,2.1 mmol)被 30 ml 无水二氯甲烷溶解后,加入 4-氯甲基苯甲酰氯 2(200 mg,1.05 mmol),在氩气保护下室温搅拌10 min,之后加热至 50 ℃搅拌 2 h。冷却后真空蒸馏出大部分溶剂,向母液中加入 30 ml 无水甲苯和 5 ml 无水二氯甲烷,室温搅拌 10 min 后,加入三乙胺(505 mg,5 mmol)和三氟化硼乙醚溶液(760 mg,5 mmol),之后加热至 50 ℃搅拌 2 h。反应结束后,真空蒸馏出大部分溶剂,加入乙酸乙酯 300 ml,再用饱和 NaCl 溶液洗至中性,有机相用无水 Na2SO4进行干燥。之后通过中压纯化色谱仪分离出70 mg 中间体 3,收率 18%。

1 2 3 4 5
1.2.1.2 CLFP-1 的合成 将中间体 3(50 mg,0.13 mmol),Cs2CO3(87 mg,0.26 mmol)和 KI(45 mg,0.26 mmol)溶解于 30 ml 无水乙腈中,再加入正丁胺(95 mg,1.3 mmol),氩气保护下室温搅拌 10 min,再升温至 80 ℃搅拌 2 h。反应结束后,真空蒸馏出大部分溶剂,加入乙酸乙酯 200 ml,再用饱和 NaCl 溶液洗至中性,有机相用无水 Na2SO4进行干燥,之后通过中压纯化色谱仪分离出目标化合物。最后将产物经过氯化氢的二氯甲烷溶液制备成盐酸盐,得到 30 mg CLFP-1,收率 57%。
1.2.1.3 CLFP-2 的合成 将中间体 3(50 mg,0.13 mmol),Cs2CO3(87 mg,0.26 mmol)和 KI(45 mg,0.26 mmol)溶解于 30 ml 无水乙腈中,再加入戊胺(113 mg,1.3 mmol),氩气保护下室温搅拌 10 min,再升温至 80 ℃搅拌 2 h。反应结束后,真空蒸馏出大部分溶剂,加入乙酸乙酯 200 ml,再用饱和 NaCl 溶液洗至中性,有机相用无水 Na2SO4进行干燥,之后通过中压纯化色谱仪分离出目标化合物。最后将产物经过氯化氢的二氯甲烷溶液制备成盐酸盐,得到 48 mg CLFP-2,收率 80%。
1.2.2 CLFP 探针的细胞定位研究 将 HepG2 细胞接种于 24 孔细胞培养板中,当细胞覆盖了培养板的 50%。将上述合成的探针加入到培养基中至终浓度为 1.0 μmol/L。在 37 ℃细胞培养箱中孵育大约 20 min 后,用 PBS 缓冲液清洗没有吸收的荧光探针。在荧光显微镜下,采用蓝光激发,观察细胞中的绿色荧光。
1.2.3 多核化细胞模型的构建 将HepG2 细胞接种于 24 孔细胞培养板中,当细胞覆盖了培养板的 70%,在细胞培养基中加入 0.5 μmol/L 的紫杉醇,孵育过夜之后,即可以得到细胞多核化或细胞核片段化模型。
1.2.4 CLFP 探针观察多核化细胞模型的方法 将 CLFP 荧光探针加入含有多核化细胞的细胞培养基中至终浓度为 1 μmol/L,孵育 20 min。采用 PBS 缓冲液清洗培养基中没有吸收的染料,荧光显微镜下观察细胞多核化现象。
2 结果
2.1 CLFP 荧光探针的化学结构鉴定
基于荧光母核 BODIPY,我们设计合成了两个 CLFP 荧光探针,分别为CLFP-1(图 2)和CLFP-2(图 3)并且对其进行核磁共振(NMR)鉴定和高分辨质谱(HRMS)分析。

图 2 荧光探针CLFP-1
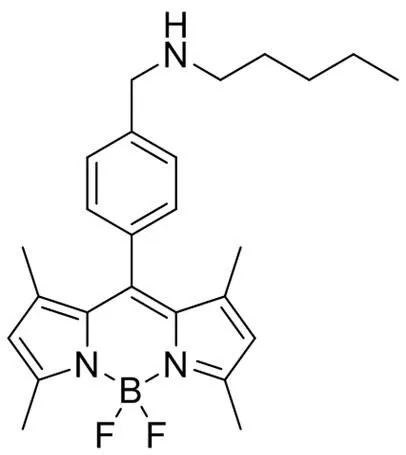
图 3 荧光探针CLFP-2
2.1.1 CLFP-1 的图谱信息1H-NMR(400MHz,CDCl3):= 0.91(t,3H),1.21(m,2H),1.41(s,6H),1.71(m,2H),2.45(s,6H),3.05(t,2H),4.30(s,2H),6.05(s,2H),7.42(d,= 8.0Hz,2H)7.68(d,= 8.0Hz,2H)。
13C-NMR(101MHz,CDCl3):= 12.40,13.12(2C),13.15(2C),19.44,27.63,50.34,60.08,120.99(2C),128.90(2C),130.78(2C),130.80,132.40(2C),136.23(2C),140.85,142.88,155.62(2C)。
HRMS(ESI):m/z [M + H] 计算所得 C25H31N3BF2:410.25806;检测得到:410.25736。
2.1.2 CLFP-2 的图谱信息1H-NMR(400 MHz,CDCl3):= 0.87(t,3H),1.29(br,10H),1.90(br,2H),2.55(br,6H),2.76(br,2H),4.29(br,2H),5.98(s,2H),7.39(d,= 8.0Hz,2H),7.82(d,= 8.0Hz,2H),10.10(br,NH-HCl,2H)。
13C-NMR(101 MHz,CDCl3):= 13.82,14.48,14.62,21.95,25.53,28.80,45.44(2C),49.87(2C),121.50(2C),129.21(2C),130.95(2C),131.06,131.16,136.56(2C),140.20,142.66(2C),155.95(2C)。
HRMS(ESI):m/z [M + H] 计算所得C25H33N3BF2:424.27301;检测得到:424.27234。
2.2 CLFP 荧光探针在 HepG2 细胞中的定位
将两个 CLFP 荧光探针(CLFP-1,CLFP-2)与培养的 HepG2 细胞进行共同孵育。荧光显微镜下观察到两个荧光探针均为细胞质特异性定位的探针,图像边缘清晰,对比度高,荧光强度适中(图 4)。我们在 BODIPY 荧光母核上增加脂溶性的基团所生成的 CLFP 探针更加有利于进入活细胞,并且成功地定位于细胞质中,而不进入细胞核中。由于两个探针在结构上非常相似(仅侧链有 1 个 CH2的差别),所以在细胞影像图像的清晰度和对比度上没有明显的差别。
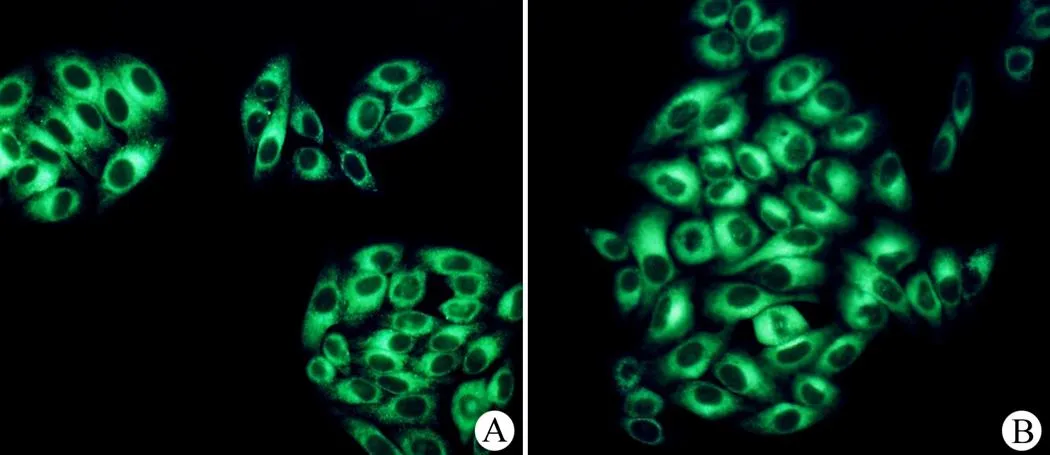
图 4 荧光探针 CLFP-1(A)和CLFP-2(B)在 HepG2 细胞中的定位(两个荧光探针均为细胞质特异性定位荧光探针,且能够提供清晰的荧光图像)

图 5 CLFP-1(A)和 CLFP-2(B)荧光探针显示紫杉醇处理的具有细胞多核化及细胞核片段化特征的 HepG2 细胞
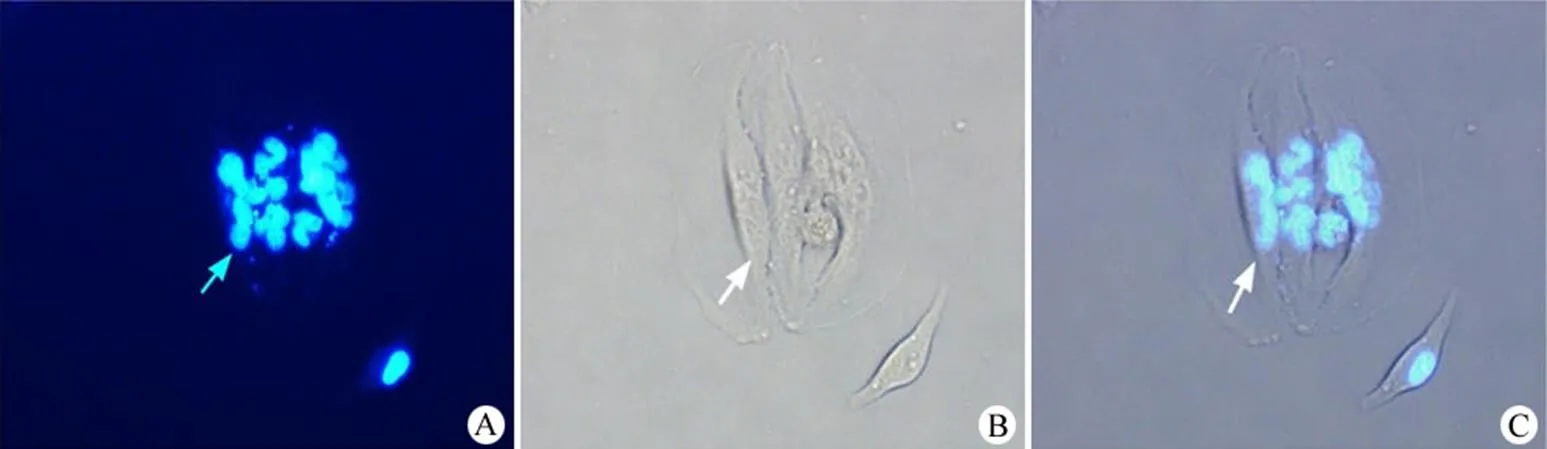
图 6 Hoechst 染色紫杉醇处理的具有细胞多核化及细胞核片段化特征的 HepG2 细胞(A:Hoechst 染色;B:可见光区域;C:图像叠加;图中箭头标示了一个多核化的细胞,但是这个细胞与其相邻细胞的边缘在明场照片中不是很清楚,合理评价细胞多核化受到影响)
2.3 CLFP 荧光探针呈现细胞多核化及细胞核片段化
CLFP-1,CLFP-2 均为较好的细胞质特异性定位荧光染料,能够特异性地定位于活细胞的细胞质中。接下来,我们采用 0.5 μmol/L 紫杉醇过夜处理了 HepG2 细胞,细胞的染色质在迁移的过程中受到了紫杉醇的抑制,抑制了 HepG2 细胞核的正常分裂,从而制备了经典的细胞多核化及细胞片段化的模型。经过荧光染料 CLFP 的染色,由于细胞核部分不发生荧光染色,显示为黑色的孔洞(图 5),所以,我们可以清楚地看到细胞质中细胞核数目。
同样,我们采用传统的细胞核染料 Hoechst 对经0.5 μmol/L 紫杉醇处理的多核化 HepG2 细胞进行染色。我们同时进行可见光的图像拍摄以及细胞核图像的拍摄,将两者进行叠加,可以观察到细胞多核化的现象(图 6)。但是,传统的方法,由于各个小细胞核片段具有荧光强度,在进行图像记录时,会互相影响小细胞核的边缘。另外,明场图像无法清晰地区分细胞核的边缘,对于细胞核片段的计数存在一定的缺陷。
3 讨论
异常的细胞分裂或融合会产生多核细胞,以及任何阻断细胞分裂进程的相关因素都可诱导细胞多核化,细胞多核化现象广泛地存在于生物医学研究中。然而,对于这一现象呈现与评估目前不是非常的方便,传统的评估方法是通过进行细胞核染色来确定细胞核是否存在于一个细胞中。不仅操作不方便,而且由于多核化细胞通常表现出细胞肥大的现象,且细胞边缘不易界定。这些都局限了传统细胞核染色来观察细胞多核化。发展新的实验技术来有效地评估细胞多核化非常有意义。
另外一方面,荧光探针已经可以特异性地染色活细胞中特定细胞器。CLFP 是一种特异性染色细胞质的荧光探针。CLFP 在各种细胞中的分布情况以及其光物理学的特性也已经有所报道了。运用 CLFP 进行细胞质染色,从而衬托细胞核的形状,用来研究细胞的多核化。这一方法的特点如下:
⑴ CLFP 方法操作简单,只需要进行探针与观察细胞共同孵育 20 min 左右,在荧光显微镜下即可观察。
⑵ CLFP 方法能够清晰显示各个细胞核的形状,尤其可以显现出细胞的轮廓。这就使得对于评估多个细胞核是否位于一个细胞内非常简便。
因此,CLFP 方法评估细胞多核化现象简便易行,图像分辨清晰,是生物医学研究细胞多核化现象的一个有价值的实验技术方法。
[1] Wen H, Cui Q, Meng H, et al. A high-resolution method to assess cell multinucleation with cytoplasm-localized fluorescent probes. Analyst, 2016, 141(13):4010-4013.
[2] Yu Y, Duan J, Geng W, et al. Aberrant cytokinesis and cell fusion result in multinucleation in HepG2 cells exposed to silica nanoparticles. Chem Res Toxicol, 2015, 28(3):490-500.
[3] Yoshida K, Obata S, Ono M, et al. TPA-induced multinucleation of a mesenchymal stem cell-like clone is mediated primarily by karyokinesis without cytokinesis, although cell-cell fusion also occurs. Eur J Cell Biol, 2007, 86(8):461-471.
[4] Shekhar MP, Lyakhovich A, Visscher DW, et al. Rad6 overexpression induces multinucleation, centrosome amplification, abnormal mitosis, aneuploidy, and transformation. Cancer Res, 2002, 62(7):2115-2124.
[5] Mukherjee A, Misra S, Howlett NG, et al. Multinucleation regulated by the Akt/PTEN signaling pathway is a survival strategy for HepG2 cells. Mutat Res, 2013, 755(2):135-140.
[6] Dean P, Kenny B. A bacterial encoded protein induces extreme multinucleation and cell-cell internalization in intestinal cells. Tissue Barriers, 2013, 1(1):e22639.
[7] Brown HM, Knowlton AE, Snavely E, et al. Multinucleation during C. trachomatis infections is caused by the contribution of two effector pathways. PLoS one, 2014, 9(6):e100763.
[8] Lewis JS Jr, Scantlebury JB, Luo J, et al. Tumor cell anaplasia and multinucleation are predictors of disease recurrence in oropharyngeal squamous cell carcinoma, including among just the human papillomavirus-related cancers. Am J Surg Pathol, 2012, 36(7):1036- 1046.
[9] Alvarez JV, Pan TC, Ruth J, et al. Par-4 downregulation promotes breast cancer recurrence by preventing multinucleation following targeted therapy. Cancer Cell, 2013, 24(1):30-44.
[10] Cunningham CW, Mukhopadhyay A, Lushington GH, et al. Uptake, distribution and diffusivity of reactive fluorophores in cells: implications toward target identification. Mol Pharm, 2010, 7(4): 1301-1310.
[11] Kowada T, Maeda H, Kikuchi K. BODIPY-based probes for the fluorescence imaging of biomolecules in living cells. Chem Soc Rev, 2015, 44(14):4953-4972.
[12] Yun SW, Kang NY, Park SJ, et al. Diversity oriented fluorescence library approach (DOFLA) for live cell imaging probe development. Acc Chem Res, 2014, 47(4):1277-1286.
[13] Sinkeldam RW, Greco NJ, Tor Y. Fluorescent analogs of biomolecular building blocks: design, properties, and applications. Chem Rev, 2010, 110(5):2579-2619.
[14] Lee JS, Kang NY, Kim YK, et al. Synthesis of a BODIPY library and its application to the development of live cell glucagon imaging probe. J Am Chem Soc, 2009, 131(29):10077-10082.
[15] Gonçalves MS. Fluorescent labeling of biomolecules with organic probes. Chem Rev, 2009, 109(1):190-212.
[16] Michel BW, Lippert AR, Chang CJ. A reaction-based fluorescent probe for selective imaging of carbon monoxide in living cells using a palladium-mediated carbonylation. J Am Chem Soc, 2012, 134(38): 15668-15671.
[17] Benniston AC, Copley G. Lighting the way ahead with boron dipyrromethene (Bodipy) dyes. Phys Chem Chem Phys, 2009, 11(21): 4124-4131.
[18] Kim E, Koh M, Ryu J, et al. Combinatorial discovery of full-color-tunable emissive fluorescent probes using a single core skeleton, 1,2-dihydropyrrolo[3,4-beta]indolizin-3-one. J Am Chem Soc, 2008, 130(37):12206-12207.
10.3969/j.issn.1673-713X.2017.05.013
国家自然科学基金(81472396)
胡泽斌,Email:huzbcmba@163.com
2017-06-06

