贵州烤烟糖苷类化学成分抗氧化活性及分离鉴定
丁根胜,葛永辉,杨 超,李永青,王承福,黄新民,黄正虹,杨盛刚,万里兴,惠建权,耿召良*
(1.贵州中烟工业有限责任公司,贵阳 550009;2.贵州省烟草科学研究院,贵阳 550081;3.云南中医学院,昆明 650500)
贵州烤烟糖苷类化学成分抗氧化活性及分离鉴定
丁根胜1,葛永辉2,杨 超1,李永青1,王承福3,黄新民1,黄正虹1,杨盛刚1,万里兴1,惠建权1,耿召良2*
(1.贵州中烟工业有限责任公司,贵阳 550009;2.贵州省烟草科学研究院,贵阳 550081;3.云南中医学院,昆明 650500)
为深入研究烟草糖苷类化学成分及其抗氧化活性,以贵州烤烟为材料,首先用有机溶剂甲醇回流提取和大孔树脂吸附法获得糖苷类化学成分粗提物,对糖苷粗提物不同溶剂萃取物的清除DPPH自由基活性进行研究,再应用反相色谱、凝胶色谱、半制备液相色谱及薄层层析等技术,对清除自由基活性最好的组分进行进一步分离纯化。结果表明,糖苷粗提物不同溶剂萃取物均表现一定的清除 DPPH自由基活性,其中乙酸乙酯部分活性最好。从乙酸乙酯部分分离获得了多个糖苷类单体,并利用核磁共振仪对其中4个单体结构进行了鉴定,分别为7,8-二氢-3-氧代-α-紫罗兰醇-β-D-吡喃葡萄糖苷(化合物1),3-氧代-α-紫罗兰醇-β-D-吡喃葡萄糖苷(化合物2),异嗪皮啶6-O-β-D-吡喃葡萄糖苷(化合物3),东莨菪苷(化合物4)。
烟草;糖苷;分离纯化;DPPH;结构鉴定
糖苷是烟草中重要的潜香物质[1-3],由单糖或低聚糖的半缩醛羟基和另一分子中的羟基、氨基、硫羟基等失水而产生的化合物。烟草糖苷不具有明显的挥发性和香味特征,但在经过高温加热或燃烧时释放香气香味,是影响烟叶香气的重要因素[4-8]。因分离难度大,难以获得单体化合物,烟草中糖苷类物质一直是研究的重点和难点。从烟草中分离鉴定糖苷类香气前体的工作已经开展了一些,主要集中在20世纪70年代中期至80年代初,其单体结构的分离鉴定也为烟草香气的形成机理提供了新见解。此外,在多种植物化学成分的研究中,很早就发现糖苷类成分具有较好的体外抗氧化活性[9-12],但烟草糖苷类成分的抗氧化活性鲜有研究。确定烟草糖苷类等成分的清除自由基能力和抗氧化活性,对于降低卷烟的危害性具有一定的现实意义。本研究采用天然产物分离方法,通过测定烟草粗糖苷不同极性萃取物对1,1-二苯基-2-三硝基苯肼(DPPH)的清除能力来评估其抗氧化活性,并对活性较好部分进行系统分离鉴定,为烟草糖苷抗氧化活性研究及烟草综合开发利用提供依据。
1 材料与方法
1.1 仪器与材料
Inova400核磁共振仪,TMS内标;ESI-MS由Waters Xevo-QTOF质谱仪测定;柱色谱硅胶和薄层色谱硅胶(青岛海洋化工厂);反相材料 RP-18(40~63 μm)(Merck);Amberlite XAD-2 大孔吸附树脂(Sigma);凝胶柱填料为 Sephadex LH-20(25~100 μm)(Amersham Biosciences);半制备液相色谱(Waters 1525型),流动相为甲醇:去离子水; UV-2501PC紫外可见分光光度计(日本SHIMADZU);XT-4双目显微熔点测定仪(北京泰克仪器有限公司);化学试剂均为分析纯,半制备系统采用色谱纯级别(Merck);糖苷显色剂为5% α-萘酚甲醇溶液;维生素C(VC,天津市大茂化学试剂厂);DPPH(上海麦克林公司)。烟叶材料:烟叶均为贵州产区烤烟。
1.2 方法
1.2.1 提取样品的制备 取烤烟烟叶2.2 kg,粉碎至20~40目,加入3倍重量的95%乙醇溶液,加热回流提取3次,每次4 h,合并提取液后浓缩蒸干,加适量甲醇溶解,趁热抽滤得到深红色液体,滤液再次减压浓缩,得浸膏436 g。浸膏加水悬浊,用石油醚多次萃取,合并萃取液并减压浓缩,得石油醚萃取层27.25 g,计算得率为6.25%。再依次用乙酸乙酯、正丁醇萃取,得乙酸乙酯萃取层28.14 g和正丁醇萃取层 70.85 g,得率依次为 6.45%和16.25%,收集水层。
1.2.2 粗糖苷成分的富集及检测 乙酸乙酯部分溶液通过Amberlite XAD-2大孔树脂柱,依次用去离子水和不同浓度乙醇水溶剂逐级洗脱,收集中间段洗脱物,减压蒸干,通过薄层层析(TLC)检测,经α-萘酚浓硫酸溶液喷洒后加热显色反应,检测出含有糖苷成分的粗分段组分,合并相似组分得糖苷类粗成分。
1.2.3 抗氧化活性研究 抗氧化活性检测参考文献[13]方法。(1)DPPH储备液的配制:准确称取1,1-二苯基-2-三硝基苯肼(DPPH)0.078 g,用无水乙醇溶解定容至100 mL棕色容量瓶中,摇匀,得浓度为2.0 mmol/L母液,4 ℃保存备用。(2)VC溶液的配制:准确称取 VC 0.25 g,水溶解得母液浓度2.5mg/mL,分别取母液 0.01、0.02、0.03、0.05、0.08、0.10和0.15 mL定容至25 mL容量瓶中,得浓度梯度 0.001、0.002、0.003、0.005、0.008、0.010和 0.015 mg/L溶液,室温放置备用。(3)供试品溶液配制:将各萃取层浸膏用无水乙醇溶解,按一定浓度梯度依次稀释备用。(4)自由基清除率测定方法:参照文献[13]方法,取2 mL不同浓度供试品溶液与2 mL浓度为0.2 mmol/L DPPH溶液加入比色管中,混匀后室温避光放置30 min,于517 nm处测定吸光度值(A值),平行测定3次,以VC为阳性对照。利用DPPH溶液的特征紫红色基团的吸收,用紫外-可见分光光度法测定反应后的供试溶液在517 nm吸收的下降程度,表示其对有机自由基的清除能力。按照公式和回归方程分别计算自由基清除率和半数清除率(IC50)。
DPPH清除率=1-(Ai-Aj)/A0
Ai为样品+DPPH吸光度的平均值;Aj为样品溶液吸光度的平均值;A0为DPPH吸光度的平均值。
1.2.4 化合物分离与富集 取烟草乙醇提取物中乙酸乙酯萃取段浸膏(28.14 g)用Amberlite XAD-2大孔树脂柱色谱粗分,经水-乙醇(1∶0~0∶1,V∶V)梯度洗脱,TLC检测分段为9个部分(Fr.1~9),将其中的Fr.2段通过凝胶柱(LH-20)层析后,进样至半制备色谱系统中进行分离,在流动相为37%甲醇-水溶剂条件下,保留时间为12 min时获得化合物1(34 mg);Fr.5段通过RP-18反相硅胶柱层析,流动相为甲醇-水(1∶9~10∶0,V∶V),通过TLC检测合并后分段为6段(PE.1~6),其中PE.3部分经过凝胶柱(LH-20)层析后,经过HPLC系统分离,在37%乙腈-水流动相条件下,在保留时间为12 min和14 min分别获得化合物2(36 mg)和3(41 mg);Fr.6段通过正相硅胶柱层析(流动相为石油醚-丙酮5∶1,V∶V)后,TLC检测含有糖苷类物质的样品段,进样至半制备色谱系统中进行分离,在流动相为19%乙腈-水溶剂条件下,保留时间为9 min时获得化合物4(24 mg)。
1.2.5 结构鉴定 分别采用电喷雾质谱(ESI/MS)和核磁共振(1H NMR和13C NMR)对分离产物进行结构鉴定。1H NMR的核磁共振频率为400 MHz,13C NMR的核磁共振频率为100 MHz,以DMSO-d6为溶剂,四甲基硅烷(TMS)为内标。
2 结 果
2.1 烤烟粗提物不同萃取层抗氧化活性
以样品溶液质量浓度为横坐标,DPPH自由基清除率为纵坐标,绘制曲线如图1,并计算IC50值(表1)。
抗氧化活性测定结果表明(图1),烟叶浸膏不同极性溶剂萃取层均具有一定抗氧化活性,抗氧化活性由强到弱为:乙酸乙酯萃取层>正丁醇萃取层>水层>石油醚萃取层。其 IC50值由大到小为:石油醚萃取层>水层>正丁醇萃取层>乙酸乙酯萃取层。IC50值越小说明其抗氧化性越强,后续单体化合物分离试验选取抗氧化活性最好的乙酸乙酯萃取层为材料进行活性物质的分离纯化。
2.2 糖苷成分结构鉴定
经柱层析及半制备色谱系统分离,从烟草乙醇提取物中乙酸乙酯萃取段浸膏获得多个糖苷单体化合物,对其中4个单体进行结构解析。结果表明,化合物 1:白色粉末(甲醇:水溶剂),mp.375~378 ℃。TOF-MS FD+:m/z (%):372,分子式为C19H32O7。不饱和度为5。易溶于甲醇、乙醇、乙酸乙酯,不溶于石油醚、乙醚。α-萘酚-浓硫酸溶液喷洒后加热显色反应呈紫红色斑点。1HNMR [MeOD,400 MHz]:δH5.80(1H,s,H-4),5.71(1H,dd,J=16,6.4Hz,H-7),5.67(1H,d,J=16,6.4Hz,H-8),4.29(1H,d,H-2'),4.19(1 H,d,J=7.6 Hz,H-1’),3.60(2H,m,H-6'),3.12(1H,m,H-9),3.10-3.01(3H,m,H-4',H-S',H-3'),2.62(1H,dd,J=8.8 Hz,H-6),2.38(1H,s,H-2),2.07(1H,s,H-2),1.85(3H,s,H-10),1.20(3H,d,J=6.4 Hz,H-13),0.95(6H,dd,J=15.2 Hz,H-11,H-12);13CNMR[MeOD,100 MHz]:δC20.2(CH3,C-13),22.4(CH3,C-10),26.3(CH3,C-11),26.9(CH3,C-12),35.1(C-1),46.7(CH2,C-2),53.9(CH,C-6),60.6(CH2,C-6'),69.3(CH,C-4'),73.1(CH,C-3'),74.1(CH,C-2'),76.2(CH,C-9),76.3(C-3),100.3(CH,C-1'),123.8(CH,C-4),126.6(CH,C-8),136.1(CH,C-7),169.7(C-5),200.6(C=O,C-3)。
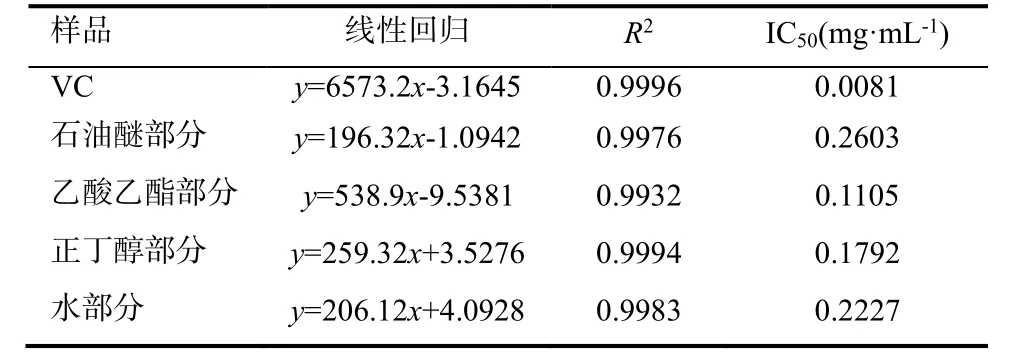
表1 各烤烟粗提样品对DPPH自由基的IC50检测结果Table 1 Scavenging IC50 of each sample on DPPH free radical
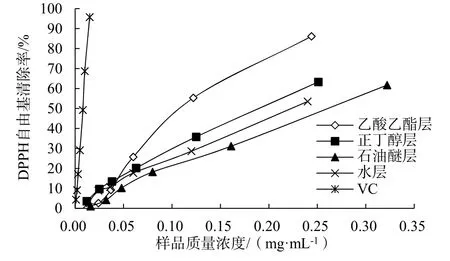
图1 各样品对DPPH自由基清除力随质量浓度变化曲线Fig. 1 DPPH scavenging curves of each sample with change of concentrations
以上数据与文献报道的 7,8-dihyd-3-oxo-αionol-β-D-glucopyranoside 基本一致[14],可以判断该化合物为 7,8-二氢-3-氧代-α-紫罗兰醇-β-D-吡喃葡萄糖苷,其结构式如图2。
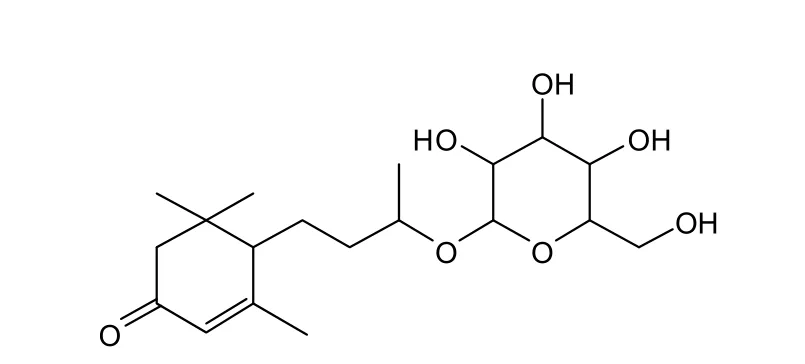
图2 化合物1的化学式结构Fig. 2 The structure of compound 1
化合物2,白色粉末(丙酮溶剂),mp. 398~402℃。TOF-MS FD+:m/z(%): 370,分子式为C19H30O7,不饱和度为 5。易溶于甲醇、乙醇、丙酮,不溶于石油醚、乙醚。α-萘酚-浓硫酸溶液喷洒后加热显色反应呈紫红色斑点。1HNMR [MeOD,400 MHz]:δH5.73(1H,s,H-4),5.62(1H,d,J=16,6.4Hz,H-7),5.54(1H,d,J=16,6.4Hz,H-8),4.18(1H,d,H-2’),4.19(1H,d,J=7.6Hz,H-1’),3.60(2H,m,H-6’),3.12(1H,m,H-9),3.10-3.01(3H,m,H-4’,H-5’,H-3’),2.62(1H,d,J=8.8Hz,H-6),2.38(1H,s,H-2),2.07(1H,s,H-2),1.85(3H,s,H-10),1.20(3H,dd,J=6.4Hz,H-13),0.95(6H,dd,J=15.2Hz,H-11,H-12);13CNMR[MeOD,100MHz]:δC20.3(CH3,C-13),22.2(CH3,C-10),26.1(CH3,C-11),26.8(CH3,C-12),35.2(C-1),46.5(CH2,C-2),54.0(CH,C-6),60.2(CH2,C-6’),69.3(CH,C-4’),73.0(CH,C-3’),74.1(CH,C-2’),76.3(CH,C-9),76.2(C-3),100.1(CH,C-1’),123.7(CH,C-4),126.6(CH,C-8),136.1(CH,C-7),161.5(C-5),197.0(C=O,C-3)。
以上数据与文献报道的 3-oxo-α-ionol-β-D-glucopyranosid基本一致[14-16],可以判断该化合物为3-氧代-α-紫罗兰醇-β-D-吡喃葡萄糖苷。其结构式如图3。
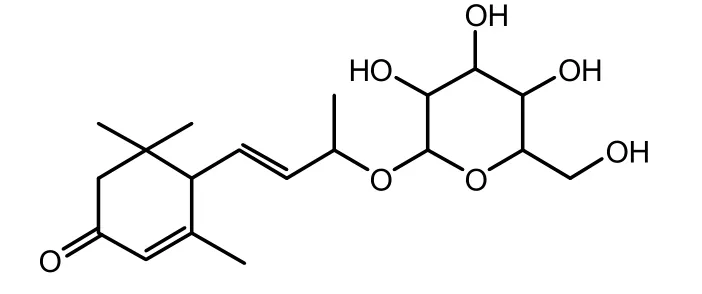
图3 化合物2的化学式结构Fig. 3 The structure of compound 2
化合物3,白色粉末(甲醇溶剂),mp.267~270℃。TOF-MS FD+:m/z(%): 370,分子式为C16H18O10,不饱和度为 9。易溶于甲醇、乙醇,不溶于石油醚、乙醚、氯仿。α-萘酚-浓硫酸溶液喷洒后加热显色反应呈紫红色斑点。1HNMR [MeOD,400 MHz]: δH7.81(1H,d,J=3.9Hz,H-4),7.22(1H,d,H-8),6.93(1 H,d,J=4.2 Hz,H-3),6.29(1H,d,J=9.8 Hz,H-9),5.19(1H,d,J=5.8Hz,H-1'),3.40(1H,d,J=9.2Hz,H-6'),1.26(3H,s,7-OMe);13CNMR[MeOD,100 MHz]:δC56.1(C-OMe),60.2(CH2,C-6'),69.2(CH,C-4'),72.3(CH,C-2'),74.9(CH,C-3'),75.8(CH,C-5'),99.0(CH,C-1'),99.1(C-10),103.4(CH,C-8),108.9(CH,C-3),113.0(C-6),149.9(C-4),145.0(C-5),148.2(C-7),164.3(C-9),170.3(C=O,C-2)。
以上数据与文献报道的 Isofraxetin 6-O-β-D-glucopyranoside基本一致[15],可以判断该化合物为异嗪皮啶6-O-β-D-吡喃葡萄糖苷。其结构式如图4。
化合物 4,白色粉末(甲醇溶剂),mp.232~236 ℃。TOF-MS FD+: m/z(%): 354,分子式为C16H18O9,不饱和度为 9。易溶于甲醇、乙醇,不溶于石油醚、乙醚、氯仿。α-萘酚-浓硫酸溶液喷洒后加热显色反应呈紫红色斑点。1HNMR [MeOD,400 MHz]:δH3.69(1H,s,6-OMe),4.13(1H,m,H-5'),4.40(1 H,m,H-4'),4.30(1H,m,H-2'),4.41(1H,m,H-3'),4.31(1H,m,H-6a'),4.52(1H,d,J=2.2 Hz,H-6b'),5.88(1H,d,J=7.2 Hz,H-1’),6.39(1H,d,J=9.6 Hz,H-3),7.11(1H,s,H-5),7.59(1H,s,H-8),7.63(1H,d,J=9.6 Hz,H-4);13CNMR [MeOD,100 MHz]:δC57.0(6-OMe),64.2(CH2,C-6'),71.9(CH,C-4'),74.9(CH,C-2'),79.2(CH,C-3'),80.0(CH,C-5'),102.9(CH,C-1'),105.2(CH,C-8),110.8(CH,C-5),112.8(CH,C-10),115.1(CH,C-3),144.8(CH,C-4),148.1(CH,C-6),150.9(CH,C-9),152.2(CH,C-7),162.5(C=O,C-2)。
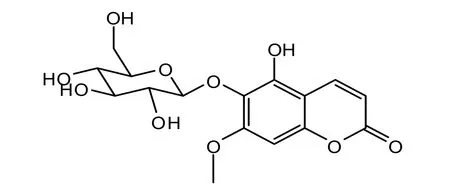
图4 化合物3的化学式结构Fig. 4 The structure of compound 3
以上数据与文献报道的 Scopolin基本一致[15,17],可以判断该化合物为东莨菪苷。其结构式如图5。
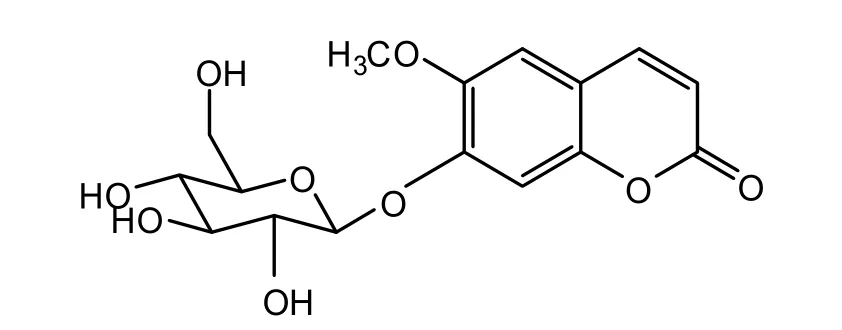
图5 化合物4的化学式结构Fig. 5 The structure of compound 4
3 讨 论
以贵州烤烟为材料提取获得烤烟浸膏,通过大孔树脂吸附法获得糖苷类化学成分粗提物,再通过不同极性有机溶剂分级分离,对烤烟糖苷粗提物不同溶剂萃取物进行清除DPPH自由基活性研究。结果表明,糖苷粗提物不同溶剂萃取物均表现一定的清除DPPH自由基活性,其中乙酸乙酯部分活性最好。应用反相色谱、凝胶色谱、半制备液相色谱及薄层层析等技术,对烤烟糖苷粗提物的乙酸乙酯部分进一步分离纯化,获得了多个糖苷类单体。利用核磁共振仪对其中4个单体结构进行了鉴定,分别为:7,8-二氢-3-氧代-α-紫罗兰醇-β-D-吡喃葡萄糖苷(化合物 1),3-氧代-α-紫罗兰醇-β-D-吡喃葡萄糖苷(化合物 2),异嗪皮啶 6-O-β-D-吡喃葡萄糖苷(化合物3),东莨菪苷(化合物4)。
吸烟过量有害健康,可引起人体呼吸道等部位的损伤,但流行病学研究报告也显示,吸烟可降低老年痴呆症(Alzheimer 's disease,AD)和帕金森氏综合症(Parkinson 's disease,PD)的发病率,这可能与发现的烟草尼古丁清除活性氧自由基活性有关[18]。此外,烟草中还含有黄酮类、香豆类和单宁类等多种化学成分,而这些化合物已经被证明具有较好的抗氧化性和降低自由基活性的功能[19]。本研究采用 DPPH法测定烟草糖苷类物质抗氧化能力,结果显示烟草糖苷提取物各萃取层均具有不同程度的抗氧化活性,并对抗氧化活性较好的乙酸乙酯萃取层进行了系统分离。在分离的多个化合物单体中,首先鉴定了4个糖苷类化合物,其中化合物3和4是具有多酚单元的糖苷,可能是烤烟糖苷粗提物具有抗氧化活性的物质基础之一。同时,3-氧代-α-紫罗兰醇-β-D-吡喃葡萄糖苷为具有良好加香作用的紫罗兰醇类[20]。研究结果证明了烟草糖苷类化学成分的抗氧化活性,为开展系统的烟草糖苷单体抗氧化活性研究及烟草综合开发利用提供了依据。
[1] GREEN C R,COBLY D A,COOPER P J,et al. Advances in analytical methodology of leaf and smoke[J]. Recent Advances in Tobacco Science, 1980(6): 123-183.
[2] HECKMAN R A,DULE M F, RIVER L D. The role of tobacco leaf precursors in cigarette flavor[J]. Recent Advances in Tobacco Science, 1981(7): 107-53.
[3] KAPFER G F, NITZ S, DRAWERT F. Bound aroma compounds in tobacco smoke condensate[J]. European Food Research and Technology, 1989, 188(6): 512-516.
[4] 史宏志,刘国顺. 烟草香味学[M]. 北京:中国农业出版社,1998:45-50.
[5] 刘百战,宗若雯,岳勇,等. 国内外部分白肋烟香味成分的对比分析[J]. 中国烟草学报,2000,6(2):l-5.
[6] 刘百战,徐玉田,孙哲建,等. 加料前后烟草中游离及糖苷结合态香味成分的分析研究[J]. 中国烟草学报,1998,4(1):1-8.
[7] 田振峰,瞿先中,方鼎,等. 烟叶调制过程中糖苷类香味前体的含量变化研究[C]//中国烟草学会工业专业委员会烟草化学学术研讨会论文集,2005.
[8] SHA Y F, DENG C H, LIU B Z. Development of C18-functionalized magnetic silica nanoparticles as samplepreparation technique for the determination of ergosterol in cigarettes by microwave-assisted derivatization and gas chromatography/mass spectrometry[J]. Journal of chromatography A, 2008, 1198-1199(1):27-33.
[9] 徐贵华,叶兴乾,徐国能,等. 微波处理对胡柚皮酚酸、黄烷酮糖苷含量及抗氧化性的影响[J]. 中国食品学报,2007,5(7):69-74.
[10] 汪艳丽,余燕影,曹树稳. 水飞蓟宾乳糖苷的合成、表征及抗氧化活性研究[J]. 天然产物研究与开发,2013,25(2):161-165.
[11] 邵菊芳,金黄涛,朱红威,等. 银杏黄酮糖苷醇提工艺参数优化及体外抗氧化研究[J]. 中国矿业大学学报,2013,42(4):663-669.
[12] 李爽,郑毅男,韩佳彤,等. 发酵处理对毛豆异黄酮苷元含量及其乙醇提取物抗氧化活性的影响[J]. 西北农林科技大学学报(自然科学版),2016,44(7):202-208.
[13] LEE Y L, YANG J H, MAU J L. Antioxidant properties of water extracts from Monascus fermented soybeans[J].Food chemisty, 2008, 106(3): 1127-1137.
[14] 王燕,刘志华,刘春波,等. 烟草中两种紫罗兰醇葡萄糖苷衍生物的分离鉴定及热分析研究[J]. 分析测试学报,2012,31(1):22-28.
[15] 王燕. 烟草糖甙类化合物的研究[D]. 昆明:昆明理工大学,2011.
[16] 陈振玲,张浩博,周宛虹,等. 烟草中3-氧代-α-紫罗兰醇-β-D-吡喃葡萄糖苷的分离鉴定及其热解产物分析[J]. 烟草科技,2008(7):28-31.
[17] LI Z L, LI X, LI D Y, et al. A new coumarin glycoside from the husks of Xanthocerassorbifolia [J]. Fitoterapia,2007, 78(7-8): 605-606.
[18] 赵保路. 尼古丁预防帕金森氏综合症和老年痴呆症的分子机理研究[J]. 生理物理学报,2007,23(2):82-92.
[19] HIRAMOTO K, OJIMA N, SAKO K, et al. Effect of plant phenolics on the formation of the spin-adduct of hydroxyl[J]. Biological & pharmaceutical bulletin, 1996, 19: 558-563.
[20] TEH C H, MORITA H, SHIROTA O, et al. 2,3-Dehydro-4α-Hydroxyl Ongilactone, a novel quassinoid and two known phenyl propanoids from Rurycomalongifolia Jack[J]. Food chemistry, 2010, 120(3): 794-798.
Antioxidant Activity and Active Component Identification of Glycosides from Leaves of Guizhou Flue-cured Tobacco
DING Gensheng1, GE Yonghui2, YANG Chao1, LI Yongqing1, WANG Chengfu3, HUANG Xinmin1,HUANG Zhenghong1, YANG Shenggang1, WAN Lixing1, HUI Jianquan1, GENG Zhaoliang2*
(1. China Tobacco Guizhou Industrial Co., Ltd., Guiyang 550009, China; 2.Guizhou Tobacco Science Research Institute, Guiyang 550081, China; 3.Yunnan University of Traditional Chinese Medicine, Kunming 650500, China)
To explore the chemical constituents of tobacco glycosides and their antioxidant activities, crude glycoside extracts from Guizhou flue-cured tobacco leaves were obtained by methanol-reflux and macroporous resin adsorption. DPPH radical-scavenging activities of different extracts of crude glycoside were investigated. Further separation and purification of ethyl acetate fractions were processed through reversed phase chromatography, gel chromatography, preparative liquid chromatography and thin layer chromatography. The results showed that, each crude glycoside extract showed certain DPPH radical-scavenging activities, in which the ethyl acetate fraction exhibited the best activity. Multiple monomeric compounds were isolated from the ethyl acetate fraction, and four glycoside chemical compounds were identified by NMR. The four monomers are 7,8-dihyd-3-oxo-α-ionol-β-D-glucopyranoside(1), 3-oxo-α-ionol-β-D-glucopyranosid (2), 6-O-β-D-glucopyranosid(3) and O-β-D- glucopyranosid(4).
flue-cured tobacco; glycoside; separation and purification; DPPH; structure identification
TS41+1
1007-5119(2017)05-0087-06 DOI:10.13496/j.issn.1007-5119.2017.05.015
中国烟草总公司贵州省公司重点科技计划项目“贵州烟叶中性致香物质研究”(2013-07);贵州中烟工业有限责任公司科技项目“贵州烟叶本源香提取物在卷烟配方中的应用研究”(GZZY/KJ/JS/2015CY014-1)
丁根胜(1982-),男,硕士,农艺师,主要从事卷烟产品研发与维护。E-mail:20020004@163.com*通信作者,E-mail:zhaolianggeng1104@126.com
2017-05-12
2017-09-06

