壳聚糖改性对磁性Fe3O4吸附去除Pb(Ⅱ)和Cd(Ⅱ)的影响研究*
商 娟 赵 军
(1.河海大学文天学院土木工程系,安徽 马鞍山 243000; 2.同济大学环境科学与工程学院,长江水环境教育部重点实验室,上海 200092)
壳聚糖改性对磁性Fe3O4吸附去除Pb(Ⅱ)和Cd(Ⅱ)的影响研究*
商 娟1赵 军2#
(1.河海大学文天学院土木工程系,安徽 马鞍山 243000; 2.同济大学环境科学与工程学院,长江水环境教育部重点实验室,上海 200092)
利用壳聚糖改性磁性Fe3O4以提高其对重金属Pb(Ⅱ)和Cd(Ⅱ)的吸附性能,考察了改性前后磁性Fe3O4对Pb(Ⅱ)、Cd(Ⅱ)的吸附等温线及吸附动力学过程。结果表明,经壳聚糖改性后,壳聚糖-磁性Fe3O4比表面积大幅增加,由原来的76.12m2/g增加到142.67m2/g;壳聚糖-磁性Fe3O4对Pb(Ⅱ)、Cd(Ⅱ)的吸附性能优于磁性Fe3O4;当pH为2.0~7.0时,提高pH有助于促进两种磁性材料对Pb(Ⅱ)和Cd(Ⅱ)的吸附量;两种磁性材料对Pb(Ⅱ)和Cd(Ⅱ)的吸附符合准二级动力学模型,吸附过程属于吸热过程;重复吸附—脱附循环再生5次后,壳聚糖-磁性Fe3O4对Pb(Ⅱ)、Cd(Ⅱ)的去除率仍在80%以上,磁性Fe3O4对Pb(Ⅱ)、Cd(Ⅱ)的去除率在75%以上,两种磁性材料再生性能较好。
Fe3O4磁性材料 吸附 壳聚糖 重金属
Abstract: In this paper,the chitosan was employed to modify the surface structure of synthesized magnetic Fe3O4in order to enhance its adsorption capacity towards heavy metals Pb(Ⅱ) and Cd(Ⅱ). The adsorption isotherms and adsorption kinetics of magnetic Fe3O4and chitosan-magnetic Fe3O4for Pb(Ⅱ) and Cd(Ⅱ) was investigated and compared. The results showed that the surface area of magnetic Fe3O4increased from 76.12 m2/g to 142.67 m2/g after chitosan modification. The adsorption properties of chitosan-magnetic Fe3O4on Pb(Ⅱ) and Cd(Ⅱ) were better than those of magnetic Fe3O4. When pH ranged 2.0-7.0,increasing pH would promote the adsorption quantity of two magnetic materials on Pb(Ⅱ) and Cd(Ⅱ). The adsorption of Pb(Ⅱ) and Cd(Ⅱ) by two magnetic materials conformed to the quasi two order kinetic model,and the adsorption process belonged to endothermic process. After regeneration for 5 times,Pb(Ⅱ) and Cd(Ⅱ) removal rate of chitosan-magnetic Fe3O4was still more than 80%,and that of magnetic Fe3O4was more than 75%,showing the better regeneration performance of two magnetic materials.
Keywords: Fe3O4; magnetic material; adsorption; chitosan; heavy metals
磁性材料具有经济高效、易于回收、吸附性能好、容易分离和再生等优点,可用于去除环境中的重金属[1-3]。ZHANG等[4]将Fe2+和H2O2置于十二烷基硫酸钠溶液中,在3种温度下焙烧得到分离较好的磁性Fe3O4;ZHONG等[5]以乙二醇为反应溶剂、尿素为水解剂,在195 ℃下制得磁性Fe3O4。上述制得的磁性Fe3O4对于重金属的吸附容量较低,在处理重金属含量较高的工业废水时所需成本较高,因此需要在其表面进行改性,提高其对重金属的吸附容量。
壳聚糖是一种由几丁质在碱性条件下发生脱乙酰作用产生的天然多糖,具有较好的亲水性、无毒性及可生物降解性[6-7]。壳聚糖分子有较多的氨基和羟基,能较方便地负载在磁性材料表面,且能通过这些基团固定重金属。LIU等[8]将壳聚糖负载在纳米零价铁表面并用其处理电镀废水,对电镀废水中Cu(Ⅱ)、Cd(Ⅱ)、Pb(Ⅱ)的去除率均达89%以上。然而纳米零价铁容易被氧化,释放到水溶液中易发生氧化还原反应。因此,本研究在磁性Fe3O4上引入壳聚糖分子制得壳聚糖-磁性Fe3O4,分析两种磁性材料对于重金属Pb(Ⅱ)、Cd(Ⅱ)的吸附情况。
1 材料与方法
1.1 试 剂
FeCl3·6H2O、尿素、乙醇、乙二醇、四丁基溴化铵和壳聚糖均为分析纯;Pb(NO3)2、Cd(NO3)2、浓盐酸、醋酸、纤维素、NaNO3和氢氧化钠均为普通市售产品,纯度能满足试验要求。试验中使用的水均为去离子水。
1.2 磁性Fe3O4的制备
分别称取1.2 g FeCl3·6H2O、2.7 g尿素和7.2 g四丁基溴化铵,置于装有180 mL乙二醇的圆底烧瓶中,在200 ℃下磁力搅拌均匀,溶解60 min。待圆底烧瓶温度冷却至室温后静置15 min,弃上清液,收集烧瓶中的沉淀。经乙醇清洗3次后再用去离子水清洗4次,最后置于60 ℃恒温烘箱中干燥,制得磁性Fe3O4,收集备用。
1.3 壳聚糖-磁性Fe3O4的制备
称取2.0 g壳聚糖并溶解于100 mL质量分数为1%的醋酸溶液中,待完全溶解后加入1.0 g纤维素粉末,在磁力搅拌器上搅拌2 h使其溶解均匀。将1.0 g制得的磁性Fe3O4加入到醋酸混合液中,逐滴加入2 mol/L的氢氧化钠溶液10 mL,不断搅拌,经过24 h硬化后得到壳聚糖-磁性Fe3O4,用去离子水清洗4次,60 ℃下烘干、备用。
1.4 材料表征
采用扫描电子显微镜(SEM)和透射电子显微镜(TEM)观察法观察磁性Fe3O4及壳聚糖-磁性Fe3O4的表面形态结构;采用傅立叶变换红外光谱(FTIR)法对两种材料进行结构表征分析;利用N2吸附脱附曲线BET法测定两种材料的比表面积;采用元素分析仪法对两种材料中的元素进行定量分析;利用Zeta电位仪法测定两种材料的等电点。
1.5 吸附试验
1.5.1 pH的影响
分别以磁性Fe3O4及壳聚糖-磁性Fe3O4为吸附剂处理含Pb(Ⅱ)、Cd(Ⅱ)的溶液,具体方法如下:取0.05 g吸附剂分别加入到50 mL初始质量浓度均为50.0 mg/L的Pb(Ⅱ)、Cd(Ⅱ)标准溶液中,用0.1 mol/L的盐酸和氢氧化钠调节溶液pH为2.0、3.0、4.0、5.0、6.0、7.0。为接近环境条件,利用NaNO3将溶液的离子强度调节为0.01 mol/L。室温下吸附反应12 h,吸附结束后磁选分离吸附剂,测定吸附剂对Pb(Ⅱ)、Cd(Ⅱ)的吸附量。
1.5.2 等温吸附试验
向150 mL锥形瓶中分别加入50 mL不同初始质量浓度(0.5、1.0、5.0、10.0、20.0、30.0、40.0、50.0、60.0 mg/L)的Pb(Ⅱ)、Cd(Ⅱ)标准溶液,加入0.05 g吸附剂进行混合。参考1.5.1节调节溶液pH为5.0,离子强度为0.01 mol/L。将锥形瓶封口并转移到恒温振荡箱中开始吸附试验,控制恒温振荡箱温度分别为25、35、45 ℃。设定吸附时间为12 h,吸附结束后磁选分离吸附剂,测定吸附剂对Pb(Ⅱ)、Cd(Ⅱ)的吸附量。
1.5.3 动力学分析
向150 mL锥形瓶中分别加入50 mL初始质量浓度均为50.0 mg/L的Pb(Ⅱ)、Cd(Ⅱ)标准溶液,加入0.05 g吸附剂进行混合。参考1.5.1节调节溶液pH为5.0,离子强度为0.01 mol/L,在常温下进行吸附试验,吸附时间为0、30、60、120、180、240、360、480、600 min时取样,磁选分离吸附剂后测定上清液中Pb(Ⅱ)、Cd(Ⅱ)的浓度,根据上清液中Pb(Ⅱ)、Cd(Ⅱ)剩余浓度与初始浓度的比值(c/c0)随时间的变化,绘制吸附动力学曲线。
1.5.4 循环再生试验
向150 mL锥形瓶中分别加入50 mL初始质量浓度均为50.0 mg/L的Pb(Ⅱ)、Cd(Ⅱ)标准溶液,加入0.05 g吸附剂进行混合。参考1.5.1节调节溶液pH为5.0,离子强度为0.01 mol/L,达到吸附平衡后,磁选分离吸附剂,用去离子水将吸附剂清洗3次去除表面残留的重金属溶液,然后在70 ℃的恒温烘箱中烘干,将烘干后的吸附剂加入到50 mL 0.1 mol/L的氢氧化钠溶液中,超声30 min使颗粒分散均匀,放置于恒温振荡箱中30 ℃振荡12 h进行解吸。重复上述吸附—脱附循环再生操作5次,试验中设置两组平行试验,结果取平均值。
2 结果与讨论
2.1 材料表征结果
两种磁性材料的SEM图见图1。由图1可以看出,磁性Fe3O4颗粒表面较为粗糙,覆有大量非晶体状微球,可见大量纳米颗粒构成了磁性Fe3O4表面的粗糙结构[9]。与磁性Fe3O4相比,壳聚糖-磁性Fe3O4表面更加致密,说明壳聚糖成功地负载在磁性Fe3O4表面。

图1 两种磁性材料的SEM图Fig.1 SEM profiles of two magnetic materials

图2 两种磁性材料的TEM图Fig.2 TEM profiles of two magnetic materials
由磁性Fe3O4及壳聚糖-磁性Fe3O4的TEM图(见图2)可以看出,两种磁性材料皆为不规则、无定形态,由一个黑色中心和透明边缘组成。中心黑色区域为磁核,边缘外壳较为松散。另外,从TEM图可以推测出磁性Fe3O4及壳聚糖-磁性Fe3O4尺寸较小,总体为20~50 nm。
为分析对比磁性Fe3O4及壳聚糖-磁性Fe3O4的表面官能团和化学键,本研究采用FTIR对两种磁性材料的表面结构进行表征,结果如图3所示。由图3可见,磁性Fe3O4及壳聚糖-磁性Fe3O4均在3 500 cm-1附近出现—OH伸缩振动峰,在1 630 cm-1处出现O—H伸缩振动峰,在560 cm-1处出现Fe—O的伸缩振动峰。经壳聚糖改性后,在3 500 cm-1附近的吸收峰变强,且在1 421 cm-1处出现C—H的伸缩振动吸收峰,说明壳聚糖成功负载在Fe3O4表面。此外,改性后560 cm-1处的Fe—O吸收峰也稍有变强,说明壳聚糖可能通过与Fe元素结合而负载在磁性Fe3O4表面上。

图3 磁性Fe3O4及壳聚糖-磁性Fe3O4的FTIR谱图Fig.3 FTIR spectra of magnetic Fe3O4 and chitosan- magnetic Fe3O4
测得磁性Fe3O4及壳聚糖-磁性Fe3O4的比表面积分别为76.12、142.67 m2/g。可见,经壳聚糖改性后磁性Fe3O4比表面积大幅增加,有助于提高其对重金属的吸附容量。由元素分析结果(见表1)可知,经壳聚糖改性后,磁性Fe3O4表面C、N元素质量分数明显增加。Zeta电位测定结果表明,磁性Fe3O4的等电点为3.5~4.0,壳聚糖-磁性Fe3O4的等电点升高到4.5~5.0,这是由于带正电的壳聚糖负载在Fe3O4表面所致。

表1 磁性Fe3O4及壳聚糖-磁性Fe3O4中各元素质量分数

图4 不同pH下两种磁性材料对Pb(Ⅱ)、Cd(Ⅱ)的吸附量变化Fig.4 Change of Pb(Ⅱ) and Cd(Ⅱ) adsorption quantity of two magnetic materials with different pH

图5 磁性Fe3O4对Pb(Ⅱ)、Cd(Ⅱ)的吸附等温线Fig.5 Adsorption isotherms of magnetic Fe3O4 on Pb(Ⅱ) and Cd(Ⅱ)
2.2 pH对吸附的影响
不同pH条件下,磁性Fe3O4及壳聚糖-磁性Fe3O4对Pb(Ⅱ)、Cd(Ⅱ)的吸附量变化见图4。
由图4可见,当pH较低时,磁性Fe3O4及壳聚糖-磁性Fe3O4对Pb(Ⅱ)、Cd(Ⅱ)的吸附量相差不大,随着pH增加至中性,二者对Pb(Ⅱ)、Cd(Ⅱ)的吸附量均明显增加,其中壳聚糖-磁性Fe3O4吸附量增幅更加明显。当pH为7.0时,磁性Fe3O4及壳聚糖-磁性Fe3O4对Pb(Ⅱ)的吸附量分别为32.32、50.00 mg/g,对Cd(Ⅱ)的吸附量分别为26.78、42.58 mg/g。可见,经壳聚糖改性后磁性Fe3O4对重金属离子的吸附性能大幅提高,这是由于改性后的壳聚糖-磁性Fe3O4表面具有更多的羟基和氨基,能固定更多的重金属。此外,两种磁性材料对Pb(Ⅱ)的吸附量均比Cd(Ⅱ)高,说明其对Pb(Ⅱ)的亲和力比Cd(Ⅱ)强,可能与Cd(Ⅱ)的水合离子半径大于Pb(Ⅱ)有关[10],因此Cd(Ⅱ)较难经过材料表面空隙扩散至材料内部而被固定下来。
2.3 等温吸附试验结果
磁性Fe3O4及壳聚糖-磁性Fe3O4对Pb(Ⅱ)、Cd(Ⅱ)的吸附等温线分别见图5、图6。
由图5、图6可见,磁性Fe3O4及壳聚糖-磁性Fe3O4对Pb(Ⅱ)、Cd(Ⅱ)的吸附特性相似。在相同温度下,随着Pb(Ⅱ)、Cd(Ⅱ)初始浓度的增加,两种磁性材料对Pb(Ⅱ)、Cd(Ⅱ)的吸附量均呈增加趋势,且高温条件下吸附量增加更为明显。当重金属初始质量浓度≤10 mg/L时,温度对两种磁性材料吸附性能几乎没有影响。当重金属初始质量浓度>10 mg/L时,温度的影响逐渐明显,表现出随着温度的升高,两种磁性材料对Pb(Ⅱ)、Cd(Ⅱ)的吸附量均呈增加趋势,说明此吸附过程为吸热过程,重金属浓度越高,温度对吸附量的影响越明显。
2.4 吸附动力学试验结果
磁性Fe3O4及壳聚糖-磁性Fe3O4对Pb(Ⅱ)、Cd(Ⅱ)的吸附动力学曲线如图7所示。由图7(a)可见,利用磁性Fe3O4及壳聚糖-磁性Fe3O4吸附处理Pb(Ⅱ)时,c/c0在吸附初期迅速下降,随着吸附时间的延长,c/c0的下降速率逐渐放缓,最终在480 min时基本达到吸附平衡。这是因为两种磁性材料的表面均为多孔结构,溶液中的Pb(Ⅱ)很容易扩散至磁性材料表面,当表层吸附位点达饱和后,Pb(Ⅱ)向内层扩散的阻力增加,吸附去除速率逐渐降低[11]。由图7(b)可见,两种磁性材料对Cd(Ⅱ)的去除情况与Pb(Ⅱ)相似,但达到吸附平衡所需时间较长,这是由于两种磁性材料对Cd(Ⅱ)的亲和力比Pb(Ⅱ)弱,导致吸附去除速率较慢。
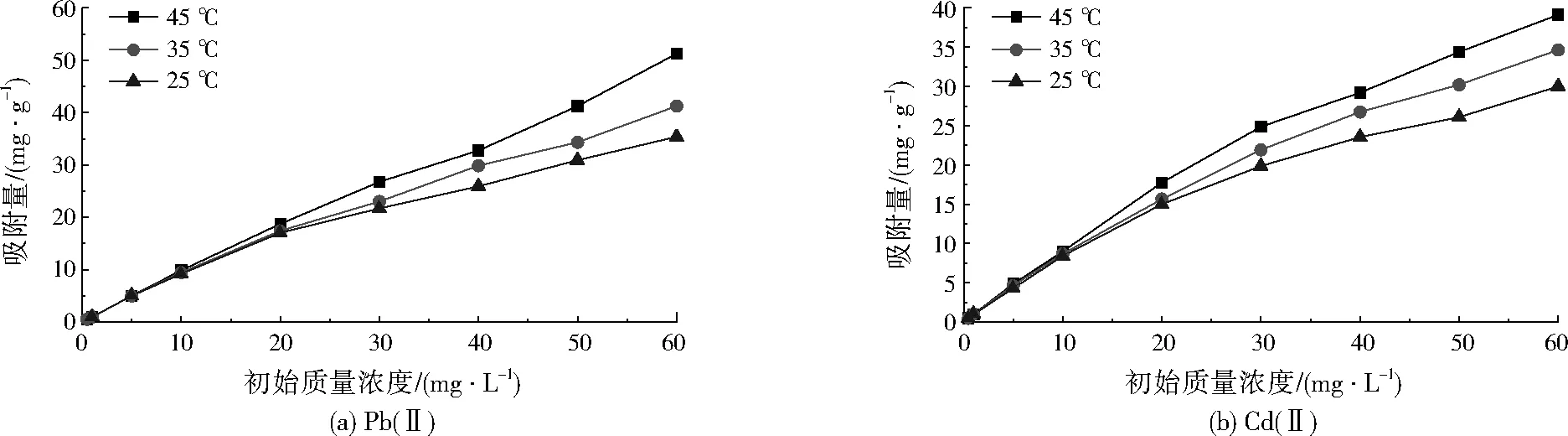
图6 壳聚糖-磁性Fe3O4对Pb(Ⅱ)、Cd(Ⅱ)的吸附等温线Fig.6 Adsorption isotherms of chitosan-magnetic Fe3O4 on Pb(Ⅱ) and Cd(Ⅱ)
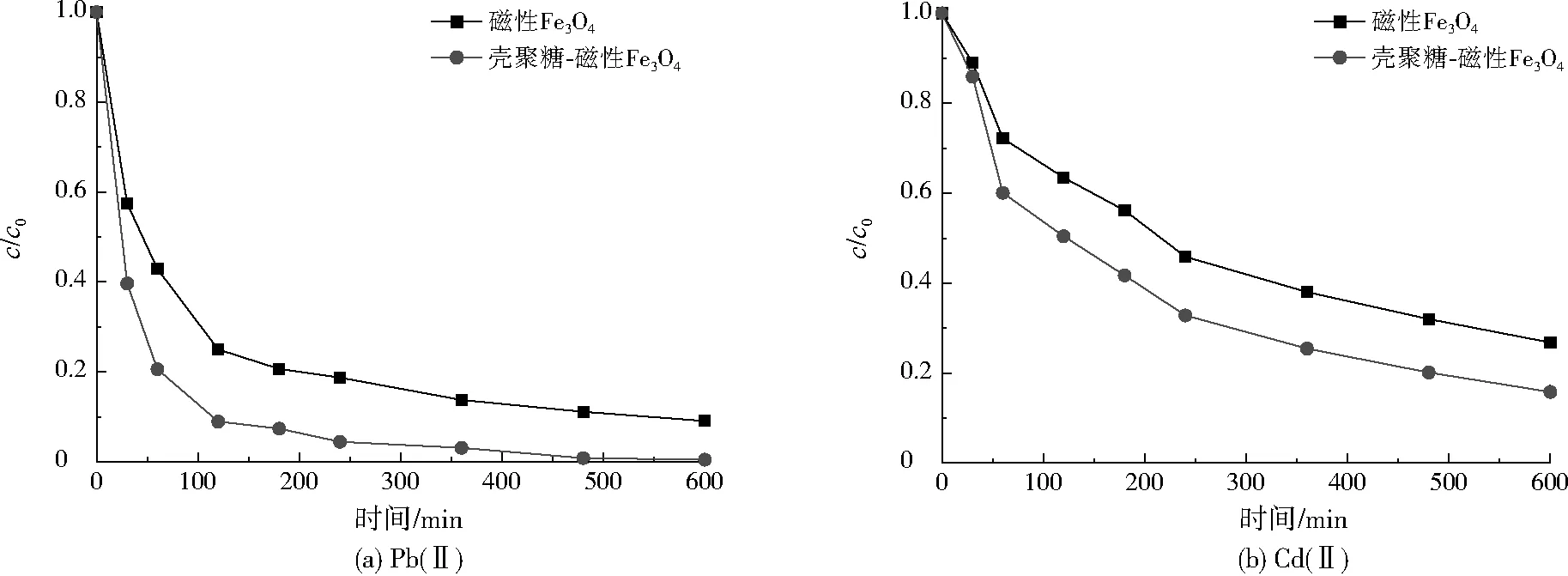
图7 两种磁性材料对Pb(Ⅱ)、Cd(Ⅱ)的吸附动力学曲线Fig.7 Adsorption kinetic curves of two magnetic materials on Pb(Ⅱ) and Cd(Ⅱ)
本研究采用准二级动力学模型[12]对两种磁性材料吸附Pb(Ⅱ)、Cd(Ⅱ)的过程进行分析,得到平衡吸附量的拟合值(Qe,cal,mg/g),并将其与平衡吸附量的试验值(Qe,exp,mg/g)进行对比,结果见表2。由表2可见,Qe,cal与Qe,exp比较接近,且准二级动力学模型对吸附数据拟合的相关系数R2均在0.99以上,说明准二级动力学模型可以较好的描述两种磁性材料对Pb(Ⅱ)和Cd(Ⅱ)的吸附动力学过程。
2.5 吸附—脱附循环再生试验结果
由于本研究合成的磁性Fe3O4及壳聚糖-磁性Fe3O4均具有较好的磁响应性能,故能在循环再生试验中快速分离回收。由图8可见,随着吸附—脱附循环再生次数的增加,两种磁性材料对Pb(Ⅱ)、Cd(Ⅱ)的吸附去除率逐渐降低。对循环再生5次的壳聚糖-磁性Fe3O4进行元素分析,测得C、H、N元素的质量分数分别为12.91%、3.19%、1.92%,与循环再生前差别不大,说明壳聚糖在循环过程中较为稳定,未发生明显脱落。此外,壳聚糖-磁性Fe3O4对重金属吸附性能的下降趋势与磁性Fe3O4总体一致,说明可能是循环过程中吸附剂有部分损失,或再生过程并未解吸完全导致磁性材料表面的活性吸附位点降低,造成吸附性能下降。

表2 两种磁性材料对Pb(Ⅱ)、Cd(Ⅱ)的平衡吸附量
在5次循环再生过程中,壳聚糖-磁性Fe3O4对Pb(Ⅱ)、Cd(Ⅱ)的去除率均高于磁性Fe3O4,5次循环再生后,壳聚糖-磁性Fe3O4对Pb(Ⅱ)、Cd(Ⅱ)的去除率分别为87.5%、82.3%,磁性Fe3O4对Pb(Ⅱ)、Cd(Ⅱ)的去除率分别为76.8%、78.2%,说明本研究合成的壳聚糖-磁性Fe3O4具有较好的再生性能。
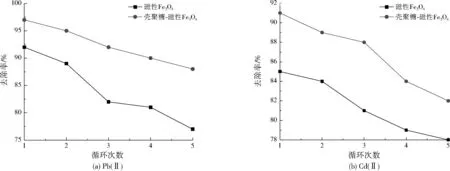
图8 循环再生过程中两种磁性材料对Pb(Ⅱ)、Cd(Ⅱ)的去除率Fig.8 Removal rate of Pb(Ⅱ) and Cd(Ⅱ) by two magnetic materials after regeneration
3 结 论
(1) 壳聚糖改性可大幅提高磁性Fe3O4的比表面积,壳聚糖-磁性Fe3O4的比表面积由原来的76.12 m2/g增加到了142.67 m2/g。
(2) 当pH为2.0~7.0时,提高pH有助于促进两种磁性材料对Pb(Ⅱ)和Cd(Ⅱ)的吸附量。当pH为7.0时,磁性Fe3O4及壳聚糖-磁性Fe3O4对Pb(Ⅱ)的吸附量分别为32.32、50.00 mg/g,对Cd(Ⅱ)的吸附量分别为26.78、42.58 mg/g。
(3) 磁性Fe3O4及壳聚糖-磁性Fe3O4对Pb(Ⅱ)、Cd(Ⅱ)的吸附符合准二级动力学模型。
(4) 当重金属初始质量浓度≤10 mg/L时,温度对两种磁性材料吸附性能几乎没有影响。当重金属初始质量浓度>10 mg/L时,温度的影响逐渐明显,表现出随着温度的升高,两种磁性材料对Pb(Ⅱ)、Cd(Ⅱ)的吸附量总体呈增加趋势,说明吸附过程为吸热过程。
(5) 两种磁性材料具有较好的再生性能,重复吸附—脱附循环再生5次后,壳聚糖-磁性Fe3O4对Pb(Ⅱ)、Cd(Ⅱ)的去除率仍在80%以上,磁性Fe3O4对Pb(Ⅱ)、Cd(Ⅱ)的去除率在75%以上。
[1] 艾翠玲,雷英杰,张国春,等.纳米铁氧化物吸附处理重金属废水的研究进展[J].化工环保,2015,35(6):593-598.
[2] 杜雪岩,路翠萍,马应霞,等.磁性微/纳米材料处理水溶液中金属离子研究进展[J].材料导报,2013,27(12):66-70.
[3] 杨梖,白雪,顾海鑫.磁性吸附材料的制备及其在污水处理中的应用[J].环境工程,2015,33(4):25-29.
[4] ZHANG Chang,YU Zhigang,ZENG Guangming,et al.Phase transformation of crystalline iron oxides and their adsorption abilities for Pb and Cd[J].Chemical Engineering Journal,2016,284:247-259.
[5] ZHONG Liangshu,HU Jinsong,LIANG Hanpu,et al.Self-assembled 3D flowerlike iron oxide nanostructures and their application in water treatment[J].Advanced Materials,2006,18(18):2426-2431.
[6] 吴永娟,罗鸣,闫俊英,等.磁性介孔γ-Fe2O3制备及其处理含Cr(Ⅵ)废水的应用[J].工业水处理,2014,34(1):15-17.
[7] PAULA I P S,DIANA M,CÉSAR L,et al.Thermal and magnetic properties of chitosan-iron oxide nanoparticles[J].Carbohydrate Polymers,2016,149:382-390.
[8] LIU Tingyi,YANG Xi,WANG Zhongliang,et al.Enhanced chitosan beads-supported Fe0-nanoparticles for removal of heavy metals from electroplating wastewater in permeable reactive barriers[J].Water Research,2013,47(17):6691-6700.
[9] MAO Dan,YAO Jianxi,LAI Xiaoyong,et al.Hierarchically mesoporous hematite microspheres and their enhanced formaldehyde-sensing properties[J].Small,2011,7(5):578-582.
[10] 李文文,李梦蕊,赵广超.磁性竹基炭对Pb2+、Cd2+与Cu2+的吸附机理研究[J].环境科学学报,2014,34(4):938-943.
[11] ZENG Guangming,LIU Yuanyuan,LIN Tang,et al.Enhancement of Cd(Ⅱ) adsorption by polyacrylic acid modified magnetic mesoporous carbon[J].Chemical Engineering Journal,2015,259:153-160.
[12] 贾志刚,彭宽宽,许立信,等.磁性介孔锰铁复合氧化物对Cr(Ⅵ)的吸附性能研究[J].环境工程学报,2012,6(1):157-162.
EffectofchitosanmodificationonPb(Ⅱ)andCd(Ⅱ)adsorptionbymagneticFe3O4
SHANGJuan1,ZHAOJun2.
(1.DepartmentofCivilEngineering,HohaiUniversityWentianCollege,MaanshanAnhui243000;2.KeyLaboratoryofYangtzeRiverWaterEnvironment,MinistryofEducation,SchoolofEnvironmentalScienceandEngineering,TongjiUniversity,Shanghai200092)
10.15985/j.cnki.1001-3865.2017.07.011
2016-12-27)
商 娟,女,1986年生,硕士,讲师,研究方向为水污染控制。#
。
*安徽省高校自然科学研究重点项目(No.KJ2016A622)。

