长非编码RNA MT1JP调控p53抑制类风湿关节炎炎症反应作用及机制研究
洪宏海++王征++夏勇
【摘 要】目的:探讨长非编码RNA MT1JP调控p53抑制类风湿关节炎炎症反应的作用及机制。
方法:qRT-PCR法检测类风湿关节炎患者和骨关节置换患者滑膜组织中长非编码RNA MT1JP相对表达;小分子干扰RNA干扰MT1JP研究其作用;ELISA检测炎症因子白细胞介素(IL)-1β、IL-6、IL-8水平;Western blot检测p53蛋白水平。结果:类风湿关节炎患者滑膜组织MT1JP水平明显低于骨关节置换患者,且类风湿关节炎患者滑膜组织MT1JP水平与血清中炎症因子IL-1β、IL-6、IL-8水平呈负相关;干扰MT1JP后明显促进MH7A滑膜细胞的IL-1β、IL-6、IL-8分泌和抑制p53表达。结论:类风湿关节炎患者滑膜组织MT1JP水平下调,通过调控p53进而促进炎症因子的分泌和炎症反应。
【关键词】 关节炎,类风湿;MT1JP;炎症因子;p53
The Role and Mechanism of Long Noncoding RNA MT1JP Regulating p53 to Inhibit Inflammatory Reaction of Rheumatoid Arthritis
HONG Hong-hai,WANG Zheng,XIA Yong
【ABSTRACT】Objective:To study the role and mechanism of long noncoding RNA MT1JP regulating p53 to inhibit inflammatory reaction of rheumatoid arthritis.Methods:The qRT-PCR method was used to detect the relative expression of long noncoding RNA MT1JP in patients with rheumatoid arthritis or having undergone bone joint replacement.Small molecules interfered RNA to interfere MT1JP to study the effects.ELISA was used to detect the levels of(IL)-1β,IL-6 and IL-8.Western blot was used to detect the protein level of p53.Results:The levels of MT1JP in synovial tissue of patients with rheumatoid arthritis was significantly lower than that in patients with bone and joint replacement surgery,and the levels of MT1JP in patients with synovial tissue were negatively correlated with inflammatory factor IL-1β,IL-6 and IL-8.after interference,the secretion of IL-1β,IL-6 and IL-8 in MH7A synovial cells were enhanced,and expression of p53 was inhibited.Conclusion:The level of MT1JP in synovial tissue of rheumatoid arthritis is down regulated,which can promote the secretion of inflammatory factors and inflammatory response by regulating p53.
【Keywords】 arthritis,rheumatoid;MT1JP;inflammatory factors;p53
类风湿关节炎(rheumatoid arthritis,RA)是一种自身免疫性疾病,其病理特征为炎症反应和炎症因子分泌增多。RA临床表现为长期慢性炎症浸润、关节疼痛、关节肿大和畸形[1]。女性RA发病率约为1.16%,明显高于男性的0.44%[1]。RA的具体发病机制目前还不清楚。炎症反应过度激活是RA最重要的致病机制[2]。文献报道,肿瘤坏死因子-α(TNF-α)、LPS等促炎因子刺激关节滑膜细胞后激活核转录因子-κB(NF-κB)信号通路,随后诱导白细胞介素(IL)-6、IL-8、IL-1β和基质金属蛋白酶(MMPs)表达,最终导致关节炎症反应和骨关节破坏[3]。敲除IL-1或阻断IL-6明显改善RA动物模型中炎症浸润和软骨破坏[4]。因此,寻找新的靶点来抑制炎症因子分泌和炎症反应对治疗RA尤为重要。
长非编码RNA是一类普遍存在于哺乳动物,长度 > 200 bp的非编码RNA。长非编码RNA有着广泛的生物学功能,如调控基因转录和翻译,蛋白质定位,细胞结构完整性,细胞周期和炎症反应
等[5]。目前,长非编码RNA与RA的关系研究尚少。长非编码RNA MT1JP在肺癌、肝癌、结直肠癌和胃癌中表达低,而在正常组织中表达丰富,随后发现其可调控p53促进肿瘤凋亡[6]。研究表明,p53亦可抑制NF-κB活性进而抑制炎症反应[7]。但是,MT1JP在RA患者中表达及其是否调控RA患者p53和炎症反应尚未清楚。笔者将研究MT1JP在RA患者滑膜组织中表达及其在RA患者診断中的意义,以及其调控p53和炎症因子作用及机制。
1 实验材料endprint
1.1 标本收集 选取本院的RA患者35例和骨关节置换患者(选取车祸等各种原因导致粉粹性骨折的患者)35例。收集患者的临床资料、滑膜组织、血清。滑膜组织采用无菌收集,手术后取关节滑膜组织于干净无菌的50 mL离心管中,置于冰上。然后于无菌操作台剥除脂肪组织、骨头、血管等。收集到的滑膜组织用生理盐水洗3遍,无菌管冻存于液氮罐中,用于后续实验研究。所有患者资料和标本收集均严格按照广州医科大学伦理委员会相关规定。
1.2 试剂和仪器 IL-6、IL-8、IL-1β ELISA检测试剂盒(BD公司);SYBER Green试剂盒(Takara公司);MT1JP小分子干扰片段(锐博公司);转染试剂Lipo2000(Invtrogen公司);细胞培养液(Hyclone公司);细胞培养皿(康宁公司);p53抗体(CST公司);电泳电转仪、凝胶成像系统(伯乐公司);离心机(eppendorf);pH计(上海佑仪公司);荧光PCR仪(ABI公司)。
2 方 法
2.1 细胞培养 MH7A细胞为RA滑膜细胞,购自广州吉妮欧公司。用高糖DMEM + 10%FBS于5% CO2,37 ℃的培养箱中培养。购买时为第3代,扩增3代后用于后续实验研究。
2.2 长非编码RNA MT1JP干扰实验 具体方法如下:MH7A细胞种植于六孔板中,待其融合度为50%~60%,换上无双抗的培养液,按照转染试剂Lipo2000说明书,每孔转染MT1JP干扰小分子片段100 pmol,转染6 h后,撤掉旧培养液,换上含有双抗、10%胎牛血清培养液,继续培养
48 h后收集细胞培养上清和蛋白,检测炎症因子IL-1β、IL-6、IL-8和p53水平。
2.3 qRT-PCR实验 qRT-PCR用来检测MT1JP和炎症因子IL-1β、IL-6、IL-8相对表达水平。具体实验如下:收集处理好的滑膜组织或MH7A细胞RNA,逆转录为cDNA,用SYBER Green试剂盒进行实时荧光PCR实验。PCR条件为:9 ℃ 30 s,
1个循环;PCR反应,95 ℃ 5 s,60 ℃ 15 s,45个循环;溶解,95 ℃ 15 s,65 ℃20 s,95 ℃ 15 s,
1个循环。PCR结束后,根据反应得到的Cp值,使用相对定量的分析方法,以标准曲线进行校正,最后计算出样品中各mRNA的相对浓度。
2.4 Western blot实验 Western blot实验用来检测p53蛋白水平,具体实验方案如下:收集处理好的MH7A细胞蛋白,进行蛋白定量,然后以每孔上样量为60 μg上样,然后跑电泳。蛋白电泳完毕后,用7%的脱脂牛奶封闭PVDF膜1 h,然后加入p53(1∶1000)一抗,4 ℃过夜,收集一抗,加入二抗(1∶2000),TBST洗3遍后,暗房中加入ECL显色,X线片显影定影,拍照。
2.5 统计学方法 采用SPSS 17.0软件进行统计分析。计量资料以表示;RA患者滑膜组织MT1JP相对表达水平和血清中炎症因子和相关
指标采用t检验;ROC曲线分析用来判断MT1JP对RA诊断价值。以P < 0.05为差异有统计学意义。
3 结 果
3.1 2组滑膜组织中长非编码RNA MT1JP水平比较 骨关节置换患者滑膜组织和RA患者相关临床资料见表1。分别检测35例RA患者和35例骨关节置换患者滑膜组织中MT1JP水平,结果显示,与骨关节置换患者相比,RA患者滑膜中MT1JP水平明显低于骨关节置换患者,见图1。此外,为了验证MT1JP水平对RA患者的诊断价值,笔者进行了ROC曲线分析,结果显示,AUC面积为0.984,表明MT1JP对RA的诊断具有较好价值,见图2;同时,ROC曲线分析表明,MT1JP对RA诊断敏感性和特异性分别为97.1%和91.4%;95%置信区间为[0.963,1.006]。
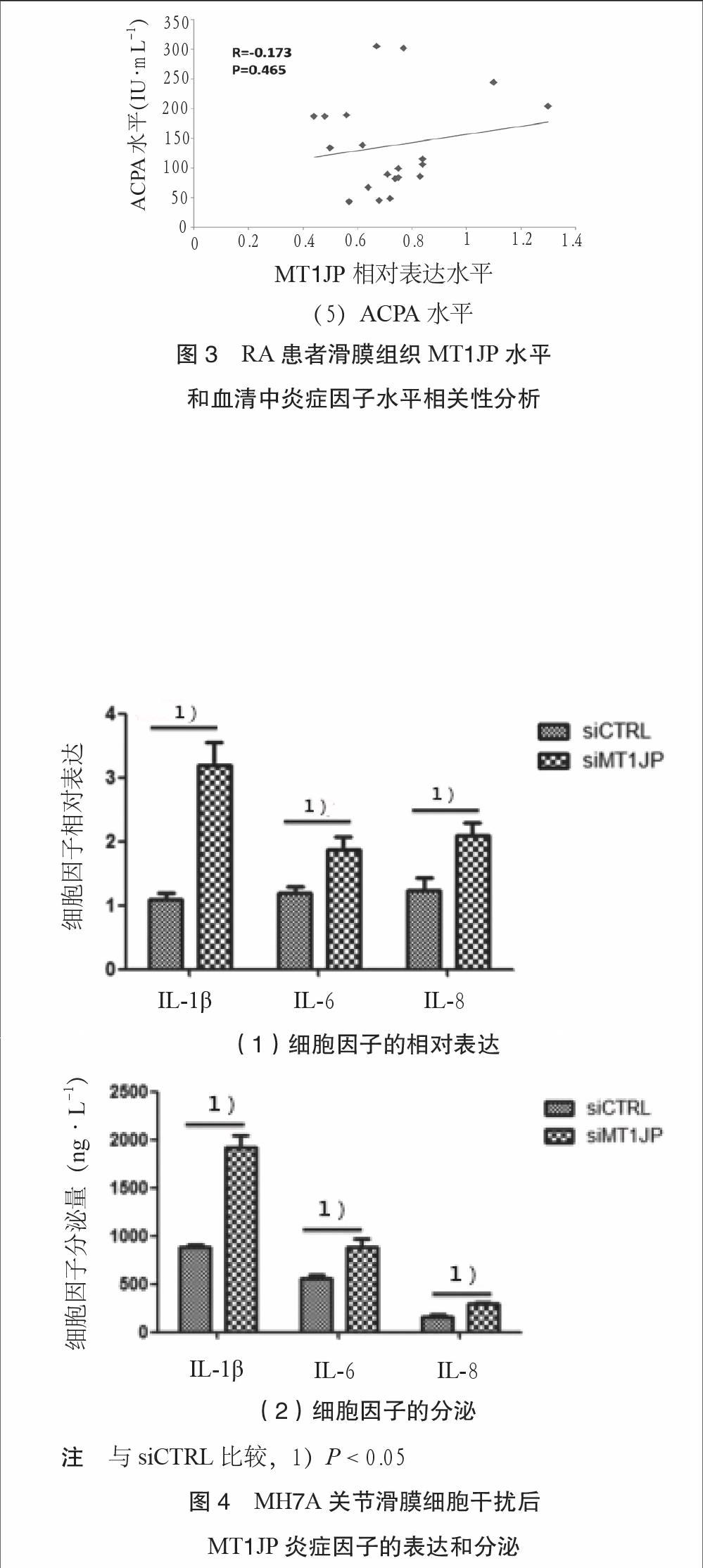
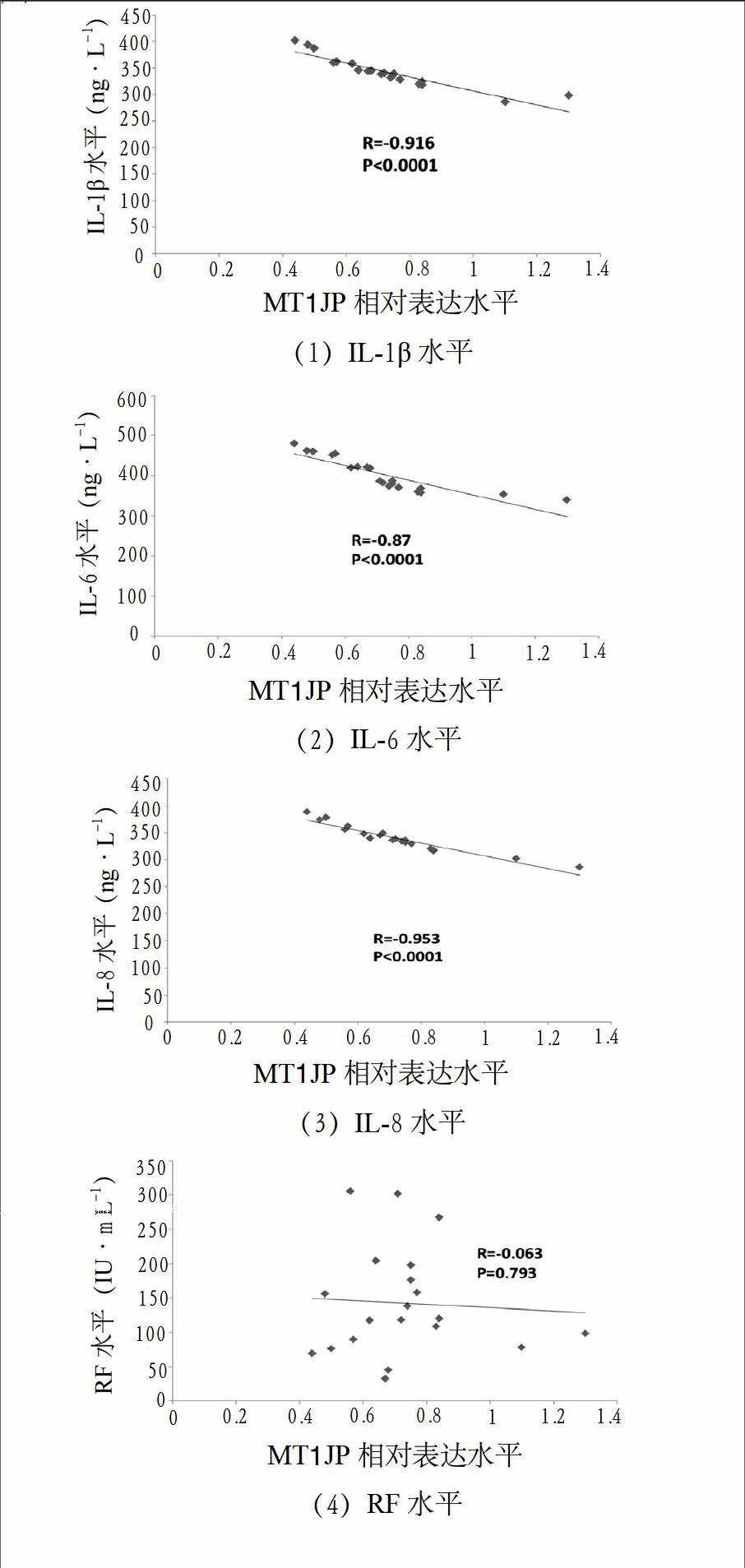
3.2 RA患者滑膜组织MT1JP水平和血清中炎症因子水平呈负相关 收集RA患者血清,检测RA患者血清中RF、ACPA、IL-1β、IL-6、IL-8水平。RA相关指标临床资料和检测结果见表1。相关性分析发现,MT1JP与RA患者血清中炎症因子
IL-1β、IL-6和IL-8呈负相关;但是,MT1JP与RA患者血清RF和ACPA并没有相关性,见图3。长非编码RNA MT1JP与RA炎症反应密切联系,可能在RA的炎症反应中起着关键
作用。
3.3 MH7A关节滑膜细胞干扰MT1JP后炎症因子的表达和分泌增多 干扰MT1JP后,关节滑膜细胞MH7A的炎症因子IL-1β、IL-6和IL-8表达水平明显上调,见图4(1);与此对应的是,关节滑膜细胞MH7A培养上清中IL-1β、IL-6和IL-8含量也明显升高,见图4(2)。
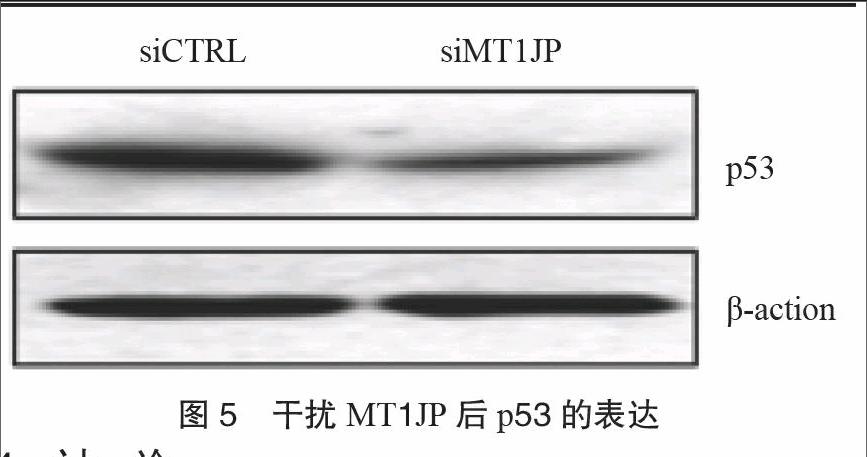
3.4 MT1JP通过调控p53进而调控RA患者的炎症因子表达和分泌 Western blot实验结果表明,干扰MT1JP后,p53蛋白水平明显下调,MT1JP可能通过调控p53蛋白水平进而调控炎症因子
IL-1β、IL-6和IL-8表达,从而抑制RA炎症反应。见图5。
4 讨 论
RA是一种自身免疫性疾病,其基本病理特征为炎症反应。RA临床表现为关节慢性炎症浸润、关节疼痛、关节肿大和畸形。RA详细的发病机制尚未清楚,目前认为炎症反应是主要的致病机制。研究表明,抑制RA炎症反应可有效改善RA患者生活水平和疾病状态[8]。因此,寻找有效药物或靶点抑制RA炎症反应尤为重要。长非编码RNA与肿瘤增殖、凋亡、转移和抗药性等生物学行为密切联系,如促进肝癌发生的H19等[9]。在RA中,长非编码RNA研究甚少。在本研究中,笔者发现长非编码RNA MT1JP在RA患者滑膜组织中表达下调,且对RA诊断具有一定意义;进一步研究其与RA炎症反应密切相关,小分子干扰RNA干扰MT1JP后明显抑制炎症因子IL-6、IL-8、IL-1β表达和分泌。此外,我们也發现MT1JP调控p53蛋白水平,提示MT1JP可能通过调控p53蛋白水平进而调控RA的炎症反应。endprint
RA发病机制尚未清楚,但是炎症反应是其最基本的病理状态。研究表明,TNF-α、LPS、IL-1β等促炎因子刺激关节滑膜细胞后激活NF-κB信号通路,随后诱导IL-6、IL-8、IL-1β和MMPs表达,最终导致关节炎症反应和骨关节破坏[3],提示炎症因子和炎症反应在RA患者中起关键作用。许多研究发现血浆中IL-1β和IL-6浓度比正常人高
10倍左右[10],敲除IL-1或阻断IL-6基因明显改善RA动物模型中炎症浸润和软骨破坏[4]。此外,临床上使用IL-1β抗体阿那白滞素(anakinra)和IL-6受体阻断药塔西单抗治疗RA取得较好的效果[11]。以上研究都提示抑制炎症因子和炎症反应可有效改善RA的病理状态。目前研究发现,长非编码RNA与炎症因子和炎症反应密切联系[12]。
lnc-IL7R通过结合IL7R基因3'UTR抑制LPS诱导的炎症反应[13]。长非编码RNA Lethe通过结合转录因子阻止NF-κB启动下游炎症反应[14]。在骨关节炎患者中,长非编码RNA H19水平上调,促进IGF-2表达,但是其分子机制尚未清楚[15]。RA中长非编码RNA研究尚少。研究发现,甲氨蝶呤通过诱导长非编码RNA p21进而抑制RA的炎症反应[16]。笔者在RA患者滑膜组织中发现长非编码RNA MT1JP表达下调,且与炎症因子呈负相
关;进一步研究表明MT1JP通过p53抑制炎症因子分泌,与长非编码RNA p21抑制炎症反应结果类似,提示MT1JP可能成为治疗RA的新靶点,具有临床意义。此外,ROC曲线分析表明MT1JP对RA具有较好的诊断价值。
p53是一种重要的抑癌基因,其在细胞生长中起着关键调控作用,参与细胞生长、凋亡、肿瘤增殖等生理功能[17]。此外,研究表明p53亦可调控NF-κB活性进而抑制炎症反应[7]。笔者发现干扰MT1JP后,p53蛋白水平下调,表明MT1JP可能调控p53蛋白进而抑制RA的炎症反应过程。但是,MT1JP调控p53和炎症反应的具体分子机制还有待进一步研究。
總之,本文实验结果证明,长非编码RNA MT1JP在RA患者中表达下调,且与RA炎症反应密切相关;此外,MT1JP通过调控p53蛋白水平和炎症因子分泌从而抑制RA的炎症反应,为RA的治疗提供了新的靶点和治疗方案,具有一定的临床意义。
5 参考文献
[1] Charles J,Britt H,Pan Y.Rheumatoid arthritis[J].Aust Fam Physician,2013,42(11):765.
[2] Alghasham A,Rasheed Z.Therapeutic targets for rheumatoid arthritis:Progress and promises[J].Autoimmunity,2014,47(2):77-94.
[3] Zhong H,May MJ,Jimi E,et al.The phosphorylation status of nuclear NF-kappa B determines its association with CBP/p300 or HDAC-1[J].Mol Cell,2002,9(3):625-636.
[4] Hirano T,Matsuda T,Turner M,et al.Excessive production of interleukin 6/B cell stimulatory factor-2 in rheumatoid arthritis[J].Eur J Immunol,1988,18(11):1797-1801.
[5] Chandra Gupta S,Nandan Tripathi Y.Potential of long non-coding RNAs in cancer patients:From biomarkers to therapeutic targets[J].Int J Cancer,2017,140(9):1955-1967.
[6] Liu L,Yue H,Liu Q,et al.LncRNA MT1JP functions as a tumor suppressor by interacting with TIAR to modulate the p53 pathway[J].Oncotarget,2016,7(13):15787-15800.
[7] Komarova EA,Krivokrysenko V,Wang K,et al.p53 is a suppressor of inflammatory response in mice[J].FASEB J,2005,19(8):1030-1032.
[8] Chen D,Zeng S,Huang M,et al.Role of protein arginine methyltransferase 5 in inflammation and migration of fibroblast-like synoviocytes in rheumatoid arthritis[J].J Cell Mol Med,2017,21(4):781-790.
[9] Yang F,Bi J,Xue X,et al.Up-regulated long non-coding RNA H19 contributes to proliferation of gastric cancer cells[J].FEBS J,2012,279(17):3159-3165.
[10] Pap T,Aupperle KR,Gay S,et al.Invasiveness of synovial fibroblasts is regulated by p53 in the SCID mouse in vivo model of cartilage invasion[J].Arthritis Rheum,2001,44(3):676-681.endprint
[11] Obermair F,Pieringer H.Biological Therapies:Effects of Proinflammatory Pathways and their Inhibition on the Myocardium of Rheumatoid Athritis Patients[J].Curr Med Chem,2015,22(16):1911-1929.
[12] Marques-Rocha JL,Samblas M,Milagro FI,et al.Noncoding RNAs,cytokines,and inflammation-related diseases[J].FASEB J,2015,29(9):3595-3611.
[13] Cui H,Xie N,Tan Z,et al.The human long noncoding RNA,lnc-IL7R,regulates inflammatory response[J].Eur J Immunol,2014,44(7):2085-2095.
[14] Rapicavoli NA,Qu K,Zhang J,et al.A mammalian pseudogene lncRNA at the interface of inflammation and anti-inflammatory therapeutics[J].Elife,2013,2(2):e00762.
[15] Steck E,Boeuf S,Gabler J,et al.Regulation of H19 and its encoded microRNA-675 in osteoarthritis and under anabolic and catabolic in vitro conditions[J].J Mol Med(Berl),2012,90(10):1185-1195.
[16] Spurlock CF,Tossberg JT,Matlock BK,et al.Methotrexate inhibits NF-κB activity via long intergenic(noncoding)RNA-p21 induction[J].Arthritis Rheumatol,2014,66(11):2947-2957.
[17] Carrasco-Garcia E,Moreno M,Moreno-Cugnon L,et al.
Increased Arf/p53 activity in stem cells,aging and cancer[J].Aging Cell,2017,16(2):219-225.
收稿日期:2017-03-31;修回日期:2017-06-12endprint

