树脂吸附富集试纸法快速检测亚硝酸根离子浓度
熊慧娟,占秋玲,曾小明,吴海智,刘 海,司士辉*
(1中南大学 化学化工学院,湖南 长沙 410083;2湖南省产商品质量监督检验研究院,湖南 长沙 410007)
树脂吸附富集试纸法快速检测亚硝酸根离子浓度
熊慧娟1,占秋玲1,曾小明2,吴海智2,刘 海1,司士辉1*
(1中南大学 化学化工学院,湖南 长沙 410083;2湖南省产商品质量监督检验研究院,湖南 长沙 410007)
为了简单快速测定亚硝酸根离子浓度,选用D301树脂吸附富集亚硝酸根离子,然后用1.0 mol/L的硫酸钠解吸,再用试纸条检测解吸液,最后亚硝酸根离子在酸性条件下与对氨基苯磺酸、盐酸萘乙二胺耦合生成紫红色化合物显示在试纸上,其颜色深浅与亚硝酸根离子含量成比例关系。在最优的实验条件下,该试纸法检测亚硝酸根离子浓度的范围为0.1~50 mg/L。此方法具有良好的抗干扰性、较好的灵敏度,而且操作简单,能应用于实际样品中亚硝酸盐含量的快速检测。
离子交换树脂;试纸法;亚硝酸根
亚硝酸盐作为防腐剂和添加剂,被广泛应用于食品、天然水、环境和服务行业[1]。这是因为亚硝酸盐能够有效防止食品的腐败变质,其杀菌或者抑菌的效能十分显著[2];另外,添加亚硝酸盐也能够改变食品的味道和色泽,特别是在肉制品中亚硝酸盐得到广泛的应用。除此之外,在乳制品、蔬菜、饮用水中也有不同含量的亚硝酸盐。然而亚硝酸盐是对环境和人类健康有害的[3]。因此,亚硝酸盐的浓度水平对于环境和生物安全是非常重要的参数。一方面,人体内过量的亚硝酸盐会导致血红蛋白不可逆的氧化,降低血容量;另一方面,亚硝酸盐与胺相互作用转化为致癌亚硝胺,特别是N-亚硝胺,其具有潜在的毒性、致突变性和致癌性[4],对人类和动物的健康会造成严重危害[5];此外,亚硝酸盐还会引起肠源性青紫症、致畸等危害[6],是一种被国家、行业和地方标准规定需要被严格控制残留量的化学物质[7]。所以寻找一种方便经济、快速准确的亚硝酸盐检测方法十分重要。
亚硝酸盐的检测方法较多,主要有分光光度法[8]、毛细管电泳法[9]、比色法[10]、共振光散射法[11]、极谱法[12]、色谱法[13]等。但是这些检测方法所使用的仪器价格昂贵且操作复杂,不利于现场检测,同时还需专业人员操作,不利于方法的普及。而试纸法因具有操作简单、携带方便、价格低廉 、无需定期维护、检测迅速、适合现场检测等突出优点[14],现已有十分广泛的研究和应用。试纸法检测是在酸性条件下,亚硝酸根离子先与对氨基苯磺酸发生重氮化反应,再和盐酸萘乙二胺耦合生成紫红色化合物,且其颜色深浅与亚硝酸根离子含量成比例关系[15]。但是传统的试纸法因检测限高、灵敏度低等缺点,不能检测出食品中少量亚硝酸根离子含量。
离子交换树脂法以其操作简单、成本低、二次污染小、可再生循环利用等优势,成为研究热点[16]。D301树脂即弱碱性苯乙烯系阴离子交换树脂,能交换无机酸,且交换容量大、再生效率高、抗污染能力强、机械强度好[17]。D201树脂即强碱性苯乙烯系阴离子交换树脂,具有廉价、高效、抗污染和容易再生等特点[16]。因此本实验采用这2种阴离子交换树脂富集亚硝酸根离子并对比其吸附效果。
最后,本实验选用D301树脂吸附低浓度的亚硝酸根离子,吸附完全后用硫酸钠解吸,再用试纸检测解吸液,提高了试纸法的灵敏度,降低了检测下限。该方法操作简单,实验所需器材方便易得,成本低,适用于偏远地区食品中亚硝酸盐浓度的检测。
1 实验部分
1.1仪器及试剂
实验仪器:电子分析天平(上海良平仪器仪表有限公司);研钵(宝仁堂医疗实验用品店);超声波清洗器(昆山市超声仪器有限公司);膨胀石墨纸(四川广汉士达炭素股份有限公司);PHS-25酸度计(上海精科仪器有限公司);干燥箱(广州市大祥电子机械设备有限公司);智能数显恒温水浴锅(巩义市予华仪器有限公司);捣碎机(温州标诺仪器有限公司);酸式滴定管(新星实验器材商城)。
实验材料:膨胀石墨纸、D301树脂和D201树脂(购自廊坊盛青化工有限公司);对氨基苯磺酸、盐酸萘乙二胺、酒石酸、盐酸、氢氧化钠、亚硝酸钠、硫酸钠、聚乙烯醇,以上均为分析纯试剂;试剂溶剂均为二次超纯水。
1.2实验方法
1.2.1试纸的制备与选择
分别将宣纸、定性滤纸和定量滤纸3种滤纸剪成2 cm×0.4 cm的试纸条备用;然后分别移取5 mL的1.2%对氨基苯磺酸溶液,5 mL的0.6%盐酸萘乙二胺溶液和2.5 mL的50 g/L酒石酸溶液于50 mL烧杯中,再用氯化铵-氨水的缓冲溶液将溶液pH值调至2.0,将制备好的试纸条均匀地浸泡在溶液里,15 min后,将试纸条取出,放在干净的表面皿上,在避光密封的干燥器中放置24 h,然后密封避光保存。
1.2.2树脂的预处理
实验所用树脂均采用常用的乙醇-酸-碱依次泡洗方法进行预处理[18],最后将树脂洗至中性,晾干,备用。
将预处理好的D301树脂用研钵研磨后,分别用孔径为250 μm、150 μm和74 μm的网筛过筛。
1.2.3树脂吸附法富集检测亚硝酸根的步骤
将柔性石墨纸用蒸馏水清洗烘干,切成5 cm×1 cm的矩形条,用2片PET板固定石墨纸中部后用透明胶缠绕,并控制其面积为1 cm2,再用防水胶涂覆四周,晾干备用。
取0.3 g聚乙烯醇于50 mL烧杯中,首先加入10 mL去离子水,将烧杯放入100 ℃的恒温水浴中,待其完全溶解后加入适量处理好的树脂,搅拌成糊状;然后均匀涂布在制备好的石墨纸上,晾干备用;再取适量待测液于酸式滴定管中,控制滴定速度,使待测液以适当的流速滴在制备好的带有树脂的石墨纸上;吸附完全后用0.1 mL的1.0 mol/L的硫酸钠解吸,最后用试纸检测浓度。试纸法检测亚硝酸根离子浓度的步骤流程图如图1所示。
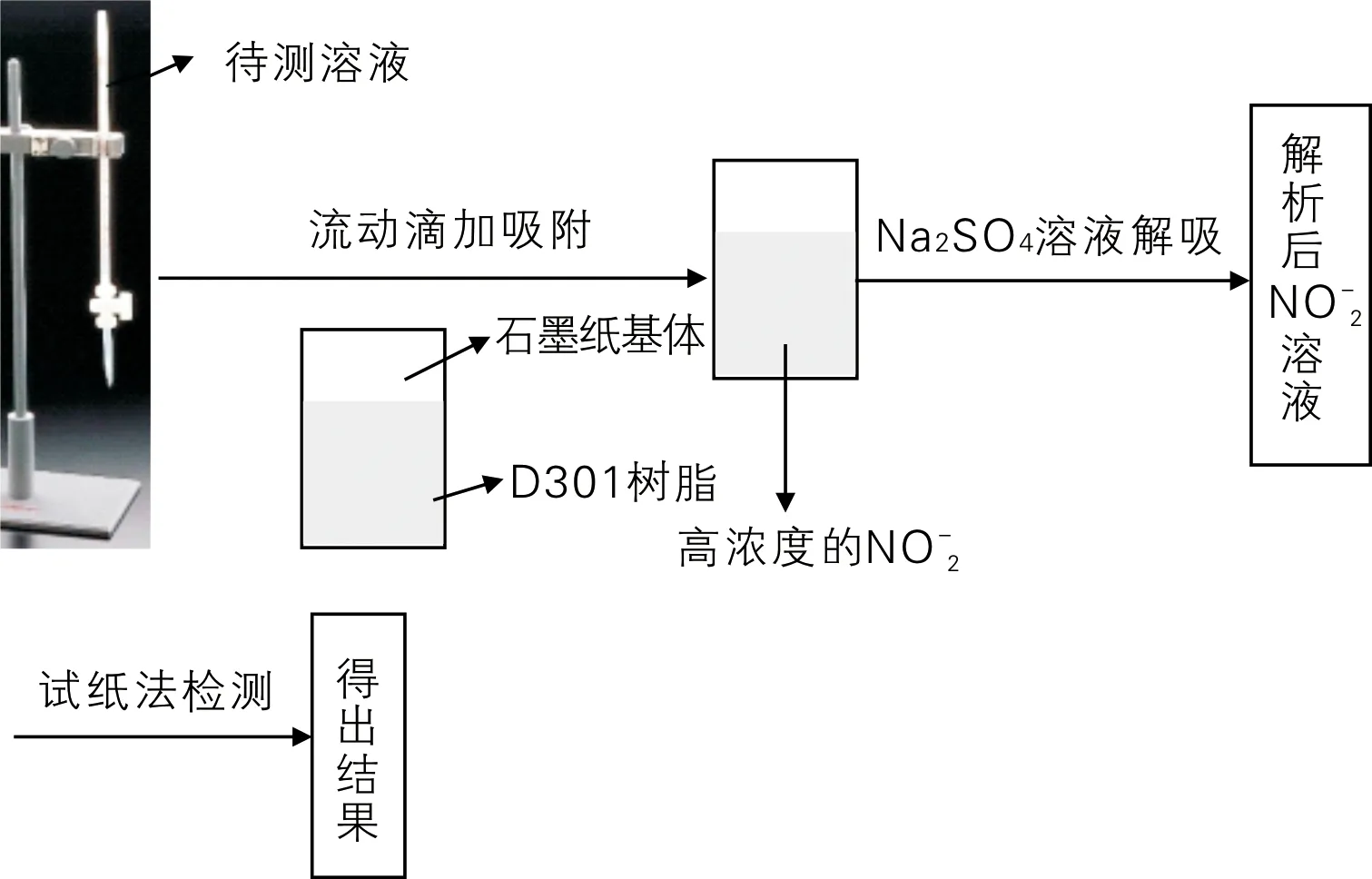
图1 试纸法检测亚硝酸根离子浓度的步骤流程图
1.2.4标准比色卡的制作
先配制100 mg/L的亚硝酸钠标准溶液,然后逐级稀释配制一系列浓度分别为0,5,10,20,30,40,50 mg/L的标准亚硝酸钠溶液,再将制作好的试纸(3 cm×0.5 cm)分别浸入上述标准溶液中,待颜色不变后,拍照记录。待试纸干燥后塑封即为标准比色卡。同样配制一系列浓度分别为5,4,3,2,1,0.5,0.4,0.3,0.2,0.1 mg/L的亚硝酸钠标准溶液,分别取10 mL上述溶液于酸式滴定管中,然后取吸附-解吸后的亚硝酸钠溶液于备用的试纸上,拍照记录,制作标准比色卡。
1.2.5实际样品的测定
对购买的榨菜、火腿和蔬菜进行预处理,将一定量剪碎的榨菜放在50 mL的烧杯中,加入30 mL的蒸馏水后,将其放入恒温水浴锅中(温度设定为 100 ℃),取其溶液备用。火腿和榨菜用同样方法处理。取一定量的新鲜蔬菜,冲洗干净,然后用豆浆机将其粉碎成菜汁,取出备用。分别把预处理好的样品放入酸式滴定管内,对其进行吸附-解吸测定,然后将测定结果与标准比色卡对比读出样品中亚硝酸盐的含量。
2 结果与讨论
2.1试纸纸基材料的选择
3种试纸的显色效果见表1。由表1可见,3种试纸的显色效果因试纸类型的不同而不同,对比表1中的结果不难看出,定性试纸效果最好,因此本实验选用2 cm×0.4 cm规格的定性试纸。
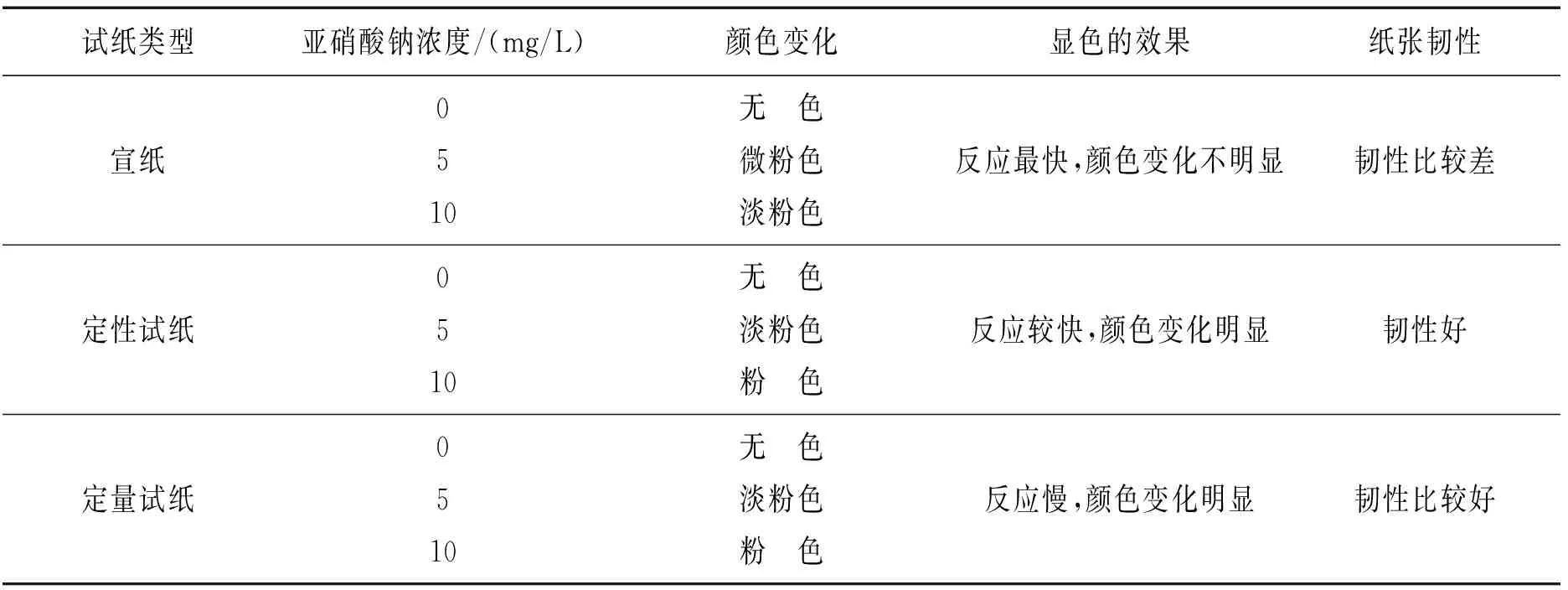
表1 3种试纸的显色效果
2.2反应时间对试纸显色效果的影响
亚硝酸钠浓度为40 mg/L时,反应时间对试纸显色效果的影响见表2。由表2可见,从第3 min开始,其颜色不再变化且为紫色,说明3 min内,试纸上的化学反应已经发生完全。因此本实验在3 min后记录试纸的颜色。

表2 反应时间对试纸显色效果的影响
2.3吸附树脂种类的选择
采用实验1.2.4中方法,直接用试纸法检测亚硝酸钠溶液浓度时,只能检测到5 mg/L以上的浓度,且灵敏度很低。为了提高检测灵敏度和降低检测下限,本实验采用树脂吸附低浓度的亚硝酸根离子来富集其浓度。不同类型的未研磨树脂对不同浓度亚硝酸根离子吸附解吸后,试纸颜色的变化结果见表3。由表3可知,当用D201树脂吸附时,试纸的颜色不变,但用D301树脂吸附时,当亚硝酸钠浓度从1 mg/L增大到5 mg/L时,试纸颜色由无变化到淡粉色。此现象说明D301树脂对亚硝酸根离子的吸附效果比D201树脂的吸附效果要好。因此,在实验中选择D301 树脂为吸附材料。

表3 不同种类树脂对亚硝酸根离子的吸附效果对比
2.4树脂颗粒大小的选择
尽管D301树脂对亚硝酸根离子具有吸附作用,但对其吸附-解吸后检测时,只能检测到4 mg/L以上的浓度,因此本实验将树脂研磨过筛得到颗粒小的粉末状来增加其表面积,从而提高吸附能力。亚硝酸钠溶液的浓度均为5 mg/L,不同颗粒大小的树脂吸附-解吸后试纸的颜色显示结果如图2所示。由图2可知未研磨的树脂吸附后,试纸显色效果不太明显,为微粉色;颗粒大小为250 μm的树脂吸附后,试纸显色效果略明显,为深粉色;颗粒大小为150 μm和74 μm的树脂吸附后,其试纸的显色效果较明显,都为紫色。为了达到良好的显色目的并且节省实验时间,本次实验选取颗粒大小为150 μm的树脂。

图2 不同颗粒大小树脂对亚硝酸根离子的吸附效果
2.5吸附方式的选择
为了使树脂充分吸附亚硝酸根离子,本实验探讨了3种吸附方式,即将涂有树脂的石墨纸直接浸泡在1 mg/L亚硝酸钠溶液中吸附、让其在电场中吸附、将亚硝酸钠溶液加入酸式滴定管中后流动滴加吸附。3种吸附方式对测定结果的影响见表4。从表4中可以看出,在浸泡吸附中,不管浸泡吸附10 min还是60 min,解吸后检测试纸均无变化,但是当加上电场后,30 min吸附解吸后检测,试纸呈粉色,当用流动滴加的方式时,10 min后吸附解吸检测,试纸显粉色。这说明流动滴加的方式吸附效果最好。原因是亚硝酸根带负电荷,在正电场中静电吸引下有利于吸附,而当用流动滴加的方式时,在重力作用下能与树脂充分接触,从而使吸附效果更好。所以在本实验中选用流动滴加的吸附方式。
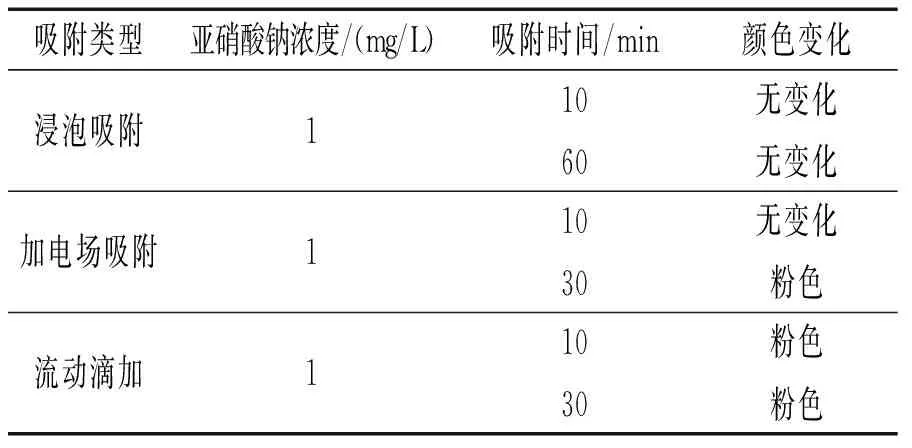
表4 3种吸附方式对测定结果的影响
2.6亚硝酸钠流动滴加体积的选择
将不同体积的0.1 mg/L亚硝酸钠溶液加入酸式滴定管中,采用流动滴加的方式吸附10 min后解吸检测的结果见表5。从表5中可以看出,流动滴加5 mL亚硝酸钠溶液吸附后解吸检测时,试纸颜色基本无变化,但当取10 mL以上的溶液吸附后解吸检测时,试纸颜色为微粉色。所以试纸对10 mL 以上的溶液富集后检测才有响应,为了节约样品,在实验中取10 mL 的亚硝酸钠溶液。

表5 流动滴加不同体积亚硝酸钠溶液的吸附效果
2.7直接检测和树脂吸附后检测的标准比色卡对比
试纸直接检测的标准比色卡如图3所示。由图3可见,随着亚硝酸钠溶液浓度的增加,试纸的颜色逐渐加深,说明颜色的深浅与亚硝酸钠溶液浓度成正比关系,当亚硝酸钠的浓度为5 mg/L 时,试纸的颜色为淡粉色,低于此浓度就基本看不出颜色的变化,因此用试纸直接检测亚硝酸钠浓度时,其检测下限为5 mg/L。树脂吸附-解吸后试纸检测的标准比色卡如图4所示。由图4可以看出,经过吸附-解吸后再测定时,试纸的颜色变化很明显,与图3相对比,同样为5 mg/L的亚硝酸钠溶液,未被富集时,直接检测的试纸颜色为微粉色,当亚硝酸根离子被富集后,其颜色为深紫色。由此说明用树脂吸附解吸后再检测亚硝酸盐浓度时,能够大大提高试纸检测的灵敏度。由图4可知,在亚硝酸钠溶液的浓度分为 5,4,3,2,1,0.5,0.4,0.3,0.2,0.1 mg/L时,随着浓度的降低,颜色越来越浅。当亚硝酸钠的浓度在0.1~0.3 mg/L之间时,其试纸颜色只有微小的差别,但也不能忽视。故用树脂吸附后其检测下限能达到0.1 mg/L。

图3 试纸直接检测的标准比色卡

图4 树脂吸附-解吸后试纸检测的标准比色卡
2.8检测限的判定
由图3和图4可知,亚硝钠溶液经过吸附-解吸后,观察到试纸颜色为:当亚硝酸钠溶液的溶度小于0.1 mg/L 时,该试纸呈现为无色;当亚硝酸钠溶液的浓度范围为0.2~0.4 mg/L 时,该试纸的颜色为微粉色,颜色略浅;当亚硝酸钠溶液的浓度范围为0.5~5 mg/L 时,该试纸的颜色逐渐加深,具有明显的变化。直接检测亚硝酸钠溶液的浓度,观察到试纸颜色为:当亚硝酸钠溶液的浓度范围为5~30 mg/L时,试纸的颜色也在逐渐加深,呈现不同的变化;当亚硝酸钠溶液的浓度为40~50 mg/L 时,该试纸的颜色呈现比较稳定的变化。因而,试纸的检测范围为0.1~50 mg/L。本实验的检测下限为0.1 mg/L,与传统的试纸法检测下限1 mg/L[19]相比,灵敏度明显提高。
2.9干扰实验
用试纸法检测食品中的亚硝酸根离子含量时,食品中的一些常见离子如Na+、Cl-、K+、SO42-、CO32-和HCO3-等可能会对测定结果造成干扰。在最优的实验条件下,在亚硝酸钠标准溶液中分别加入100倍NO2-浓度的上述干扰离子,采用D301树脂吸附后解吸检测,观察试纸显色情况。实验发现试纸颜色和未加入干扰离子的空白试纸颜色基本一致,这说明干扰离子对亚硝酸根离子浓度的检测无影响,试纸法可以应用于实际食品中的亚硝酸根离子含量的测定。
2.10样品的测定结果
用试纸分别测定蔬菜、火腿和榨菜中的亚硝酸盐含量并与国标法测定进行比较,其结果见表6。由表6可知,采用国标法检测的亚硝酸盐含量均在试纸法检测值范围内。因此,不需要严格测定结果的情况下,可用试纸法快速半定量检测食品中亚硝酸盐含量。
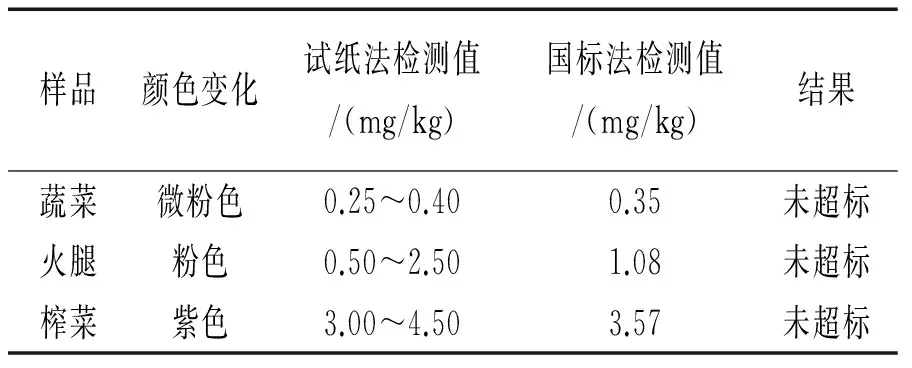
表6 样品中亚硝酸盐的测定结果
注:试纸法检测值(mg/kg)转换公式为C=(C0*V)/m,其中,C表示样品中试纸法检测值(mg/kg);C0表示样品测定结果与标准比色卡对比读出的样品中亚硝酸盐的含量(mg/L);V表示样品配成的溶液体积(L);m表示样品质量(kg)
3 结论
本研究采用定性试纸法快速测定亚硝酸盐浓度,并用树脂吸附富集低浓度亚硝酸盐,将试纸法和树脂吸附富集法联用,提高了检测的灵敏度。探讨了吸附树脂的种类、树脂颗粒的大小、吸附方式等对测定结果的影响,实验表明150 μm的D301树脂采用流动滴加的方式吸附解吸亚硝酸根离子的测定结果最好。在最优的实验条件下,该试纸法检测亚硝酸钠浓度的范围为0.1~50 mg/L。溶液在试纸上3 min即可稳定显色,此方法简便快捷,能应用于实际样品中亚硝酸盐浓度的检测。
[1] Zhang ML,Huang DK,Cao Z,et al.Determination of trace nitrite in pickled food with a nano-composite electrode by electrodepositing ZnO and Pt nanoparticles on MWCNTs substrate[J].LWT-Food Science and Technology,2015,64(2):663-670.
[2] Dutra MP,Ramos EM,Ramos ADLS,et al.Gamma radiation and storage time on lipidic oxidation,color, heme pigments and residual nitrite of bologna-type sausages formulated with different nitrite additions[J].Ciência Rural,2011,41(12):2203-2209.
[3] Boningari T,Smirniotis PG.Impact of nitrogen oxides on the environment and human health:Mn-based materials for the NOx abatement[J].Current Opinion in Chemical Engineering,2016,13:133-141.
[4] Jakszyn P,González C A.Nitrosamine and related food intake and gastric and oesophageal cancer risk:A systematic review of the epidemiological evidence[J].World Journal of Gastroenterology,2006,12(27):4296-4303.
[5] Yue R,Lu Q,Zhou Y.A novel nitrite biosensor based on single-layer graphene nanoplatelet-protein composite film[J].Biosensors & Bioelectronics,2011,26(11):4436-4441.
[6] Hornyak I,Kozma L,Lapat A,et al.Spectrofluorimetric determination of diethazine and promethazine in pharmaceutical preparations[J].Biomedical Chromatography Bmc,1997,11(2):99-101.
[7] 周令国,祝义伟,肖琳,等.傅立叶近红外光谱法快速测定腊肉中亚硝酸盐[J].食品研究与开发,2013(17): 89-91.
[8] AydIn A,Ercan O,Taclolu S.A novel method for the spectrophotometric determination of nitrite in water[J].Talanta,2005,66(5):1181.
[10] 张捷莉,丁博,刘志强,等.几种肉制品中亚硝酸盐含量的测定[J].食品科技,2006,31(9):242-244.
[11] 贺冬秀,李贵荣,杨慧仙,等.罗丹明B共振光散射法测定水中痕量亚硝酸根[J].中国卫生检验杂志,2004,14(6):689-690.
[12] 李建平,屈优优,魏小平.甲基橙亚硝化极谱法测定亚硝酸根[J].分析试验室,2001,20(3):60-62.
[13] Khan MR,Wabaidur SM,Alothman ZA,et al.Method for the fast determination of bromate,nitrate and nitrite by ultra performance liquid chromatography-mass spectrometry and their monitoring in Saudi Arabian drinking water with chemometric data treatment[J].Talanta,2016,152:513-520.
[14] 屈智慧,邹东雷,张思相,等.亚硝酸根试纸的开发与研制[J].化学工程师,2005,19(7):1-4.
[15] He BS,Wei F,Gao N,et al.Fast Detection of Nitrite with a Test Paper Tape[J].Advanced Materials Research,2012,538-541:2181-2183.
[16] 熊桂慧,赵东风,李石,等.D201树脂的SO42-吸附及脱附性能[J].环境工程学报,2017,11(1):366-370.
[17] 曾君丽,邵友元,易筱筠,等.D301弱碱性阴离子交换树脂吸附Cr(Ⅵ)的研究[J].环境科学与技术,2012(8):10-15.
[18] 郑申声,周小华,陈迅.用D201阴离子交换树脂从脱硫废液中分离硫氰酸根[J].能源化工,2007,28(4):12-15.
[19] 欧少清,袁斌,许元豪.亚硝酸盐检测试纸的研制[J].轻工科技,2009,25(4):38-39.
Test Paper Rapid Determination of Nitrite by Using Resin Adsorption Enrichment
XiongHuijuan1,ZhanQiuling1,ZengXiaoming2,WuHaizhi2,LiuHai1,SiShihui1*
(1School of Chemistry and Chemical Engineering,Central South University,Changsha Hunan 410083;2Hunan Commodity Supervision and Inspection Research Institute,Changsha Hunan 410007)
In order to quickly and easily measure nitrite ions,the concentration of nitrite was enriched by adsorption of nitrite ions with D301 resin,and then desorbed with 1.0 mol/L sodium sulfate solution,afterwards,test strip was employed to detect the solution.The overall test process was based on the coupling principle that nitrite could couple with p-aminobenzenesulfonic acid and naphthalene ethylenediamine hydrochloride in the acidic conditions to form purple-red compounds appearing on the test paper,and color depth of test paper was proportional to nitrite content.Under the optimum experimental conditions,the concentration of sodium nitrite solution in the test paper was in the range of 0.1~50 mg/L.The test method had good anti-interference,better sensitivity,facile and simple operation.and could be applied to the rapid detection of nitrite in the actual sample.
ion exchange resin;test paper method;nitrite
2017-06-13
湖南省质量技术监督管理局科研项目(项目编号201602)。
熊慧娟,硕士生。
*通讯作者:司士辉,教授,博士,博士生导师,研究方向:食品分析、环境分析研究。
10.3969/j.issn.2095-4565.2017.05.007
O661
A
2095-4565(2017)05-0029-06
(责任编辑高嵩)

