关于电解质溶液教学若干问题的探讨
王云生



摘要:依据中学电解质教学实际,探讨离子反应发生的条件、离子方程式的书写以及“电解质溶液三大平衡”等知识与技能的教学;结合高考考试要求,就电解质溶液教学中补充讲解“质子平衡”方程的必要性做分析。提出电解质溶液教学的注意点:要把握好教学要求,全面解读教材,遵循学生的认识规律;知识与技能的教学,切忌要求过高过急,克服随意扩展延伸,用大量练习代替分析解决问题能力培养的弊病。
关键词:电解质溶液;教学要求;教材解读;能力培养
文章编号:1005–6629(2017)10–0040–04 中图分类号:G633.8 文献标识码:B
电解质溶液基本原理是高中化学最基础、最核心的教学内容之一,学习时间跨度大,是必修也是选修《化学反应原理》模块的重要内容。这部分内容教学难度大,教学效果往往不够理想。平时教学,尤其高考总复习期间,花在这些内容的教学、复习和练习的时间多,效果并不佳。不少学生对电解质溶液原理知识的理解肤浅,应用于分析、解决有关酸、碱、盐溶液的组成、化学反应等问题,往往感到困难;高考相关试题的解答,得分率普遍不高。其原因涉及许多方面。从教学层面上看,教师在教学要求的把握、教材的解读上,就有不少问题值得探讨。为了进一步了解情况,我们就电解质溶液原理和教学要求的把握等问题,在一个省的地区高中化学教师群体中做了一次问卷调查(该地区基础教育尤其化学教学质量是较好的)。从97份有效问卷的数据统计结果,也证实了我们的判断。以下以电解质溶液教学中常见的三个问题为例,做粗浅的分析探讨。
1 关于离子反应发生的条件
问卷调查中对于“离子反应发生的条件是什么?”的问题,有25%的教师认为“离子反应发生的条件是要有沉淀、气体、难电离物质生成”;有20.6%的教师把该结论进一步引伸为“离子反应总是向离子浓度降低的方向进行”。只有60.8%的教师认为“有沉淀、气体、难电离物质生成只是离子互换反应发生的条件,不能说明氧化还原型离子反应的发生”;认为“可以从热力学角度,用自由能的变化做判据说明离子反应进行的方向”的教师仅有5.1%。
分析离子反应发生的条件(或离子反应自发进行方向),应该和分析其他化学反应自发进行条件一样,可以用热力学数据做判据。依据在一定温度、压力条件下,反应的吉布斯自由能ΔG=ΔHTΔS是否小于0来判断。酸、碱、盐在溶液中离子互换反应,若有沉淀、气体生成,由于发生了相变,ΔS发生了很大变化;若有难电离物质生成,ΔH有较大的降低。因此,这些离子反应的自由能ΔG=ΔH-TΔS都小于0,都能自发进行。因此,当酸、碱、盐在溶液中的离子互换反应有沉淀、气体、水(难电离物质)生成时,可以判断反应能发生。有沉淀、气体、水(难电离物质)生成的离子互换反应,溶液中某些或某种离子浓度必然降低。但这不意味着,所有的离子反应总是朝着离子浓度降低的方向进行。例如,醋酸和氨水的反应,金属钠和水的反应,离子浓度都增大,由于反应的ΔG<0,都能自发进行。从因果关系上看,离子反应生成沉淀、气体、水(难电离物质)是反应发生的宏观现象,不是反应发生的根本原因。离子反应和所有化学反应一样,反应的推动力是反应自由能的降低。
现行三种版本的高中教材,对离子反应发生的条件,表述不尽相同,但给出的结论性论述都是科学的,适合于刚学习离子反应知识的高中学生。例如,“酸、碱在水溶液中发生的复分解反应,实质上就是电解质在溶液中相互交换离子的反应,这类离子反应发生的条件是:生成沉淀、放出气体或生成水。只要具备上述条件之一,反应就能发生”[1]。在后续课程的学习中,又指出,“由能量判據(以焓变为基础)和熵判据组合而成的复合判据,将更适合所有的过程……”[2]。又如,“如果离子之间结合生成沉淀、弱电解质或气体(挥发性物质),或者发生氧化还原反应,使溶液中某种或某些离子浓度降低,就会发生离子反应”;“通常可利用焓变与熵变判据、平衡常数判据来判断离子反应的方向”,“在温度、压强一定时,利用ΔH-TΔS判据可以判断离子反应能否自发进行”[3]。如果能全面解读、正确理解教材,应当可以避免出现上述论述不够严谨、归纳片面等问题,给学生的后续学习带来负迁移。
2 关于离子方程式书写的教学方法
离子方程式书写在教学中常见有两种方法。一是在初学阶段强调按4个步骤,即先写出反应的化学方程式、再把溶于水且完全电离的物质写成离子形式、难溶于水或溶于水但难电离的物质仍用化学式表示,删去化学方程式两边不参加反应的离子。最后配平离子方程式,使离子方程式两边各元素的原子数目和离子所带的电荷总数相等。问卷调查中,有55.6%教师在教学中用“写、拆、删、平”四字口诀归纳这四个步骤,让学生依据四步法做练习从化学方程式改写成离子方程式。有33%的教师只强调记背四字口诀,做大量练习。部分学生由于初中化学基础不扎实,必修模块教学内容多、课时偏少,教学赶进度,所掌握的常见酸、碱、盐组成、常温下的存在状态、溶解性等知识不多、不熟练,要按四步骤书写,在拆和删两步上存在较大的困难。如果教师没有注意帮助学生认识要“拆”得正确,关键是要能正确判断反应物在水溶液里的存在形式,正确区分反应物是电解质还是非电解质、是强电解质还是弱电解质、在稀溶液中可否完全电离、依什么样的规律电离成自由移动离子;没有注意帮助学生掌握借以判断反应是否有沉淀、水(难电离物质)、气体生成所必备的知识,学习效果必然不佳。如果形成性练习的选择、运用要求过急、过高,学生难免会出现囫囵吞枣,随意拆分化学式、拼凑离子方程式等问题,甚至对离子反应的分析、书写产生畏惧心理。
离子方程式的书写不仅是技能问题,需要对要表述的离子反应的本质有比较深刻的理解。帮助学生形成正确运用离子方程式描述离子反应的能力,不能靠熟记“离子方程式书写方法(步骤)”和大量的机械操练。问卷调查发现只有29.9%的教师认同“离子方程式是表述离子反应的工具,只有理解所要表述的反应的本质才能正确书写”的看法。不少教师没有意识到,离子反应的分析、离子方程式的书写,只能在元素化合物教学中结合电解质溶液间的反应事例,逐步扩展、逐步提高。不能希望靠“四步法真经”一步教会、学会。如何把握学生的认识规律,帮助学生深刻理解离子反应的本质和描述方式,是提高离子方程式书写教学效果的关键。endprint
3 关于电解质溶液“三大平衡”的教学问题
电解质溶液的教学,要求学生会运用有关原理来分析、判断和比较电解质水溶液的pH、离子浓度的大小,加深对有关电解质溶液的基本概念和基本知识的理解,提高灵活运用有关知识分析、解决问题的能力。
分析、判断电解质溶液中氢离子浓度或某种离子浓度大小的问题,涉及溶液浓度、溶液pH、电解质电离、强弱电解质、电离平衡及其移动、电离平衡常数、电离度、水的电离、盐的水解等重要化学概念和原理知识。在不少中学教学实际中,一些教师认为要达到上述要求,必须在电解质溶液的教学中,尤其在高三总复习中,补充讲解和练习有关电解质溶液物料平衡方程、电荷平衡方程、质子条件方程的教学内容。他们在教学中用不少时间给学生补充扩展大学分析化学的相关内容,让学生做大量练习,削弱了上述基础知识的复习和基本观念的教育。问卷调查发现,有34%的教师认为,“电解质溶液三大守恒,虽然课标不要求,教科书没写,但是对于分析判断电解质溶液中各组分浓度大小、溶液的pH等问题是非常有用的,应该补充”。仅有4.1%的教师认为“这些内容是大学分析化学处理酸碱平衡有关计算问题的学习内容,中学生对酸碱质子理论理解不深,质子条件方程不是课标学习要求,难度大,不宜、也不必讲授”。
要用中学化学电解质溶液的教学要求分析、判断补充讲解电解质溶液“三大平衡”教学内容的必要性。中学电解质溶液教学中应该帮助学生形成的几个基本观念中,就包含了物料平衡、电荷平衡的基本含义:
(1)电解质溶液是电中性的。电解质溶液中存在带电的自由移动离子,但是,从整体看,电解质溶液总是呈电中性的,因为溶液中阴、阳离子所带电荷电性相反,总量相等。
(2)电解质溶液中的各种组分,会发生电离或水解等变化,但这些变化也遵循质量守恒定律。电解质溶液各组分无论发生电离、水解或其他化学变化,变换存在的形式,但组成该组分的各元素的原子总数不会发生变化。
这些观念的形成,并不一定需要靠到高三总复习时补充物料平衡方程、电荷平衡方程知识来达到。高考中诸如下述关系式的理解和掌握,应是平时教学的基本其求:
就质子条件方程(或质子平衡方程)的教学而言,有的教师认为,应补充讲解质子平衡,让学生掌握“酸碱反应结果,有些物质失去质子,有些物质得到质子,碱得到的质子的量(mol)与酸失去的质子的量(mol)相等”,难度大,学生不好理解,只讲“电解质溶液中各组分,包括水,在发生变化中可以得到或失去质子(H+),但质子的总的物质的量是相等的”。让学生据此判断、比较、电解质溶液中各种离子浓度大小关系或计算溶液的pH。近几年来,有关中学化学质子平衡的教学和讨论,十分热闹。各种化学教学刊物、网络上,有不少介绍、分析文章。例如,有教师以2009年江苏高考化学试题13为例,详细分析如何应用质子平衡判断该题D选项的正确性。文章还指出江苏2008年高考化学选择题12、2014年高考化学试题选择题14等难度较大的选项都可以用质子平衡方程来分析解答[4]。

中学化学的教学和高考大纲都没有掌握、应用质子平衡方程的要求。大学分析化学讲解、讨论电解质溶液的质子条件是为了定量地处理酸碱平衡有关计算的问题。纯粹为了解答某些练习、试题,孤立地讲授质子平衡方程,做各种关系式变换的操练,是否有助于电解质溶液原理的理解和应用能力的提高?对于基础好、学有余力的学生,做适当的提高是可以的,但对于多数学生还是不补充为好。
近几年高考中常见有关电解质溶液pH、离子浓度的综合分析试题,大都着眼于考查考生是否具备依据试题的情景和提供的信息(尤其是实验的数据图表),用最基础、最核心的知识做分析、比较和推理,得出正确认识的能力。并不需要在知识学习的深度和广度上,补充电解质溶液“三大平衡”,做扩展延伸。例如,2012年高考北京化学试卷中的一道试题(为节省编幅,试题文字略有改动):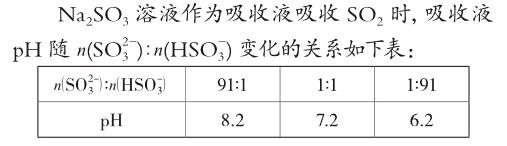
(1)利用上表数据判断NaHSO3溶液显性,用化学平衡原理解释: 。
解答思路:由表中信息分析,可知NaHSO3溶液为酸性溶液,c(H+)>c(OH-)。
(2)吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
不少教师在教学实践中也发现,花时间补充讲解电解质溶液“三大平衡”,增加了学生学习负担,而且学习效果也不理想;提高讲授知识的深广度,辅以大量练习,并不是有效提高学生分析、解决问题的能力的好方法。但受从众心理的影响,为应付“万一出现的考题”,仍然照样做讲解、练习。
严格依据课程标准、依据学生心理发展规律实施教学,切实做到在加强最基础、最核心知识的基础上,提高学生分析、解决问题的能力,需要真正认真地对待和落实。
参考文献:
[1]王晶主编.普通高中课程标准实验教科书·化学1[M].北京:人民教育出版社,2014:36.
[2]王晶主编.普通高中课程标準实验教科书·化学反应原理[M].北京:人民教育出版社,2014:47.
[3]王明召主编.普通高中课程标准实验教科书·化学反应原理[M].济南:山东科学技术出版社,2006:102~105.
[4]周惠忠.双组分混合溶液中质子守恒式的书写[J].化学教学,2015,(3):67~69.endprint

