饥饿对龙虎斑幼鱼生长和饵料利用的影响
王成桂,梁华芳,陈嘉华
( 广东海洋大学 水产学院,广东 湛江 524088 )
饥饿对龙虎斑幼鱼生长和饵料利用的影响
王成桂,梁华芳,陈嘉华
( 广东海洋大学 水产学院,广东 湛江 524088 )
在室内0.5 m3玻璃钢桶对平均体质量为(31.3±3.8) g的龙虎斑进行36 d的养殖试验以研究不同的饥饿时间对龙虎斑生长和饵料利用的影响。按试验鱼停止投饵0(对照组)、4、8、12、16 d后再恢复投喂的方案进行试验。试验结果表明,各组的平均体质量差异显著(P<0.05),停止投饵4 d组高于对照组,停止投饵8、12 d组低于对照组,差异不显著(P>0.05),停止投饵16 d组显著低于对照组(P<0.05);日增体质量和质量增加率差异显著(P<0.05),停止投饵4 d组最大,与对照组差异不显著(P>0.05),停止投饵8 d组、停止投饵12 d组和停止投饵16 d组的日增体质量和质量增加率显著低于对照组(P<0.05);各组的特定生长率差异显著(P<0.05),停止投饵4 d组显著高于对照组(P<0.05),停止投饵8 d组和对照组差异不显著(P>0.05),停止投饵12 d组和停止投饵16 d组显著低于对照组(P<0.05);各饥饿组的摄食率显著低于对照组(P<0.05);各组的食物转化率差异显著(P<0.05),停止投饵4 d组和停止投饵8 d组差异不显著(P>0.05),但显著高于对照组(P<0.05),停止投饵12 d组的食物转化率和对照组差异不显著(P>0.05),停止投饵16 d组显著低于对照组(P<0.05)。停止投饵4 d组具有超补偿生长能力,停止投饵8 d组和停止投饵12 d组具有部分补偿生长能力,停止投饵16 d组不具备补偿生长能力,停止投饵4 d组、停止投饵8 d组和停止投饵12 d组主要是通过提高食物转化率的方式达到补偿生长。因此,适度饥饿后再投喂以提高食物转化率的方式可以作为龙虎斑有益的养殖管理策略。
龙虎斑;饥饿;生长;饵料利用
龙虎斑是由鞍带石斑鱼(Epinepheluslanceolatus♂)(俗称龙趸石斑鱼)与棕点石斑鱼(E.fuscoguttatus♀)(俗称老虎斑)杂交的后代,又称珍珠龙趸石斑鱼、珍珠斑等, 杂交优势明显,具有鞍带石斑鱼生长速度快和棕点石斑鱼抗病力强的遗传特性[1-2],并且肉质细嫩,商品鱼市场价格较好,是近几年沿海地区快速发展起来的养殖新品种。
由于季节更替、生活环境变化等因素引起食物的分布在不同时期的不均匀,动物常会遇到在一定时期的食物缺乏而受到饥饿的胁迫。作为动物生理生态学上的一种适应性反应,动物会在继营养不足甚至饥饿后再恢复正常摄食时表现出超越正常摄食个体的生长速度,称为补偿生长现象[3]。目前许多研究已对多种鱼类的补偿生长现象进行了报道,如千年笛鲷(Lutjanussebae)[4]、卵形鲳鲹(Trachinotusovatus)[5]、太平洋鲑鱼(Oncorhynchussp.)[6]、眼斑拟石首鱼(Sciaenopsocellatus)[7]、西伯利亚鲟(Acipenserbaerii)[8]、奥尼罗非鱼(Oreochromisaureu×O.niloticus)[9]等,由于龙虎斑是新开发的养殖品种,诸如此类的研究报道较少。本试验拟分析不同的饥饿时间对恢复再投喂的龙虎斑日增体质量、质量增加率、特定生长率、摄食率、食物转化率等特性的影响,研究龙虎斑饥饿后的补偿生长方式,以期为龙虎斑的养殖生产提供有益的参考资料。
1 材料与方法
1.1 试验材料
1.1.1 试验用水
采用自然海区海水,自海底沙井中抽提、沉淀后使用。盐度26~28、pH 8.0~8.2、温度27~28 ℃。
1.1.2 试验饵料
饵料为“中丸牌”海水鱼配合饲料(石斑鱼专用),主要原料组成为鱼粉、乌贼粉、酵母粉、豆粕等,根据试验鱼的规格选用4#~6#料投喂。
1.1.3 试验用鱼
2014年7月28日,龙虎斑苗购自广东省湛江市东海岛简镇海神公司,用充氧运输方法运至广东海洋大学东海岛海洋生物研究基地,置于室内水泥池暂养7 d后,选择活力好,体表无明显伤痕、规格相对一致[平均体质量(31.3±3.8) g]的龙虎斑进行试验。
1.2 试验方法
试验在基地室内车间进行,试验分成5组,分别停止投饵0(对照组)、4、8、12、16 d后再恢复投喂,整个试验周期36 d。每组设置3个重复,试验桶为0.5 m3的玻璃钢桶,每桶放养试验鱼15尾,桶内放置一个气石,24 h连续充气。每日8:00和17:00投饵,慢慢投喂,直至所有鱼不抢食为止,记录每次的投喂量。每日上午投喂前换水1次,换水量80%,换水时排出粪便,保持试验桶内良好的水环境。每隔4 d测量鱼的体质量,投饵前测量,数据精确至0.1 g。测量过程轻拿轻放,尽量不要损伤试验鱼,以免影响到下一步试验。
1.3 数据分析和处理
试验数据采用SPSS 19.0统计软件进行分析处理,描述性统计值用平均值±标准差表示,以P<0.05显著性水平进行单因素方差分析,有显著性差异的数据再作Duncan多重比较。日增体质量、质量增加率、特定生长率、摄食率、食物转化率分别按下式计算:
日增体质量/g=(mt-m0)/t
质量增加率/%=(mt-m0)/m0×100%
特定生长率/%·d-1=(lnmt-lnm0)/t×100%
摄食率/%=ct/[t×(mt+m0)/2]×100%
食物转化率/%=(mt-m0)/ct×100%
式中,t为养殖周期(d),mt为终末体质量(g),m0为试验初始体质量(g),ct为t时间内的摄食总量(g)。
2 结 果
2.1 饥饿对龙虎斑体质量生长的影响
随着饥饿时间的增加,试验鱼的体质量缓慢下降,但第4 d差异不显著(P>0.05),对照组和停止投饵4 d组的平均体质量差异不显著(P>0.05),并保持至试验结束,但对照组和停止投饵4 d组与其他3组差异显著(P<0.05)。停止投饵16 d组与其他各组差异显著。恢复投饵后,各试验组鱼的体质量开始较快生长,至试验的32 d,停止投饵4 d组、停止投饵8 d组、停止投饵12 d组的平均体质量与对照组差异不显著(P>0.05),但与停止投饵16 d组差异显著,停止投饵16 d组还未得到完全恢复。试验结束时,停止投饵4 d组质量最高,为60.8 g,其次为对照组、停止投饵8 d组和停止投饵12 d组,分别为61.1、60.0、54.5 g,最轻为停止投饵16 d组,仅49.5 g(表1)。停止投饵4 d组与对照组差异不显著,但与其他试验组差异显著(P<0.05)。
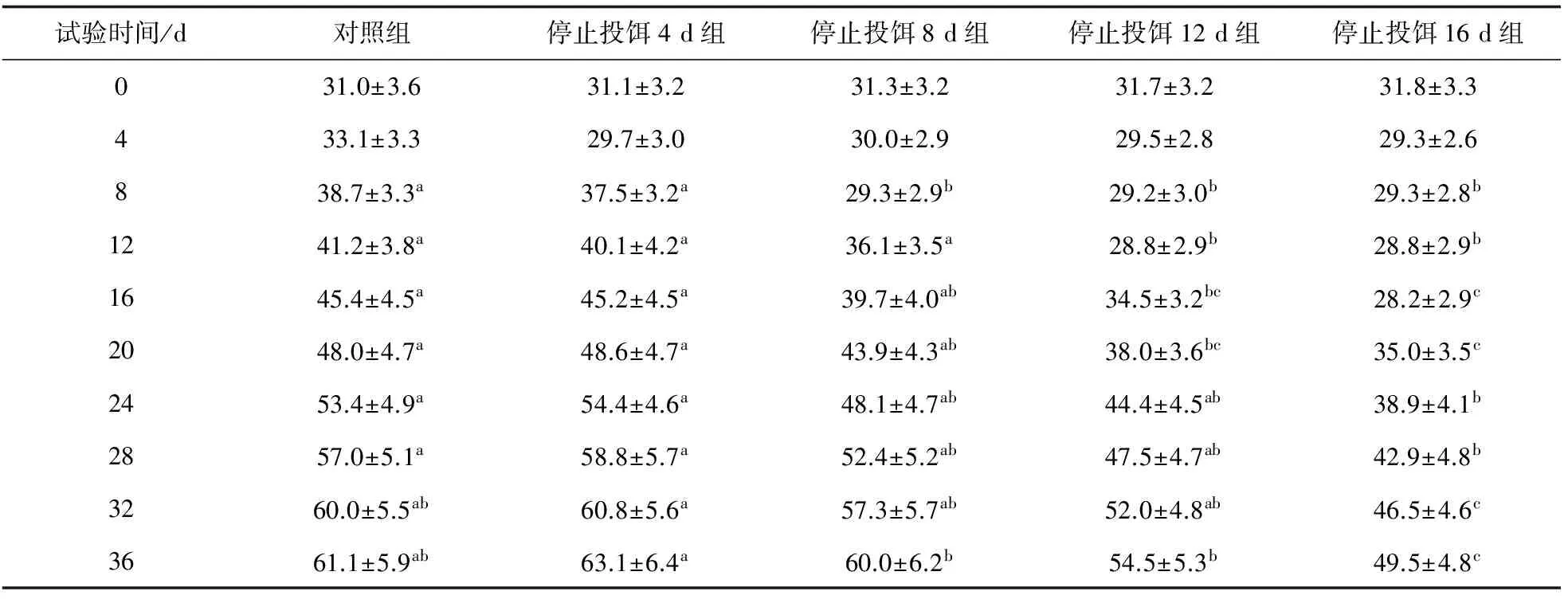
表1 龙虎斑在不同试验时间平均体质量
注:同行的不同字母表示差异显著(P< 0.05).下同.
以恢复投喂后的养殖时间(t)为自变量,平均体质量(m)为因变量进行线性回归分析,建立回归方程(表2)。回归方程的显著性水平均<0.01,变量具有极显著的相关性,所建立的回归方程有效。回归方程的斜率均>0,平均体质量和养殖时间具有正相关关系,各方程的斜率表示龙虎斑的生长速度,其值越大表示生长速度越快。对照组平均体质量回归方程斜率最小,为3.5752,停止投饵8 d组最大,为4.3238,其次为停止投饵12 d组、停止投饵4 d组和停止投饵16 d组,分别为4.3429、4.1683和4.1429。

表2 饥饿对龙虎斑平均体质量的回归分析
2.2 饥饿对龙虎斑、日增体质量、质量增加率和特定生长率的影响
各组在试验周期内日增体质量、质量增加率存在显著差异(P<0.05)(表3)。对照组和停止投饵4 d组的日增体质量无显著性差异(P>0.05),但显著大于停止投饵8、12、16 d组(P<0.05),停止投饵8、12、16 d组间差异显著(P<0.05);日增体质量最大的为停止投饵4 d组,为0.89 g,其次分别为对照组、停止投饵8 d组和停止投饵12 d组,分别为0.84、0.80 g和0.63 g,停止投饵16 d组最小,为0.49 g。对照组和停止投饵4 d组的质量增加率无显著性差异(P>0.05),但显著大于停止投饵8、12、16 d组(P<0.05),停止投饵8、12、16 d组间差异显著(P<0.05);质量增加率最大的为停止投饵4 d组,为102.89%,其次分别为对照组、停止投饵8 d组和停止投饵12 d组,分别为97.10%、91.69%和71.92%,停止投饵16 d组最小,为55.66%。在整个试验中,对照组和停止投饵4 d组的质量增加率大于停止投饵8、12、16 d组;第20 d后,停止投饵4 d组的质量增加率大于对照组,停止投饵8 d组大于停止投饵12 d组,停止投饵16 d组的质量增加率最小。

表3 龙虎斑的日增体质量、质量增加率、特定生长率、摄食率、食物转化率
各组在试验周期内的特定生长率差异显著(P<0.05)。停止投饵4 d组最大,为1.97%/d,显著高于其他组(P<0.05);对照组和停止投饵8 d组差异不显著(P>0.05),分别为1.88%/d和1.81%/d,显著高于停止投饵12 d组和停止投饵16 d组(P<0.05);停止投饵12 d组为1.51%/d,显著高于停止投饵16 d组(P<0.05);停止投饵16 d组最小,为1.23%/d(表3)。在试验过程中,停止投饵8、12、16 d组的特定生长率小于对照组和停止投饵4 d组,试验前期,对照组的特定生长率大于停止投饵4 d组,第20 d后,停止投饵4 d组大于对照组(图1)。
2.3 饥饿对龙虎斑摄食率、食物转化率的影响
各试验组的摄食率差异显著(P<0.05)。对照组最大,为2.51%,显著高于其他组(P<0.05),其次为停止投饵4 d组和停止投饵8 d组,分别为2.27%和2.22%,显著高于停止投饵12 d组和停止投饵16 d组(P<0.05),停止投饵12 d组为2.07%,显著高于停止投饵16 d组(P<0.05),停止投饵16 d组最小,仅1.89%。各试验组的食物转化率差异显著(P<0.05),停止投饵4 d组最大,为82.96%,其次为停止投饵8 d组,为78.73%,停止投饵4 d组和停止投饵8 d组差异不显著(P>0.05),但显著高于其他组(P<0.05),对照组和停止投饵12 d组差异不显著(P>0.05),分别为72.22%和71.01%,显著高于停止投饵16 d组(P<0.05),停止投饵16 d组最小,为63.96%(表3)。

图1 饥饿对龙虎斑特定生长率的影响
3 讨 论
3.1 饥饿对龙虎斑生长的影响
鱼类的补偿生长按照其类型可分为超补偿生长、完全补偿生长、部分补偿生长和不能补偿生长[10]。本试验中,龙虎斑饥饿4 d后恢复投喂,其特定生长率显著高于对照组(P<0.05),平均体质量和质量增加率高于对照组,具有超补偿生长能力,与对真鲷(Pagrosomusmajor)[11]的补偿生长研究发现饥饿9、12、15 d的真鲷具有超补偿生长能力的结果类似,亦与发现饥饿5 d后的美国红鱼[7]也具有超补偿生长的现象相同;停止投饵8 d组和停止投饵12 d组恢复投喂后,短期内生长速度加快,恢复期内回归方程的斜率较其他组大,但试验结束时,体质量均低于对照组,表现部分补偿生长现象,同饥饿处理4周和6周后的黄鳍鲷(Sparuslatus)、饥饿6周和9周的斑点叉尾(Ictaluruspunctatus)表现类似[12-13],恢复摄食后只具有部分补偿能力;停止投饵16 d组经恢复投喂后,生长速度加快,但试验结束时的平均体质量低于对照组,日增体质量和质量增加率均低于对照组,整个试验过程生长速度未及对照组,不能补偿生长。
鱼类对饥饿时间有一定范围的承受,超出这一范围,生长不能恢复,甚至可能带来长时期的生长停滞[13-14]。有关学者提出的“不可逆点”表明,饥饿鱼在不可逆点时尽管还可以存活一段较长的时间,但太虚弱而不具备再恢复摄食和生长的能力[15-16]。本试验中,试验鱼最长的饥饿时间为16 d,恢复投喂后,饥饿处理组回归方程的斜率均大于对照组,饥饿后的试验鱼虽然具备摄食和生长的能力,但龙虎斑尚未达到不可逆点,龙虎斑承受饥饿的能力应超过16 d。补偿生长过程中鱼体的特定生长率表现为先上升一段时间后再恢复至正常水平,如果恢复时间太短特定生长率仍未能恢复至正常水平,则不能体现补偿生长效应[17],本试验亦有同样的结果,停止投饵4 d组受饥饿时间较短,恢复时间较长,特定生长率能恢复至正常水平,试验结束时甚至超过对照组,停止投饵16 d组在恢复期生长速度加快,但恢复时间太短,特定生长率未能追上对照组,亦未能体现补偿生长效应。
3.2 饥饿对龙虎斑饵料利用的影响
有研究表明,饥饿后恢复投喂时鱼类体内立即进行大量合成作用,代谢水平将迅速升高,补偿生长是鱼类在恢复喂食时增加了食欲,大幅度提高摄食水平实现的[10]。本试验中,对照组的摄食率显著高于其他组(P<0.05),停止投饵4 d组的摄食率亦显著低于对照组(P<0.05),但停止投饵4 d组的生长速度快于对照组,表明本试验饥饿鱼的补偿生长并不是通过提高摄食水平实现的。对于补偿生长机制的具体原因,目前尚有争议,也有观点认为,饥饿使鱼类标准代谢降低,当恢复投喂时,代谢还不能立即适应高水平的食物摄入,较低的代谢水平能维持一段时间,这样代谢所用能量降低而用于生长的能量比例增加,从而提高食物转化率,达到补偿生长[18-19]。本试验中,停止投饵4 d组和停止投饵8 d组试验鱼的食物转化率显著高于对照组,停止投饵4 d组和停止投饵8 d组通过提高食物转化率从而达到补偿生长,停止投饵12 d组与对照组差异不显著,略低于对照组,表现部分补偿生长能力,停止投饵16 d组的食物转化率显著低于对照组,不具备补偿生长能力。有研究发现,饥饿鱼以提高食物转化率的方式达到补偿生长[20],本试验亦有类似的结果。
4 结 论
龙虎斑饥饿后恢复摄食,饥饿4 d的试验组具有超补偿生长能力,饥饿8 d和12 d的试验组具有部分补偿生长能力,饥饿5 d不具备补偿生长能力,饥饿4、8、12 d的试验组主要是通过提高食物转化率的方式达到补偿生长效应。因此,适度饥饿后再投喂可作为龙虎斑有益的饲养管理策略。
[1] 梁华芳,黄东科,吴耀华,等.温度和盐度对龙虎斑存活与摄食的影响[J].广东海洋大学学报,2013,33(4):21-26.
[2] 郑石勤.珍珠龙胆 石斑鱼明日之星[J].海洋与渔业,2011(3):47.
[3] Wang Y, Cui Y B. Compensatory growth in hybrid tilapia,Oreochromismossambicus×O.niloticus, reared in seawater[J].Aquaculture,2000,189(1/2):101-108.
[4] 区又君,刘泽伟.千年笛鲷幼鱼的饥饿和补偿生长[J].水产学报,2007,31(3):323-328.
[5] 刘龙龙,罗鸣,陈傅晓,等.卵形鲳鲹幼鱼的饥饿和补偿生长研究[J].上海海洋大学学报,2014,23(1):31-36.
[6] 冯健,李程琼,梁桂英,等.淡水养殖太平洋鲑鱼饥饿后补偿性生长效果研究[J].中山大学学报,2005,44(3):86-89.
[7] 姜志强,贾泽梅,韩延波.美国红鱼继饥饿后的补偿生长及其机制[J].水产学报,2002,26(1):67-72.
[8] 黄莹,朱晓鸣,解绶启,等.西伯利亚鲟在高温下饥饿后的补偿生长[J].水生生物学报,2010,34(6):1113-1121.
[9] 李程琼,冯健,刘永坚,等.奥尼罗非鱼多重周期饥饿后的补偿生长[J].中山大学学报:自然科学版,2005,44(4):99-102.
[10] 沈文英,寿建昕.鱼类补偿生长的研究进展[J].水利渔业,2003,23(4):40-42.
[11] 张波,孙耀,唐启升.饥饿对真鲷生长及生化组成的影响[J].水产学报,2000,24(3):206-210.
[12] Kim M K, Lovell R T. Effect of restricted feeding regimens on compensatory weight gain and body tissue changes in channel catfishIctaluruspunctatusin ponds[J]. Aquaculture, 1995, 135(4):285-293.
[13] Paul A J, Paul J M, Smith R L. Compensatory growth in Alaska yellow sole,Pleuronectesasper[J]. Journal of Fish Biology,1995,46(3):442-448.
[14] Miglavs I, Jobling M. Effects of feeding regime on food consumption, growth rates and tissue nucleic acids in juvenile Arctic charr,Salvelinusalpinus, with particular respect to compensatory growth[J]. Journal of Fish Biology,2006,34(6):947-957.
[15] Wilson P N, Obsourn D F. Compensatory growth after undernutrition in mammals and birds[J].Biological Reviews,1960,35(3):324-363.
[16] Blaxter J H S, Hempel G.The influence of egg size on herring larrae(Clupeaharengus)[J].Ices Journal of Marine Science,1963,28(2):211-240.
[17] Wieser W, Krumschnabel G, Ojwang-Okwor J P. The energetics of starvation and growth after refeeding in juveniles of three cyprinid species[J].Environmental Biology of Fishes,1992,33(1):63-71.
[18] Dobson S H, Holmes R M. Compensatory growth in the rainbow trout,SalmogairdneriRichardson[J].Journal of Fish Biology, 2006, 25(6):649-656.
[19] Reimers E, Kjorrefjrd A G, Stavostrand S M. Compensatory growth and reduced maturation in second sea winter farmed Atlantic salmon following starvation in February and March[J].Journal of Fish Biology,1993,43(5):805-810.
[20] 邓利,张波,谢小军.南方鲇继饥饿后的恢复生长[J].水生生物学报,1999,23(2):167-173.
EffectofStarvationonGrowthandFeedUtilizationofJuvenileDragon-TigerGrouper
WANG Chenggui, LIANG Huafang, CHEN Jiahua
( Fisheries College, Guangdong Ocean University, Zhanjiang 524088, China )
A 36-day experiment was carried out in indoor buckets to study the capacity of compensatory growth of dragon-tiger grouper(Epinepheluslanceolatus)with body weight of (31.3±3.8) g after four different starvation periods. The fish were divided into 5 groups and starved for 0 day(S1),4 days(S2),8 days(S3),12 days(S4) and 16 days(S5), then continued to be fed. The results showed that there was a significant difference in the average body weight in each group(P<0.05). The fish in group S2had higher average body weight than the fish in group S1, lower in groups S3and S4than in group S1without significant difference (P>0.05). There was significantly lower average body weight in groups S5than S1(P<0.05). There was a significant difference in the daily weight gain and weight gain rate in each group (P<0.05), the maximum in group S2, without significant difference in the daily weight gain and weight gain rate in S2and S1(P>0.05).The daily weight gain and weight gain rate were significantly lower in groups S3,S4and S5than those in group S1(P<0.05). There was a significant difference in the specific growth rate in every group (P<0.05). The specific growth rate was significantly higher in group S2than in S1(P<0.05), without significant difference in groups S3and S1(P>0.05). The specific growth rate was significantly lower in S4and S5groups than in S1(P<0.05). The fasted fish had significantly lower food intake than the fish in S1did (P<0.05). There was a significant difference in the food conversion ratio in each group (P<0.05). There was no significant difference in the food conversion ratio in groups S2and S3(P>0.05), significantly higher than in group S1(P<0.05). There was no significant difference in the food conversion ratio between group S4 and group S1 (P>0.05). The food conversion ratio was significantly lower in S5than in S1(P<0.05). After refeeding, the fish in group S2had the ability of excess compensatory growth, in groups S3and S4had partial compensatory growth ability, and S5had no compensatory growth ability. The fish in groups S2, S3and S4had compensatory growth ability by the improvement of the food conversion rate mainly. Therefore, the appropriate starvation and refeeding can be used as a good breeding management strategy to dragon-tiger grouper.
dragon-tiger grouper; starvation; growth; feed utilization
10.16378/j.cnki.1003-1111.2017.05.012
2015-12-08;
2016-11-14.
广东省海洋渔业科技推广专项(A2011100103,A201108B04,A201208G02).
王成桂(1978-),男,助理研究员;研究方向:海产动物增养殖. E-mail:longshore@163.com.通讯作者:梁华芳(1965-),男,教授;研究方向:水产经济动物养殖技术.E-mail:hfliang@126.com.
S965.344
A
1003-1111(2017)05-0612-05

