日本沼虾表皮蛋白-5基因全长cDNA克隆及表达分析
郑征帆,吕艳杰,王 佩,宁黔冀
( 河南师范大学 生命科学学院,河南 新乡 453007 )
日本沼虾表皮蛋白-5基因全长cDNA克隆及表达分析
郑征帆,吕艳杰,王 佩,宁黔冀
( 河南师范大学 生命科学学院,河南 新乡 453007 )
为探究甲壳动物表皮蛋白多样性及其功能,根据表皮转录组资料,利用RACE技术扩增得到日本沼虾表皮蛋白-5基因的cDNA全长序列,分析其生物信息学、不同蜕皮时期的表达特征以及KK-42对其表达特征的影响。日本沼虾表皮蛋白-5基因的cDNA全长796 bp,开放阅读框477 bp,编码158个氨基酸,含RR基序,预测蛋白等电点为4.22,分子量为16.46 ku;氨基酸序列比对发现日本沼虾表皮蛋白-5与克氏原螯虾Casp-2相似性最高,为76%,与其他甲壳动物表皮蛋白相似性为41%~53%。实时荧光定量PCR结果显示,日本沼虾表皮蛋白-5基因在3个时期——蜕皮间期、蜕皮前早期和蜕皮前晚期均有表达,其中在脱皮前晚期的相对表达量最高,为蜕皮间期的1400倍,与之有极显著差异(P<0.01)。KK-42处理显著上调日本沼虾表皮蛋白-5基因在蜕皮前早期的表达,在处理后3、6 h和48 h表达量分别是对照组的6.3、4.8和11.4倍。KK-42诱导日本沼虾表皮蛋白-5基因的表达,使峰值前移,这可能是KK-42缩短日本沼虾幼虾蜕皮周期的机制之一。
日本沼虾;表皮蛋白;基因克隆;表达;KK-42
由于坚硬表皮的限制,甲壳动物必须经过蜕皮才能生长,蜕皮是一个周期性的动态过程,包括旧表皮降解和新表皮的形成。作为表皮组成成分的几丁质是和蛋白质以结合的形式存在,此蛋白即为表皮蛋白(CPs),是甲壳动物表皮中重要的结构性蛋白,由蜕皮激素的靶组织——表皮上皮细胞按照一定的周期和步骤表达合成[1-2]。
表皮蛋白的表达与蜕皮周期的关系是研究此类蛋白功能的重要方面。采用分离纯化方法获得表皮蛋白,根据氨基酸测序结果推定碱基序列,在转录水平分析相关基因表达在蜕皮周期中的变化趋势[3-5]。近年来应用高通量测序技术大大加快了新表皮蛋白基因发现的进程,在日本囊对虾(Marsupenaeusjaponicus)[6-7]、蓝蟹(Callinectessapidus)[8]、克氏原螯虾(Procambarusclarkii)[9-11]少数几个物种获得9个甲壳动物表皮蛋白基因全长。尚未见到日本沼虾(Macrobrachiumnipponense)表皮蛋白的相关报道。
前期研究发现咪唑类物质KK-42能缩短日本沼虾幼虾蜕皮周期[12],机制尚不明确,推测与表皮蛋白表达有关。本试验采用cDNA 末端快速扩增技术首次从日本沼虾尾扇中克隆出一个表皮蛋白基因全长,命名为日本沼虾表皮蛋白-5(MnCP-5,GenBank 登录号:KU356774),对其进行序列分析、不同蜕皮时期表达分析以及KK-42处理等相关研究,探究甲壳动物表皮蛋白的多样性,也为阐明KK-42缩短蜕皮周期的作用机制积累资料。
1 材料与方法
1.1 试验材料及KK-42处理
日本沼虾幼虾捕捞于河南卫辉市顺城关公园,实验室暂养后选取400尾体长(3.0±0.5) cm,体质量约0.30 g个体分为2组:KK-42试验组和对照组,其蜕皮周期的鉴定依据Cesar等[13]显微形态学观察的方法。试验组用1.95×10-4mol/L的KK-42溶液浸泡处理1 min,取出后迅速去除水分,立刻置于水族箱中,室温全天通氧饲养;对照组用不含KK-42溶液做相同的处理[14]。
1.2 日本沼虾表皮蛋白-5基因全长克隆
用MiniBEST Universal RNA Extraction Kit (TaKaRa) 试剂盒提取尾扇总RNA,微量紫外分光光度仪检测RNA含量,1%琼脂糖凝胶电泳检测RNA完整性。按照SMARTerTMRACE 5′/3′Kit (Clontech) 试剂盒说明, 合成cDNA第一链,用于全长cDNA 5′和3′端序列快速扩增的模板。根据表皮转录组资料及甲壳动物表皮蛋白RR保守序列,设计降落PCR特异性引物RMnCP-5-R和RMnCP-5-F(表1)。
PCR产物经1%的琼脂糖凝胶电泳检测后,用BIOMIGA Gel/PCR Extraction Kit回收,采用pUC19, Linearized(Clontech)连接,利用DH5α(TaKaRa)感受态细胞进行转化,培养得到的阳性克隆经过菌液PCR验证后由生工生物工程(上海)股份有限公司进行序列测序。

表1 基因克隆和实时定量所用引物
1.3 日本沼虾表皮蛋白-5基因序列特征分析
将5′-RACE片段和3′-RACE片段序列进行拼接,开放阅读框利用ORF finder (http://www.ncbi.nlm.nih.gov/gorf/gorf.html)查询;Conserved Domain Search Service (http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)在线工具进行保守域分析;Protparam程序(http://web.expasy.org/protparam/)预测氨基酸等电点、分子量等参数;TMHMM、SingalP 3.0 Server(http://www.cbs.dtu.dk/services/TMHMM-2.0/、http://www.cbs.dtu.dk/services/SignalP-3.0/)等在线软件分析蛋白的跨膜结构和预测信号肽。MEGA 6.0软件邻接法构建系统进化树。SMS工具包(http://www.bio-soft.net/sms/)进行氨基酸多序列比对。
1.4 日本沼虾表皮蛋白-5基因的表达分析
MiniBEST Universal RNA Extraction Kit(TaKaRa)试剂盒提取蜕皮间期、蜕皮前早期和蜕皮前晚期以及KK-42处理后0、3、6、12、24 h和48 h日本沼虾步足RNA,反转录合成cDNA。根据表皮转录组资料设计特异性引物QMnCP-5-F和QMnCP-5-R (表1),18S rRNA 基因作为内参进行实时荧光定量PCR, 每个样本做3个平行。数据处理采用相对值2-△△CT计算,SPSS 13.0进行统计分析。
2 结 果
2.1 日本沼虾表皮蛋白-5基因cDNA全长克隆
日本沼虾表皮蛋白-5基因cDNA全长796 bp,ORF包含158个氨基酸残基,基因第1~136 bp为5′UTR区,第137~151位编码以起始密码子ATG为开端的信号肽序列,覆盖15个氨基酸残基,几丁质结合结构域——RR基序从第90位氨基酸开始至第124位氨基酸结束,覆盖35个氨基酸残基,终止密码子TAG,3′UTR区有表明序列完整性的加尾信号AATAAA及polyA尾(图1)。预测该蛋白等电点为4.22,分子量为16.46 ku,无跨膜结构。
2.2 日本沼虾表皮蛋白-5氨基酸序列同源性分析
利用MEGA 6.0软件邻接法将日本沼虾表皮蛋白-5氨基酸与相关代表甲壳动物和昆虫的表皮蛋白氨基酸序列共同构建发育树(图2),参与构建发育树的表皮蛋白均包含RR-1基序。结果显示,日本沼虾和其他甲壳动物聚为1支,节肢动物另聚3支,其中日本沼虾表皮蛋白-5和克氏原螯虾表皮蛋白Csap-2单独聚为1小支,二者相距最近。经BLASTP比对表明,日本沼虾表皮蛋白-5氨基酸序列与红螯螯虾(Cheraxquadricarinatus)、美洲螯龙虾(Homarusamericanus)、黄道蟹(Cancerpagurus)、蓝蟹、日本囊对虾相似度41%~53%,其中与克氏原螯虾Casp-2相似度最高,达76%(图3)。

图1 日本沼虾表皮蛋白-5基因核苷酸序列及推测的氨基酸序列实线方框:起始密码子(ATG)和终止密码子(TAG);灰底框:poly(A)加尾信号(AATAAA);*:终止密码;下划线:信号肽;虚线:RR基序;圆圈:RR基序中保守的氨基酸.

图2 邻接法构建的日本沼虾表皮蛋白-5与其他物种表皮蛋白的系统进化树

图3 日本沼虾表皮蛋白-5与其他物种表皮蛋白的氨基酸序列比对日本沼虾CP-5:KU356774;蓝蟹AMP6.0:AAV28477.1;蓝蟹CP14.1:ABB91676.1;红螯螯虾M15:AIN36963.1;日本囊对虾DD9A:BAA90875.1;克氏原螯虾Casp-2:BAF73806.1;克氏原螯虾SCBP-1:BAM99303.1;美洲螯龙虾AMP1A:P81384.1;美洲螯龙虾AMP4:P81388.1;黄道蟹AM1159:P81576.1.RR一致序列标注于多序列下方.
2.3 蜕皮周期不同阶段日本沼虾表皮蛋白-5基因表达分析
实时荧光定量PCR结果表明,日本沼虾表皮蛋白-5基因在蜕皮间期、蜕皮前早期和蜕皮前晚期均有表达,但表达量存在差异(图4),在蜕皮前晚期急剧升高,是蜕皮间期的1400倍,与之呈极显著差异(P<0.01)。
2.4 KK-42对日本沼虾表皮蛋白-5基因表达的影响
KK-42处理能显著上调基因的表达,尤其是蜕皮前早期和蜕皮间期。K-42处理后48 h,蜕皮间期的表达量是对照组的2.1倍(图5a);在3、6 h和48 h,蜕皮前早期表达极显著升高,分别是对照组的6.3、4.8倍和11.4倍(图5b);在蜕皮前晚期,处理组的转录水平明显降低(图5c)。
3 讨 论
RR基序[Gx8Gx6YxAxExGYx7Px2P](x代表任意氨基酸,阿拉伯数字代表任意氨基酸的数目)最先在昆虫中发现,是表皮蛋白中分布最广、研究最为深入的基序[15-18]。离体研究显示,该基序能结合几丁质,覆盖35个氨基酸残基。甲壳动物表皮蛋白是含RR基序、与蜕皮周期相关且种内和种间相似度较低的一类结构性蛋白。本试验首次克隆出日本沼虾表皮蛋白-5基因cDNA全长,含RR基序(图1)。对甲壳动物表皮蛋白的研究表明,RR基序可以鉴别表皮蛋白,是其特征性保守序列[1]。日本沼虾表皮蛋白-5基因编码蛋白预测分子量是16.46 ku,与克氏原螯虾、蓝蟹的全长cDNA编码蛋白类似[8-11];蛋白呈酸性(等电点为4.22),可能与表皮钙化相关[9]。甲壳动物表皮蛋白常含有12~19个aa不等的信号肽,日本沼虾表皮蛋白-5含15个aa的信号肽,表明其属于基质蛋白,由上皮细胞分泌至胞外,参与表皮结构的形成[9]。

图4 日本沼虾表皮蛋白-5 在不同蜕皮时期的表达n=5/蜕皮时期.**表示与蜕皮间期比P<0.01.
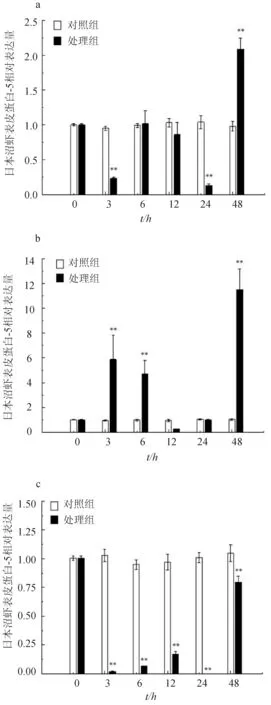
图5 KK-42处理后日本沼虾表皮蛋白-5在不同蜕皮时期的表达变化n=5/组/时间点.a:蜕皮间期;b:蜕皮前早期;c:蜕皮前晚期.**表示与对照组比P<0.01.
在甲壳动物周期性蜕皮过程中,表皮结构也不断地变化,蜕皮前新的上表皮和外表皮已经形成,蜕皮后内表皮逐渐形成[19]。日本沼虾表皮蛋白-5基因在蜕皮前晚期显著表达(图4),与克氏原螯虾[10]、蓝蟹[8,20]表皮蛋白的表达特征相一致,因此推测日本沼虾表皮蛋白-5参与外表皮的形成。
前期研究显示,KK-42能显著提高日本沼虾血淋巴中蜕皮激素20-羟蜕皮酮的滴度[21],合成表皮蛋白的表皮上皮细胞是蜕皮激素的靶组织,推测KK-42 上调日本沼虾表皮蛋白-5基因的表达是间接效应;而蜕皮前晚期该基因表达显著降低的原因,可能是KK-42促使蜕皮激素的峰值从蜕皮前晚期前移至蜕皮前早期,进而加速了新表皮的形成,蜕皮周期缩短[12]。
[1] Roer R,Abehsera S, Sagi A. Exoskeletons across the Pancrustacea: comparative morphology, physiology, biochemistry and Genetics. [J]. Integrative and Comparative Biology, 2015, 55(5):771-791.
[2] Roer R,Dillaman R.The structure and calcification of the crustacean cuticle[J].Integrative and Comparative Biology, 1984, 24(4):893-909.
[3] Jacobsen S L, Andersen S O, Hojrup P. Amino acid sequence determination of a protein purified from the shell of the shrimp,Pandalusborealis[J].Comparative Biochemistry and Physiology Part B, 1994, 109(2/3):209-217.
[4] Andersen S O.Characterization of proteins from arthrodial membranes of the lobster,Homarusamericanus[J].Comparative Biochemistry and Physiology Part A, 1998, 121(4):375-383.
[5] Andersen S O.Exoskeletal proteins from the crab,Cancerpugurus[J].Comparative Biochemistry and Physiology Part A, 1999, 123(2):203-211.
[6] Ikeya T,Persson P,Kono M,et al.The DD5 gene of the decapods crustaceanPenaeusjaponicasencodes a putative exoskeletal protein with a novel tandem repeat structure[J].Comparative Biochemistry and Physiology Part B, 2001, 128(3):379-388.
[7] Endo H,Persson P,Watanabe T.Molecular cloning of the crustacean DD4 cDNA encoding a Ca2+-binding protein[J].Biochemical and Biophysical Research Communications, 2000, 276(1):286-291.
[8] Wynn A,Shafer T H.Four differentially expressed cDNAs inCallinectessapiduscontaining Rebers-Riddiford consensus sequence[J].Comparative Biochemistry and Physiology Part B, 2005, 141(3):294-306.
[9] Inoue H,Ohira T,Ozaki N,et al.Cloning and expression of a cDNA encoding a matrix peptide associated with calcification in the exoskeleton of the crayfish[J].Comparative Biochemistry and Physiology Part B, 2003, 136(4):755-765.
[10] Inoue H, Yuasa-Hashimoto N, Suzuki M, et al.Structure determination and functional analysis of a soluble matrix protein associated with calcification of exoskeleton of the crayfish,Procambarusclarkii[J]. Bioscience Biotechnology and Biochemistry, 2008, 72(10):2697-2707.
[11] Suzuki M,Sugisaka-Nobayshi A,Kogure T,et al.Structural and functional analyses of a strong chitin-binding protein-1 (SCBP-1) from the exoskeleton of the crayfishProcambarusclarkii[J]. Bioscience Biotechnology and Biochemistry, 2013, 77(2):361-368.
[12] Guan J,Lv Y,Zhang Y,et al.A shortening effect of KK-42 on the moult cycle of juvenileMacrobrachiumnipponense(De Haan, 1849) (Decapoda, Palaemonidae)[J].Crustaceana, 2016, 89(1):85-95.
[13] Cesar J,Zhao B,Malecha S,et al.Morphological and biochemical changes in the muscle of the marine shrimpLitopenaeusvannameiduring the molt cycle[J].Aquaculture, 2006, 261(2):688-694.
[14] Ning Q,Fu S,Xu X,et al.A new and practical application of JH antagonist KK-42 to promoting growth of shrimpPenaeusvannamei[J].Aquaculture, 2007, 270(1/4):422-426.
[15] Togawa T,Dunn W A,Emmons A C,et al.Developmental expression patterns of cuticular protein genes with the R&R Consensus fromAnophelesgambiae[J].Insect Biochemistry and Molecular Biology, 2008, 38(5):508-519.
[16] Charles J P.The regulation of expression of insect cuticle protein genes[J].Insect Biochemistry and Molecular Biology, 2010, 40(3):205-213.
[17] Willis J H.Structural cuticular proteins from arthropods: annotation, nomenclature, and sequence characteristics in the genomics era[J].Insect Biochemistry and Molecular Biology, 2010, 40(3):189-204.
[18] Zhu K Y,Merzendorfer H,Zhang W,et al.Biosynthesis, turnover, and functions of chitin in insects[J]. Annual Review of Entomology, 2016(61):177-196.
[19] Nagasawa H.The crustacean cuticle: structure, composition and mineralization[J]. Frontiers in Bioscience, 2012, 4(1):711-720.
[20] Faircloth L M,Shafer T H.Differential expression of eight transcripts and their roles in the cuticle of the blue crab,Callinectessapidus[J].Comparative Biochemistry and Physiology Part B, 2007, 146(3):370-383.
[21] 刘方,陈香丽,郭爱莲,等. KK-42对日本沼虾蜕皮激素及其受体表达的影响[J]. 河南师范大学学报: 自然科学版,2013,41(4):124-127.
Full-lengthcDNACloningandExpressionofCuticularProtein-5inFreshwaterPrawnMacrobrachiumnipponense
ZHENG Zhengfan, LÜ Yanjie, WANG Pei, NING Qianji
( College of Life Science, Henan Normal University, Xinxiang 453007, China )
To explore the diversity and functions of cuticular proteins in crustacean, full-length cDNA of cuticular protein-5 in freshwater prawnMacrobrachiumnipponense(MnCP-5) was cloned using epidermis transcriptome by RACE technique. The bioinformatics, expression profile and effects of KK-42 for the expression of MnCP-5 were analyzed in different molt stages. The full sequence is 796bp containing a complete 477 bp ORF which encodes 158 amino acids with RR motif, a calculated molecular mass of 16.46 ku and pI of 4.22. Comparison of amino acid sequences in crustacean, MnCP-5 shared 41%-53% identity with others, and the maximal similarity of 76% with swamp red prawnProcambarusclarkiiCasp-2. The Quantitative Real-time PCR (qRT-PCR) showed that MnCP-5 was expressed on all 3 stages—C, D0-2and D3-4, while the relative expression level at stage D3-4was 1400 times as the level at stage C with very significant difference (P<0.01). KK-42 treatment can up-regulate the expression of MnCP-5 at stage D0-2, and the expression levels at 3, 6 and 48 h were 6.3, 4.8 and 11.4 times as the levels in control group. KK-42 can importantly move forward the peak expression of MnCP-5 from stage D3-4to D0-2, which is involved in one of the potential molecular mechanisms of KK-42 for shortening the molt cycle of juvenile freshwater prawn.
Macrobrachiumnipponense; cuticular protein; gene cloning; expression; KK-42
10.16378/j.cnki.1003-1111.2017.06.009
S917.4
A
1003-1111(2017)06-0747-06
2017-01-16;
2017-03-09.
河南省基础与前沿技术研究项目(142300410021).
郑征帆(1990—),女,硕士研究生;研究方向:甲壳动物生长发育的体液调节. E-mail: zhengzhengfan@163.com. 通讯作者:宁黔冀(1964—),女,教授,博士;研究方向:甲壳动物激素调控. E-mail: nqjnqj1964@163.com.

