氮磷饥饿时间对筒柱藻生长及总脂含量的影响
梁 英,孟祥荣,孙明辉,田传远,黄徐林
( 中国海洋大学,海水养殖教育部重点实验室,山东 青岛 266003 )
氮磷饥饿时间对筒柱藻生长及总脂含量的影响
梁 英,孟祥荣,孙明辉,田传远,黄徐林
( 中国海洋大学,海水养殖教育部重点实验室,山东 青岛 266003 )
以筒柱藻为试验材料,研究了其在一次性培养过程中,氮磷营养盐饥饿时间(0、1、2、4、6、8 d)对该藻叶绿素荧光参数、细胞密度、叶绿素含量、干质量、总脂含量及脂肪酸组成的影响。结果表明,光系统Ⅱ最大光化学量子产量、光化学淬灭、最大光合作用速率、快速光曲线的初始斜率和半饱和光照度均随氮、磷饥饿时间的延长而显著下降,说明该藻的光合作用受到了抑制。细胞密度分别在氮饥饿的第6 d和磷饥饿的第8 d达到最大值,但总体升高幅度不大。氮饥饿和磷饥饿条件下,干质量和总脂含量均随氮磷饥饿时间的延长逐渐升高,总脂含量分别在氮饥饿的第8 d(35.3%)和磷饥饿的第6 d(28.9%)达到最大值。氮磷饥饿时间对筒柱藻的脂肪酸组成也有显著影响,16:0和总饱和脂肪酸含量随氮磷饥饿时间的延长逐渐升高,20:4n-6、20:5n-3和总多不饱和脂肪酸含量则随氮磷饥饿时间的延长逐渐降低,16:1n-7和总单不饱和脂肪酸含量随氮饥饿时间的延长逐渐升高,而磷饥饿时间对16:1n-7和总单不饱和脂肪酸含量变化影响不显著。上述指标随氮磷饥饿时间的变化趋势可为筒柱藻的大规模培养及开发利用提供参考。
筒柱藻;氮磷饥饿时间;叶绿素荧光参数;生长;总脂含量;脂肪酸组成
随着石油资源的逐渐枯竭,用微藻生产生物柴油的研究正成为目前的热点[1-2],而选育生长繁殖速度快、产油量高的微藻是生物柴油产业发展中的一个关键环节[3]。诸多研究表明,氮磷营养盐限制或饥饿是提高微藻油脂含量的有效方法[4-6]。对海绿球藻(Halochlorococumsarcotum)的研究结果表明[4],氮限制能显著提高该藻的总脂含量。小球藻(Chlorellasp.)[5]在缺磷条件下总脂和中性脂肪酸含量均逐渐升高。三角褐指藻(Phaeodactylumtricornutum)和角毛藻(Chaetocerossp.)在磷饥饿条件下,总脂含量增加,但效果没有氮饥饿显著[6]。氮磷限制或饥饿可提高微藻的总脂含量和改变脂肪酸组成,但影响的程度受到微藻种类、受限营养盐种类、营养盐限制程度、限制时间等因素的影响。在氮磷胁迫条件下,微藻生物量往往较低,从而影响微藻作为生物柴油原料的开发利用。国内外学者尝试用“两步法”来调控生物量与总脂含量之间的平衡[7-9],但对于氮磷限制或饥饿多长时间能提高微藻的总脂含量,还需要进一步研究。
筒柱藻(Cylindrothecasp.)细胞壁硅化弱[10],富含胞外多糖[11]和多种高度不饱和脂肪酸[12]。在流加—连续培养条件下,可得到高含量的粗蛋白、粗脂肪和种类齐全的氨基酸,适合作为海洋经济动物苗种的饵料[13]。该藻通过优化培养,可获得较高的生物量和高达50%以上的总脂含量,而且脂肪酸组成主要为16碳链,与柴油分子15个左右的碳链极其相似,可作为生物柴油的生产原料[14]。笔者以筒柱藻B200为试验材料,采用“两步法”对其进行培养,即首先在最适培养基条件下培养筒柱藻,到指数生长末期时,将其离心转接到不添加氮盐和磷盐的培养基中进行饥饿试验以促进脂类积累,研究氮、磷饥饿时间对其叶绿素荧光参数、细胞密度、叶绿素含量、干质量、总脂含量和脂肪酸组成的影响,以期为该藻的开发利用提供参考。
1 材料与方法
1.1 试验藻种
试验所用筒柱藻藻种取自中国海洋大学微藻种质库,编号为MACC/B200。
1.2 试验方法和培养条件
将50 mL处于指数生长期的筒柱藻接种到4000 mL的f培养基(即f/2培养基[15]的2倍)中,在25 ℃、5000 lx光照度下连续充气培养到指数生长末期,离心后,分别以2.2×106个/mL和3.42×106个/mL的接种量转接到不含氮、磷元素的f培养基中(培养液体积为4000 mL),分别进行氮、磷饥饿试验,每种饥饿处理设3个平行。每日定时取样10 mL进行叶绿素荧光参数和细胞密度的测定。在第0、1、2、4、6、8 d分别收获500 mL藻液进行干质量、叶绿素含量、总脂含量和脂肪酸组成的测定。
1.3 参数测定
1.3.1 叶绿素荧光参数的测定
每天定时取样,采用德国Walz公司产Water-PAM调制式水样叶绿素荧光仪,按文献[16]中的方法测定叶绿素荧光各参数:光系统Ⅱ最大光化学量子产量、光化学淬灭、非光化学淬灭,并参照Platt等[17]的方法进行快速光曲线拟合,拟合方程如下:
P=Ps(1-e-(α×PAR/Ps))·e-(β×PAR/Ps)
式中,Ps表示无光抑制时的最大相对电子传递速率,α表示拟合后快速光曲线的初始斜率,β表示光抑制参数,PAR表示光合有效辐射强度[μmol/(m2·s)]。拟合后,最大相对电子传递速率rETRmax表示为Pm,Pm=Ps×[α/(α+β)]×[β/(α+β)]β/α,半饱和光照度Ik=Pm/α。
1.3.2 细胞密度和叶绿素含量的测定
每日定时取样,用血球计数板进行细胞密度的测定,测4次取平均值。按照文献[18]的方法进行叶绿素含量的测定。
1.3.3 总脂含量和脂肪酸组成的测定
在第0、1、2、4、6、8 d定时取样,冷冻干燥后测定其单位体积干质量(g/L)和总脂含量(占干质量的百分比)。总脂含量按改进的Bligh-Dyer[19](简称BD)方法进行。脂肪酸样品的处理按照改进的Lepage等[20]方法,先对冷冻干燥的筒柱藻样品进行甲酯化,然后用2 mL正己烷对获取的脂肪酸甲酯进行萃取,振荡离心,最后取分层后上层液体放入1.5 mL EP管,等待分析。
脂肪酸分析采用岛津气相色谱质谱联用仪GCMS-QP2010Ultra。色谱柱型号为Rxi-1MS,色谱柱规格为:30.0 m×0.25 mm×0.25 μm。载气为高纯氦气,流速1.00 mL/min,整体流速24.0 mL/min,压力92.4 kPa。进样口温度25 ℃,进样量1 μL,色谱柱初温150 ℃,3 min内匀速升温至200 ℃并保持1 min,然后以2 ℃/min升至250 ℃,分析过程持续30 min。采用EI离子源,温度为230 ℃,接口温度280 ℃,扫描质量质荷比为1.5~1090 u,最大扫描频次20 000 u/s。通过检索NIST质谱图库获取每个脂肪酸的质谱图,通过比较样品的质谱图与图库中标准的质谱图以及比较试验样品与标准样品每个脂肪酸的出峰时间来对脂肪酸的种类进行鉴定。
1.3.4 数据处理
用Sigmaplot 10.0软件进行作图。用SPSS 19.0软件对试验数据进行非线性拟合,单因子方差分析,P<0.05表示差异显著。
2 结果与分析
2.1 氮、磷饥饿时间对筒柱藻叶绿素荧光参数的影响
氮饥饿时间对筒柱藻叶绿素荧光各参数的影响见图1。单因子方差分析结果表明,氮饥饿时间对筒柱藻叶绿素各荧光参数均有显著影响(P<0.05)。由图1可知,光系统Ⅱ最大光化学量子产量,自接种后的第1 d开始随氮饥饿时间的延长缓慢下降,到第7 d时显著下降,至试验结束时(第8 d),该参数从接种时的0.67降至0.58。光化学淬灭、最大光合作用速率和半饱和光照度随氮饥饿时间的延长变化趋势相似,从接种后的第1 d开始随氮饥饿时间的延长先降低,在第5 d达到最小值,然后随氮饥饿时间的延长逐渐升高。非光化学淬灭在接种后的1~3 d变化很小,第3 d以后随氮饥饿时间的延长显著升高,第7 d时达到最大值后显著下降。光饱和曲线的初始斜率随氮饥饿时间的延长先升高,在饥饿的第2 d达到最大值,然后随着氮饥饿时间的延长而逐步降低,在饥饿的第8 d达到最小值。
磷饥饿时间对筒柱藻叶绿素各荧光参数的影响见图2。单因子方差分析结果表明,磷饥饿时间对筒柱藻叶绿素各荧光参数均有显著影响(P<0.05)。由图2可知,光系统Ⅱ最大光化学量子产量和光饱和曲线的初始斜率变化趋势相似,均随磷饥饿时间的延长先升后降,均在第3 d出现最大值,其中磷饥饿组光系统Ⅱ最大光化学量子产量由第3 d时的0.72降至试验结束时的0.69。光化学淬灭,最大光合作用速率和半饱和光照度均随磷饥饿时间的延长持续降低。其中,第0~4 d,最大光合作用速率变化不显著,第4 d后,显著下降。非光化学淬灭随磷饥饿时间的延长先升后降。
2.2 氮、磷饥饿时间对筒柱藻细胞密度、干质量、叶绿素含量和总脂含量的影响
氮饥饿时间对筒柱藻细胞密度、干质量、叶绿素含量和总脂含量的影响见图3。由图3可知,筒柱藻的细胞密度随氮饥饿时间的延长先升高后小幅降低,总体变化幅度不大,到培养结束时(第8 d),细胞密度是接种时(0 d)的1.35倍。干质量随氮饥饿时间的延长不断升高,到饥饿的第8 d干质量达到最大值,其中第6、8 d干质量差异不显著。叶绿素含量随氮饥饿时间的延长先升后降,第1 d达到最大值。总脂含量随氮饥饿时间的延长显著升高,刚接种时总脂含量为22.5%,饥饿8 d后总脂含量达到35.3%,比未进行氮饥饿时增加了56.9%,其中第4、6、8 d差异不显著。
磷饥饿时间对筒柱藻细胞密度、干质量、叶绿素含量和总脂含量的影响结果见图4。由图4可知,筒柱藻的细胞密度也随磷饥饿时间的延长逐步升高,但升高幅度不大,到培养结束时(第8 d),细胞密度是接种时(0 d)的1.43倍。干质量、叶绿素含量和总脂含量均随磷饥饿时间的延长不断升高,其中总脂含量在磷饥饿的第6 d达到较大值(28.9%),比未进行磷饥饿时增加了19.0%,但第4、6、8 d差异不显著。

图1 不同氮饥饿时间对筒柱藻叶绿素荧光参数的影响
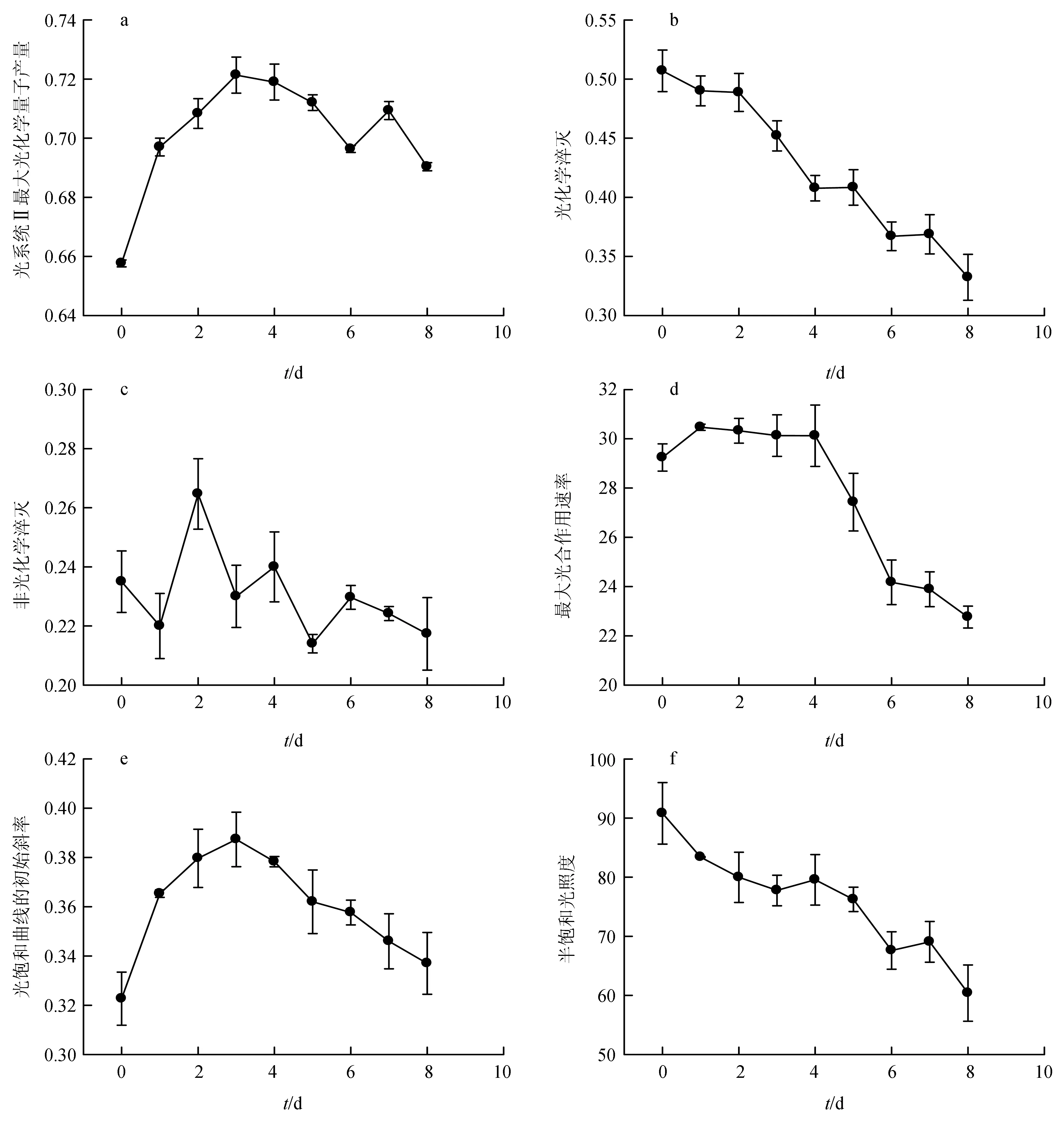
图2 不同磷饥饿时间对筒柱藻叶绿素荧光参数的影响
2.3 氮、磷饥饿时间对筒柱藻脂肪酸组成的影响
氮饥饿时间对筒柱藻脂肪酸组成的影响见表1。由表1可知,氮饥饿条件下,筒柱藻的主要脂肪酸是14:0(7.31%~9.66%)、16:0(28.01%~39.07%)、16:1n-7(28.51%~37.23%)、20:4n-6(4.52%~8.76%)和20:5n-3(3.48%~10.46%)。单因子方差分析结果表明,氮饥饿时间对14:0、16:0、16:1n-7、20:4n-6及20:5n-3含量的影响差异显著(P<0.05)。其中16:0和总饱和脂肪酸含量随氮饥饿时间的延长先逐渐升高,分别在饥饿的第6 d和第4 d达到最大值,之后缓慢下降;16:1n-7和总单不饱和脂肪酸含量随氮饥饿时间的延长逐渐升高,至培养结束时达到最大值;14:0、20:4n-6、20:5n-3和总多不饱和脂肪酸含量随氮饥饿时间的延长逐渐降低,至培养结束时达到最小值。

图3 不同氮饥饿时间对筒柱藻细胞密度、干质量、叶绿素含量和总脂含量的影响
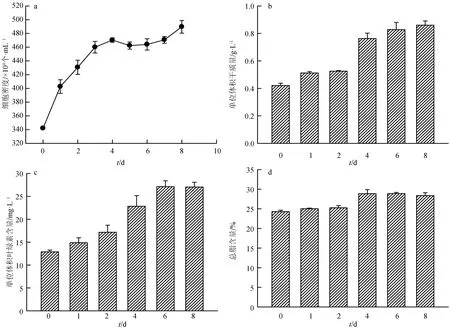
图4 不同磷饥饿时间对筒柱藻细胞密度、干质量、叶绿素含量和总脂含量的影响

表1 不同氮饥饿时间对筒柱藻脂肪酸组成的影响(占总脂肪酸的百分比) %
磷饥饿时间对筒柱藻脂肪酸组成的影响见表2。由表2可知,磷饥饿条件下,筒柱藻的主要脂肪酸是14:0(6.90%~9.12%)、16:0(30.66%~38.61%)、16:1n-7(29.13%~31.61%)、20:4n-6(4.14%~8.23%)和20:5n-3(4.39%~10.33%)。单因子方差分析结果表明,磷饥饿时间对14:0、16:0、20:4n-6及20:5n-3含量的影响差异显著(P<0.05),对16:1n-7和总单不饱和脂肪酸含量的影响差异不显著(P>0.05)。其中,14:0含量随磷饥饿时间的延长先升后降,在饥饿的第2 d达到最大值;16:0和总饱和脂肪酸含量随磷饥饿时间的延长逐渐升高,至培养的第6 d达到最大值,之后逐渐降低;20:4n-6、20:5n-3和总多不饱和脂肪酸含量随磷饥饿时间的延长逐渐降低,至培养的第6 d达到最小值,之后逐渐升高;16:1n-7和总单不饱和脂肪酸含量变化不显著。

表2 不同磷饥饿时间对筒柱藻脂肪酸组成的影响(占总脂肪酸的百分比) %
3 讨 论
3.1 氮、磷饥饿时间对筒柱藻叶绿素荧光参数的影响
通过叶绿素荧光技术测定的叶绿素荧光各参数能反映光合作用的原初反应过程包括光能吸收、激发能传递和光化学反应等,且各荧光参数与电子传递、质子梯度的建立及二氧化碳同化过程有关[21-22]。因此,叶绿素荧光参数可作为胁迫条件下微藻抗逆反应的指标,用于浮游植物营养盐限制的监测[23-24]。光系统Ⅱ最大光化学量子产量是环境胁迫对光合作用影响的重要指标之一,在胁迫条件下明显降低[16]。徐兴莲等[25]研究发现,三角褐指藻在氮限制的条件下,该参数值显著下降。刁永芳等[26]研究发现,筒柱藻B169在磷饥饿条件下,光系统Ⅱ最大光化学量子产量与接种时相比显著降低,由最初的0.668降至0.304。本试验对筒柱藻B200的研究也得出了相同的结论,氮饥饿组和磷饥饿组上述参数与接种时相比均有显著下降,但磷饥饿组的下降幅度(第3 d时的0.72 降至试验结束时的0.69)小于刁永芳等[26]的研究结果,原因可能是不同藻种或不同试验条件造成的。刁永芳等[26]的试验用的是中国海洋大学微藻种质库保存的筒柱藻B169,而本试验所用的是筒柱藻B200,虽然来自同一个种质库,但品系不同。此外,刁永芳等[26]的试验是由密度7.33×104个/mL接种时开始进行磷饥饿试验,而本试验是先在最适培养基条件下培养筒柱藻,到指数生长末期达到密度3.42×106个/mL时,将其离心转接到磷饥饿的培养基中进行饥饿试验,试验设计的不同导致了结果的差异。光系统Ⅱ最大光化学量子产量下降说明氮、磷饥饿条件下,筒柱藻光系统Ⅱ活性中心受到伤害,光合作用受到了抑制,卡尔文循环速率降低,进而使光合效率下降[27]。本试验结果还表明,与磷饥饿组相比,氮饥饿组的光系统Ⅱ最大光化学量子产量下降的幅度更大一些,说明筒柱藻对氮饥饿更敏感,当培养条件中氮元素缺乏时,光合系统在较短的时间内更易受到损伤或抑制。光化学淬灭表示光能被光系统Ⅱ反应中心捕获并参与光化学反应的部分[28],最大光合作用速率的变化与暗反应碳同化过程中的核酮糖-1,5-二磷酸羧化酶有很大关系,快速光曲线的初始斜率表示微藻细胞内光能利用效率,半饱和光照度表示强光耐受力[16]。本试验中,上述荧光参数均随氮饥饿和磷饥饿时间的延长有所降低,说明在氮饥饿和磷饥饿的条件下,筒柱藻光合机构的捕光色素复合体合成不足,影响光系统Ⅱ对光能的吸收、传递和光化学反应,从而使光合同化能力下降,光能吸收量降低,耐强光能力下降[16]。非光化学淬灭表示光系统Ⅱ天线色素吸收的过剩光能以热能的形式耗散掉的部分[4]。本试验中,非光化学淬灭随氮、磷饥饿时间的延长,先升后降。开始阶段该参数升高,表明其卡尔文循环的活性受抑制的程度增大,叶绿素吸收的光能利用率降低,光系统Ⅱ的潜在热耗散能力增强,对藻体本身是一种保护。随后该参数下降,表明筒柱藻的正常生理功能受到严重伤害,对热能的耗散能力不断丧失[27]。
3.2 氮、磷饥饿时间对筒柱藻细胞密度和叶绿素含量的影响
氮和磷是植物生长必需的大量元素,对藻细胞的生长、发育和分裂等生理活动有着极其重要的作用[29],一旦缺乏,蛋白质及核酸等物质合成受阻,细胞分裂缓慢甚至停止[30]。在长期的进化过程中,微藻已形成了一些适应营养盐限制的方法,以保障其生理代谢过程的正常进行[31]。夏荣霜等[32]研究发现,在氮、磷营养盐限制的初期,东海原甲藻(Prorocentrumdonghaiense)受到的抑制作用较弱,细胞仍能进行生长和分裂。许海等[33]研究发现,铜绿微囊藻(Microcystisaeruginosa)在无磷的培养基中可保持8 d的指数生长,而斜生栅藻(Scenedesmusobliquus)在无氮或无磷培养基中生长均很缓慢。本试验结果显示,筒柱藻在氮饥饿和磷饥饿条件下细胞密度均有所升高,但总体升幅不大,这可能与天然海水中存在微量的氮、磷元素有关[34]。另外,本试验也发现,磷饥饿条件下,细胞密度和叶绿素含量在整个培养周期内均不断升高,而氮饥饿条件下,细胞密度和叶绿素含量随氮饥饿时间的延长先升后降。这说明筒柱藻对磷饥饿的耐受能力高于对氮饥饿的耐受能力。刘皓等[35]研究发现,中肋骨条藻(Skeletonemacostatum)和威氏海链藻(Thalassiosiraweissflogii)在磷限制的条件下,细胞数量明显高于氮限制条件。Guerrini等[36]研究发现,氮磷限制均可使短柄曲壳藻(Achnanthesbrevipes)细胞密度和叶绿素含量下降,但磷限制没有氮限制效果明显,以上试验结果与本试验结果相一致。Cembella等[37]研究表明,藻类的生长直接取决于胞内磷而并非胞外磷,当环境中磷缺乏时并不一定意味着生长受到营养盐限制而出现抑制现象,藻类细胞内普遍存在“磷库”,当受到缺磷胁迫后,藻细胞可利用细胞中的“磷库”进行生长代谢。Li等[38]认为,叶绿素是富氮化合物,当氮缺乏时,叶绿素作为一种胞内易得的氮源供细胞生长所需,导致叶绿素含量降低,当叶绿素降低到临界值以下时,细胞生长会受到抑制。本试验结果也间接证明了这一点,即氮饥饿条件下,叶绿素含量在氮饥饿的第1 d达到最高值后逐渐降低,降低到一定含量时,细胞停止生长。
3.3 氮、磷饥饿时间对筒柱藻总脂含量的影响
许多研究表明,氮、磷等营养盐限制可有效提高藻细胞的油脂含量[4-7]。这可能是因为氮磷限制时,蛋白质、酶和糖类等合成受阻,迫使代谢流向不含这些元素的化合物,如中性脂的合成[39],最终使细胞中的总脂含量升高。也有学者认为,细胞在氮磷胁迫条件下,细胞内类囊体膜的含量降低,使乙酰水解酶得到活化,促进了磷脂水解[40]。这些变化可能增加了细胞内乙酰辅酶A的含量,同时氮胁迫又能活化甘油二脂酰转移酶,该酶能促使乙酰辅酶A向甘油三酯转化。因此,氮磷胁迫能增加细胞内总脂及甘油三酯的含量。本试验结果发现,筒柱藻的总脂含量在氮饥饿的第8 d达到最大值,比未进行氮饥饿时增加了56.9%;在磷饥饿的第6 d达到最大值,比未进行磷饥饿时增加了19.0%。从以上数据可以看出,氮饥饿能更好的增加筒柱藻的总脂含量。Reitan等[6]的研究结果发现,三角褐指藻和角毛藻在磷饥饿条件下,总脂含量增加,但效果没有氮饥饿那么显著,与本试验结果一致。而刁永芳等[26]对筒柱藻B169的研究结果发现,磷限制并未提高该藻的总脂含量,原因可能与筒柱藻的不同品系及培养条件不同有关。刁永芳等[26]是从低密度(7.33×104个/mL)接种时开始进行磷饥饿试验,本试验是采用“两步法”培养筒柱藻,磷饥饿试验开始时的最初细胞密度较高(3.42×106个/mL),试验方法的不同导致了结果的差异。此外,对于生物柴油下游加工成本而言,生物量和总脂含量起着同等重要的作用,本试验发现,在氮、磷饥饿的第4、6、8 d,筒柱藻的总脂含量没有发生显著变化,基于生物量和总脂含量两方面的考虑,筒柱藻最佳氮限制时间为6 d,最佳磷限制时间为8 d。
3.4 氮、磷饥饿时间对筒柱藻脂肪酸组成的影响
营养盐限制对微藻脂肪酸组成也有显著影响。石伟杰[41]采用“两步法”研究了氮饥饿时间对海绿球藻和微绿球藻(Nannochlorisoculata)脂肪酸组成的影响,结果表明,总单不饱和脂肪酸含量随氮饥饿时间的延长逐渐升高,总多不饱和脂肪酸含量随氮饥饿时间的延长逐渐降低,氮饥饿时间对总饱和脂肪酸含量没有显著影响。本试验得出的氮饥饿时间对筒柱藻总单不饱和脂肪酸和总多不饱和脂肪酸含量影响的结果与石伟杰[41]的研究结果一致,但本试验中总饱和脂肪酸含量随氮饥饿时间的延长逐步升高,与石伟杰[41]得出的结论不同。两个试验都是采用“两步法”进行氮饥饿试验,氮饥饿对总饱和脂肪酸含量影响不同的原因可能与微藻种类的不同有关。刁永芳[42]对筒柱藻B169的研究结果表明,总饱和脂肪酸在缺氮和缺磷条件下含量较高,总多不饱和脂肪酸在缺氮和缺磷条件下含量较低,总单不饱和脂肪酸含量的变化则与受限营养盐种类有关,缺氮时总单不饱和脂肪酸含量较高,而缺磷对总单不饱和脂肪酸含量的影响差异不显著。本试验研究氮磷饥饿时间对筒柱藻B200脂肪酸组成的影响得出了与刁永芳[42]基本一致的结论,但刁永芳[42]对筒柱藻B192的研究结果则与上述结果有所不同,不同之处是缺氮和缺磷条件均能促进该藻总单不饱和脂肪酸含量的增加,这可能与微藻的不同品系有关。因此,氮磷饥饿对微藻脂肪酸组成的影响与微藻种类、受限营养盐种类、限制时间等因素相关,可根据不同的目的选择合适的微藻品系以及营养盐限制方法,以获取不同的脂肪酸组成。此外,有研究表明[43],富含总饱和脂肪酸和总单不饱和脂肪酸的原料更适合生产生物柴油。由脂肪酸分析可以看出,筒柱藻中总饱和脂肪酸和总单不饱和脂肪酸含量均随氮、磷饥饿时间的延长达到较高值,而且该藻的主要脂肪酸是16碳链,与生物柴油分子15个左右的碳链极其相似,因此从脂肪酸组成来看,该藻是1株十分有潜力的产油微藻。
4 结 论
微藻因含油量高、易培养、单位面积产量大等优点,被视为新一代生物柴油原料,但从经济方面来讲,生产成本是目前制约微藻应用的主要因素,因此,要想使其工业化生产,降低生产成本非常关键。对微藻生产生物柴油的深入研究发现,提高微藻的产油能力、优化产油条件等下游工程可有效地降低生物成本,提高生物柴油的产量与质量[2]。有研究发现[4-5],氮、磷胁迫虽是一种提高总脂含量的有效方法,但会使微藻的生物量下降。针对以上问题,本试验通过两步培养法,即先在最适条件下培养筒柱藻,至指数生长末期时,将其离心转接到氮饥饿和磷饥饿的培养基中使其积累大量的脂类,结果发现该藻在氮饥饿的第6 d和磷饥饿的第8 d均可获得较高的生物量和总脂含量,从而为上述问题的解决提供了一定的理论依据。另外,该藻的脂肪酸16:0和总饱和脂肪酸含量均随氮磷饥饿时间的延长达到较高含量,16:1n-6和总单不饱和脂肪酸含量在氮饥饿的第8 d达到最大值,这些都有利于生物柴油的生产。因此,可以利用上述指标找出最佳的培养条件及培养工艺,为筒柱藻的大规模生产培养及开发利用提供理论依据。
[1] 郑亚君.人类的环保卫士—微藻[J].山西科技,2016,31(1):81-82.
[2] 童牧,周志刚.新一代生物柴油原料—微藻[J].农业工程技术:新能源产业,2009,6(5):19-26.
[3] 范丽敏,梁英,田传远.营养盐浓度对棕鞭藻叶绿素荧光参数、细胞密度和总脂含量的影响[J].水产科学,2012,31(5):249-254.
[4] 梁英,石伟杰,田传远.氮浓度对海绿球藻生长及总脂含量的影响[J].水产科学,2011,30(11):653-658.
[5] 江怀真,张维,刘天中,等.氮、磷浓度对小球藻生长及油脂积累的影响[J].食品工业科技,2011,32(6):204-207.
[6] Reitan K I,Rainuzzo J R,Olsen Y.Effect of nutrient limitation on fatty acid and lipid content of marine microalgae1 [J].Journal of Phycology,1994,30(6):972-979.
[7] Courchesne N M D,Parisien A,Wang B,et al.Enhancement of lipid production using biochemical,genetic and transcription factor engineering approaches [J].Journal of Biotechnology,2009,141(1):31-41.
[8] Devi M P,Subhash G V,Mohan S V.Heterotrophic cultivation of mixed microalgae for lipid accumulation and wastewater treatment during sequential growth and starvation phases:effect of nutrient supplementation [J].Renewable Energy,2012(43):276-283.
[9] Dhup S,Dhawan V.Effect of nitrogen concentration on lipid productivity and fatty acid composition ofMonoraphidiumsp.[J].Bioresource Technology,2014(152):572-575.
[10] 史策.鲜活菱形筒柱藻(硅藻)对刺参饵料效果的研究[D].青岛:中国海洋大学,2014.
[11] Urbani R,Magaletti E,Sist P,et al.Extracellular carbohydrates released by the marine diatomsCylindrothecaclosterium,ThalassiosirapseudonanaandSkeletonemacostatum:effect of P-depletion and growth status [J].Science of the Total Environment,2005,353(1):300-306.
[12] Suman K,Kiran T,Devi U K,et al.Culture medium optimization and lipid profiling ofCylindrotheca,a lipid and polyunsaturated fatty acid-rich pennate diatom and potential source of eicosapentaenoic acid [J].Botanica Marina,2012,55(3):289-299.
[13] 兰岚,王巧晗,赫勇,等.流加—连续培养的筒柱藻营养成分分析[J].中国海洋大学学报:自然科学版,2012,42(6):68-71.
[14] 彭小伟,张维,刘天中,等.两株硅藻筒柱藻和纤细角毛藻的油脂生产[J].海洋科学,2013,37(2):43-47.
[15] Guillard R R L,Ryther J H.Studies of marine planktonic diatoms:Ⅰ.CyclotellananaHustedt andDetonulaconfervacea(CLEVE)Gran [J].Canadian Journal of Microbiology,1962,8(2):229-239.
[16] 梁英,孙明辉,田传远,等.氮磷源对筒柱藻叶绿素荧光特性和生长的影响[J].水产科学,2014,33(5):269-276.
[17] Platt T,Gallegos C L,Harrison W G.Photoinhibition of photosynthesis in natural assemblages of marine phytoplankton [J].Journal of Marine Research,1980,38(4):687-701.
[18] 戴荣继,黄春,佟斌,等.藻类叶绿素及其降解产物的测定方法[J].中央民族大学学报:自然科学版,2004,13(1):75-80.
[19] Bligh E G,Dyer W J.A rapid method of total lipid extraction and purification [J].Canadian Journal of Biochemistry and Physiology,1959,37(8):911-917.
[20] Lepage G,Roy C C.Improved recovery of fatty acid through direct transesterification without prior extraction or purification [J].Journal of Lipid Research,1984,25(12):1391-1396.
[21] Krause G H,Weis E.Chlorophyll fluorescence and photosynthesis:the basics [J].Annual Review of Plant Biology,1991,42(1):313-349.
[22] 刘志梅,蒋文伟,杨广远,等.干旱胁迫对3种金银花叶绿素荧光参数的影响[J].浙江农林大学学报,2012,29(4):533-539.
[23] Herrzig R,Falkowski P G.Nitrogen limitation inIsochrysisgalbana(Haptophyceae).I photosynthetic energy conversion and growth efficiencies [J].Journal of Phycology,1989,25(3):462-471.
[24] Lourenco S O,Barbarino E,Mancini-Filho J,et al.Effects of different nitrogen sources on the growth and biochemical profile of 10 marine microalgae in batch culture:an evaluation for aquaculture [J].Phycologia,2002,41(2):158-168.
[25] 徐兴莲,宋熙坤,岳瑞,等.氮限制对硅藻三角褐指藻光系统Ⅱ光化学反应的影响[J].生态学杂志,2016,35(1):183-188.
[26] 刁永芳,梁英,田传远.磷浓度对筒柱藻叶绿素荧光参数、生长及总脂含量的影响[J].海洋湖沼通报,2012(4):47-54.
[27] 梁英,金月梅,田传远.氮磷浓度对绿色巴夫藻生长及叶绿素荧光参数的影响[J].海洋湖沼通报,2008(1):120-128.
[28] 陈莲花,刘雷.叶绿素荧光技术在藻类光合作用中的应用[J].江西科学,2007,25(6):788-790.
[29] Ballin G,Doucha J,Zachleder V,et al.Macromolecular syntheses and the course of cell cycle events in the chlorococcal algaScenedesmusquadricaudaunder nutrient starvation:effect of nitrogen starvation [J].Biologia Plantarum,1988,30(2):81-91.
[30] Larson T R,Rees T A V.Changes in cell composition and lipid metabolism mediated by sodium and nitrogen availability in the marine diatomPhaeodactylumtricornutum(Bacillariophyceae)1 [J].Journal of Phycology,1996,32(3):388-393.
[31] 周志强,彭英丽,孙铭隆,等.不同氮素水平对濒危植物黄檗幼苗光合荧光特性的影响[J].北京林业大学学报,2015,37(12):17-23.
[32] 夏荣霜,徐兆礼,高倩.东海原甲藻在氮、磷限制胁迫下的补偿生长[J].中国水产科学,2014,21(6):1200-1210.
[33] 许海,吴雅丽,杨桂军,等.铜绿微囊藻、斜生栅藻对氮磷饥饿的耐受能力研究[J].生态科学,2014,33(5):879-884.
[34] 葛蔚,柴超,董超.氮浓度对牟氏角毛藻富集 2,2′,4,4′,5-五溴联苯醚的影响[J].中国环境科学,2012,32(10):1882-1887.
[35] 刘皓,高永利,殷克东,等.不同氮磷比对中肋骨条藻和威氏海链藻生长特性的影响[J].热带海洋学报,2010,29(6):92-97.
[36] Guerrini F,Cangini M,Boni L,et al.Metabolic responses of the diatomAchnanthesbrevipes(Bacillariophyceae)to nutrient limitation [J].Journal of Phycology,2000,36(5):882-890.
[37] Cembella A D,Antia N J,Harrison P J,et al.The utilization of inorganic and organic phosphorous compounds as nutrients by eukaryotic microalgae:a multidisciplinary perspective:part 2 [J].CRC Critical Reviews in Microbiology,1984,11(1):13-81.
[38] Li Y,Horsman M,Wang B,et al.Effects of nitrogen sources on cell growth and lipid accumulation of green algaNeochlorisoleoabundans[J].Applied Microbiology and Biotechnology,2008,81(4):629-636.
[39] 胡章喜,安时,段舜山,等.不同氮源对布朗葡萄藻生长、总脂和总烃含量的影响[J].生态学报,2009,29(6):3290-3294.
[40] Xin L,Hong-ying H,Ke G,et al.Effects of different nitrogen and phosphorus concentrations on the growth,nutrient uptake and lipid accumulation of a freshwater microalgaScenedesmussp.[J].Bioresource Technology,2010,101(14):5494-5500.
[41] 石伟杰.高脂绿藻的选育以及油脂积累条件的初步研究[D].青岛:中国海洋大学,2012.
[42] 刁永芳.筒柱藻生长和油脂积累条件的初步研究[D].青岛:中国海洋大学,2012.
[43] Stansell G R,Gray V M,Sym S D.Microalgal fatty acid composition:implications for biodiesel quality [J].Journal of Applied Phycology,2012,24(4):1-11.
EffectsofNitrogenandPhosphorusStarvationTimeonGrowthandTotalLipidContentofMarineDiatomCylindrothecasp.
LIANG Ying, MENG Xiangrong, SUN Minghui, TIAN Chuanyuan, HUANG Xulin
( The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China )
In this experiment, the chlorophyll fluorescence parameters, cell densities, chlorophyll contents, dry weights, total lipid contents and fatty acid compositions of marine diatomCylindrothecasp.B200 were studied under different nitrogen and phosphorus starvation time (0 d, 1 d, 2 d, 4 d, 6 d, and 8 d). The results showed that the maximal photochemical efficiency of PSⅡ, photochemical quenching, non-photochemical quenching, the maximum efficiency of photosynthesis, initial slope of rapid light curve and the half saturation light intensity were all decreased significantly with the increase in nitrogen and phosphorus starvation time, indicating that the photosynthesis of marine diatom was inhibited. Under nitrogen and phosphorus starvation conditions, the maximal values of the cell density were recorded at the 6th day and the 8th day, respectively, but increased slightly. The dry weight and total lipid content were increased gradually with the increasing nitrogen and phosphorus starvation time, with the maximum total lipid occurring on the day 8 (35.3%) in nitrogen starvation treatment and that on day 6 in phosphorus starvation treatment (28.9%). Nitrogen and phosphorus starvation time also had significant effects on the fatty acid compositions of the marine diatom. The contents of 16:0 and the total saturated fatty acids were increased while those of 20:4n-6, 20:5n-3 and the total polyunsaturated fatty acids decreased as nitrogen and phosphorus starvation time increased. For the 16:1n-7 and the total monounsaturated fatty acids, the values increased with the increasing nitrogen starvation time, whereas there was no significant variation in the above fatty acids related to the phosphorus starvation time. The trend of these indicators changing with nitrogen and phosphorus starvation time provides the reference for the large-scale cultivation and exploitation of marine diatom.
Cylindrothecasp.; nitrogen and phosphorus starvation time; chlorophyll fluorescence parameter; growth; total lipid content; fatty acid composition
10.16378/j.cnki.1003-1111.2017.03.001
Q945.79
A
1003-1111(2017)03-0249-10
2016-07-01;
2016-08-29.
“十二五”国家科技支撑计划项目(2011BAD14B01);国家“863”计划项目(2014AA022001).
梁英(1967-),女,教授,博士;研究方向:微藻生理生化.E-mail: yliang@ouc.edu.cn.

