三疣梭子蟹多克隆抗体与4种经济蟹类血细胞交叉反应的研究
蔡 鑫,邓 灯,王 颖,王文琪
( 1.青岛农业大学 海洋科学与工程学院,山东 青岛 266109;2.青岛农业大学 合作社学院,山东 青岛 266109 )
三疣梭子蟹多克隆抗体与4种经济蟹类血细胞交叉反应的研究
蔡 鑫1,邓 灯2,王 颖1,王文琪1
( 1.青岛农业大学 海洋科学与工程学院,山东 青岛 266109;2.青岛农业大学 合作社学院,山东 青岛 266109 )
采用激光共聚焦扫描显微镜技术、免疫印迹技术和流式细胞术3种方法对鼠抗三疣梭子蟹血细胞多克隆抗体与黄道蟹、日本蟳、中华绒螯蟹、勘察加帝王蟹血细胞的免疫交叉反应进行分析。激光共聚焦扫描显微镜结果表明,该抗体与黄道蟹、日本蟳、勘察加帝王蟹、中华绒螯蟹血细胞均发生了免疫交叉反应,且发生反应的抗原决定簇均位于细胞膜上;流式细胞术测定该抗体与黄道蟹颗粒血细胞和透明血细胞交叉反应阳性率最高,分别为99.45%、98%,与中华绒螯蟹颗粒血细胞和透明血细胞交叉反应阳性率最低,阳性率分别为81.34%、78.56%;免疫印迹结果显示该抗体与日本蟳血细胞结合的蛋白分子量是80、38.5 ku;与勘察加帝王蟹血细胞结合的蛋白分子量是80、93 ku;与中华绒螯蟹血细胞结合的蛋白分子量是82、41、30 ku;与黄道蟹血细胞结合的蛋白分子量是70、43 ku。
三疣梭子蟹;多克隆抗体;交叉反应
三疣梭子蟹(Portunustrituberculatus)、黄道蟹(Cancermagister)、日本蟳(Charybdisjaponica)、中华绒螯蟹(Eriocheirsinensis)、勘察加帝王蟹(Paralithodescamtschaticus)均属于甲壳类,因味道鲜美而深受大众喜爱[1-2],具有较高的经济价值[3],但近年来随着工厂集约化养殖规模扩大,各种疾病大规模爆发[4]。由于甲壳类动物缺乏适应性免疫,主要依靠非特异性免疫抵抗病原体,而参与非特异性免疫的细胞主要为血细胞,可通过吞噬、包埋、伤口修复、聚集、增生等方式消灭入侵的病原体[5-7]。目前甲壳类血细胞分类尚无统一标准,其分类存在争议,多数学者根据形态学特点及多种染色法,将甲壳类血细胞分为3类,即透明血细胞、半颗粒血细胞和颗粒血细胞[8-9]。由于流式细胞术可精确判断血细胞大小及颗粒度,目前采用该技术对甲壳类动物血细胞分类的研究逐渐增多[9-12]。交叉反应是指不同抗原分子上有相同或相似的抗原决定簇,一种抗体可以与两种或两种以上的抗原发生反应,其本质是抗原决定簇与抗体的特异性结合[13-14]。多克隆抗体因具有易获得、稳定性好、效价高等优点,成为疾病诊断、疫苗研制等研究领域的重要工具[15-17]。目前已有学者利用抗体研究甲壳类血细胞间的交叉反应[18-20],但是利用多克隆抗体分析日本蟳、勘察加帝王蟹、中华绒螯蟹和黄道蟹血细胞之间的免疫交叉反应未见报道,笔者在制备鼠抗三疣梭子蟹血细胞多克隆抗体的基础上,应用激光共聚焦扫描显微镜技术、免疫印迹技术分析了该抗体与4种蟹类血细胞的免疫交叉反应情况,并利用流式细胞术进一步定量免疫交叉反应的比率,以期为蟹类血细胞分类研究进一步积累资料,提供参考。
1 材料与方法
1.1 材料
三疣梭子蟹、黄道蟹、日本蟳、中华绒螯蟹、勘察加帝王蟹均购自青岛水产批发市场;Wistar大鼠购于青岛动物检疫监督所。
异硫氰酸荧光素标记羊抗大鼠IgG、碱性磷酸酶标记羊抗大鼠IgG,均购自Sigma公司;5-溴-4-氯-3-吲哚—磷酸、氯化硝基四氮唑蓝、硝化纤维膜均购自生工生物工程(上海)股份公司。
1.2 方法
1.2.1 血细胞制备
购买健康无病、肢体健全的5种蟹在条件控制为充氧24 h、20 ℃的水循环系统中暂养2 d,用无菌注射器从游泳足基部软膜抽取血淋巴,置于4 ℃预冷的抗凝剂[21](450 mmol/L NaCl,10 mmol/L KCl,10 mmol/L EDTA,10 mmol/L HEPES,pH 7.3),以1∶1比例混合。4 ℃,1000 r/min离心5 min,去上清液,用磷酸盐缓冲液重悬血细胞,重复3次,调整血细胞密度至107个/mL备用。
1.2.2 三疣梭子蟹多克隆抗体制备及纯化
采用文献[22]描述的方法进行免疫,取1 mL三疣梭子蟹血细胞悬液腹腔免疫大鼠,两周后进行二次免疫,以后每隔一周进行一次加强免疫,第四次免疫结束后3 d,心脏取血,4 ℃自然沉降12 h,2000 r/min离心10 min,取上层血清。采用辛酸—硫酸铵法对血清进行纯化,分装后-80 ℃冻存备用。
1.2.3 激光共聚焦显微镜观察交叉反应
调整血细胞密度为107个/mL,20 μL滴片,室温自然沉降5 h后用含0.5% Triton的磷酸盐缓冲液浸洗10 min,而后磷酸盐缓冲液洗5 min;10%山羊血清的磷酸盐缓冲液,室温封闭45 min;滴加鼠抗三疣梭子蟹血细胞多抗50 μL(1∶256),37 ℃湿盒中孵育1 h,然后用含0.05% Tween20的磷酸盐缓冲液洗3次,每次5 min;加50 μL(1∶3000)异硫氰酸荧光素标记羊抗大鼠IgG,37 ℃湿盒孵育1 h,而后磷酸盐缓冲液洗3次,每次5 min;4′,6-二脒基-2-苯基吲哚染色5 min,滴加防淬灭剂封片,激光共聚焦显微镜观察、拍照,并用Image Pro Plus分析荧光强度。
1.2.4 免疫印迹技术分析抗原决定簇分子量
取10 μL制备好的血细胞与5 μL示踪染料混合,100 ℃水浴5 min后进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,5%浓缩胶恒流30 mA,12%分离胶60 mA,示踪染料到达最底端时结束电泳;一块胶用考马斯亮蓝R250染液染色,染色结束后进行脱色并用凝胶成像系统进行拍照;同时制备的另一块胶与硝化纤维膜进行“三明治”电转膜,4 ℃ 200 mA恒流,转移5 h。结束后将硝化纤维膜置于含3%牛血清蛋白的磷酸盐缓冲液中37 ℃封闭1 h;加鼠抗三疣梭子蟹血细胞多克隆抗体 37 ℃孵育1 h,磷酸盐缓冲液洗3次,每次5 min;加碱性磷酸酶标记的羊抗大鼠IgG,37 ℃湿盒中孵育1 h,结束后磷酸盐缓冲液洗涤3次,每次5 min。5-溴-4-氯-3-吲哚—磷酸—氯化硝基四氮唑蓝底物发色15 min,加终止液终止反应,拍照。
1.2.5 流式细胞术测定交叉反应阳性率
取200 μL制备好的血细胞加鼠抗三疣梭子蟹血细胞多克隆抗体37 ℃振荡孵育1 h,1500 r/min离心5 min,弃上清液,磷酸盐缓冲液重悬沉淀,重复3次。加异硫氰酸荧光素标记的羊抗大鼠IgG,37 ℃振荡孵育1 h(阴性对照只加入异硫氰酸荧光素标记的羊抗大鼠IgG孵育),1500 r/min离心5 min,去上清液,而后磷酸盐缓冲液重悬沉淀,重复3次,调整细胞密度至107个/mL。流式细胞仪检测,以前向角散射为横坐标,侧向角散射为纵坐标,生成等高图,并根据细胞群聚集程度强弱对血细胞进行分类,Win MDI 2.9软件分析结果。
2 结 果
2.1 激光共聚焦扫描显微镜观察交叉反应结果
结合激光共聚焦扫描显微镜观察结果及细胞质内有无颗粒,将日本蟳、勘察加帝王蟹、中华绒螯蟹、黄道蟹血细胞分为两大类,即颗粒血细胞和透明血细胞(图1a3~d3)。细胞经4′,6-二脒基-2-苯基吲哚染色后细胞核为蓝色(图1a~d),鼠抗三疣梭子蟹血细胞多抗与4种蟹子血细胞均发生交叉反应(图1a1~d1),点状荧光信号在血细胞细胞膜上呈环状密集分布,其中该抗体与黄道蟹血细胞交叉反应的阳性信号最强烈(图1d2),荧光强度整体处于最高水平(图1d4);与日本蟳和勘察加帝王蟹血细胞交叉反应的阳性信号比较强烈(图1a2,b2),荧光强度整体处于相对较高水平(图1a4,b4);与中华绒螯蟹血细胞交叉反应的阳性信号最弱(图1c2),荧光强度整体较低(图1c4)。
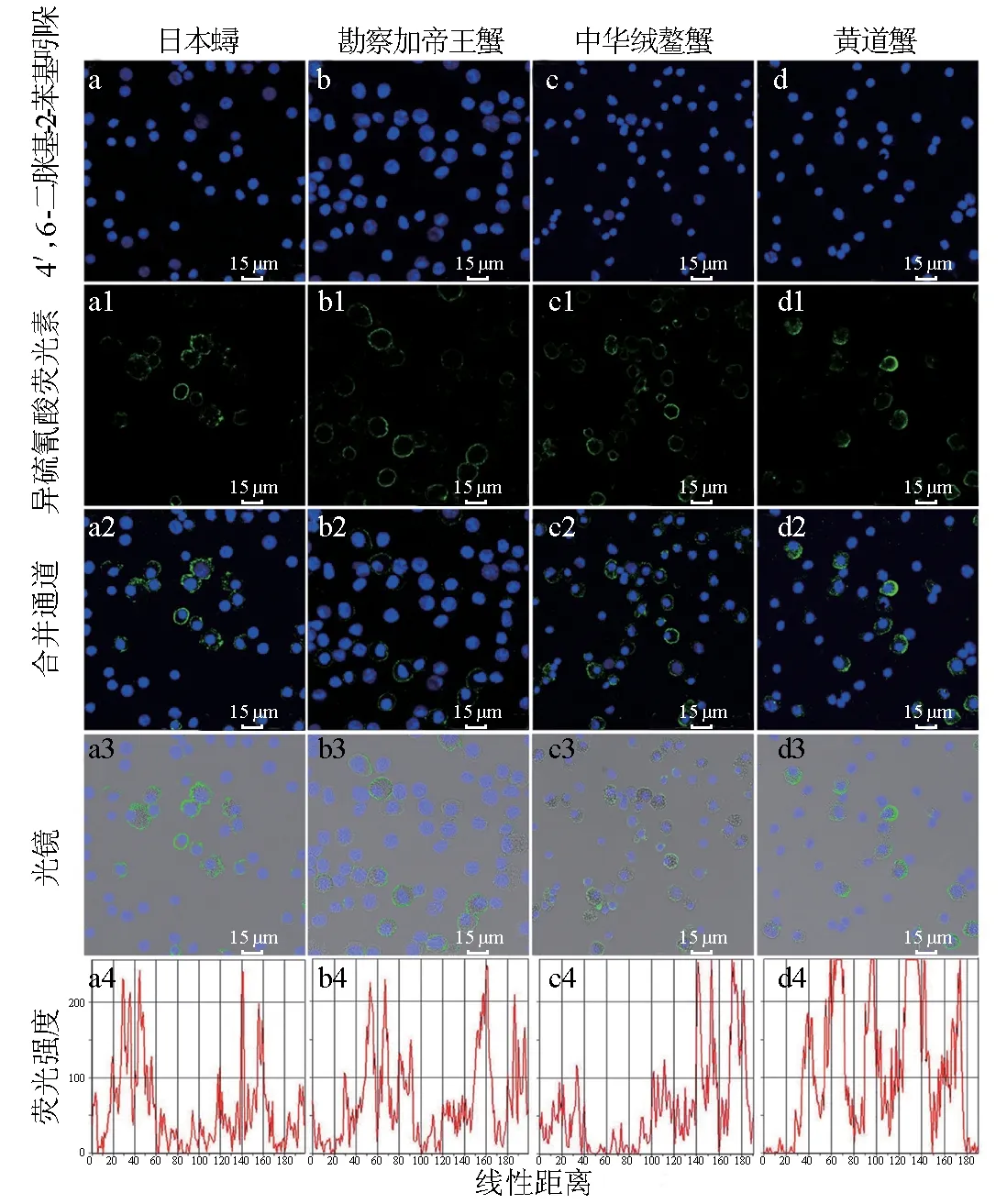
图1 激光共聚焦显微镜观察鼠抗三疣梭子蟹血细胞多克隆抗体与4种蟹血细胞的免疫交叉反应(1)a~d 4′,6-二脒基-2-苯基吲哚通道;a1~d1 异硫氰酸荧光素标记羊抗大鼠IgG通道;a2~d2 合并通道;a3~d3 光镜、4′,6-二脒基-2-苯基吲哚、异硫氰酸荧光素标记羊抗大鼠IgG通道;a4~d4 荧光强度.(2)a~a3 日本蟳血细胞;b~b3 勘察加帝王蟹血细胞;c~c3 中华绒螯蟹血细胞;d~d3 黄道蟹血细胞.
2.2 免疫印迹分析抗原决定簇分子量结果
电泳图谱中,4种蟹血细胞蛋白条带丰富。免疫印迹结果显示鼠抗三疣梭子蟹血细胞多抗与日本蟳血细胞交叉反应的蛋白条带有2条,其分子量分别为80、38.5 ku;与勘察加帝王蟹交叉反应的蛋白条带有2条,其分子量分别为90、80 ku;与中华绒螯蟹血细胞交叉反应的蛋白条带有3条,其分子量分别为82、41、30 ku;与黄道蟹血细胞交叉反应的蛋白条带有2条,分别为70、43 ku(图2)。
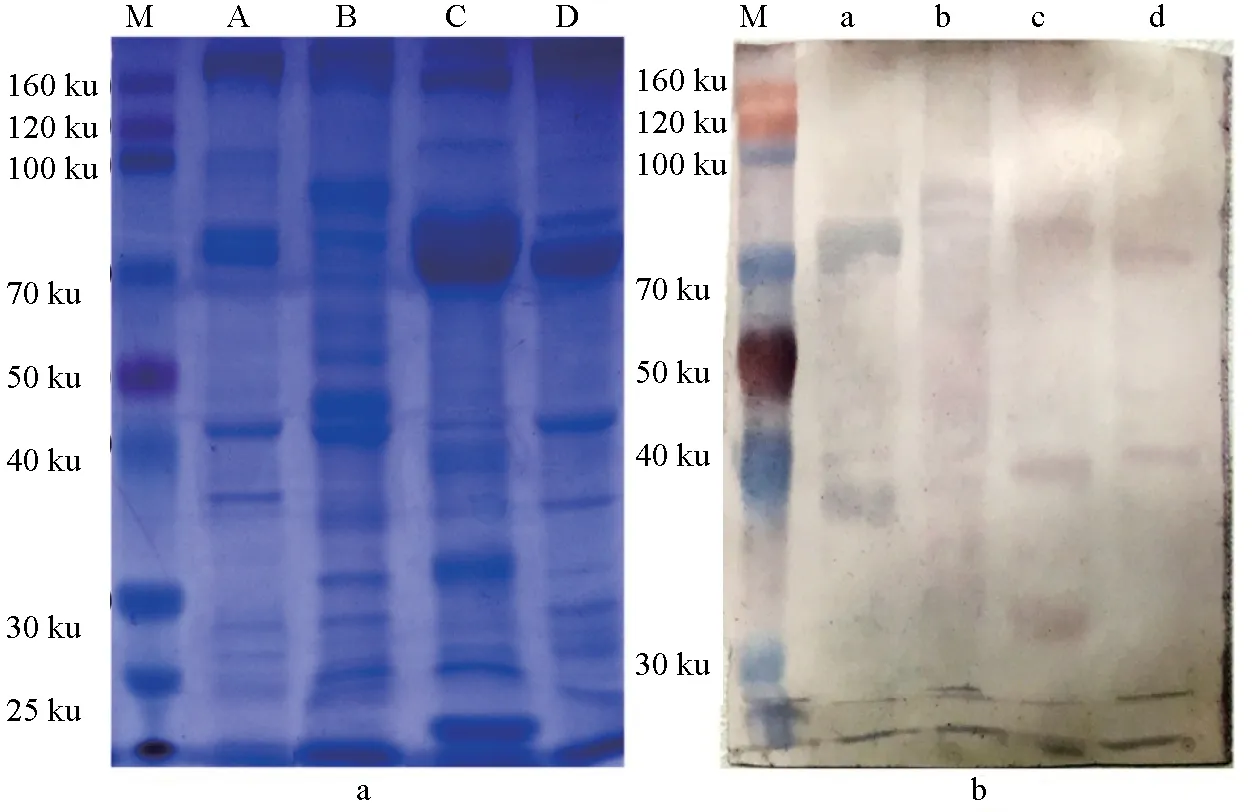
图2 电泳图谱(a)和免疫印迹(b)分析交叉反应结果十二烷基硫酸钠聚丙烯酰胺凝胶电泳中各条带分别为M marker、A 日本蟳、B帝王蟹、C中华绒螯蟹、D黄道蟹.免疫印迹中各条带分别为M marker、a 日本蟳、b帝王蟹、c中华绒螯蟹、d黄道蟹.
2.3 流式细胞术检测阳性率结果
根据前向角散射和侧向角散射流式等高图,将日本蟳、勘察加帝王蟹、中华绒螯蟹血细胞分为两类,即透明血细胞(红色环形标记)和颗粒血细胞(深蓝色环形标记)(图3a~c);将黄道蟹血细胞分为透明血细胞(红色环形标记),颗粒血细胞(深蓝色环形标记)和半颗粒血细胞(青色环形标记),3类(图3d)。
图4荧光直方图中黑线为阴性对照,蓝线为发生交叉反应的4种蟹颗粒血细胞,红线为发生交叉反应的4种蟹透明血细胞,青色线则为黄道蟹半颗粒血细胞。流式细胞术结果显示鼠抗三疣梭子蟹血细胞多抗与黄道蟹发生交叉反应的阳性率最高,发生交叉反应的颗粒血细胞占总颗粒血细胞的99.45%、发生反应的透明血细胞占总透明血细胞的98%(图4d1, d);鼠抗三疣梭子蟹血细胞多抗与中华绒螯蟹发生交叉反应的阳性率最低,其中发生交叉反应的颗粒血细胞占总颗粒血细胞的81.34%、发生交叉反应的透明血细胞占总透明血细胞的78.56%(图4c1, c)。另外,根据流式细胞术结果可知该抗体与4种蟹血细胞发生交叉反应时颗粒血细胞的阳性率均高于透明血细胞(表1)。
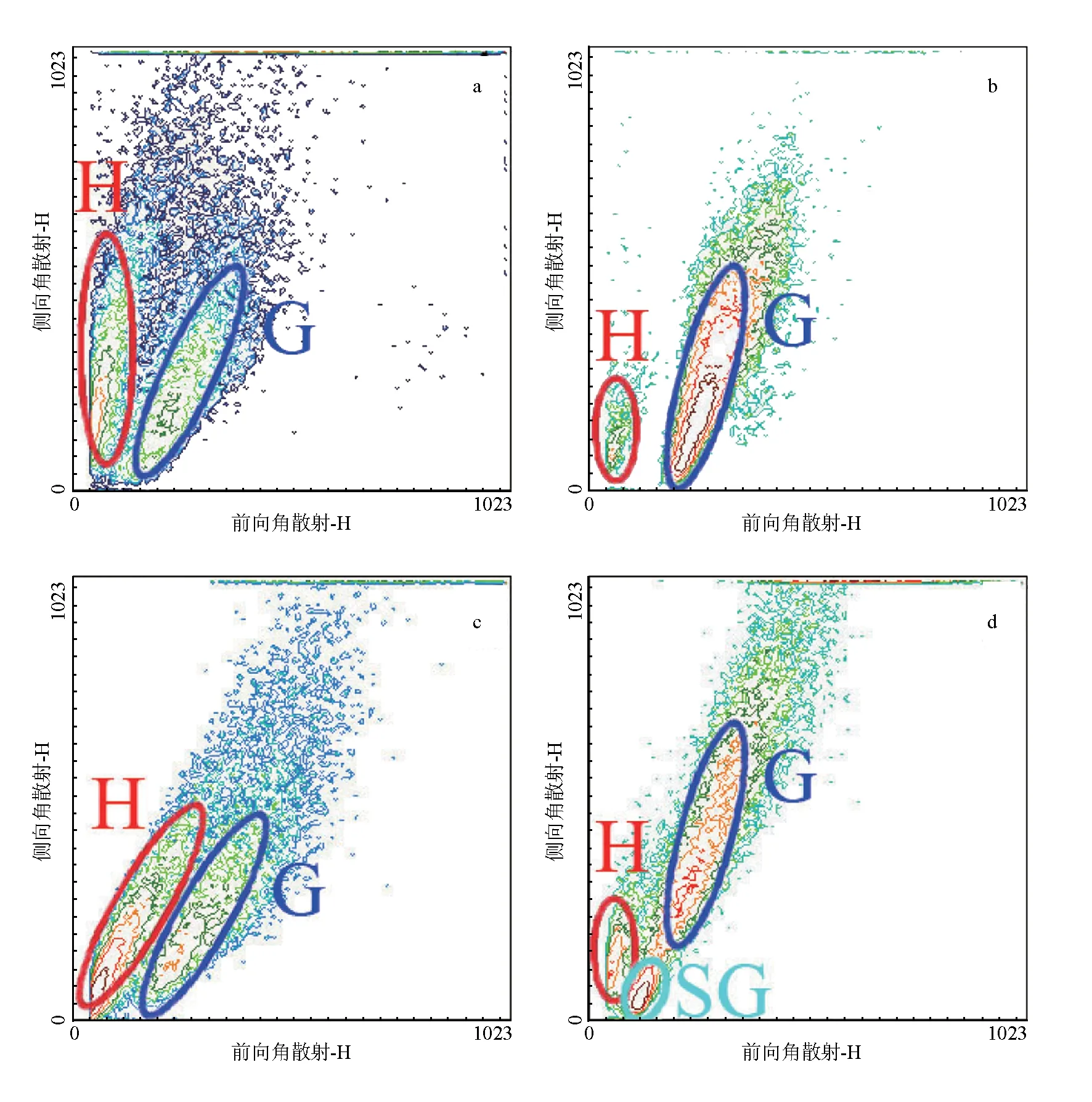
图3 流式细胞术检测4种蟹血细胞等高图 a 日本蟳、b 勘察加帝王蟹、c 中华绒螯蟹、d 黄道蟹.H为透明血细胞;SG为半颗粒血细胞;G为颗粒血细胞,下同.
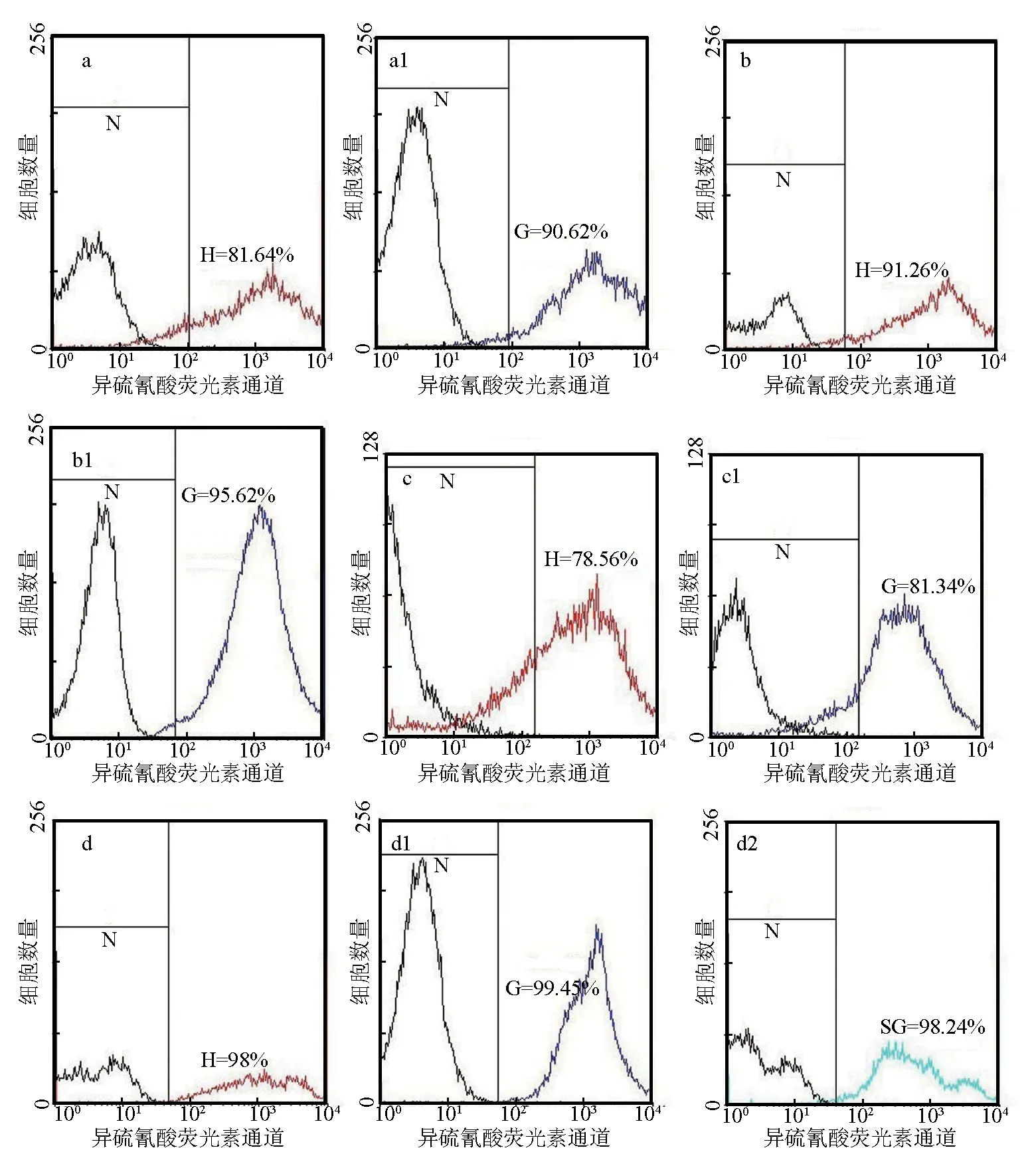
图4 鼠抗三疣梭子蟹血细胞多抗与4种蟹血细胞发生交叉反应的荧光直方图鼠抗三疣梭子蟹血细胞多抗与透明血细胞发生交叉反应阳性率:a 日本蟳、b 勘察加帝王蟹、c 中华绒螯蟹、d 黄道蟹.鼠抗三疣梭子蟹血细胞多抗与颗粒血细胞发生交叉反应阳性率:a1 日本蟳、b1 勘察加帝王蟹、c1 中华绒螯蟹、d1 黄道蟹.鼠抗三疣梭子蟹血细胞多抗与半颗粒细胞发生交叉反应阳性率:d2黄道蟹.N代表阴性,为黑色线;红线为与鼠抗三疣梭子蟹血细胞多抗发生阳性交叉反应的透明血细胞;蓝色线为与鼠抗三疣梭子蟹血细胞多抗发生阳性交叉反应的颗粒血细胞.

表1 鼠抗三疣梭子蟹血细胞多抗与4种蟹的细胞亚群交叉反应阳性率 %
3 讨 论
利用激光共聚焦扫描显微镜检测鼠抗三疣梭子蟹血细胞多抗与4种蟹类血细胞的交叉反应情况,发现4种蟹类血细胞的细胞膜上均有阳性信号,激光共聚焦扫描显微镜技术能精确地、高灵敏度地探测细胞荧光,通过激光断层扫描,可以反映出从亚细胞器到离子水平的形态学方面结构、同时借助其良好的横向和纵向分辨率,使样本的二维图像非常清晰[23-24],本试验采用该技术对鼠抗三疣梭子蟹血细胞多抗特异性结合的抗原决定簇进行了准确的定性和细胞定位分析。随后采用了免疫印迹技术寻找含有共同抗原决定簇的血细胞蛋白的分子量,该方法具有特异性强、灵敏性高的优点[17],采用该方法确定了4种蟹类血细胞与鼠抗三疣梭子蟹血细胞多抗发生特异性结合的血细胞蛋白多肽的分子量。在此基础上为进一步明确发生交叉反应的血细胞种类及比率,采用流式细胞术对4种蟹类血细胞进行分类并检测交叉反应比例,流式细胞术可检测细胞大小及内部颗粒,在单细胞水平上短时间内对群体细胞进行检测分析,同时在分类收集某一亚群细胞时,能避免主观性因素造成的不确定性,使统计数据更为准确[25-26]。由流式细胞术结果可知,日本蟳、勘察加帝王蟹、中华绒螯蟹血细胞分为颗粒血细胞、透明血细胞两类,而黄道蟹血细胞则分为颗粒血细胞、半颗粒血细胞和透明血细胞3类,且鼠抗三疣梭子蟹血细胞多抗与黄道蟹发生交叉反应的阳性率最高,与中华绒螯蟹的阳性率最低。
Roulston等[27]利用流式细胞术与Percoll离心将蜘蛛蟹(Hyasaraneus)血细胞分为透明前体血细胞、透明血细胞、半颗粒血细胞及颗粒血细胞4类;王颖等[21]利用流式细胞术将三疣梭子蟹血细胞分为颗粒血细胞和透明血细胞两类;Battison等[28]根据形态学将美国龙虾(Homarusamericanus)血细胞分为11类。尽管目前对甲壳类血细胞分类标准尚不明确,但两大类血细胞已确定,即细胞质内含颗粒的颗粒血细胞和不含颗粒的透明血细胞[9],本文由激光共聚焦扫描显微镜结果可将4种蟹血细胞均分为颗粒血细胞和透明血细胞两类,流式细胞术结果也将日本蟳、勘察加帝王蟹、中华绒螯蟹血细胞分为两类。Oliver等[10]利用流式细胞术将凡纳滨对虾(Litopenaeusvannamei)分为颗粒血细胞和透明血细胞两类;William等[29]将岸蟹(Carcinusmaenas)血细胞也分为颗粒血细胞和透明血细胞两类。这些研究结果与本文结论类似。但本研究应用流式细胞术却将黄道蟹血细胞分为的颗粒血细胞、半颗粒血细胞和透明血细胞3类,Denis等[8,11-12]应用流式细胞术将印度淡水蟹(Paratelphusajacquemontii)、蓝蟹(Callinectessapidus)和罗氏沼虾(Macrobrachiumrosenbergii)血细胞也分为颗粒血细胞、半颗粒血细胞和透明血细胞3类。本试验利用流式细胞术与激光共聚焦扫描显微镜技术针对蟹类血细胞分类得出不同结果,Xue等[30]指出显微观察不利于血淋巴细胞亚群的定量功能评估,而流式细胞术可以准确、快速和定量分析血细胞形态学及相关免疫功能,为研究甲壳类血细胞提供一种更为准确的方法。因此本研究以流式细胞术结果为主。
激光共聚焦扫描显微镜、免疫印迹与流式细胞术检测发现鼠抗三疣梭子蟹血细胞多抗与4种蟹血细胞均发生交叉反应,说明三疣梭子蟹血细胞与该4种蟹血细胞上存在共同抗原决定簇;激光共聚焦扫描显微镜观察鼠抗三疣梭子蟹血细胞多抗与黄道蟹血细胞免疫交叉反应阳性信号最强,且流式细胞术检测鼠抗三疣梭子蟹血细胞多抗与黄道蟹血细胞交叉反应阳性率最高,Kumar等[18]利用抗锯缘青蟹(Scyllaserrata)血细胞抗体检测其与紫螯青蟹(S.tranquebarica)、斑节对虾(Penaeusmonodon)、罗氏沼虾等甲壳类血细胞交叉反应时,发现亲缘关系近的物种,其交叉反应的免疫荧光信号强;Van de Braak等[19]利用斑节对虾血细胞单抗分析斑节对虾血细胞与罗氏沼虾、克氏原螯虾(Procambarusclarkii)等甲壳类血细胞交叉反应时,发现该抗体与罗氏沼虾血细胞具有较高的阳性荧光强度,其认为是由于该两种对虾亲缘关系较近,抗原决定簇具有更好的保守性。由此推测三疣梭子蟹血细胞与黄道蟹血细胞的抗原决定簇更为接近,即三疣梭子蟹与黄道蟹亲缘关系较其他3种蟹亲缘关系更近。
流式细胞术检测鼠抗三疣梭子蟹血细胞多抗与4种蟹血细胞交叉反应时,发现4种蟹的颗粒血细胞阳性率均高于透明血细胞阳性率。Kumar等[18,20-21]应用抗体分析甲壳类血细胞交叉反应,也得到同样的结果。究其原因为颗粒血细胞相比透明血细胞,其细胞中含有较多免疫因子,如酚氧化酶原、细胞黏附蛋白、抗菌肽等,其分子结构和空间构象更复杂,免疫原性更强[1,6],从而刺激机体产生更多针对颗粒血细胞的抗体。
本研究发现三疣梭子蟹血细胞抗体与日本蟳、勘察加帝王蟹、中华绒螯蟹、黄道蟹均发生交叉反应,说明三疣梭子蟹血细胞与4种蟹血细胞细胞膜上存在共同抗原决定簇,从分子水平为蟹类血细胞发生与分化的研究提供试验依据,同时对梳理三疣梭子蟹与4种蟹的亲缘关系有一定参考意义。
[1] Söderhäll K. Invertebrate Immunity[M].New York: Springer US, 2010:239-259.
[2] Jiang K, Zhang F, Pi Y, et al. Amino acid, fatty acid, and metal compositions in edible parts of three cultured economic crabs:Scyllaparamamosain,Portunustrituberculatus, andEriocheirsinensis[J]. J Aquat Food Prod T, 2014,23(1):73-86.
[3] 洪宇航, 杨筱珍, 张金彪, 等. 中华绒螯蟹血细胞原代培养条件的优化[J].动物学杂志,2012,47(2):52-58.
[4] 王晓璐. 凡纳滨对虾抗脂多糖因子ALF-AVK基因的克隆及其特性研究[D].青岛:中国海洋大学, 2013.
[5] Lv S, Xu J, Zhao J, et al. Classification and phagocytosis of circulating haemocytes in Chinese mitten crab (Eriocheirsinensis)and the effect of extrinsic stimulation on circulating haemocytes in vivo[J]. Fish & Shellfish Immun, 2014,39(2):415-422.
[6] Johansson M W, Keyser P, Sritunyalucksana K, et al. Crustacean haemocytes and haematopoiesis[J]. Aquaculture,2000,191(1):45-52.
[7] Seksan M, Piyachat S, Tanatchaporn U, et al. Characterization of the circulating hemocytes in mud crab (Scyllaolivacea) revealed phenoloxidase activity[J]. Dev Comp Immunol, 2013, 44(1):116-123.
[8] Denis M, Thayappan K, Ramasamy S M, et al. Opsonic function of sialic acid specific lectin in freshwater crabParatelphusajacquemontii[J]. Springer Plus, 2014, 4(1):1-15.
[9] Matozzo V, Marin M G. First cytochemical study of haemocytes from the crabCarcinusaestuarii(Crustacea, Decapoda)[J]. Eur J Histochem, 2010,54(1): 44-49.
[10] Oliver J D,Dusty Loy J,Parikh G, et al. Comparative analysis of hemocyte phagocytosis between six species of arthropods as measured by flow cytometry[J]. J Invertebr Pathol, 2011, 108(2):126-130.
[11] Alvarez J V, Chung J S.The involvement of hemocyte prophenoloxidase in the shell-hardening process of the blue crab,Callinectessapidus[J]. Plos One, 2015,10(9):e0136916.
[12] Du J, Zhu H, Ren Q, et al. Flow cytometry studies on theMacrobrachiumrosenbergiihemocytes sub-populations and immune responses to novel pathogen spiroplasma MR-1008[J]. Fish & Shellfish Immun, 2012,33(4):795-800.
[13] 王欣欣, 绳秀珍, 战文斌. 降低交叉反应的鱼类病原菌检测抗体芯片初步研究[J]. 海洋湖沼通报, 2013(1):23-28.
[14] 陈路, 张新红. 医学免疫学与病原生物学[M]. 北京:化学工业出版社, 2013:8-9.
[15] 李华, 李重实, 李明, 等. 抗鲶爱德华氏菌多克隆抗体的制备及特性分析[J]. 中国海洋大学学报:自然科学版, 2010,40(10):29-32.
[16] 窦勇, 宁喜斌. 副溶血弧菌多克隆抗体的制备及其特性分析[J]. 食品与生物技术学报, 2007,26(3):85-89.
[17] 战文斌, 齐继光, 刘洪明, 等. 水产动物6种主要病原菌与抗血清的免疫交叉反应[J]. 中国水产科学, 2004,11(1):14-19.
[18] Kumar B,Deepika A,Makesh M, et al. Production and characterization of monoclonal antibodies to the hemocytes of mud crab,Scyllaserrata[J].J Invertebr Pathol, 2012, 111(1):86-89.
[19] Van de Braak C B, Botterblom M H, Taverne N, et al. Monoclonal antibodies against haemocyte molecules ofPenaeusmonodonshrimp react with haemolymph components of other crustaceans and disparate taxa[J].Dev Comp Immunol,2001,25(4):279-283.
[20] Winotaphan P,Sithigorngul P,Muenpol O, et al. Monoclonal antibodies specific to haemocytes of black tiger prawnPenaeusmonodon[J].Fish & Shellfish Immun, 2005,18(3):189-198.
[21] 王颖, 王文琪, 程顺峰. 三疣梭子蟹颗粒血细胞单克隆抗体的研制及7种甲壳类动物血细胞的交叉反应研究[J]. 水产学报, 2015, 39(6):810-817.
[22] 陈骋. 半滑舌鳎(Cynoglossussemilaevis)免疫相关基因CsG3BP的克隆、表达及功能研究[D]. 青岛:中国科学院研究生院海洋研究所, 2013.
[23] 韩卓, 陈晓燕, 马道荣, 等. 激光扫描共聚焦显微镜实验技术与应用[J]. 科技信息, 2009(19):27-28.
[24] 夏宏林, 何颖, 邹泽红, 等. 苹果过敏原Mal d 4蛋白抗原表位预测及交叉反应分析[J]. 中国免疫学杂志, 2012,28(1):57-61.
[25] 王有基, 林江兴, 李琼珍, 等. 翡翠贻贝血淋巴细胞亚群鉴定及相关免疫功能的流式细胞分析[J]. 水产学报, 2014, 38(3):385-399.
[26] 吴晓娜, 蒋红兵. 流式细胞术的工作原理及其临床应用[J]. 中国医疗设备, 2011,26(3):91-93.
[27] Roulston C, Smith V J. Isolation and in vitro characterisation of prohaemocytes from the spider crab,Hyasaraneus(L.)[J]. Dev Comp Immunol, 2010,35(5):537-544.
[28] Battison A, Cawthorn R, Horney B. Classification ofHomarusamericanushemocytes and the use of differential hemocytes counts in lobsters inflected withAerococcusviridansvar. homari(Gaffkemia)[J]. J Invertebr Pathol, 2003,84(3):177-197.
[29] Williams A J, Lutz P L. Blood cell types inCarcinusmaenasand their physiological role[J]. J Mar Biol Assoc UK, 1975,55(3):671-674.
[30] Xue Q G, Renault T, Chilmonczyk S. Flow cytometric assessment of haemocyte sub-populations in the European flat oyster,Ostreaedulis, haemolymph[J]. Fish & Shellfish Immunol,2001, 11(7):557-567.
AntigenicCross-reactivityofCrustaceanHemocytesUsingPolyclonalAntibodiesofSwimmingCrabPortunustrituberculatus
CAI Xin1, DENG Deng2, WANG Ying1, WANG Wenqi1
( 1. College of Marine Science and Engineering, Qingdao Agricultural University, Qingdao 266109, China;2. College of Cooperatives Institute, Qingdao Agricultural University, Qingdao 266109, China )
In order to research the role of hemocytes in immune mechanism of crustaceans, polyclonal antibodies against hemocytes of swimming crabPortunustrituberculatuswere raised, and laser scanning confocal microscopy (LSCM), Western-blotting and Flow Cytometry (FCM) were used to detect the cross-reaction between antisera of swimming crab and 4 species crustacean (Cancermagister,Charybdisjaponic,Eriocheirsinensis,Paralithodescamtschaticus)hemocytes.Two types of hemocytes inC.japonic,E.sinensi, andP.camtschaticusand three types of hemocytes inC.magisterwere distincted by FCM. The strongest intensity of immuno-reactivity was inC.magisterby LSCM, and the maximal positive rate was that antisera reacted with hemocytes ofC.magisterdetected by FCM, with 99.45% of granulocytes and 98% of hyalinocytes. The results indicated antigenic similarities were found among the two species. Thus,C.magisterbeing more closely related species to swimming crab exhibited many immuno-reactions, while the other species with a phylogenetically longer distance to swimming crab did not. The immuno-reactive epitopes inC.magisterand swimming crab on the hemocyte membranes and in the plasma seemed to be well conserved, however, they are not necessarily the same, with similar functions. There was higher positive rate in granulocytes (81.34%) than in hyalinocytes (78.56%) detected by FCM in four species. The findings indicate that antigenic similarities exist among the four crustaceans species,C.magisterbeing more closely related species to swimming crab.
Portunustrituberculatus; polyclonal antibody; cross-reactivity
关于《水产科学》增页的通知
随着《水产科学》杂志影响力的不断提升,论文来稿量亦不断增多,为更快的传播渔业科技信息,缩短论文出版时滞,满足科研人员的发表科研论文需求,经辽宁省新闻出版广电局批准,《水产科学》杂志由2017年第3期始,页码增至144页。特此通知。欢迎广大读者踊跃投稿。
10.16378/j.cnki.1003-1111.2017.03.008
S917
A
1003-1111(2017)03-0303-08
2016-06-16;
2016-08-31.
山东省现代农业产业技术体系虾蟹类创新团队项目(SDAIT-15-011-06);山东省“两区”建设专项.
蔡鑫(1990—),女,硕士;研究方向:水产病害及免疫学.E-mail:caixin0105@163.com.通讯作者:王文琪(1969—),女,教授,硕士生导师;研究方向:水产疾病防治.E-mail:wenqi31@163.com.
(本刊编辑部)

