饲料浮萍水平对大正三色锦鲤TYR及MC1R基因表达的影响
张植元,魏 东,乔秀亭,白东清,范 泽,李静辉,安贸麟
( 天津农学院 水产学院,天津市水产生态及养殖重点实验室,天津 300384 )
饲料浮萍水平对大正三色锦鲤TYR及MC1R基因表达的影响
张植元,魏 东,乔秀亭,白东清,范 泽,李静辉,安贸麟
( 天津农学院 水产学院,天津市水产生态及养殖重点实验室,天津 300384 )
为探究饲料中不同浮萍添加水平对大正三色锦鲤酪氨酸酶TYR以及黑素皮质素受体MC1R基因表达的影响,配制浮萍添加水平分别为0%、3%、6%、9%、13%、14% 6种等蛋白(38.6%)饲料饲养大正三色锦鲤(42.19±1.32) g 8周,分别记为Diet 1(0/13)、Diet 2(3/10)、Diet 3(6/7)、Diet 4(9/4)、Diet 5(13/1)、Diet 6(14/0)。每种饲料设3个重复,每个重复饲喂10尾鱼。试验结果表明:(1)TYR基因在大正三色锦鲤的心脏、肝脏、眼睛、黑色皮肤、脑中均有表达,并且在脑、皮肤、眼睛中表达量相对较高;(2)各组织中TYR mRNA表达量随浮萍添加水平的升高均有一定波动,在皮肤与眼睛中,以Diet 6(14/0)组显著高于其他各组(P<0.05),在脑中,以Diet 3(6/7)组显著高于除Diet 6的其他各组(P<0.05);(3)皮肤与眼睛中MC1R mRNA表达量以Diet 6(14/0)组显著高于其他各组(P<0.05),而在脑中各组差异均不显著(P>0.05)。综上所述,在本试验条件下,饲料不同浮萍添加水平促进大正三色锦鲤TYR以及MC1R基因表达,有利于鱼体黑色素沉积,因此选择Diet 6(14/0)组饲料投喂大正三色锦鲤最适。
浮萍;大正三色锦鲤;TYR基因;MC1R基因;黑色素
锦鲤(Cyprinuscarpio)属鲤形目、鲤亚目、鲤科、鲤属。体形健壮,体长、体高、体厚三者适中[1]。现如今人工选育的品种已达到100多种,其经济价值相当可观[2-3]。白底三色是锦鲤的代表品种之一,体色为红、白、黑三色,体色是在红白标准的基础上,有少量黑斑,胸鳍有放射条状黑纹,与红白、黑底三色合称“日本御三家”[4-5]。
在锦鲤中,除黑色素之外,其他体表色素都是靠体外摄入进行合成的,而黑色素是一种广泛存在于脊椎动物皮肤、眼睛、毛发中的生物多聚体,由细胞器黑色素小体合成[6],其合成过程与酪氨酸酶(TYR)密切相关。酪氨酸酶是一种含铜的氧化还原酶,是大正三色锦鲤体表黑色素生成的关键酶与限速酶。而黑素皮质素受体(MC1R)又是控制鱼体黑色素的重要基因,与其他两个配体α-促黑素细胞激素和促肾上腺皮质激素共同经过一系列反应最终转变为环腺苷酸,进而激活酪氨酸酶合成黑色素[7-8]。因此,黑色素合成的速度与产量由酪氨酸酶在体内的表达量及活性决定[9]。由此推断,锦鲤日粮中酪氨酸水平可能会对体表黑色素合成有重要影响。
浮萍是一种分布广泛的水生植物,具有生长速度快、营养成分好和蛋白含量高等优点,且叶黄素和酪氨酸含量丰富,是极具潜力的新型饲料原料。浮萍的粗纤维和蛋白质分别占其干质量的5%~15%和35%~45%[10-12]。因此,本试验在常用锦鲤饲料原料基础上,设计不同浮萍水平替代菜粕,采用半定量PCR的方法,通过对TYR及MC1R mRNA表达量的影响,来评估饲料中不同浮萍水平对大正三色锦鲤体表黑色素的表达,从而得到最适的浮萍饲料配方。
1 材料与方法
1.1 试验鱼与饲养管理
大正三色锦鲤鱼种购自天津市蓝科水产有限公司,饲养试验在天津市天津农学院水族实验室18个50 cm×45 cm×45 cm的观赏鱼鱼缸中进行。试验鱼驯化适应环境7 d以后,选取体质健壮、规格一致、无伤无病,初始体质量为(42.19±1.32) g,随机分为6组,每组3个重复,每个重复10尾。养殖水源为曝气后的自来水,水温(29±1.1) ℃,pH为7.8±0.2,日投喂率为体质量的3%,日投喂2次(9:00,15:30),养殖试验持续8周。
1.2 试验饲料
首先室外采集鲜浮萍,清理晒干后进入粉碎机粉碎,以鱼粉、全虾粉、豆粕和棉粕作为蛋白源,配制浮萍(干品)替代菜粕水平分别为0%、3%、6%、9%、13%、14% 6种等蛋白(38.6%)饲料,分别记为Diet 1(0/13)、Diet 2(3/10)、Diet 3(6/7)、Diet 4(9/4)、Diet 5(13/1)、Diet 6(14/0),其组成与营养水平见表1。各饲料原料均通过粉碎机粉碎过60目网筛,混合均匀后,使用专业饲料制作机器制成直径为1.00 mm的沉性颗粒饲料。

表1 试验饲料组成及营养水平 %
1.3 样本采集
饲养结束后,禁食48 h,取每个重复中的3尾鱼的肝胰脏、心脏、眼睛、黑色皮肤、脑在液氮中速冻,然后转入低温冰箱中-80 ℃保存,待测TYR以及MC1R基因表达。
1.4 组织中TYR及MC1R mRNA 测定
1.4.1 引物设计
根据GenBank中现有的锦鲤及其相关鱼类的TYR和MC1R基因保守序列设计引物,根据鱼类β-actin保守序列,设计锦鲤 β-actin引物[13-14](表 2)。所有引物均由金唯智公司合成。
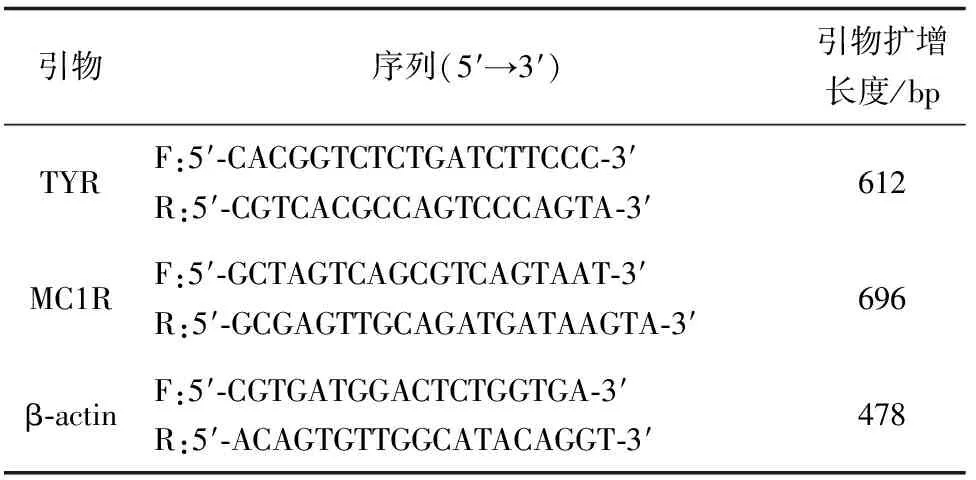
表2 试验所用引物
1.4.2 总RNA的提取和cDNA的第一链合成
总RNA提取采用RNAiso Plus试剂,根据说明书进行RNA抽提。使用微分光光度计检测总RNA纯度和定量OD260/280值。使用PrimeScriptTM1stStand cDNA Synthesis Kit(大连宝生物工程有限公司)将提取的组织总RNA反转录成 cDNA,以Oligo(dT)为引物,反应条件为:50 ℃,45 min,70 ℃,15 min,合成的cDNA第一链保存于-20 ℃冰箱中。
1.4.3 PCR扩增
PCR反应每一样品扩增体系为25 μL,其中10×PCR Buffer 2.5 μL,dNTP Mixture 1.5 μL,TaKaRa TaqE 0.5 μL,引物F 0.5 μL,引物R 0.5 μL,双蒸水18.5 μL,cDNA模板1 μL。
TYR cDNA片段扩增反应条件为95 ℃预变性4 min;95 ℃变性45 s,59 ℃退火40 s,72 ℃延伸45 s,36个循环;最后72 ℃延伸8 min。MC1R cDNA片段扩增反应条件为95 ℃预变性4 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,35个循环;最后72 ℃延伸10 min。β-actinc DNA片段扩增反应条件为94 ℃预变性10 min;94 ℃变性45 s,59 ℃退火30 s,72 ℃延伸1 min,30个循环;最后72 ℃延伸10 min。
1.5 组织中mRNA相对表达量的数据统计分析
利用Gel-Pro analyzer软件分析电泳图像中各条带的信号强度,用TYR及MC1R信号强度分别与相对应β-actin信号强度的比值表示TYR mRNA及MC1R mRNA的相对表达量,并根据TYR/β-actin及MC1R/β-actin比值,对TYR mRNA及MC1R mRNA的相对表达量采用SPSS 17.0统计软件进行分析。试验结果进行单因素方差分析,差异显著时进行邓肯多重比较,显著性标准P<0.05。数据均以平均值±标准差表示。
2 结 果
2.1 大正三色锦鲤各组织TYR基因差异表达
2.1.1 大正三色锦鲤总RNA的提取及检测结果
本试验提取的RNA经过微分光光度计检测总RNA纯度,其定量OD260/280值为1.8~2.0。再将提取的总RNA样品,经1%琼脂糖凝胶电泳检测显示RNA无明显的降解,条带较完整,即作为反转录的模板,进行cDNA的第一链合成。心脏、肝脏、皮肤、眼睛、脑中的RNA样本电泳结果见图1。

图1 大正三色锦鲤总RNA的琼脂糖凝胶电泳由左至右依次为:心脏、肝脏、皮肤、眼睛、脑.
2.1.2 大正三色锦鲤TYR和β-actin在不同组织中的表达
半定量RT-PCR结果显示,TYR基因在大正三色锦鲤的心脏、肝脏、眼睛、黑色皮肤、脑中均有表达(图2)并且在眼睛、皮肤、脑中表达量最高,因此选择这3个组织为代表做后续试验。

图2 TYR及β-actin基因在大正三色锦鲤各组织中的表达电泳h:心脏、l:肝脏、s:皮肤、e:眼睛、b:脑.
2.2 饲料浮萍添加水平对大正三色锦鲤TYR及MC1R mRNA基因表达的影响
2.2.1 饲料不同浮萍添加水平对大正三色锦鲤TYR mRNA表达的影响
投喂6种不同浮萍添加水平饲料后,各组织中TYR mRNA表达丰度的平均值有一定的波动。在皮肤中Diet 5(13/1)组与Diet 6(14/0)组差异不显著(P>0.05),但均显著大于其他各组(P<0.05);
在眼睛中,Diet 6(14/0)组表达丰度显著高于其他各组(P<0.05),而Diet 5(13/1)组与Diet 2(3/10)组差异不显著(P>0.05),并且显著最低(P<0.05);而在脑组织中,从Diet 1(0/13)到Diet 6(14/0)组表达丰度呈现先升后降的趋势,Diet 4(9/4)与Diet 5(13/1)、Diet 6(14/0)组差异不显著(P>0.05),Diet 3(6/7)组表达丰度显著最高(P<0.05)(图3、图4、表3)。

图3 TYR基因在大正三色锦鲤各组织中的RT-PCR扩增产物

饲料号(浮萍/菜粕)皮肤眼睛脑Diet1(0/13)0.29±0.11b0.24±0.16ab0.16±0.06bDiet2(3/10)0.31±0.14b0.13±0.02b0.15±0.03bDiet3(6/7)0.50±0.20ab0.36±0.16ab0.43±0.22aDiet4(9/4)0.24±0.17b0.27±0.19ab0.28±0.12abDiet5(13/1)0.60±0.20a0.16±0.06b0.25±0.16abDiet6(14/0)0.72±0.22a0.43±0.28a0.27±0.16ab
注:表中同一列数据右上角标有相同字母的表示差异不显著(P>0.05);标有不同字母表示差异显著(P<0. 05),下表同.
2.2.2 饲料不同浮萍添加水平对大正三色锦鲤MC1R mRNA表达的影响
投喂6种不同浮萍添加水平饲料后,各组织中MC1R mRNA表达丰度的平均值有一定的波动。在皮肤中表达丰度呈先降后升的趋势,且Diet 5(13/1)与Diet 6(14/0)组均显著高于其他各组(P<0.05),其他各组差异不显著(P>0.05);在眼睛中,Diet 1(0/13)组表达丰度显著最低(P<0.05),而Diet 6(14/0)组显著高于其他各组(P<0.05),Diet 2(3/10)与Diet 3(6/7)、Diet 4(9/4)组差异不显著(P>0.05);在脑中表达丰度呈缓慢上升趋势,但各组表达丰度均不显著(P>0.05)(图5、图6、表4)。

图4 TYR及β-actin基因在大正三色锦鲤皮肤、眼睛、脑中的表达电泳

饲料号(浮萍/菜粕)皮肤眼睛脑Diet1(0/13)0.11±0.03bc0.08±0.01c0.12±0.04aDiet2(3/10)0.12±0.02bc0.13±0.08abc0.12±0.07aDiet3(6/7)0.11±0.00bc0.16±0.04ab0.12±0.06aDiet4(9/4)0.06±0.01c0.15±0.02ab0.15±0.07aDiet5(13/1)0.16±0.02ab0.12±0.01bc0.16±0.02aDiet6(14/0)0.20±0.07a0.18±0.04a0.16±0.02a

图6 MC1R及β-actin基因在大正三色锦鲤皮肤、眼睛、脑中的表达电泳
3 讨 论
3.1 大正三色锦鲤各组织TYR基因差异表达
脊椎动物的色素细胞主要起源于两种:一是神经外胚层,例如视网膜外层的色素上皮层,布满许多黑色素细胞[15];二是神经脊,比如动物真皮层中的各组色素细胞[6]。本试验与王巍等[13]得出结果一样,TYR基因均在眼睛、皮肤、脑中表达量高。由于视网膜上皮层中有很多视觉功能所必需的黑色素细胞[16],因此TYR基因在眼睛中的表达量很高,这一结果与瓯江彩鲤[17]、斑马鱼[18](Daniorerio)一致。大正三色锦鲤的黑色皮肤主要由黑色素的数量、种类和分布决定[19],而鱼类表皮黑色素的沉淀是一个相当复杂的过程,涉及到一系列的遗传变异、细胞合成以及生理因素[20]。鱼类皮肤中黑色素细胞普遍是存在于真皮层的皮下层中,但也有研究发现,表皮中黑色素小体通过聚散与胞质扩散到表皮中[21]。因此,本试验中大正三色锦鲤的皮肤TYR mRNA表达量很高,与王巍等研究结果一致[13,18]。黑色素是由神经细胞发育产生的物质,而脑部是神经中枢,因此TYR mRNA在脑中的表达量也较高,而且据有关研究发现,在脑组织深处有黑色素存在[22]。在心脏与肝脏中TYR mRNA也有少量表达,但不显著。在金鱼、瓯江彩鲤的心脏中均发现了TYR基因的表达,而在斑马鱼与瓯江彩鲤的肝脏中没有发现表达[17-18],这有可能与神经细胞的发育和黑色素巨噬细胞的吞噬能力有关[23]。
3.2 饲料不同浮萍添加水平对大正三色锦鲤TYR mRNA表达的影响
酪氨酸是一种芳香族氨基酸,也是20种用来合成蛋白质的蛋白氨基酸之一,属于非必需氨基酸。酪氨酸也是酪氨酸酶单酚酶功能的催化产物,是最终合成黑色素的主要必需物。由于浮萍中酪氨酸含量丰富,本试验以饲料蛋白为基准,用浮萍替代菜粕,从而使饲料中酪氨酸含量呈线性增长。最终TYR mRNA表达结果显示,随着浮萍替代量的增加,大正三色锦鲤眼睛、皮肤、脑中的TYR基因表达量均在上升。根据相关研究报道,日粮氨基酸水平对丝毛乌骨鸡黑色素相关基因表达显示,随着氨基酸添加量的提高,皮肤的TYR基因表达量先升高后降低[24],与本试验结果不太一致,可能是由于试验对象不同所造成的差异,但是都起到了升高的作用。马兰春等[25]提出,酪醇是红景天甙糖基化反应的甙元底物分子,是酪氨酸经过高温或者腐败后形成酪醇,是一种生物碱代谢途径。而张迪敏等[26]通过研究女贞子单体酪醇对培养黑素细胞酪氨酸酶活性的影响表明,酪醇虽然不刺激黑素细胞增殖,但能提高酪氨酸酶活性、加速黑素合成,并能上调黑素细胞酪氨酸酶和TYRP1 mRNA表达,从而使黑素细胞的酪氨酸酶活性增强,黑素合成增加。
3.3 饲料不同浮萍添加水平对大正三色锦鲤MC1R mRNA表达的影响
MC1R基因对酪氨酸酶蛋白中TYR、TYRP1、TYRP2的3个酶活性的表达水平均有影响,是一个调控黑色素合成的重要基因[27]。本试验结果表明,在大正三色锦鲤的皮肤与眼睛中,MC1R mRNA的表达量随着饲料浮萍水平提高在增加,并且Diet 6(14/0)显著最高(P<0.05),而在脑中,MC1R mRNA的表达差异均不显著(P>0.05)。大正三色锦鲤眼睛与皮肤中MC1R mRNA的表达结果与TYR mRNA的表达结果相对一致,说明饲料中浮萍添加量的提高可能会促进体酪氨酸酶活性,最终提高皮肤与眼睛中的黑色素表达。而脑中MC1R mRNA的表达均没有差异,与脑中TYR mRNA的表达结果不一致,可能是当α-促黑素细胞激素和促肾上腺皮质激素与黑色素细胞膜上的黑素皮质素受体结合后,激活酪氨酸激酶大量产生,导致色素细胞产生的是真黑色素[28],而脑中几乎没有色素细胞或者黑色素存在,因此在脑中MC1R没有显著变化。
[1] 金万昆,高永平.超级鲤的生物学特性和养殖技术[J].天津水产,2013(2):39-44.
[2] Tamadachi M. The cult of the Koi[M]. Neptune: TFH Publications Inc,1990:288-289.
[3] 苏建通.锦鲤的养殖与鉴赏[M].北京:中国农业出版社,2011:60-72.
[4] 史东杰,梁拥军,孙砚胜,等.锦鲤“御三家”新品系的选育[J].水产科技情报,2014,41(3):152-154.
[5] 晶莹.锦鲤品系[J].水族世界,2005(3):14-19.
[6] Kelsh R N. Genetics and evolution of pigment patterns in fish[J]. Pigment Cell Research, 2004, 17(4):326-336.
[7] 杨永升,邓学梅,李宁,等. MC1R是控制鸡黑色素形成的候选主效基因[J]. 生物化学与生物物理进展,2004,31(6):500-505.
[8] 于云柱,何亦多,刘丽,等.黑素皮质素受体1(MC1R)基因的研究进展[J].中国畜牧兽医,2010,37(6):232-233.
[9] 朱庆,周海龙.乌骨鸡黑色素生成的分子机理[J].中国家禽学报,2003,7(1):115-117.
[10] 李新波,蔡发国,邓岳松.浮萍饲用价值研究进展[J]. 饲料研究,2011(10):3-6.
[11] 任维美.浮萍可用作鱼饲料蛋白源[J].饲料与畜牧,2000(2):25-26.
[12] 冯益民.浮萍可促进罗非鱼生长[J].台湾农村,1988,21(2):39.
[13] 王巍,胡红霞,孙向军,等.锦鲤酪氨酸酶基因序列分析及其在不同锦鲤品系不同组织中的表达[J].水产学报,2012,36(11):1658-1666.
[14] 奥斯卡.日粮脂肪对鲤鱼脂蛋白酯酶和脂肪酸合成酶基因表达的影响[D].重庆:西南大学,2012.
[15] Martínez-Morales J R, Rodrigo I, Bovolenta P. Eye development: a view from the retina pigmented epithelium [J]. Bioessays, 2004, 26(7):766-777.
[16] Zou J, Beermann F, Wang J, et al. The Fugu tyrp1 promoter directs specific GFP expression in zebrafish: tools to study the RPE and the neural crest-derived melanophores[J]. Pigment Cell Research, 2006, 19(6):615-627.
[17] 李康乐.瓯江彩鲤体色相关基因Sox10、Agouti、Tyrp1、Dct的分子克隆与表达分析[D].上海:上海海洋大学,2014.
[18] Chiu C. Molecular cloning of tyrosinase gene of goldfish and its impacts on the pigmentation of two ornamental fish (CarassiusaruatusandDaniorerio) [D].Taipei: Taiwan Ocean University,2003:98.
[19] Parra E J. Human pigmentation variation: evolution, genetic basis, and implications for public health[J]. American Journal of Physical Anthropology, 2007, 134(45):85-105.
[20] Colihueque N. Genetics of salmonid skin pigmentation: clues and prospects for improving the external appearance of farmed salmonids[J]. Reviews in Fish Biology and Fisheries, 2010, 20(1):71-86.
[21] Leclercq E, Taylor J F, Migaud H. Morphological skin colour changes in teleosts[J]. Fish and Fisheries, 2010,11(2):159-193.
[22] Sulzer D, Bogulavsky J, Larsen K E, et al. Neuromelanin biosynthesis is driven by excess cytosolic catecholamines not accumulated by synaptic vesicles [J]. Proceedings of the National Academy of Sciences, 2000, 97(22):11869-11874.
[23] Thorsen J, Høyheim B, Koppang E O. Isolation of the Atlantic salmon tyrosinase gene family reveals heterogenous transcripts in a leukocyte cell line[J]. Pigment Cell Research, 2006, 19(4):327-336.
[24] 张立恒.日粮酪氨酸、苯丙氨酸水平对丝毛乌骨鸡生产性能和黑色素相关基因表达的影响[D].郑州:河南农业大学,2010.
[25] 马兰青,柳春梅,于寒松,等.红景天甙生物合成途径:酪醇合成的起始反应及其糖基化[J].生物工程学报,2012,28(3):282-294.
[26] 张迪敏,李永伟,尉晓冬,等.女贞子对培养的黑素细胞酪氨酸酶活性和黑素合成的影响[J].中华皮肤科杂志,2006,39(4):197-199.
[27] 舒文,杨舒黎,邓卫东,等.乌骨绵羊MC1R基因多态性研究[J].畜牧与兽医,2006,38(4):5-7.
[28] 胡建尊,李康乐,项松平,等.瓯江彩鲤体色调控相关因子MC1R的克隆与表达分析[J].上海海洋大学学报,2013,22(4):518-523.
EffectsofDietaryDuckweedLevelsonExpressionofTyrosinaseGeneandMelaninCortisolReceptorsGeneinKoiTajsho-sanke
ZHANG Zhiyuan, WEI Dong, QIAO Xiuting, BAI Dongqing, FAN Ze, LI Jinghui, AN Maolin
( Department of Fishery Science, Tianjin Agricultural University, Tianjin 300384, China )
The present study was conducted to investigate the effect of dietary duckweed levels on the expression of tyrosinase (TYR) gene and melanin cortisol receptors gene (MC1R) in koi Tajsho-sanke (Cyprinuscarpio). Six isonitrogenous diets (38.6%) formulated ocontained 0%,3%,6%,9%,13%,and 14% duckweed replacing rapeseed meal[referred to as Diet 1(0/13), Diet 2(3/10), Diet 3(6/7), Diet 4(9/4), Diet 5(13/1)and Diet 6(14/0)]. A total of 180 fish with body weight of (42.19±1.32) g were randomly divided into five groups with three replicates and fed twice a day (09:00 and 15:30) for 8 weeks. The results showed that TYR mRNA was detected in heart, hepatopancreas, eye, black skin and brain tissue of Tajsho-sanke, with higher TYR expression in the brain, black skin and eye. With the increase in duckweed level, the expression quantity of tyrgene showed some fluctuation. There were significantly higher expression of tyrgene in eye and black skin in Diet 6(14/0) than in the other groups (P<0.05), while the expression quantities were significantly higher in brain in Diet 3(6/7)compared with other groups (P<0.05). The expression quantities of MC1R in eye and black skin of the fish in Diet 6(14/0) were significantly higher than those in other goups (P<0.05). There was no significant difference in MC1R expression in brain among all groups (P>0.05). The findings indicate that 14% duckweed level can promote TYR and MC1R expression and improve melanin deposition.
duckweed; koi Tajsho-sanke; TYR gene; MC1R gene; melanin pigment
10.16378/j.cnki.1003-1111.2017.02.009
2016-04-28;
2016-06-29.
天津市科技重大专项与工程计划项目(15ZXBFNC00340).
张植元(1992-),男,硕士研究生;研究方向:水产动物营养与饲料.E-mail:382402187@qq.com.通讯作者: 魏东(1970-),男,副教授,硕士生导师;研究方向:观赏鱼养殖.E-mail:wd0528@126.com.
S965.116
A
1003-1111(2017)02-0172-06

