猪肺炎支原体与猪鼻支原体分离鉴定及鉴别检测
李海利,邓祖丽颖,徐引弟,王治方,张青娴,朱文豪,方剑玉,游 一,侯自花,郎利敏,王克领
(1.河南省农业科学院 畜牧兽医研究所,河南 郑州 450002;2.郑州幼儿师范高等专科学校,河南 郑州 450000)
猪肺炎支原体与猪鼻支原体分离鉴定及鉴别检测
李海利1,邓祖丽颖2,徐引弟1,王治方1,张青娴1,朱文豪1,方剑玉1,游 一1,侯自花1,郎利敏1,王克领1
(1.河南省农业科学院 畜牧兽医研究所,河南 郑州 450002;2.郑州幼儿师范高等专科学校,河南 郑州 450000)
为建立猪肺炎支原体与猪鼻支原体的鉴别诊断方法,对从河南省及周边地区猪场采集的患呼吸道疾病的猪只样品进行支原体的分离培养,针对猪肺炎支原体与猪鼻支原体设计了2对引物,扩增片段大小分别为480 bp和360 bp,对所分离纯化的病原微生物进行了菌落形态观察及分子鉴定。结果显示,分离的病原微生物为支原体,菌落呈典型的“煎蛋样”特征;通过单一PCR扩增反应,分别得到了猪肺炎支原体与猪鼻支原体相应的目的扩增片段。表明分离到了猪肺炎支原体与猪鼻支原体。在单一扩增的基础上,建立了猪肺炎支原体与猪鼻支原体二重PCR反应方法,可同时得到2条目的条带,与单一PCR扩增结果一致。表明建立的二重PCR方法可用于猪肺炎支原体与猪鼻支原体的同时检测和鉴别诊断。
猪肺炎支原体; 猪鼻支原体; 鉴别诊断; 二重PCR
猪支原体肺炎(MPS)又称猪地方流行性肺炎,俗称猪气喘病,是由猪肺炎支原体引起的猪的一种慢性呼吸道传染病[1-3]。其主要临床症状为咳嗽和气喘,病理变化特征是肺的尖叶、心叶、中间叶和隔叶前缘呈肉样或虾肉样实变[4-5]。该病广泛分布于世界各地,主要特点是高接触性、高传染性、高发病率和低死亡率[6],可导致日增质量减少、长期生长不良、饲料报酬率大幅下降[7-8]。该病常与其他呼吸道病原如多杀性巴氏杆菌、副猪嗜血杆菌或胸膜肺炎放线杆菌等协同感染引起猪地方性肺炎,常与猪繁殖与呼吸综合征病毒、猪流感病毒和猪圆环病毒协同感染引起猪呼吸道综合征[9]。猪鼻支原体(Mhn)通常存在于猪鼻腔和扁桃体中,一般条件下并不致病。但猪鼻支原体感染肺脏时可引起肺炎,还可导致多发性浆膜炎和关节炎[10-11]。
猪肺炎支原体和猪鼻支原体发病率较高,一般在50%~80%,个别新建猪场或感染猪场发病率可达100%,死亡率高达14%~37%[12-13]。流行后期或老疫区则以哺乳仔猪和断奶仔猪多发,死亡率较高[14-15],母猪和成年猪多呈慢性和隐性感染[16-18]。病猪与健康猪群混合饲养,常引起猪支原体肺炎的暴发。消除患病动物和彻底消毒,切断传播途径,加强检疫和监测,对防治猪支原体肺炎和猪鼻支原体具有重要意义[19]。
支原体可持续存在,并且可导致其他疫苗免疫失败[20-23]。猪支原体病流行于世界各地,在畜牧业发达的美国、澳大利亚等国也普遍存在,造成了巨大的经济损失[24-27]。防控猪支原体肺炎需掌握支原体的流行特征,猪肺炎支原体与猪鼻支原体的临床症状相似,且在形态上难以区分,因而对猪肺炎支原体抗体的检测与猪鼻支原体的鉴别诊断显得尤为重要。鉴于此,建立猪肺炎支原体与猪鼻支原体的鉴别检测方法,旨在为控制猪支原体肺炎奠定基础。
1 材料和方法
1.1 材料
1.1.1 供试病料 从河南省及周边地区猪场采集的患呼吸道疾病样品由河南省农业科学院畜牧兽医研究所兽医室保存。
1.1.2 主要试剂 葡萄糖、PPLO肉汤粉、酵母粉、琼脂粉、马血清、精氨酸、青霉素等购自北京路桥生物技术有限公司;EDTA、聚乙二醇辛基苯基醚、异硫氰酸酯、氯化钠购自Sigma公司。dNTP Mixture(2.5 mmol/L)、DNA Marker、ExTaq(5 U/μL)、MgCl2(25 mmol/L)、10×PCR Buffer (Mg2+free)、RNase Free dH2O等均购自TaKaRa公司;琼脂糖购于Biowest公司;EB染料替代染液购自上海莱枫生物科技有限公司。
1.2 试验方法
1.2.1 病原微生物分离 取具有典型症状的支原体病例肺脏组织,表面无菌消毒,取肺脏组织样本5 g涂于固体培养基表面,放置于37 ℃、含5%的CO2细胞培养箱中培养,同时将小块无菌肺脏组织样本投入到50 mL PPLO液体培养基中。3~5 d后,用光学显微镜低倍观察菌落形态。取待检病原微生物纯培养物进行姬姆萨氏染色,于显微镜油镜下观察病原微生物形态。
将采集的鼻咽拭子浸入装有灭菌生理盐水的管中,于24 h内送入实验室,用0.50 μm滤膜过滤生理盐水除杂菌,涂于PPLO固体培养基表面或PPLO液体培养基中,放置于37 ℃、含5%的CO2细胞培养箱培养。3~5 d后,用光学显微镜低倍观察菌落形态。取待检病原微生物纯培养物进行姬姆萨氏染色,于显微镜油镜下观察病原微生物形态。
1.2.2 引物设计 引物用Array Designer 2.0 软件根据猪肺炎支原体(GenBank No.AF004388)和猪鼻支原体(GenBank No.NC014448.1)序列设计,由上海英骏生物技术有限公司合成。引物序列为MphF:5′-GAGCCTTCAAGCTTCACCAAGA-3′,MphR:5′-GTGGACTACCAGGGTATCT-3′;MhnF:5′-TGAAG-CTGTGAAGCTCCTTTC-3′,MhnR:5′-TGTTGAACG-GGATGTAGCAA-3′。预期扩增片段大小分别为480 bp和360 bp。
1.2.3 分离病原微生物基因组模板的提取 采用柱式DNA提取方法提取基因组。具体操作如下:(1)取适量菌体加入500 μL裂解液(40 mmol/L EDTA,2%聚乙二醇辛基苯基醚,2 mol/L异硫氰酸酯,0.7 mol/L氯化钠),70 ℃水浴2 min,12 000 r/min离心30 s;(2)上清液转入新的离心管中,加500 μL无水乙醇,转到DNA纯化柱上,12 000 r/min离心30 s,倒掉收集管中的废液;(3)用500 μL冲洗液1(10 mmol/L EDTA,70%乙醇,pH值7.0)冲洗,12 000 r/min离心30 s,倒掉收集管中的废液;(4)用600 μL冲洗液2(75 mmol/L Tris-HCl,80%乙醇,pH值7.0)冲洗,12 000 r/min离心30 s,倒掉收集管中的废液,重复1次;(5)将柱子转到新的离心管上,加50 μL焦碳酸二乙酯水,12 000 r/min离心30 s,即可得到高纯度的DNA,于-20 ℃保存备用。
1.2.4 分离病原微生物PCR扩增 扩增体系为25.0 μL:10×PCR Buffer(Mg2+free) 2.5 μL,MgCl2(25 mmol/L) 2 μL,Taq酶(5 U/μL) 0.5 μL,dNTP Mixture (2.5 mmol/L) 2 μL,DNA模板2 μL,正、反引物(10 μmol/L)各1 μL,RNase Free dH2O补充至25 μL。PCR扩增程序为:95 ℃预变性5 min;94 ℃变性1 min,57 ℃退火1 min,72 ℃延伸1 min,进行35个循环;72 ℃再延伸5 min。反应结束后用1%的琼脂糖凝胶进行电泳。取PCR产物5 μL进行点样,120 V电压下电泳30 min。
1.2.5 分离病原微生物二重PCR反应 扩增体系为25.0 μL:10×PCR Buffer(Mg2+free) 2.5 μL,MgCl2(25 mmol/L) 2 μL,Taq酶(5 U/μL) 0.5 μL,dNTP Mixture (2.5 mmol/L) 2 μL,DNA 2 μL,猪肺炎支原体和猪鼻支原体正、反引物(10 μmol/L)各1 μL,RNase Free dH2O补充至25 μL。PCR扩增程序为:95 ℃预变性2 min;94 ℃变性1 min,59 ℃退火1 min,72 ℃延伸1 min,进行32个循环后,72 ℃再延伸2 min。反应结束后进行1%的琼脂糖凝胶电泳。
1.2.6 检测方法的应用 用建立的二重PCR检测方法对从河南省及周边地区猪场采集的患呼吸道疾病的16份病料进行检测。
2 结果与分析
2.1 分离病原微生物形态学观察及镜检
分离病原微生物在含0.4%酚红PPLO的液体培养基中,培养基由红变黄,呈轻微浑浊,在固体培养基培养5~7 d,观察可见圆形隆起、边缘整齐、表面粗糙、中央有颗粒的针尖大小或露珠状小菌落。菌落呈支原体的“煎蛋样”典型特征(图1)。取待检病原微生物纯培养物进行姬姆萨氏染色25 min,于显微镜下观察分离病原微生物形态,形态不一,大多呈丝状(图2)。
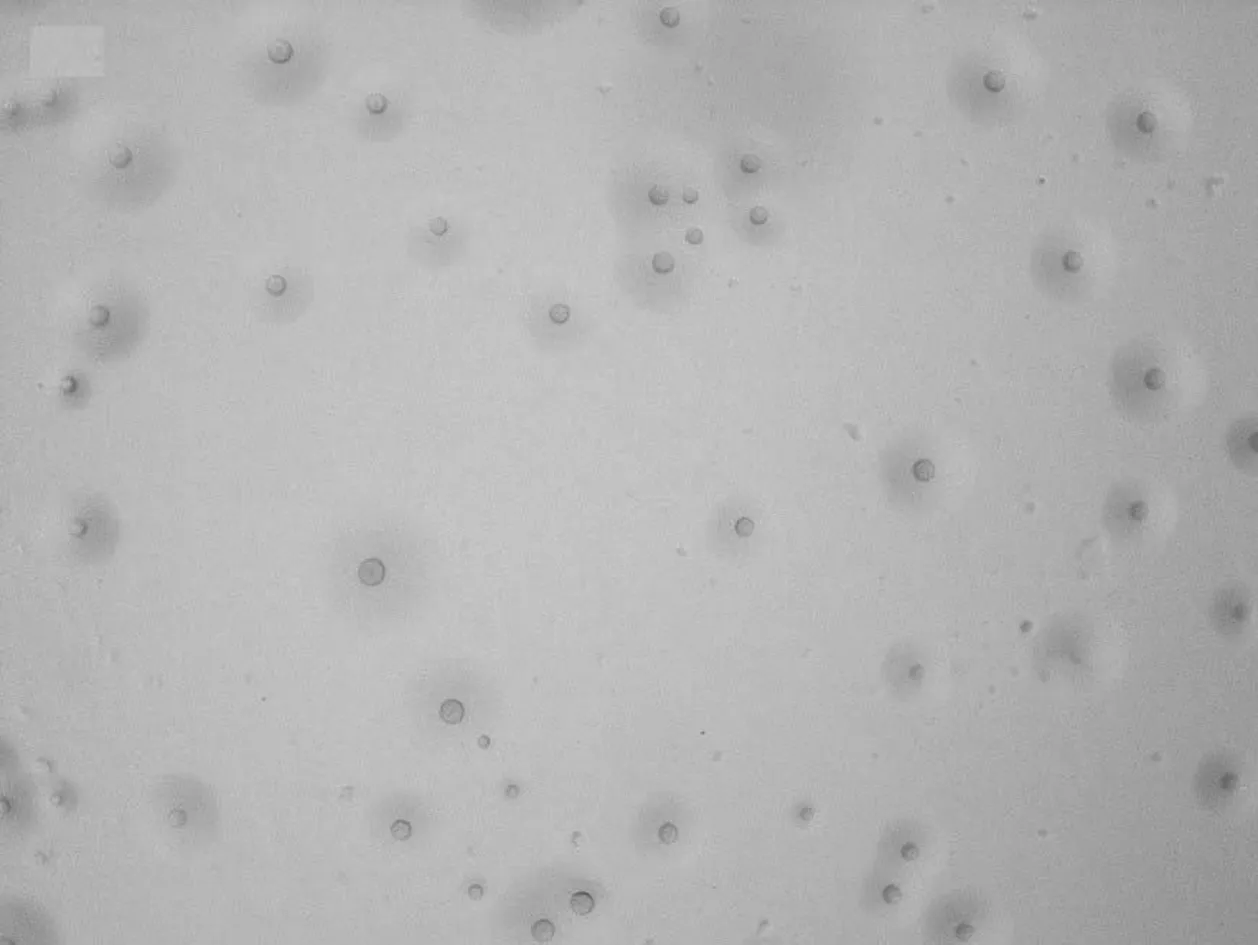
图1 分离病原微生物菌落形态

图2 分离病原微生物在显微镜下的形态
2.2 分离病原微生物PCR扩增结果
从图3可以看出,扩增产物电泳后,在480 bp和360 bp处均可见特异性扩增条带(图3),与预期结果一致。PCR产物经过纯化和测序,所得序列与数据库中猪肺炎支原体和猪鼻支原体同源性达99%。
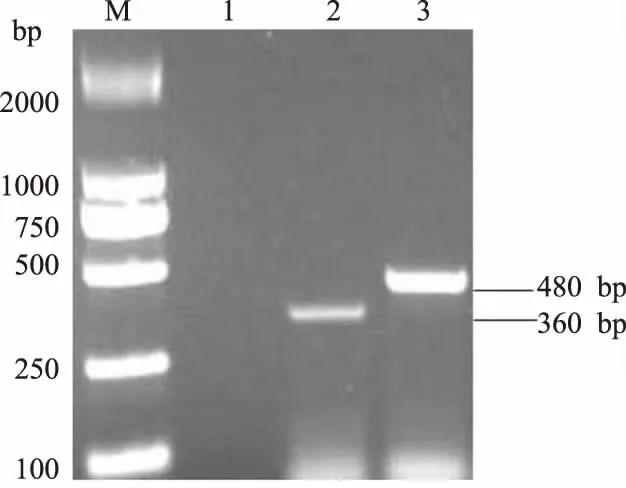
M.Marker 2000;1.空白对照;2.猪鼻支原体;3.猪肺炎支原体
2.3 猪肺炎支原体与猪鼻支原体二重PCR扩增结果
按照上述单重PCR扩增进行二重PCR,结果显示,扩增产物在480 bp和360 bp处均可见特异性扩增条带(图4),与猪肺炎支原体和猪鼻支原体预期结果一致。

M.Marker 2000;1.猪肺炎支原体;2.猪鼻支原体;3.猪肺炎支原体与猪鼻支原体二重扩增
2.4 建立检测方法的应用结果
应用上述研究所建立的方法对临床16份病料进行检测,有5份病料检测为猪肺炎支原体,5份病料检测为猪鼻支原体,6份病料检测为阴性(图5),阳性检出率为62.5%。
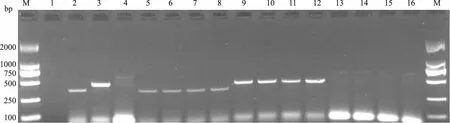
M.Marker 2000;3、9、10、11、12为猪肺炎支原体;2、5、6、7、8为猪鼻支原体;1、4、13、14、15、16为阴性
3 结论
本研究对河南省及周边地区的猪场患呼吸道疾病的样品进行支原体的分离,通过菌落观察、形态学观察及分子诊断鉴定,表明分离纯化的病原微生物为猪肺炎支原体与猪鼻支原体。在光学显微镜下低倍观察支原体菌落形态,菌落呈“煎蛋样”典型特征。针对猪肺炎支原体与猪鼻支原体设计了2对引物,扩增片段大小分别为480 bp和360 bp,通过单一PCR扩增反应,分别得到了猪肺炎支原体与猪鼻支原体相应的目的扩增片段。在单一扩增的基础上,建立了猪肺炎支原体与猪鼻支原体二重PCR反应方法,可同时得到2条目的条带,与单一PCR扩增结果一致。本研究结果表明,建立的二重PCR方法可用于猪肺炎支原体与猪鼻支原体的同时检测和鉴别诊断,且简便快捷,灵敏度高,特异性强。
[1] Lauritsen K T,Hagedorn-Olsen T,Jungersen G,etal.Transfer of maternal immunity to piglets is involved in early protection againstMycoplasmahyosynoviaeinfection[J].Vet Immunol Immunop,2017,183:22-30.
[2] Ishag H Z A,Xiong Q Y,Liu M J,etal.E.colirecAgene improves gene targeted homologous recombination inMycoplasmahyorhinis[J].J Microbiol Meth,2017,136:49-56.
[3] Lee J A,Oh Y R,Hwang M A,etal.Mycoplasmahyorhinisis a potential pathogen of porcine respiratory disease complex that aggravates pneumonia caused by porcine reproductive and respiratory syndrome virus[J].Vet Immunol Immunop,2016,177:48-51.
[4] Ishag H Z A,Liu M J,Yang R S,etal.GFP as a marker for transient gene transfer and expression inMycoplasmahyorhinis[J].Springerplus,2016,5:1-4.
[5] Gomes-Neto J C,Raymond M,Bower L,etal.Two clinical isolates ofMycoplasmahyosynoviaeshowed differing pattern of lameness and pathogen detection in experimentally challenged pigs[J].J Vet Sci,2016,17(4):489-496.
[6] Chen D,Wei Y,Huang L,etal.Synergistic pathogenicity in sequential coinfection withMycoplasmahyorhinisand porcine circovirus type 2[J].Vet Microbiol,2016,182:123-130.
[7] Chen D J,Wei Y W,Huang L P,etal.Characterization and application of monoclonal antibodies againstMycoplasmahyorhinispyruvate dehydrogenase E1 complex subunit alpha[J].Appl Microbiol Biot,2016,100(8):3587-3597.
[8] Dahlia H,Tan L J,Zarrahimah Z,etal.Isolation ofMycoplasmahyosynoviaefrom pneumonic lung of swine[J].Trop Biomed,2009,26(3):341-345.
[9] Lauritsen K T,Hagedorn-Olsen T,Friis N F,etal.Absence of strictly age-related resistance toMycoplasmahyosynoviaeinfection in 6-week-old pigs[J].Vet Microbiol,2008,130(3/4):385-390.
[10] Nielsen E O,Lauritsen K T,Friis N F,etal.Use of a novel serum ELISA method and the tonsil-carrier state for evaluation ofMycoplasmahyosynoviaedistributions in pig herds with or without clinical arthritis[J].Veterinary Microbiology,2005,111(1/2):41-50.
[11] Kokotovic B,Friis N F,Nielsen E O,etal.Genomic diversity among Danish field strains ofMycoplasmahyosynoviaeassessed by amplified fragment length polymorphism analysis[J].Veterinary Microbiology,2002,85(3):221-231.
[12] Xiong Q Y,Zhang B X,Wang J,etal.Characterization of the role in adherence ofMycoplasmahyorhinisvariable lipoproteins containing different repeat unit copy numbers[J].Veterinary Microbiology,2016,197:39-46.
[13] Xiong Q Y,Wang J,Ji Y,etal.The functions of the variable lipoprotein family ofMycoplasmahyorhinisin adherence to host cells[J].Veterinary Microbiology,2016,186:82-89.
[14] Unterweger C,Wochtl B,Spergser J,etal.Influenza outbreak in weaners with involvement ofMycoplasmahyorhinisandHaemophilusparasuis[J].Tieraerztl Prax G N,2016,44(4):259-265.
[15] Voorde J V,Vervaeke P,Liekens S,etal.Mycoplasmahyorhinis-encoded cytidine deaminase efficiently inactivates cytosine-based anticancer drugs[J].Febs Open Bio,2015,5:634-639.
[16] Palzer A,Kolb K,Strutzberg-Minder K,etal.Serological course investigations ofHaemophilusparasuisandMycoplasmahyorhinisin three pig farms[J].Schweiz Arch Tierheilkd,2015,157(2):97-103.
[17] Palzer A,Haedke K,Heinritzi K,etal.Associations amongHaemophilusparasuis,Mycoplasmahyorhinis,and porcine reproductive and respiratory syndrome virus infections in pigs with polyserositis[J].Can Vet J,2015,56(3):285-287.
[18] Kornspan J D,Tsur M,Tarshis M,etal.Mycoplasmahyorhinisinduces proinflammatory responses in mice lymphocytes[J].J Basic Microb,2015,55(5):679-684.
[19] Neto J C G,Bower L,Erickson B Z,etal.Quantitative real-time polymerase chain reaction for detectingMycoplasmahyosynoviaeandMycoplasmahyorhinisin pen-based oral,tonsillar,and nasal fluids[J].Journal of Veterinary Science,2015,16(2):195-201.
[20] Kokotovic B,Friis N F,Ahrens P.Characterization ofMycoplasmahyosynoviaestrains by amplified fragment length polymorphism analysis,pulsed-field gel electrophoresis and 16S ribosomal DNA sequencing[J].J Vet Med B,2002,49(5):245-252.
[21] Nielsen E O,Nielsen N C,Friis N F.Mycoplasmahyosynoviaearthritis in grower-finisher pigs[J].J Vet Med A,2001,48(8):475-486.
[22] Boye M,Jensen T K,Ahrens P,etal.In situ hybridisation for identification and differentiation ofMycoplasmahyopneumoniae,MycoplasmahyosynoviaeandMycoplasmahyorhinisin formalin-fixed porcine tissue sections[J].Apmis,2001,109(10):656-664.
[23] Neto J C G,Strait E L,Raymond M,etal.Antibody responses of swine following infection withMycoplasmahyopneumoniae,M.hyorhinis,M.hyosynoviaeandM.flocculare[J].Veterinary Microbiology,2014,174(1/2):163-171.
[24] Schultz K K,Strait E L,Erickson B Z,etal.Optimization of an antibiotic sensitivity assay forMycoplasmahyosynoviaeand susceptibility profiles of field isolates from 1997 to 2011[J].Veterinary Microbiology,2012,158(1/2):104-108.
[25] Makhanon M,Tummaruk P,Thongkamkoon P,etal.Comparison of detection procedures ofMycoplasmahyopneumoniae,Mycoplasmahyosynoviae,andMycoplasmahyorhinisin lungs,tonsils,and synovial fluid of slaughtered pigs and their distributions in Thailand[J].Trop Anim Health Pro,2012,44(2):313-318.
[26] 彭凌,刘博婷,杨旭夫.猪鼻支原体套式PCR诊断方法的建立及应用[J].河南农业科学,2017,46(4):121-123.
[27] 李颖平.间接免疫荧光抗体技术检测猪肺炎支原体[J].山西农业科学,2016,44(11):1702-1703,1707.
Identification and Differential Diagnosis of Mycoplasma hyosynoviae and Mycoplasma hyorhinis
LI Haili1,DENGZU Liying2,XU Yindi1,WANG Zhifang1,ZHANG Qingxian1,ZHU Wenhao1,FANG Jianyu1,YOU Yi1,HOU Zihua1,LANG Limin1,WANG Keling1
(1.Animal Husbandry and Veterinary Research Institute,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China;2.Zhengzhou Infant Normal School,Zhengzhou 450000,China)
In order to develop differential diagnosis method ofMycoplasmahyosynoviaeandMycoplasmahyorhinis,Mycoplasmawas isolated and identified from Henan province and surrounding areas.Two pairs of primers were designed to amplifyMycoplasmahyosynoviaeandMycoplasmahyorhinisDNA and the fragment sizes were 480 bp and 360 bp respectively.The results showed that the colony was a typical “fried egg” characteristic.The single amplified PCR showed that the isolated microbes wereMycoplasmahyosynoviaeandMycoplasmahyorhinis.On the basis of single amplification,the double PCR reaction was established for detectingMycoplasmahyosynoviaeandMycoplasmahyorhinis.The double PCR method could be used for detection and differential diagnosis ofMycoplasmahyosynoviaeandMycoplasmahyorhinis.
Mycoplasmahyosynoviae;Mycoplasmahyorhinis; differential diagnosis; double PCR
S855
A
1004-3268(2017)11-0148-04
2017-06-16
河南省农业科学院自主创新基金项目(2016ZC49)
李海利(1982-),男,河南开封人,助理研究员,博士,主要从事动物传染病临床诊断及防控研究工作。
E-mail:haili8693@sina.com

