制备anti-EGFR-PEG-SPIO靶向纳米分子探针对肺腺癌细胞行体外靶向MR成像
王中领,唐 纳,王 悍,解学乾,张在先,张贵祥
(上海交通大学附属第一人民医院放射科,上海 200080)
制备anti-EGFR-PEG-SPIO靶向纳米分子探针对肺腺癌细胞行体外靶向MR成像
王中领,唐 纳,王 悍,解学乾,张在先,张贵祥*
(上海交通大学附属第一人民医院放射科,上海 200080)
目的探讨anti-EGFR-PEG-SPIO纳米分子探针对表皮生长因子受体(EGFR)高表达肺腺癌细胞的靶向性及利用MRI对其监测的可行性。方法制备anti-EGFR靶向纳米分子探针(anti-EGFR-PEG-SPIO)及非靶向纳米分子探针(PEG-SPIO),行电镜(TEM)观察,并测量水合粒径及弛豫率等表征。之后将不同Fe浓度(0、10、20、40、60、80 μg/ml)的anti-EGFR-PEG-SPIO和PEG-SPIO分别与H460细胞孵育2 h后,进行体外MR成像,观察其T2WI信号强度及信号强度变化率。行H460细胞普鲁士蓝染色和电镜观察细胞摄取Fe情况。结果不同Fe浓度anti-EGFR-PEG-SPIO及PEG-SPIO探针分别与H460细胞孵育2 h后,前者显示H460细胞的信号强度随Fe浓度的升高而明显减低,Fe浓度为60 μg/ml时,相对于0、10、20、40、80 μg /ml,信号强度变化率约为-58.2%、-82.7%、-94.4%和-98.3%;而后者显示H460细胞信号强度减低相对不明显。普鲁士蓝染色及TEM结果显示anti-EGFR-PEG-SPIO的H460细胞内可见大量铁颗粒沉积,而PEG-SPIO的肿瘤细胞内仅可见少量铁颗粒沉积。结论自行制备的anti-EGFR-PEG-SPIO分子探针对H460肺腺癌细胞具有靶向效应,采用3.0T MR扫描仪可对其进行监测。
靶向成像;肺;腺癌;分子探针;超顺磁性氧化铁
MR分子成像可从细胞、分子水平对肿瘤进行靶向显像及诊断[1-3],是一种特异性高、无创的新型诊断方法。表皮生长因子受体(epidermal growth factor receptor, EGFR)在细胞的增值、生长及分化等生理过程中发挥重要的调节作用,具有较高的组织特异性,在肺腺癌中呈高表达。超顺磁性氧化铁(superparamagnetic iron oxide-dopamine, SPIO)作为非病毒载体具有低毒性以及超顺磁性,在MR分子成像中得到广泛的应用。本研究制备anti-EGFR单克隆抗体靶向多功能纳米分子探针,评价其对肺腺癌细胞的靶向性以及利用MR监测的可行性。
1 材料与方法
1.1 主要试剂 靶向anti-EGFR-PEG-SPIO及非靶向PEG-SPIO纳米探针(中国科学院化学研究所提供),RPMI 1640培养基(Gibco BRL,Gaithersburg),FBS(胎牛血清;Gibco BRL,Gaithersburg),青霉素-链霉素溶液(杭州吉诺生物技术有限公司),胰蛋白酶(1∶250;Gibco BRL,Gaithersburg)。人非小细胞型肺癌细胞(H460;购于上海生命科学院细胞库)。
1.2 主要设备 细胞CO2培养箱Heraeus BB15(美国Thermo Scientific公司),GE Signa HDx 3.0T MR扫描仪,光学显微镜Leica DFC295(德国Leica公司),投射电子显微镜2010F(日本JEOL公司)。
1.3 方法
1.3.1 anti-EGFR-PEG-SPIO的合成 参照文献[4]合成PEG-SPIO;将PEG-SPIO(Fe 2 mg,3.5 mg/ml)加入2 ml的EP管内,将1 ml 1-乙基-3-(3-二甲氨基丙基)碳化二亚胺(EDC)和N-羟基钠盐(sulfo-NHS,2.8 mg)溶解于PBS缓冲液,并迅速转移至PEG-SPIO中,室温下反应15 min;采用PD-10交换柱对活化后的PEG-SPIO进行碳酸氢钠/碳酸钠缓冲液(NaHCO3/Na2CO3;pH=8.5)交换,洗脱液采用NaHCO3(0.1 M),然后加入1 mg的西妥昔单抗在室温下进行耦联反应,4 h后采用PBS缓冲液进行透析过夜。耦联完毕后,将耦联物置于4℃储存。
1.3.2 anti-EGFR-PEG-SPIO与PEG-SPIO表征测量 采用透射电镜(transmission electron microscope, TEM)测量SPIO的粒径,纳米粒度仪测试耦联anti-EGFR前后的靶向与非靶向分子探针的水合粒径及MRI T2值,并计算弛豫率(R2;单位:s-1·mM-1):R2=1/T2。
1.3.3 细胞培养 将H460接种于含10%胎牛血清的RPMI 1640培养基,在培养箱中培养(37 ℃、5% CO2),待贴壁的H460细胞密度生长至90%时,去除原培养液,加入胰蛋白酶消化,每4天传一代。并采用光学显微镜对培养中的细胞进行动态观察。待细胞生长总数达1×107个时停止传代,备用。
1.3.4 细胞毒性实验(MTT比色法) 将密度为3×105的H460细胞种植于96孔板,于37 ℃、5% CO2恒温箱中孵育24 h,之后将不同Fe浓度的(10、20、40、60、80 μg/ml)anti-EGFR-PEG-SPIO和PEG-SPIO探针与H460细胞孵育24 h。然后在96孔板中每孔加入MTT溶液20 μl(5 mg/ml),至培养箱中继续孵育4 h,弃去培养液并加入DMSO约200 μl,20 min后采用酶标仪在490 nm处测量各孔细胞吸光度,采用PBS溶液作为对照,每孔吸光度测量4次。
1.3.5 anti-EGFR-PEG-SPIO和PEG-SPIO探针细胞摄取实验 普鲁士蓝染色:按照文献[1]方法将与H460细胞的靶向和非靶向分子探针进行普鲁士蓝染色。将1×106个H460细胞分别与Fe浓度为40 μg /ml的anti-EGFR-PEG-SPIO和PEG-SPIO探针在RPMI 1460培养液中孵育2 h(置于37 ℃、5% CO2培养箱),PBS溶液冲洗3次,4%戊二酮固定20 min,蒸馏水洗3次,核固红复染3 min,蒸馏水洗涤3次,然后于倒置显微镜下观察Fe染色结果。
细胞摄取的TEM观察:将含量1×105的H460细胞接种于培养板,待细胞倍增至90%时,加入Fe浓度为60 μg/ml 的anti-EGFR-PEG-SPIO和PEG-SPIO对比剂,孵育6 h,去除培养液后PBS溶液冲洗3次。然后采用2.5%戊二醛磷酸盐固定12 h(4℃),采用1%四氧化锇溶液于4℃固定3 h,后经乙醇梯度脱水约25 min后采用Epon 812进行包埋、修块及切片。采用醋酸铀和柠檬酸铅室温下染色各3 min,水洗、风干,电镜下观察并拍照。
1.3.6 体外MR成像 将H460细胞接种于6孔板中,分别将Fe浓度为0、10、20、40、80 μg /ml的anti-EGFR-PEG-SPIO和PEG-SPIO探针与1×106的H460细胞孵育2 h,PBS溶液冲洗3次,经胰蛋白酶消化后重悬于0.5 ml 1%琼脂糖的EP管。
采用3.0T MR扫描仪、动物小线圈对悬浮细胞进行成像。采用T2WI快速自旋转回波序列:TR 3 000 ms,TE 90.4 ms,层厚1 mm,层间距1 mm,矩阵256×256,FOV 8 cm×8 cm
信号强度分析:分别选择每各样本大小一致、同一横截面的ROI(面积>30 mm2)测量T2WI信号强度,同一样品测量6次,计算平均值及标准差。
1.4 统计学分析 采用SPSS 19.0统计分析软件。符合正态分布的计量资料以±s表示。不同Fe浓度anti-EGFR-PEG-SPIO及PEG-SPIO探针与H460细胞孵育后T2WI信号强度比较采用单因素方差分析,两两比较采用SNK及LSD检验;相同Fe浓度下,anti-EGFR-PEG-SPIO与PEG-SPIO探针的T2WI信号差异采用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 Anti-EGFR靶向与非靶向纳米聚合物的表征 TEM所测SPIO的粒径为9.2 nm,纳米粒子分布均匀,无粘连(图1A、B)。耦联anti-EGFR前后纳米聚合物水合粒径约38.5 nm和45.7 nm(图1C)。MRI所测anti-EGFR-PEG-SPIO和PEG-SPIO的T2值(图1D)分别为10.3 ms和 11.2 ms,R2分别为 97.1 s-1·mM-1和 89.3 s-1·mM-1。
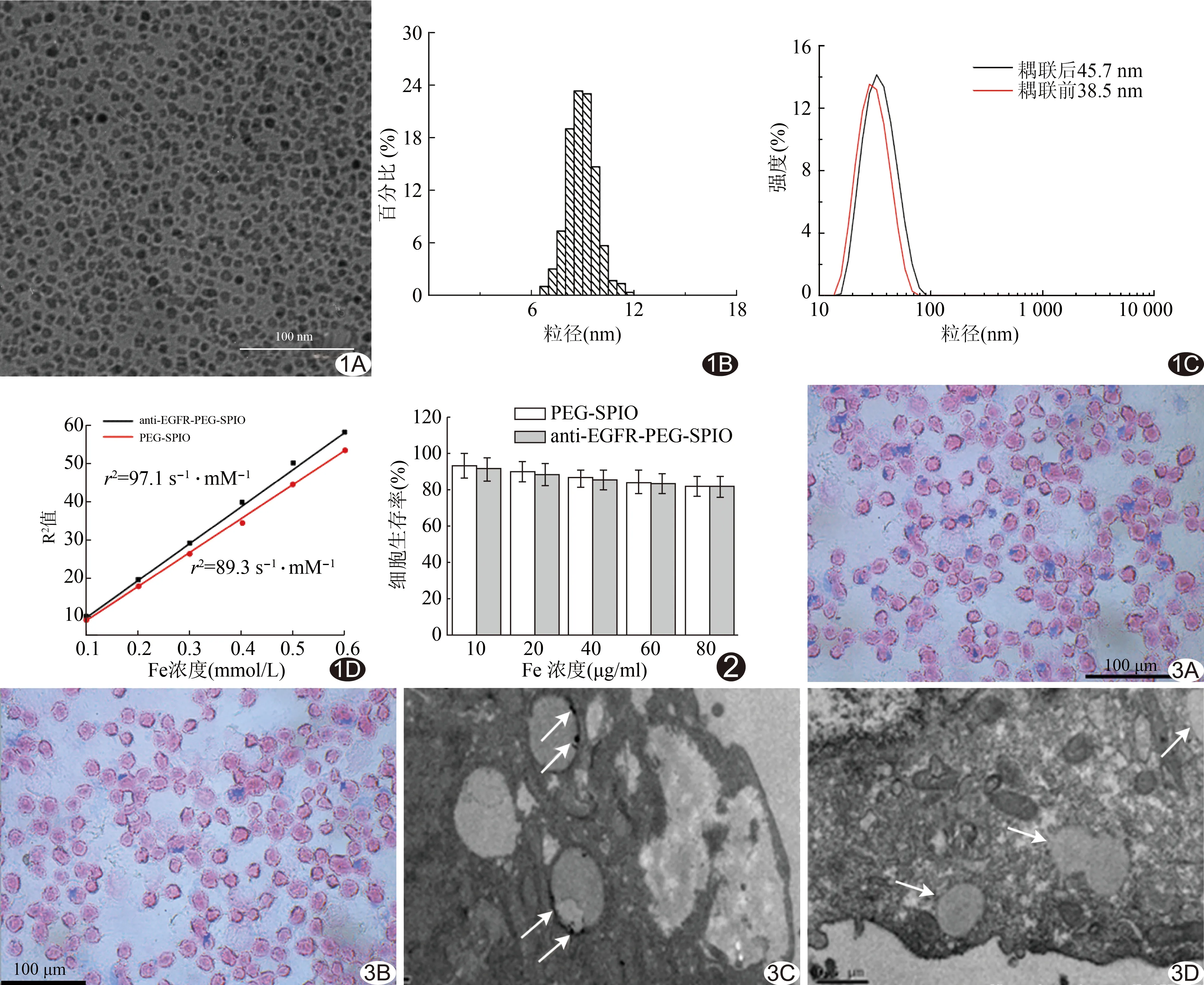
图1 anti-EGFR靶向与非靶向纳米聚合物的表征 A、B.SPIO的电镜图及粒径直径分布图; C.耦联anti-EGFR前后纳米聚合物水合粒径; D.anti-EGFR-PEG-SPIO和PEG-SPIO的R2值 图2 anti-EGFR-PEG-SPIO和PEG-SPIO的MTT 图3 体内H460细胞摄取实验 anti-EGFR-PEG-SPIO(A)和PEG-SPIO(B)的普鲁士蓝染色(×200);anti-EGFR-PEG-SPIO(C)和PEG-SPIO(D)的细胞摄取电镜表现(×20 000) 箭示Fe颗粒染色聚积
2.2 细胞毒性实验 MTT显示当anti-EGFR-PEG-SPIO和PEG-SPIO的Fe浓度为80 μg/ml时,H460细胞生存率均为85%以上(图2)。
2.3 体内H460细胞摄取实验
2.3.1 普鲁士蓝染色 浓度为40 μg /ml的anti-EGFR-PEG-SPIO探针与H460细胞孵育后,大量细胞内可见蓝色铁颗粒沉积(图3A),PEG-SPIO探针与H460细胞孵育后,细胞内仅可见少量铁颗粒沉积(图3B)。
2.3.2 细胞内摄取 anti-EGFR-PEG-SPIO纳米分子探针与H460细胞孵育6 h后,H460细胞内可见大量Fe颗粒染色沉积(图3C),而PEG-SPIO在H460细胞内仅可见少量Fe颗粒染色积聚(图3D)。
2.4 MR体外成像 anti-EGFR-PEG-SPIO和PEG-SPIO探针(Fe浓度为0 10、20、40、60、80 μg/ml)与肺腺癌细胞孵育2 h后,T2WI信号强度差异均有统计学意义(F=2 948.62、1 023.83,P均<0.01),且anti-EGFR-PEG-SPIO的Fe浓度为0、10、20、40、80 μg/ml时与其他各浓度两两比较T2WI信号强度差异均有统计学意义(P均<0.01),见表1。anti-EGFR-PEG-SPIO的T2WI信号强度随Fe浓度的升高而明显降低,Fe浓度为60 μg/ml时,细胞信号强度下降显著,相对于Fe浓度0、10、20、40、80 μg /ml,anti-EGFR-PEG-SPIO信号强度变化率分别为-58.2%、-82.7%、-94.4%和-98.3%;PEG-SPIO的T2WI信号强度减低相对较弱(图4)。Fe浓度为0时,anti-EGFR-PEG-SPIO和PEG-SPIO的T2WI信号差异无统计学意义(t=0.41,P>0.05),Fe浓度为10、20、40、80 μg /ml时,anti-EGFR-PEG-SPIO和PEG-SPIO的T2WI信号差异有统计学意义(t=6.94、10.40、13.98、7.71,P均<0.01)。
表1 不同Fe浓度anti-EGFR-PEG-SPIO及PEG-SPIO分子探针与H460细胞孵育后T2WI信号强度(±s)

表1 不同Fe浓度anti-EGFR-PEG-SPIO及PEG-SPIO分子探针与H460细胞孵育后T2WI信号强度(±s)
Fe浓度(μg/ml)anti-EGFR-PEG-SPIOPEG-SPIO01441.50±43.121424.33±58.6410603.00±26.14831.83±38.1920246.33±29.15526.33±28.604081.17±7.55287.00±34.098025.17±3.19198.33±18.14
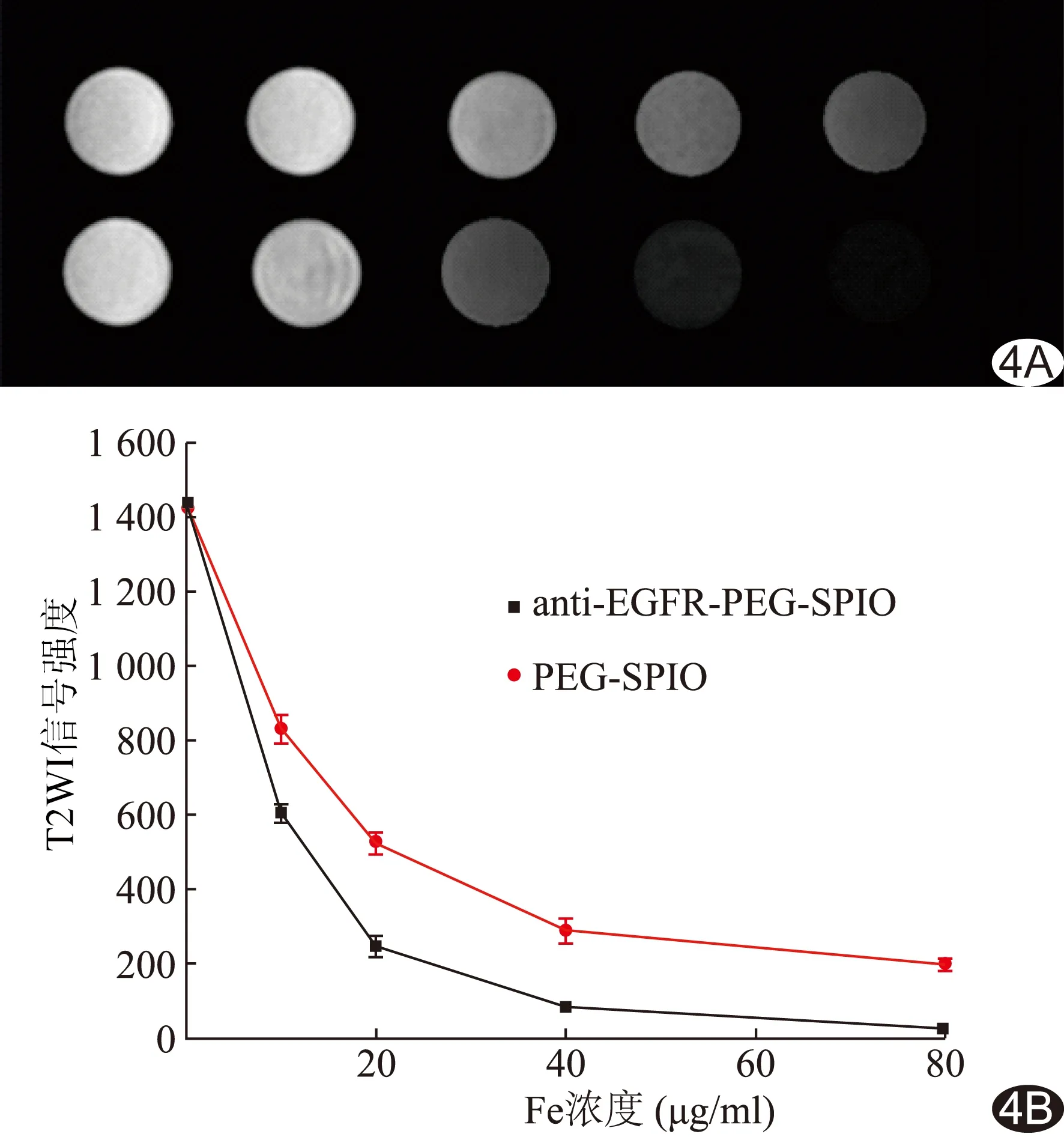
图4 T2WI信号强度 A.anti-EGFR-PEG-SPIO(下排)和PEG-SPIO(上排)的T2WI信号; B.anti-EGFR-PEG-SPIO和PEG-SPIO探针T2WI信号强化趋势图
3 讨论
EGFR在多种上皮性肿瘤中呈高度表达或过表达,如非小细胞型肺癌、乳腺癌、胃癌、宫颈癌及头颈部肿瘤,而在正常表皮细胞常不表达,具有较高的组织特异性。研究[3-5]表明anti-EGFR单克隆抗体与肺腺癌肿瘤细胞有很强的结合能力。SPIO具有良好的水溶性及超顺磁效应,常被用作MRI T2负顺磁效应对比剂、药物传递的载体及肿瘤的热疗[6-8]。利用anti-EGFR单克隆抗体作为载体,可将SPIO携带至肿瘤细胞表面,通过EGFR配体介导细胞内化并将其摄入细胞浆,降低肿瘤T2值,对药物的释放监测及提高肿瘤诊断敏感性具有重要价值,可实现MRI对肿瘤治疗监测的可视化。
本研究采用anti-EGFR抗体修饰PEG包裹的SPIO,构建anti-EGFR-PEG-SPIO靶向MRI分子探针,利用不同Fe浓度的分子探针与H460细胞孵育,根据肿瘤细胞摄取不同Fe含量的对比剂而形成细胞T2信号强度差异,从细胞水平探讨肿瘤的监测可视化以及细胞靶向成像在临床诊疗中的应用。TEM显示磁性纳米粒子具有良好分散性及水溶性,DLS结果表明anti-EGFR修饰后的PEG-SPIO,水合粒径发生变化,表明anti-EGFR单克隆抗体成功耦联到PEG-SPIO纳米粒子表面,通过体外细胞MR成像及细胞摄取实验,发现anti-EGFR单克隆抗体修饰的PEG-SPIO纳米探针具有良好的靶向性及活性。本研究以纳米分子探针对H460进行细胞毒性实验,采用不同Fe浓度的靶向与非靶向分子探针与H460肿瘤细胞孵育24 h后,细胞生存率均超过85%以上,提示该纳米分子探针具有低毒性,可作为MRI对比剂应用于体内外研究。
靶向与非靶向分子探针与H460细胞孵育后的MR成像结果显示,随着Fe浓度的增加,anti-EGFR-PEG-SPIO的肿瘤细胞摄取率明显高于PEG-SPIO,差异统计学意义。本研究结果表明,anti-EGFR单克隆抗体修饰的纳米分子探针对H460具有明显靶向效应。本研究在H460细胞靶向摄取实验中,发现在相同Fe浓度下,anti-EGFR-PEG-SPIO的肿瘤细胞内见大量铁颗粒沉积染色,而EG-SPIO仅可见少量铁颗粒染色,进一步证实靶向分子探针H460细胞对靶向纳米分子探针的摄取主要依赖于EGFR。笔者推测肿瘤细胞靶向摄取的机制可能为anti-EGFR单克隆抗体与H460细胞表面EGFR受体特异性结合,将纳米分子探针以内化方式带入细胞内,导致肿瘤细胞MRI信号强度改变。
SPIO具有很好的生物相容性及超顺磁效应,因此在药物传递、MRI的分子探针以及肿瘤热疗中得到广泛的应用[9-12]。在MR成像中,与非聚合的Gd复合物相比,SPIO则呈现更高的敏感度。通常在其表面包覆葡聚糖、PEI及PEG等衍生物,以提高其在体内外的生物相容性及稳定性[13-14]。本研究构建anti-EGFR修饰PEG包覆的SPIO靶向纳米分子探针,具有超声磁性效应及靶向性,符合作为MR分子探针的要求,具有广阔的应用前景。
[1] Zhang Z, Hu Y, Yang J, et al. Facile synthesis of folic acid-modified Iron oxide nanoparticles for targeted MR imaging in pulmonary tumor xenografts. Mol Imaging Biol, 2016,18(4):569-578.
[2] Wang Z, Zhu J, Chen Y, et al. Folic acid modified superparamagnetic Iron oxide nanocomposites for targeted hepatic carcinoma MR imaging. RSC Adv, 2014,4(15):7483-7490.
[3] 宣吉晴,陈瑜莉,敖梦,等.携带cRGD肽的靶向纳米粒超声造影剂的制备以及体外寻靶实验研究.中国医学影像技术,2017,33(6):810-815.
[4] Garousi J, Anderson KG, Mitran B, et al. PET imaging of epidermal growth factor receptor expression in tumours using Zr-89-labelled ZEGFR:2377 affibody molecules. Int J Oncol, 2016,48(4):1325-1332.
[5] Jia Q, Zeng J, Qiao R, et al. Gelification: An effective measure for achieving differently sized biocompatible Fe3O4nanocrystals through a single preparation recipe. J Am Chem Soc, 2011,133(48):19512-19523.
[6] Fu G, Liu W, Li Y, et al. Magnetic prussian blue nanoparticles for targeted photothermal therapy under magnetic resonance imaging guidance. Bioconjug Chem, 2014,25(9):1655-1663.
[7] Yang F, Li Y, Chen Z, et al. Superparamagnetic Iron oxide nanoparticle-embedded encapsulated microbubbles as dual contrast agents of magnetic resonance and ultrasound imaging. Biomaterials, 2009,30(23-24):3882-3890.
[8] Lee JH, Jang JT, Choi JS, et al. Exchange-coupled magnetic nanoparticles for efficient heat induction. Nat Nanotechnol, 2011,6(7):418-422.
[9] Foldager CB, Pedersen M, Ringgaard S, et al. Chondrocyte gene expression is affected by very small Iron oxide particles-labeling in long-term in vitro MRI tracking. J Magn Reson Imaging, 2011,33(3):724-730.
[10] Protti A, Dong X, Andia ME, et al. Assessment of inflammation with a very small iron-oxide particle in a murine model of reperfused myocardial infarction. J Magn Reson Imaging, 2014,39(3):598-608.
[11] Wagner M, Wagner S, Schnorr J, et al. Coronary MR angiography using citrate-coated very small uperparamagnetic Iron oxide particles as blood-pool contrast agent: Initial experience in humans. J Magn Reson Imaging, 2011,34(4):816-823.
[12] Wang Z, Qiao R, Tang N, et al. Active targeting theranostic Iron oxide nanoparticles for MRI and magnetic resonance-guided focused ultrasound ablation of lung cancer. Biomaterials, 2017,127:25-35.
[13] Shuai X, Ai H, Nasongkla N, et al. Micellar carriers based on block copolymers of poly (ε-caprolactone)and poly (ethylene glycol) for doxorubicin delivery. J Control Release, 2004,98(3):415-426.
[14] 王中领,郭亮,李勇刚,等.叶酸靶向超顺磁性氧化铁-多巴胺-叶酸纳米复合物的制备及体外MR成像.中国医学影像技术,2011,27(2):251-255.
Preparationofanti-EGFR-PEG-SPIOmolecularprobeanditstargetingMRIforlungadenocarcinomacells
WANGZhongling,TANGNa,WANGHan,XIEXueqian,ZHANGZaixian,ZHANGGuixiang*
(DepartmentofRadiology,ShanghaiFirstPeople'sHospital,ShanghaiJiaoTongUniversity,Shanghai200080,China)
ObjectiveTo observe the targeting function of high affinity anti-EGFR monoclonal antibody (Cetuximab)-conjugated superparamagnetic iron oxide-dopamine (anti-EGFR-PEG-SPIO) lung cancer cells via epidermal growth factor receptor (EGFR), as well as the feasibility for surveillance of tumor targeting with MRI.MethodsNanoparticles (NPs) of anti-EGFR-PEG-SPIO and PEG-SPIO were prepared, and the morphology of nanoparticles was observed with transmission electron microscope (TEM). The hydrodynamic diameter and R2 values of nanoparticles before and after conjugation with anti-EGFR were performed with dynamic light scattering (DLS) and MRI. MRI was performed in incubation with anti-EGFR-PEG-SPIO and PEG-SPIO after 2 h in vitro. The cellular uptake of anti-EGFR-PEG-SPIO and PEG-SPIO was further evaluated using Prussian blue staining and TEM.ResultsAnti-EGFR-PEG-SPIO and PEG-SPIO showed signal intensity of H460 cells on T2WI, decreased significantly compared with PEG-SPIO. The rate of signal intensity change was -58.2%, -82.7%, -94.4% and -98.3%, respectively, at iron concentrations of (0, 10, 20, 40, 80 μg/ml) of anti-EGFR-PEG-SPIO. Prussian blue staining and TEM showed that a lot of intracellular irons of anti-EGFR-PEG-SPIO were observed in H460 cells, but few of PEG-SPIO.ConclusionThe effect of active targeting via anti-EGFR in EGFR overexpressed cells can be achieved with anti-EGFR-PEG-SPIO in H460 cells in vitro, and the targeting delivery process could be monitored with 3.0T MRI.
Targeting imaging; Lung; Adenocarcinoma; Molecular probe; Superparamagnetic iron oxide-dopamine
R445.2
A
1003-3289(2017)12-1797-05
国家自然科学基金(81371623)。
王中领(1979—),男,江苏宿迁人,博士,副主任医师。研究方向:分子影像及脑功能成像。E-mail: zlwang138136@126.com
张贵祥,上海交通大学附属第一人民医院放射科,200080。E-mail: gxzhang021@163.com
2016-12-06
2017-10-10
10.13929/j.1003-3289.201612019

