二甲双胍联合艾塞那肽治疗新诊断超重2型糖尿病的疗效观察
魏伟平,全会标,陈道雄,陈开宁
·论著·
570311 海南省海口市,海南省人民医院内分泌科
*通信作者:全会标,主任医师;E-mail:quanhuibiao@aliyun.com
二甲双胍联合艾塞那肽治疗新诊断超重2型糖尿病的疗效观察
魏伟平,全会标*,陈道雄,陈开宁
目的评估二甲双胍联合艾塞那肽治疗新诊断超重2型糖尿病(T2DM)患者的疗效及安全性,并观察经该降糖方案治疗12周后停用艾塞那肽,患者各指标的变化。方法选取新诊断超重T2DM患者50例为研究对象,检测治疗前、二甲双胍联合艾塞那肽治疗12周及停用艾塞那肽12周患者体质量、体质指数(BMI)、空腹及餐后2 h血浆葡萄糖水平、糖化血红蛋白(HbA1c)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)、空腹胰岛素、空腹C肽、餐后2 h C肽、脂联素、抵抗素、肿瘤坏死因子(TNF)-α等指标,计算胰岛素抵抗指数(HOMA-IA)。采用配对t检验比较治疗前与治疗12周、治疗12周与停用艾塞那肽12周上述指标的差异。结果二甲双胍联合艾塞那肽治疗12周可降低T2DM患者体质量、BMI、空腹及餐后2 h血浆葡萄糖、HbA1c、TG、TC、LDL、HOMA-IR、抵抗素、TNF-α,升高脂联素,差异均有统计学意义(P<0.05)。停用艾塞那肽12周后,空腹及餐后2 h血浆葡萄糖、HbA1c、HOMA-IR、TNF-α较联合治疗12周时升高,差异有统计学意义(P<0.05);其余指标差异均无统计学意义(P>0.05)。结论对新诊断超重T2DM患者,早期二甲双胍联合艾塞那肽可能是一种安全、有效的治疗方案。
超重; 糖尿病,2型;艾塞那肽;二甲双胍
近年来,我国糖尿病患病率迅速升高,随着经济的发展和人民生活水平的提高,超重和肥胖的人群亦明显增加[1]。肥胖与胰岛素抵抗密切相关,是引发糖代谢紊乱的重要因素之一[2]。肥胖的2型糖尿病(T2DM)患者可产生更多的游离脂肪酸、炎性物质,加剧胰岛素抵抗,加重胰岛细胞的负担[3]。但有研究表明,肥胖的T2DM患者通常具有较好的胰岛分泌功能,因此与非肥胖者相比,肥胖患者在改善胰岛细胞功能方面有更大的潜力[4]。近年来胰高血糖素肽1(GLP-1)是糖尿病治疗研究的热点之一,艾塞那肽(exenatide)是首个被美国食品及药物管理局(FDA)批准用于临床的GLP-1受体激动剂,艾塞那肽具有一药多效的临床特点,呈葡萄糖依赖的方式降低血糖,单药使用极少发生低血糖,可以降低T2DM患者的体质量,改善脂代谢和胰岛功能[5]。经典降糖药物二甲双胍在降低血糖的同时不增加体质量,亦可改善患者的脂代谢。两种药物均可在降低血糖的同时控制T2DM患者的体质量。但单用二甲双胍部分超重患者体质量下降不明显[6],单用艾塞那肽虽然在控制血糖的同时可以降低体质量,但其为注射药物,患者长期用药不方便,且其价格较贵[5]。因此,本研究采用早期二甲双胍联合艾塞那肽的方案,观察该联合治疗方案对新诊断超重T2DM患者的疗效以及停用艾塞那肽后患者各指标的变化,以寻求针对该人群最合适的降低血糖方案。
1 对象与方法
1.1 研究对象 选取2012年2月—2014年8月在海南省人民医院内分泌科就诊的新诊断T2DM患者50例为研究对象。纳入标准:(1)符合T2DM的诊断标准:糖尿病症状+任意时间血浆葡萄糖水平≥11.1 mmol/L(200 mg/dl)和/或空腹血浆葡萄糖(FPG)水平≥7.0 mmol/L(126 mg/dl)和/或口服葡萄糖耐量试验(OGTT)中,餐后2 h 血浆葡萄糖水平(2 hPG)≥11.1 mmol/L(200 mg/dl)[7];(2)体质指数(BMI)≥24 kg/m2;(3)腰围:男性>90 cm,女性>85 cm;(4)糖化血红蛋白(HbA1c)为7.0%~10.0%;(5)肝、肾功能正常。排除标准:(1)对使用药物过敏,高血压未能控制;(2)存在严重心脏、血液、消化、呼吸、神经、精神类疾病者;(3)严重的成瘾性药物滥用者;(4)患有其他内分泌系统疾病(甲状腺功能亢进、甲状腺功能减退、皮质醇增多症等)者;(5)正在接受皮质醇激素等影响血糖的药物治疗者;(6)有手术、严重创伤等应激情况者;(7)有各种急、慢性感染性炎症者;(8)孕妇、哺乳期、有妊娠计划的妇女及近期曾使用减肥药物者。本研究经海南省人民医院伦理委员会批准,所有受试者均已签署知情同意书。
1.2 研究方法 由专职人员对患者进行饮食、运动教育;培训指尖血糖监测技术(使用德国罗氏罗康全活力型血糖检测仪及配套试纸进行)、艾塞那肽注射技术、不良事件的识别及处理并正确记录等知识。在饮食控制、适量锻炼的基础上,50例患者均给予二甲双胍联合艾塞那肽治疗。二甲双胍(商品名:格华止,施贵宝公司生产)0.5 g/次 ,2次/d;艾塞那肽(商品名:百泌达,美国礼来制药公司生产)开始5 μg/次,2次/d,早、晚餐前60 min内皮下注射4周,随后10 μg/次,2次/d,早、晚餐前60 min内皮下注射8周;之后停用艾塞那肽继续二甲双胍0.5 g/次,2次/d,治疗12周。
1.3 观察指标 (1)体质量指标:所有研究对象分别在治疗前、治疗后12、24周检测身高和体质量,计算体质指数(BMI)。BMI=体质量(kg)/身高2(m2)。(2)实验室检查指标:在治疗前、治疗后12、24周进行检测。①FPG、2 hPG、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)、空腹胰岛素(Fins)、空腹C肽、餐后2 h C肽。以上所有生化检查均在BeckmanAU5400自动分析仪(美国贝克曼公司)上完成。②HbA1c采用免疫聚集法(美国BAYER公司DCA2000HbA1c测定仪及HbA1c试剂盒)检测。③按HOMA稳态模型(homeostasis model assessment)计算胰岛素抵抗指数(HOMA-IR),HOMA-IR=(Fins×FPG)/22.5。④炎性因子:采用双抗体夹心酶联免疫吸附试验(ELISA)法测定脂联素、抵抗素和肿瘤坏死因子-a(TNF-α),检测仪器为Alisei全自动酶标分析仪,试剂盒购自Genzyme(南京凯基生物科技公司),测定均严格按照试剂盒说明书的要求步骤进行操作。
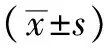
2 结果
2.1 体质量指标 治疗12周后,患者体质量、BMI较前下降,差异有统计学意义(P<0.001);停用艾塞那肽12周后(24周时),患者体质量、BMI与12周时比较差异无统计学意义(P>0.05,见表1、2)。
2.2 血糖、HbA1c比较 治疗12周后,患者FPG、餐后2 hPG、HbA1c均较治疗前下降,差异有统计学意义(P<0.05);停用艾塞那肽12周后(24周时),FPG、餐后2 hPG、HbA1c均较12周时上升,差异有统计学意义(P<0.05,见表1、2)。
2.3 血脂的比较 治疗12周后,患者TG、TC、LDL较治疗前降低,差异有统计学意义(P<0.05);停用艾塞那肽12周后(24周时),TG、TC、LDL较12周时差异无统计学意义(P>0.05,见表1、2)。
2.4 胰岛功能比较 治疗12周后,Fins、空腹C肽及餐后2 h C肽水平较治疗前差异无统计学意义(P>0.05);HOMA-IR较治疗前下降,差异有统计学意义(P<0.05)。停用艾塞那肽12周后(24周时),Fins、空腹C肽及餐后2 h C肽水平较12周时差异无统计学意义(P>0.05);HOMA-IR较12周时上升,差异有统计学意义(P<0.05,见表1、2)。
2.5 炎性因子改变 治疗12周后,脂联素水平较前上升,抵抗素和TNF-α水平下降,差异有统计学意义(P<0.05)。停用艾塞那肽12周后(24周时),脂联素、抵抗素水平与12周时比较,差异无统计学意义(P>0.05),TNF-α水平升高,差异有统计学意义(P<0.05,见表1、2)。
2.6 安全性 50例受试者,共48例完成临床观察(男25例、女23例)。退出试验的2例均为因反复出现恶心、呕吐而无法耐受继续用药,于第2周中止试验。17例患者出现轻中度消化道反应,最常见为恶心11例,其次为腹胀8例,腹泻2例,多以用药初始时明显,随着用药时间的延长,症状不同程度的缓和或消失。治疗过程中未观察到淀粉酶、脂肪酶、肝肾功能的明显改变。共4例发生12例次低血糖事件,无重大低血糖事件发生。
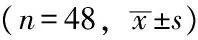
表1 患者治疗前、治疗12周各指标的比较
注:BMI为体质指数,FPG为空腹血浆葡萄糖,餐后2 hPG为餐后2 h血浆葡萄糖,HbA1c为糖化血红蛋白,TG为三酰甘油,TC为总胆固醇,LDL为低密度脂蛋白,Fins为空腹胰岛素,HOMA-IR为胰岛素抵抗指数,TNF-α为肿瘤坏死因子-a
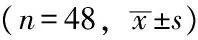
Table2 Observation indices measured at 12 weeks of ME treatment and 12 weeks after stopping using exenatide following 12-week ME treatment in newly diagnosed overweight type 2 diabetic patients

时间体质量(kg)BMI(kg/m2)FPG(mmol/L)餐后2hPG(mmol/L)HbA1c(%)TG(mmol/L)TC(mmol/L)治疗12周784±161265±2170±10105±1968±07174±109453±140治疗24周782±163261±1978±12125±1178±06182±141531±072t值-01280682-3523-4137-3633-1190-0990P值0901050400060003000502640348时间LDL(mmol/L)Fins(pmol/L)空腹C肽(nmol/L)餐后2hC肽(nmol/L)HOMA-IR脂联素(pg/ml)抵抗素(ng/ml)TNF-α(pg/ml)治疗12周35±111184±379112±033284±125416±2451721±403675±3142801±1214治疗24周36±111226±462111±036276±132427±2671681±291699±3363143±762t值-0294-2099-06561675-09410362-1421-2353P值07720359052001100049072601710030
3 讨论
对T2DM的病因学研究发现,肥胖是其发生发展的独立危险因素,肥胖诱发的高胰岛素血症、脂代谢紊乱、全身炎性状态是促进胰岛素抵抗发生发展的重要因素[3,8]。我国各年龄段超重率与肥胖率持续增长,目前我国T2DM患者中约有58.3%的患者BMI≥24 kg/m2[5]。PARK等[4]研究发现,在初发的T2DM患者中,肥胖患者虽然处于更强的胰岛素抵抗状态,但胰岛分泌功能通常优于非肥胖者,在改善胰岛细胞功能方面潜力更大。因此,在控制血糖的同时能最大限度地改善胰岛素抵抗、延缓β细胞功能衰退,既能降低血糖又能降低体质量的治疗方案将成为肥胖的T2DM患者治疗的新选择。
GLP-1是一种进食后肠道分泌的激素,具有增强葡萄糖依赖性的胰岛素分泌、抑制胰岛α细胞分泌胰高血糖素、降低胃排空速率、促进饱食感等多种生理活性[9-10]。艾塞那肽是从希拉巨蜥唾液中分离得到的一种多肽,其氨基酸序列与人类GLP-1氨基酸序列部分重叠,可与人GLP-1受体结合并激活该受体,在体内具有与GLP-1类似的抗高血糖作用,该注射液2005年4月由美国FDA批准上市,现广泛应用于T2DM的治疗。艾塞那肽治疗除了可帮助糖尿病患者更好地控制血糖外,还可改善胰岛β细胞功能,刺激胰岛β细胞的增殖与分化[9-10]。二甲双胍可改善糖代谢,增加胰岛素敏感性,同时有不增加患者体质量,改善脂代谢等作用,是肥胖T2DM患者的一线降糖药物。本研究采用二甲双胍联合艾塞那肽对超重初发T2DM进行为期12周的治疗,结果显示应用二甲双胍联合艾塞那肽治疗12周后,患者的FPG、餐后2 hPG及HbA1c明显下降,可能与艾塞那肽的葡萄糖依赖性促胰岛素分泌作用以及延缓胃排空、降低食欲等作用有关[11]。治疗过程中仅4例发生低血糖事件,无重大低血糖事件发生,提示该治疗方案安全性较好。从治疗前后的胰岛素功能变化来看,治疗后患者的空腹及餐后2 h C肽水平较治疗前差异无统计学意义,但HOMA-IR较前明显降低,提示超重初发T2DM患者的胰岛功能尚可,体内胰岛素水平不低,只是由于机体处于胰岛素抵抗状态而无法发挥作用,二甲双胍与艾塞那肽联合治疗的降糖作用不增加胰岛β细胞的负荷,主要通过减轻胰岛素抵抗,增加机体对胰岛素的敏感性,提高外周组织对胰岛素的使用效率,以达到改善胰岛β功能的目的。
艾塞那肽治疗可显著降低患者的体质量,这种作用在治疗的第2周就开始显现,且这种降低体质量的作用与患者基线时的BMI呈正相关,在超重及肥胖患者中表现更明显[12-15]。本研究中,在二甲双胍基础上加用艾塞那肽,经过12周的治疗,患者的BMI较治疗前显著下降。研究中还观察到,经治疗后,患者的TG、TC、LDL均有降低,提示该治疗方案还可以在一定程度上改善血脂代谢紊乱,与国外研究相符[15]。降低体质量可减轻胰岛抵抗,减少胰岛β细胞的负担,增加外周组织对胰岛素的敏感性,血脂的改善可以减少脂毒性对胰岛功能的损伤,亦能减轻胰岛素抵抗,延缓胰岛β细胞的衰竭。
近年来研究发现脂肪组织不仅可以作为能量储存器官,还可以分泌激素以及多种生物活性物质[16]。脂联素是一种仅由脂肪细胞分泌的蛋白质,在肥胖者、糖尿病及冠状动脉疾病患者,脂联素循环水平低于正常。以往研究显示脂联素对糖、脂代谢有影响,与胰岛素抵抗、动脉粥样硬化有密切联系[17-18]。动物研究显示,脂联素可显著增加骨骼肌中葡萄糖的摄取,降低肝糖输出,增强胰岛素介导的葡萄糖利用,生理剂量的脂联素对改善胰岛素抵抗有显著效应[19-20]。在体外培养的INS-1细胞系中,脂联素球形片段可显著抑制细胞因子和脂肪酸诱导的β细胞凋亡,恢复其胰岛分泌功能[21]。在QUAN等[22]的研究中发现,艾塞那肽可以通过促进脂联素的合成,抑制C反应蛋白的生成,从而增加小鼠胰岛β细胞的数量。国外有临床研究也报道了长期使用艾塞那肽可以增加脂联素的循环水平,减少C反应蛋白的水平[23]。二甲双胍治疗对脂联素的影响,目前尚存在争议,有研究认为,二甲双胍对其无影响[24],但SHARMA等[25]认为其对脂联素有改善作用。本研究中,经过12周艾塞那肽联合二甲双胍的治疗后,体内脂联素的水平较前显著增加,这提示除了通过降低葡萄糖毒性、减轻体质量、改善脂质代谢等方式,二甲双胍联合艾塞那肽治疗可通过增加体内脂联素水平,减轻患者的胰岛素抵抗,延缓胰岛β细胞的衰竭。
抵抗素也是在脂肪细胞中分化产生的,由脂肪细胞特异性分化表达的一种激素。在饮食诱导和基因引起的糖尿病中其水平较高。其可拮抗胰岛素作用,在饮食诱导的小鼠中应用抗抵抗素抗体可提高血糖水平及胰岛素活动。因此,抵抗素可能是联系肥胖与糖尿病的一种激素[26]。本研究发现,二甲双胍联合艾塞那肽的治疗可以降低抵抗素水平,考虑是与艾塞那肽有显著的减重、调脂作用有关,与国外研究相符[27]。
TNF-α是一种参与系统炎性反应的细胞因子,研究发现其在脂肪组织中分布较为广泛,肥胖者脂肪中TNF-α的表达水平远远高于正常人,且TNF-α的表达水平与BMI成正相关,在肥胖相关的胰岛素抵抗机制中该因子扮演了重要角色,它是胰岛素抵抗发生的中心环节之一,可以促进脂肪分解,抑制脂质合成,可直接对抗胰岛素的作用[28]。本研究发现,超重的T2DM患者经过二甲双胍联合艾塞那肽的治疗,其TNF-α水平明显降低,提示二甲双胍联合艾塞那肽治疗有降低TNF-α的能力,考虑与TNF-α广泛分布于脂肪组织,而该方案具有显著的减重效应有关。
脂肪因子与T2DM的发生有密切联系,它们随血液循环作用于个胰岛素靶组织,通过影响胰岛素信号转导途径及代谢相关酶的转录,调节机体的能量代谢,在胰岛素抵抗中发挥重要作用[29]。本研究中,二甲双胍联合艾塞那肽的治疗,可通过调节脂联素、抵抗素、TNF-α等脂肪因子来达到减轻胰岛素抵抗的作用,但脂肪细胞还可分泌瘦素、内脂素、白介素-6等其他脂肪因子,对于二甲双胍联合艾塞那肽是否还可以通过其他途径以达到改善胰岛功能的目的,尚有待进一步研究。
国外有研究表明,二甲双胍联合艾塞那肽的方案在血糖、体质量、血脂等各方面获益要明显优于单用二甲双胍,且单用二甲双胍对于炎性因子影响不大,进一步证实了艾塞那肽在该治疗方案中所起的作用[27]。为了更好地了解艾塞那肽治疗所带来的获益,在患者经过12周二甲双胍联合艾塞那肽的治疗后,本研究观察了停用艾塞那肽,单用二甲双胍继续治疗12周后患者的各项指标,结果显示,停用艾塞那肽后,患者的整体血糖水平较前升高,C肽水平较前无明显变化,TG、TC、LDL较前有上升趋势但无统计学意义,炎性因子方面,除TNF较前升高外,脂联素、抵抗素均较前无明显变化。上述结果提示尽管停用艾塞那肽后,血糖较前有所升高,但早期治疗所带来的体质量下降、脂代谢紊乱纠正、炎性因子变化的获益,即使在停用艾塞那肽后,仍可在一定时间内保持在较稳定的范围,而上述指标的稳定,则为患者进一步调整降糖方案奠定了坚实的基础,也为患者带来更为长久的获益。
综上所述,对于超重的初发的T2DM患者,经过二甲双胍联合艾塞那肽的治疗,可带来良好的血糖控制,其胰岛β细胞功能、脂代谢紊乱、体质量均可获得改善,该方案可通过调节部分脂肪因子,以达到改善胰岛素抵抗的作用,而上述的获益,即使在停用艾塞那肽后仍可以在一定时间内持续存在。胰岛素抵抗是T2DM的特点,现认为可能是多数T2DM发病的始发因素。因此,对于胰岛功能尚可的初发肥胖T2DM患者,二甲双胍联合艾塞那肽的方案不增加胰岛细胞的负担,而主要通过减重、改善脂代谢、减轻胰岛素抵抗,增加机体对胰岛素敏感性的方式,在较好的控制血糖的同时,延缓患者进行性的β细胞功能减退,以带来更为长远的获益,是该类患者早期降糖治疗的一种理想选择。
作者贡献:全会标负责提供思路和方案、指导研究实施、质量把控、修改文章;魏伟平负责收集入组患者,数据采集、整理、统计分析,撰稿书写;陈道雄、陈开宁负责质量把控、修改文章。
本文无利益冲突。
[1]黄金,胡进,朱熊兆,等. 社区2型糖尿病患者认知功能现状及其影响因素研究[J].中国全科医学,2016,19(2):135-141.DOI:10.3969/j.issn.1007-9572.2016.02.003.
HUANG J,HU J,ZHU X Z,et al.Prstatus and influencing factors for the cognitive function of patients with type 2 diabetes mellitus[J].Chinese General Practice,2016,19(19):2263-2265,2270.DOI:.10.3969/j.issn.1007-9572.2016.02.003.
[2]LEE B C,LEE J. Cellular and molecular players in adipose tissue inflammation in the development of obesity-induced insulin resistance[J].Biochimica et Biophysica Acta,2014,1842(3):446-462. DOI:10.1016/j.bbadis.
[3]陈玉,周玲,徐耀初,等.2型糖尿病与遗传和环境因素相互关系的研究[J].中华预防医学杂志,2002,36(3):191-194.DOI:10.3760/j:issn:0253-9624.
CHEN Y,ZHOU L,XU Y C,et al.A study on the relationship between genetic and environmental factors of type 2 diabetes mellitus in humans[J].Chinese Journal of Preventive Medicine,2002,36(3):191-194.DOI:10.3760/j:issn:0253-9624.
[4]PARK J Y,LEE K U,KIM C H,et al. Past and current obesity in Koreans with non-insulin-dependent diabetes mellitus[J].Diabetes Res Clin Pract,1997,35(1):49-56.DOI:10.1016/S0168-8227(96)01363-0.
[5]SYED Y Y,MCCORMARK P L. Exenatide extended-release:an updated review of its use in type 2 diabetes mellitus[J].Drugs,2015,5(10):1141-1152. DOI:10.1007/s40265-015-0420-z.
[6]ITO H,ISHIDA H,TAKEUCHI Y,et al.Long-term effect of metformin on blood glucose control in non-obese patients with type 2 diabetes mellitus[J].Nutr Metab(Lond),2010,12(7):83. DOI:10.1186/1743-7075-7-83.
[7]中华医学会糖尿病学分会.中国2型糖尿病防治指南(2007年版)[J].中华医学杂志,2008,88(18):1227-1245. DOI:10.3321/j.issn:0376-2491.
Chinese Diabetes Society.China guideline for type 2 diabetes(2007 Edition)[J].Chinese Journal of Endocrinology and Metabolism,2008,88(18):1227-1245. DOI:10.3321/j.issn:0376-2491.
[8]李春芝,刘洪英,刘军肖.慢性阻塞性肺疾病患者脂代谢和血清促血管生成素2水平与病情严重程度的关系[J].中国全科医学,2015,18(34):4210-4215.DOI:10.3969/j.issn.1007-9572.2015.34.014.
LI C Z,LIU H Y,LIU J X.Relationship between lipid metabolism and serum angiogenin 2 levels in patients with COPD and illness severity[J].Chinese General Practice,2015,18(34):4210-4215.DOI:10.3969/j.issn.1007-9572.2015.34.014.
[9]FEHSE F,TRAUTMANN M,HOLST J J.Exenatide augments first-and second-phase insulin secretion in response to intravenous glucose in subjects with type 2 diabetes[J].Journal of Clinical Endocrinology and Metabolism,2005,90(11):5991-5997. DOI:10.1210/jc.2005-1093.
[10]XU G,STOFFERS D A,HABENER J F,et al.Exendin-4 stimulates both beta-cell replication neogenesis,resulting in increased beta-cell mass improved glucose tolerance in diabetic rats[J].Diabetes,1999,48(12):2270-2276.DOI:10.2337/diabetes.48.12.2270.
[11]DE-HEER J,HOLST J J. Sulfonylurea compounds uncouple the glucose dependence of the insulinotropic effect of glucagon-like peptide 1[J].Diabetes,2007,56(2):438-443. DOI:10.2337/db.06-0738.
[12]BUSE J B,HENRY R R,Han J,et al.Effects of exenatide(exendin-4) on glycemic control over 30 weeks in sulfonylurea-treated patients with type 2 diabetes[J].Diabetes Care,2004,27(11):2628-2635.DOI:10.2337/db.06-0783.
[13]FINEMAN M S,BICSAK T A,SHEN L Z,et al. Effect on glycemic control of exenatide(synthetic exendin-4) additive to existing metformin and/or sulfonylurea treatment in patients with type 2 diabetes[J].Diabetes Care,2003,26(8):2370-2377. DOI:10.2337/diacare.26.8.2370
[14]KENDALL D M,RIDDLE M C,ROSENSTOCK J,et al.Effects of exenatide(exendin-4) on glycemiec control over 30 weeks in patients with type 2 diabetes treated with metformin and a sulfonylurea[J].Diabetes Care,2005,28(5):1083-1091.DOI:10.2337/diacare.28.5.1083.
[15]KLONOFF D C,BUSE J B,NIELSEN L L,et al.Exenatide effects on diabetes,obesity,cardiovascular risk factor and hepatic biomarkers in patients with type 2 diabetes treated for 3years[J].Curr Med Res Opin,2008,24(1):275-286.DOI:10.1185/030079908X253870.
[16]CHOI S H,HONG E S,LIM S. Clinical implications of adipocytokines and newly emerging metabolic factors with relation to insulin resistance and cardiovascular health[J].Front Endocrinol(Lausanne),2013,4:97.DOI:10.3389/fendo.2013.00097.
[17]ARITA Y,KIHARA S,OUCHI N.Paradoxical decrease of an adipose-specific protein,adiponectin,in obesity[J].Biochemical and Biophysical Research Communications,1999,257(1):79-83.DOI:10.1016/j.bbrc.2012.08.024.
[18]YAMAUCHI T,KAMON J,WAKI H. The fat-derived hormone adiponectin reverses insulin resistance associated with both lipoatrophy and obesity[J].Nature Medicine,2001,7(8):941.DOI:10.1038/90984.
[19]HALLEUX C M,TAKAHASHI M,DELPORTE M L,et al. Secretion of adiponectin and regulation of apM1 gene expression in human visceral adipose tissue[J].Biochem Biophys Res Commun,2001,288(5):1102-1107.DOI:10.1006/bbrc.2001.5904.
[20]MAEDA N,TAKAHASHI M,FUNAHASHI T,et al. PPARy gamma ligands increase expression and plasma concentrations of adiponectin,an adipose-derived protein[J].Diabetes,2001,50(9):2094-2099.DOI:10.2337/diabetes.50.9. 2094.
[21]KALTENBACH S,STAIGER H,WEISSER M,et al. Adiponectin receptor gene expression in human skeletal muscle cells is not regulated by fibrates and thiazolidinediones[J].Int J Obes,2005,29(7):760-765. DOI:10.1038/sj.ijo.0802957.
[22]QUAN H,GAO Y,ZHANG H,et al.Exenatide enhances INS-1 rat pancreatic cell mass by increasing the protein levels of adiponectin and reducing the levels of C-reactive protein[J].Molecular Medicine Reports,2014,10(5):2447-2452.DOI:10.3892/mmr.2014.2538.
[23]DEROSA G,PUTIGNANO P,BOSSI A C,et al. Exenatide or glimepiride added to metformin on metabolic control and on insulin resistance in type 2 diabetic patients[J].Eur J Pharmacol,2011,666(1/3):251-256.DOI:10.1016/j.ejphar.2011.05.051.
[24]KANDA Y,MATSUDA M,TAWARAMOTO K,et al. Effects of sulfonylurea drugs on adiponectin production from 3T3-L1 adipocytes:implication of different mechanism from pioglitazone[J].Diabetes Res Clin Pract,2008,81(1):13-18. DOI:10.1016/j. diabres.2008.01.031.
[25]SHARMA P K,BHANSALI A,SIALY R,et al. Effects of pioglitazone and metformin on plasma adiponectin in newly detected type 2 diabetes mellitus[J].Clin Endocrinol,2006,65(6):722-728. DOI:10.1111/j.1365-2265.2006.02658.x.
[26]孙青,梁晓春.脂肪细胞因子与2型糖尿病β细胞衰竭关系的研究进展[J].中国医学科学院学报,2016,38(5):601-606. DOI:10.3881/j.issn.1000-503X.2016.05.020.
SUN Q,LIANG X C.Advances in the relationship between adipokines and β-cell failure in type 2 diabetes mellitus[J].Acta Academiae Medicinae Sinicae,2016,38(5):601-606. DOI:10.3881/j.issn.1000-503X.2016.05.020.
[27]DEROSA G,FRANZETTI I G,QUERCI F,et al. Variation in inflammatory markers and glycemic parameters after 12 months of exenatide plus metformin treatment compared with metformin alone:a randomized placebo-controlled trial.[J].Pharmacotherapy,2013,33(8):817-826. DOI:10.1002/phar.1301.
[28]张奇志,陈诗鸿,王蒙,等.沙格列汀对高糖高脂饮食大鼠糖脂代谢的影响及其对脂肪因子的作用[J].中华老年医学杂志,2014,33(3):315-318. DOI:10.3760/cma.j.issn. 0254-9026.2014.03.027.
ZHANG Q Z,CHEN S H,WANG M,et al.Efficacy of Saxagliptin on glucose and lipids metabolism and adipokines in high-glucose and fat dietinduced insulin resistance rats[J].Chinese Journal of Geriatrics,2014,33(3):315-318. DOI:10.3760/cma. j.issn. 0254-9026. 2014.03.027.
[29]隋婧,陈福琴.脂肪因子与2型糖尿病[J].中国老年学杂志,2007,27(20):2048-2050. DOI:10.3969/j.issn.1005-9202.2007.20.047.
SUI J,CHEN F Q.Fat factor and type 2 diabetes[J].Chinese Journal of Gerontology,2007,27(20):2048-2050. DOI:10.3969/j.issn.1005-9202.2007.20.047.
ResponsetoMetforminCombinedwithExenatideinNewlyDiagnosedOverweightType2DiabeticPatients
WEIWei-ping,QUANHui-biao*,CHENDao-xiong,CHENKai-ning
DepartmentofEndocrinology,HainanGeneralHospital,Haikou570311,China
*Correspondingauthor:QUANHui-biao,ChiefPhysician;E-mail:quanhuibiao@aliyun.com
ObjectiveTo explore the effect and safety of 12-week metformin combined with exenatide(ME) treatment for newly diagnosed overweight type 2 diabetic patients,and to investigate the subsequent response in these patients after stop using exenatide for 12 weeks following 12-week ME treatment.MethodsThe enrolled participants were 50 cases of overweight newly diagnosed type 2 diabetic patients.Body weight,BMI,fasting plasma glucose(FPG),2 h postprandial plasma glucose(2 hPG),glycosylated hemoglobin(HbA1c),triacylglycerol(TG),total cholesterol(TC),low-density lipoprotein(LDL),insulin,C-peptide,2 h postprandial C-peptide(2 hCP),adiponectin,resistin,tumor necrosis factor-alpha(TNF-α),and other biochemical indices were measured,and HOMA-IR was calculated at baseline,at 12 weeks of ME treatment and at 12 weeks after stopping using exenatide following 12-week ME treatment.Comparisons were made between the first and second measurement data,as well as between the second and third measurement data using pairedt-test.ResultsThe body weight,BMI,FPG,2 hPG,HbA1c,TG,TC,LDL,HOMA-IR,resistin,TNF-α decreased but adiponectin increased significantly at the end of 12-week ME treatment(P<0.05).FPG,2 hPG,HbA1c,HOMA-IR and TNF-α increased(P<0.05) but other indices did not change significantly at 12 weeks after stopping using exenatide following 12-week ME treatment(P>0.05).ConclusionEarly ME treatment may be a safe and effective regimen for newly diagnosed overweight type 2 diabetic patients.
Overweight;Diabetes mellitus,type 2;Exenatide;Metformin
海南省重点科技计划项目(ZDXM20120114)
R 587.1
A
10.3969/j.issn.1007-9572.2017.34.013
魏伟平,全会标,陈道雄,等.二甲双胍联合艾塞那肽治疗新诊断超重2型糖尿病的疗效观察[J].中国全科医学,2017,20(34):4278-4283.[www.chinagp.net]
WEI W P,QUAN H B,CHEN D X,et al.Response to metformin combined with exenatide in newly diagnosed overweight type 2 diabetic patients[J].Chinese General Practice,2017,20(34):4278-4283.
2017-04-20;
2017-09-22)
殷丽刚)

