电针对电刺激硬脑膜偏头痛大鼠模型5-HT1B受体的调节作用
朱玉璞 裴 培 刘 璐 赵洛鹏 曲正阳 王麟鹏
(首都医科大学附属北京中医医院,北京,100010)
电针对电刺激硬脑膜偏头痛大鼠模型5-HT1B受体的调节作用
朱玉璞 裴 培 刘 璐 赵洛鹏 曲正阳 王麟鹏
(首都医科大学附属北京中医医院,北京,100010)
目的:探讨电针对电刺激硬脑膜大鼠偏头痛模型5-HT1B受体的调节作用。方法:选取成年雄性SD大鼠40只,随机分为5组,每组8只,对照组(C,只进行手术,不进行硬脑膜电刺激)、模型组(M,造模不给予电针)、单穴组(EA1,造模并给予电针风池穴)、双穴组(EA2,造模并给予电针风池穴、阳陵泉穴)和假穴组(SA,造模并给予电针假穴)。实验前检测面部机械痛阈基线,实验第2、4、6天分别测定大鼠足面部的机械痛阈。实验第7天取三叉神经脊束核、三叉神经核,用相对定量实时聚合酶链式反应测定5-HT1B受体基因相对表达水平,用蛋白印迹法测定5-HT1B受体蛋白相对表达水平。结果:与模型组比较,单穴组和双穴组的痛阈显著提高(P<0.05),且双穴组高于单穴组(P<0.05);单穴组和双穴组5-HT1B受体基因表达和蛋白表达比模型组显著提高(P<0.05),且双穴组高于单穴组(P<0.05)。结论:电针对偏头痛大鼠模型有治疗作用,且双穴组优于单穴组。
电针;偏头痛;电刺激硬脑膜;5-HT1B受体
偏头痛是一种多因素神经血管紊乱疾病,临床表现为反复发作性头痛,并伴有神经、胃肠道及自主神经功能紊乱症状[1]。在2012年由《柳叶刀》发起的全球疾病负担调查中,偏头痛排第8位[2]。而且,偏头痛在世界范围内已成为第6大致残性疾病[3],但治疗却缺乏完整有效的手段[1]。偏头痛久治不愈,可能会发展为慢性偏头痛最终致残,此类患者在中国占9.3%[4],在美国占12%[5]。目前,对于偏头痛的病理生理学机制仍然知之甚少,现代研究认为多与三叉神经血管系统有关[6-9]。经典疼痛传导通路由三叉神经节(Trigeminal Ganglia,TG)、三叉神经脊束核尾核(Trigeminal Nucleus Caudalis,TNC)和丘脑组成。同时,有学者认为5-HT1B受体在脑血管平滑肌、内皮细胞、TG以及TNC上均有分布[10]。还有研究发现,多数TG内的神经元具有5-HT1B受体[11]。可以确定5-HT1B存在于TG和TNC部位。目前,曲普坦类是临床治疗偏头痛的一线用药,从药理学上分析,曲普坦类是5-HT1B受体激动剂,其抗偏头痛作用的机制是收缩颅血管[12]和阻滞三叉神经引起的硬脑膜血浆蛋白渗出[13]。由此可见,5-HT1B受体在偏头痛的发生过程中扮演了非常重要的角色,同时也是偏头痛治疗当中非常重要的靶点。在最近几十年里,西方国家将针灸应用于包括偏头痛在内的各种疾病的治疗[14-15]。但是,目前对于电针治疗偏头痛的机制尚不明确。所以,本实验采用电刺激硬脑膜的方法建立大鼠偏头痛模型,应用面部机械痛测定、相对定量实时聚合酶链式反应(RT-PCR)测定和蛋白印迹法(Western blot)分别从行为学、基因以及蛋白方面对电针治疗偏头痛的机制进行阐述,以期望能够揭示电针治疗偏头痛的相关机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 成年雄性SD大鼠40只,200~220 g,由北京维通利华公司提供。适应性喂养一周,饲养环境:安静,12∶12 h明暗光照环境中(8:00AM-8:00PM),单笼喂养。
1.1.2 主要试剂 Trizol(美国Invitrogen公司);M-MLV逆转录酶(宝生物工程(大连)有限公司);DNase I(美国Fermentas(MBI)公司);6×Loading Buffer(美国Fermentas(MBI)公司);dNTP(10 mM)(宝生物工程(大连)有限公司);2×Ex TaqMix(宝生物工程(大连)有限公司);RNase-free H2O(韩国Walgene公司);Eva_green(美国Biotium公司);5-HT1B多克隆抗体(1∶1000)(美国SANTA CRUZ公司)。
1.2 方法
1.2.1 分组与模型制备 选取40只成年雄性SD大鼠,随机分为5组,每组8只,对照组(C,只进行手术,不进行硬脑膜电刺激)、模型组(M,造模不给予电针)、单穴组(EA1,造模并给予电针风池)、双穴组(EA2,造模并给予电针风池、阳陵泉)和假穴组(SA,造模并给予电针假穴)。模型的建立参照先前的实验方法 1)安置电极:用10%戊巴比妥钠40 mg/kg腹腔注射,待大鼠完全麻醉后,剔除头正中部毛发,俯卧位置于脑立体定位仪上,并将耳杆插入大鼠耳道内。皮肤消毒,逐层切开皮肤、肌肉等组织,用蘸有双氧水的棉签擦去骨膜,颅骨彻底暴露后,以颅中线冠状缝交叉点前4 mm为前界,颅中线冠状缝交叉点后6 mm为后界,用台式牙科钻小心钻开2个直径约1 mm的圆孔,钻孔时使用4 ℃生理盐水以降低钻及孔的温度,防止灼伤硬膜;暴露上矢状窦旁硬脑膜后,将双极电极放置于钻好的刺激孔中(除电极外均应是绝缘),轻柔接触硬膜,以502胶水和牙托粉将电极固定于颅骨骨面,仅留电极接头于皮肤外,并在孔内插入电极保护帽,以防止外刺激孔堵塞。以上所有操作均在无菌条件下进行。术后分笼单独饲养,温度为(24±1)℃,麻醉清醒后自由摄取水和食物,常规使用庆大霉素(0.04 million IU/100 g),密切观察生命体征和伤口愈合情况,实验严格按照国际疼痛学会(International Association for the Study of Pain,IASP)关于动物进行疼痛研究的伦理纲要进行操作,电极脱落或死亡的大鼠予以剔除。2)反复电刺激:大鼠安置电极后恢复一周,恢复后开始电刺激硬脑膜,正式刺激前以1Hz进行预刺激5~10 s,观察到大鼠1次/s的节律性点头动作表示电极安放成功,确定电极安放成功后给予正式电刺激。电刺激参数:刺激频率:20 Hz,电流强度:1.8~2.0 mA,脉宽:0.5 ms,波形:方波,刺激时间:15 min,在实验第1、3、5 d进行电刺激。对照组仅安置电极不进行电刺激。
1.2.2 电针治疗 “穴位”电针:参照《实验针灸学》的方法取穴,单穴组取大鼠双侧“风池”穴(GB20),双穴组取大鼠双侧“阳陵泉”穴(GB34)。假穴组取腰部非穴位点。在实验第1、3、5天进行电针治疗。电针(直径0.16 mm)进针2~3 mm,连接HANS电针仪,电针参数:疏密波2/15 Hz,0.5~1 mA,强度以大鼠耳郭轻度抖动或局部肌肉收缩为度,刺激10 min。
1.2.3 大鼠面部机械痛阈(Mechanical Withdrawal Threshold,MWT)的测定 本研究中大鼠面部机械刺激反应阈值同样采用测定。原理是利用不同压力作用于大鼠面部眶周,引起大鼠的躲避反应,以引起躲避反应的压力表示大鼠的机械反应阈值。安静环境中,将大鼠置于半透明有机玻璃笼中,靠近大鼠头部的两侧笼壁上有1 cm×5 cm孔径。测试前大鼠适应环境15~30 min,用电子von-Frey测痛仪直刺激大鼠面部眶周,大鼠出现躲避行为视为阳性反应,否则为阴性反应。每次刺激持续时间2 s,间隔15 s,出现阳性反应的力度即记为面部机械反应阈值。在实验前进行面部的痛阈Baseline的测定,在第2、4、6天分别进行痛阈测定。
1.2.4 取材 实验大鼠在第7天取材。PCR取材用10%水合氯醛经腹腔注射麻醉大鼠,剪开胸部,将灌注针由左心室穿入主动脉升部,注入生理盐水灌注30 min后,取TG和TNC迅速放入液氮中冷冻,冻实后备用。Western blot取材用10%水合氯醛经腹腔注射麻醉大鼠,剪开胸部,将灌注针由左心室穿入主动脉升部,注入生理盐水,灌注20 min后,取出脑组织后,取TG和TNC迅速放入液氮中冷冻,冻实后备用。
1.2.5 5-HT1B受体基因的相对表达测定 用相对定量RT-PCR测定。取组织后迅速放液氮中冷冻,冻实后置于研钵中研磨,用Trizol法抽提总RNA,取少量组织用分光光度法和琼脂糖凝胶电泳测定RNA质量。按照逆转录试剂盒要求,将1 μg总RNA逆转录为cDNA,4 ℃冰箱保存备用。配置PCR反应体系25 μL备用,包含2×PCR Taq Mix 12.5 μL,10 μmol/L下游引物各0.5 μL,cDNA模板1 μL,并用灭菌ddH20补足至25 μL。PCR反应条件:94 ℃预变性3 min,94 ℃变性20 s,60 ℃退火20 s,72 ℃延伸30 s,扩增40个循环,最后溶解曲线65~90 ℃。实验结束即可得到目的基因与内参基因的扩增曲线和溶解曲线。目的基因和内参基因均设置3个复孔,以表示5-HT1B受体基因的相对表达量。ΔCt(Ct值目的基因-Ct值内参基因)实验组-ΔCt(Ct值目的基因-Ct值管家基因)对照组,2-(△△CT)=fold difference(实验组/对照组)其中CT值为PCR扩增过程中,扩增产物的荧光信号达到设定的阈值时所经过的扩增循环次数。
1.2.6 5-HT1B受体基因蛋白的测定 实验步骤严格遵照试剂盒说明书进行。将待测定的脑组织从液氮中取出,在冰生理盐水中洗净,吸干水分后称重,加裂解液后在冰上进行匀浆,提前预冷(4 ℃)离心机后进行离心(13 000 r/min,20 min)。每等分样品取1/2上清液,测定其蛋白浓度,将10 g蛋白与上样缓冲液充分混匀,并煮沸加热5 min,置于SDS变性聚丙烯胺凝胶电泳,转膜,5%脱脂牛奶封闭1 h,加一抗和单克隆抗β-actin,洗膜,加二抗孵育1 h(抗兔IgG抗体),再次洗膜,显影,Gelpro软件分析可视带的密度。

2 结果
2.1 各组大鼠面部机械痛阈(Mechanical Withdrawal Threshold,MWT)水平比较 Von frey测试显示,模型组、单穴组、双穴组和假穴组的大鼠面部痛域在实验第2、4、6天都有下降。在实验前,各组大鼠面部痛阈值对照组(32.80±2.33)g,模型组(31.92±7.98)g,单穴组(32.96±7.76)g,双穴组(31.86±4.65)g,假穴组(29.33±4.90)g,差异无统计学意义(P>0.05)。实验第2天,模型组(7.82±1.57)g与对照组(37.50±9.51)g比较,痛阈有显著下降(P<0.001);单穴组(24.27±5.72)g相较于模型组(7.82±1.57)g痛阈显著升高(P<0.05),双穴组(27.53±7.7)g痛阈相较于模型组(7.82±1.57)g痛阈显著升高(P<0.05),同时,双穴组(27.53±7.7)g痛阈高于单穴组(24.27±5.72)g(P<0.05);模型组(7.82±1.57)g与假穴组(6.44±1.95)g比较,差异无统计学意义(P>0.05)。实验第4天,模型组(6.74±2.58)g与对照组(32.61±7.71)g比较,痛阈有显著下降(P<0.001);单穴组(20.51±3.89)g相较于模型组(6.74±2.58)g痛阈显著升高(P<0.05),双穴组(27.33±7.96)g痛阈相较于模型组(6.74±2.58)g痛阈显著升高(P<0.01),同时,双穴组(27.33±7.96)g痛阈高于单穴组(20.51±3.89)g(P<0.05);模型组(6.74±2.58)g与假穴组(9.87±3.16)g比较,差异无统计学意义(P>0.05)。实验第6天,模型组(7.14±1.34)g与对照组(33.91±6.43)g比较,痛阈有显著下降(P<0.05);单穴组(21.63±1.08)g相较于模型组(7.14±1.34)g痛阈显著升高(P<0.05),双穴组(23.94±3.77)g痛阈相较于模型组(7.14±1.34)g痛阈显著升高(P<0.05),同时,双穴组痛(23.94±3.77)g阈高于单穴组(21.63±1.08)g(P<0.01);模型组(7.14±1.34)g与假穴组(13.28±2.76)g比较,差异无统计学意义(P>0.05)。
2.2 各组5-HT1B受体基因相对表达水平比较 实验结果显示,5-HT1B受体基因在各组TNC和TG中均有表达,模型组5-HT1B受体基因相对表达水平明显高于对照组(P<0.05)。与模型组比较,单穴组和双穴组在TNC和TG基因相对表达明显较高(P<0.05)。与假穴组比较,单穴组和双穴组在TNC和TG的基因相对表达也呈现高表达态势(P<0.05)。同时,单穴组在TNC和TG的基因相对表达水平低于双穴组(P<0.05)。单穴组和双穴组在TNC和TG的基因相对表达水平高于假穴组(P<0.05)。在TNC和TG,假穴组与模型组比较基因相对表达水平,差异无统计学意义(P<0.05)。见图1。

图1 各组大鼠TNC和TG中5-HT1B受体基因相对表达量
注:M组与C组比较,*P<0.05,**P<0.01,***P<0.001;M组与EA2组比较,△P<0.05,△△P<0.01,△△△P<0.001;EA2组与EA1组比较,▲P<0.05,▲▲P<0.01,▲▲▲P<0.001;EA1组与M组比较,□P<0.05,□□P<0.01,□□□P<0.001
2.3 各组5-HT1B受体基因蛋白表达水平比较 模型组5-HT1B受体蛋白表达水平明显高于对照组(P<0.05)。与模型组比较,单穴组和双穴组在TNC和TG蛋白表达明显较高(P<0.05)。与假穴组比较,单穴组和双穴组蛋白表达也呈现高表达态势(P<0.05);同时,单穴组的表达低于双穴组(P<0.05)。在TNC和TG,单穴组和双穴组的蛋白水平大于假穴组(P<0.05)。假穴组与模型组比较,5-HT1B受体蛋白水平差异有统计学意义(P<0.05)。见图2。
3 讨论
偏头痛作为临床常见疾病,具有反复发作,迁延难愈,疼痛剧烈的特点,其发病机制尚未完全阐明,目前主要流行的学说有血管源学说、神经学说、三叉神经血管学说、遗传学说及离子学说等。中医学认为偏头痛属于“头痛”范畴,亦称“偏头风”,风池穴是电针治疗偏头痛的常用穴位。本课题组的早前调查表明,风池穴是目前偏头痛动物实验中较为常用的穴位[16]。本实验利用行为学、5-HT1B受体基因相对表达水平以及5-HT1B受体基因蛋白表达水平等多种指标对假说进行了验证。von Frey测痛数据显示,在实验第2、4、6天,对照组痛阈高于模型组(P<0.05),说明造模成功。与模型组比较,在实验第2、4、6天,单穴组和双穴组显著偏高(P<0.05),且单穴组和双穴组高于假穴组(P<0.05),同时,双穴组高于单穴组(P<0.05)。5-HT1B受体在TNC和TG均有分布。其中,对照组中5-HT1B的表达水平高于模型组(P<0.05),说明造模成功。与模型组比较,在单穴组和双穴组中5-HT1B受体表现为高表达(P<0.05),且双穴组高于单穴组(P<0.05)。这说明电针对偏头痛可以通过激活5-HT1B起到治疗作用,并且局远配穴治疗方案要优于局部单穴治疗。在TNC和TG,单穴组和双穴组的蛋白水平大于假穴组(P<0.05)。假穴组与模型组比较蛋白水平差异统计学意义(P<0.05)。这说明治疗作用是由刺激特定穴位起作用的。
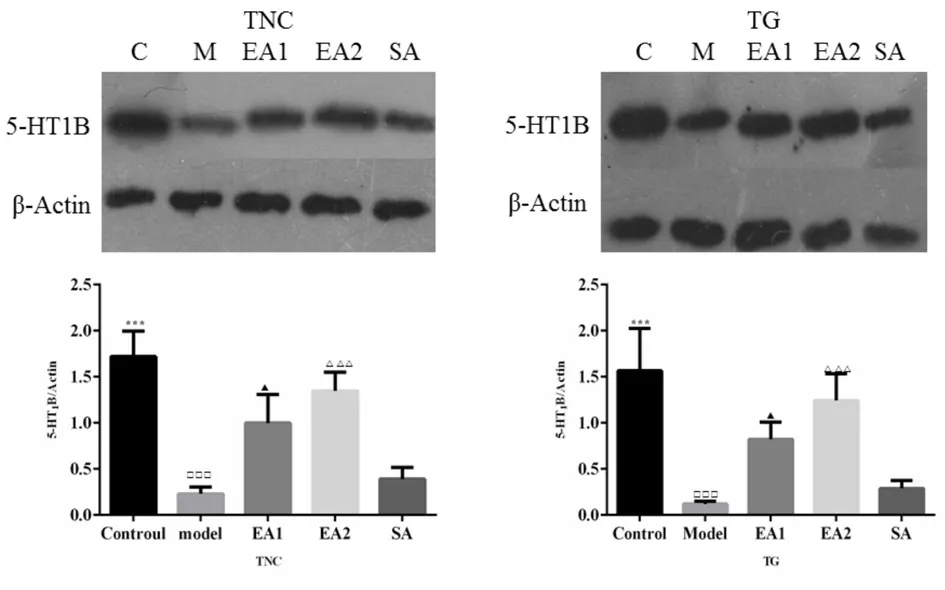
图2 各组大鼠TNC和TG中5-HT1B受体蛋白表达水平
目前在偏头痛的药物治疗当中,5-HT1B受体激动剂仍然属于一线用药,因此这提示我们5-HT1B受体在抑制偏头痛的发作过程当中具有重要意义。相关研究显示,5-HT1B受体和舒马曲坦引起的脑血管收缩有关[17],这一作用在偏头痛的发病机制当中占有一席之地,因此,电针对偏头痛的的治疗作用可能部分是通过激活5-HT1B受体来起作用。有研究显示,针刺风池穴可以提高脑内的5-HT水平[18]。临床应用当中,曲普坦类药物的缩血管作用所引起的不良反应阻碍了其在心血管疾病患者中的应用。而相关研究发现,5-HT在偏头痛病理生理机制当中,可能不仅作为其血管活性物质起作用,还可能具有神经递质或神经调质作用[19]。最近数据表明偏头痛患者的5-HT系统的5-HT转运蛋白基因发生了改变[20]。因此,电针上调5-HT表达水平不仅起到缩血管作用,同时调节神经内分泌的作用,而这一作用并非像曲普坦类药物一样作用于全身,而是直接作用于神经系统,因此可避免药物治疗带来的不良反应,使得电针治疗更加具有广泛的应用前景。此外,本实验中没有利用5-HT1B受体激动剂和抑制剂进行验证,是本实验的不足,同时也是未来继续进行实验研究的方向。同时本实验未能在电生理方面进行验证。
[1]Lionetto L,Casolla B,Mastropietri F,et al.Pharmacokinetic evaluation of zolmitriptan for the treatment of migraines[J].Expert Opin Drug Metab Toxicol,2012,8(8):1043-1050.
[2]Murray CJ,Vos T,Lozano R,et al.Disability-adjusted life years(DALYs)for 291 diseases and injuries in 21 regions,1990-2010:a systematic analysis for the Global Burden of Disease Study 2010[J].Lancet,2012,380(9859):2197-2223.
[3]Steiner TJ,Stovner LJ,Vos T.GBD 2015:migraine is the third cause of disability in under 50s[J].J Headache Pain,2016.17(1):104.
[4]Liu R,Yu S,He M,et al.Health-care utilization for primary headache disorders in China:a population-based door-to-door survey[J].J Headache Pain,2013,14:47.
[5]Hepp Z,Bloudek LM,Varon SF.Systematic review of migraine prophylaxis adherence and persistence[J].J Manag Care Pharm,2014,20(1):22-33.
[6]Santos JA,López-Díaz TM,García-Fernández MC,et al.Characterization and extracellular activity of psychrotrophic bacteria isolated from Villalón cheese(fresh variety of Spanish sheep′s milk cheese)[J].Int J Food Microbiol,1996,33(2-3):301-306.
[7]Bernstein C,Burstein R.Sensitization of the trigeminovascular pathway:perspective and implications to migraine pathophysiology[J].J Clin Neurol,2012,8(2):89-99.
[8]Noseda R,Burstein R.Migraine pathophysiology:anatomy of the trigeminovascular pathway and associated neurological symptoms,cortical spreading depression,sensitization,and modulation of pain[J].Pain,2013,154 Suppl 1:S44-53.
[9]Pietrobon D,Moskowitz MA.Pathophysiology of migraine[J].Annu Rev Physiol,2013,75:365-391.
[10]Bouchelet I,Cohen Z,Case B,et al.Differential expression of sumatriptan-sensitive 5-hydroxytryptamine receptors in human trigeminal ganglia and cerebral blood vessels[J].Mol Pharmacol,1996,50(2):219-223.
[11]Liu Y,Xu S,Woodruff AL,et al.Structural basis of glycan specificity of P[19] VP8*:Implications for rotavirus zoonosis and evolution[J].PLoS Pathog,2017,13(11):e1006707.
[12]Feniuk W,Humphrey PP,Perren MJ,et al.Rationale for the use of 5-HT1-like agonists in the treatment of migraine[J].J Neurol,1991,238 Suppl 1:S57-61.
[13]Moskowitz MA,Cutrer FM.SUMATRIPTAN:a receptor-targeted treatment for migraine[J].Annu Rev Med,1993,44:145-154.
[14]Melchart D,Linde K,Fischer P,et al.Acupuncture for recurrent headaches:a systematic review of randomized controlled trials[J].Cephalalgia,1999,19(9):779-786.
[15]von PS,Ting W,Scrivani S,et al.Survey on the use of complementary and alternative medicine among patients with headache syndromes[J].Cephalalgia,2002,22(5):395-400.
[16]刘璐,裴培,王麟鹏.针刺治疗实验性偏头痛模型大鼠机制的研究进展[J].中国针灸,2016,36(3):331-336.
[17]Bouchelet I,Case B,Olivier A,et al.No contractile effect for 5-HT1D and 5-HT1F receptor agonists in human and bovine cerebral arteries:similarity with human coronary artery[J].Br J Pharmacol,2000,129(3):501-508.
[18]Liu L,Pei P,Zhao LP,et al.Electroacupuncture Pretreatment at GB20 Exerts Antinociceptive Effects via Peripheral and Central Serotonin Mechanism in Conscious Migraine Rats[J].Evid Based Complement Alternat Med,2016,2016:1846296.
[19]Ramírez RMB,Labruijere S,Villalón CM,et al.Activation of 5-hydroxytryptamine1B/1D/1F receptors as a mechanism of action of antimigraine drugs[J].Expert Opin Pharmacother,2013,14(12):1599-1610.
[20]Dussor G.Serotonin,5HT1 agonists,and migraine:new data,but old questions still not answered[J].Curr Opin Support Palliat Care,2014,8(2):137-142.
RegulatingEffectof5-HT1BReceptorsinMigraineRatModelofElectricalStimulatingDuraMaterviaElectroacupuncture
Zhu Yupu, Pei Pei, Liu Lu, Zhao Luopeng, Qu Zhengyang, Wang Linpeng
(BeijingHospitalofTCM,Beijing100010,China)
Objective:To do research on the regulating effect of 5-HT1Breceptors in the migraine rat model of electrical stimulating dura mater via electroacupuncture.Methods40 male SD rats were divide into 5 groups, 8 for each group.Except control group, the electrical stimulation of the dura surrounding the superior sagittal sinus was carried out at the 1st, 3rd and 5th day.The control group
electrode implantation surgery only.At the 2nd, 4th and 6th day, single acupoint group and double acupoint group were received electroacupuncture as treatment.Sham acupuncture group received acupuncture at a non-acupuncture point following dural stimulation.The facial mechanical withdrawal threshold was taken at the 2nd, 4th and 6th day following dural stimulation.Eight rats from each group were decapitated, and the TG and TNC were removed and detected 5-HT1Breceptor mRNA expression by real-time quantitative PCR.5-HT1Breceptor protein was evaluated by western blot.ResultsCompared with the control group, the mechanical withdrawal threshold of model group was declined significantly (P<0.05).Compared with the model group, the mechanical withdrawal threshold of single acupoint group and double acupoint group was declined significantly (P<0.05).Compared with the model group, 5-HT1Breceptor mRNA and protein in TNC and TG tissue of rats in single control group was declined significantly (P<0.05).Compared with the model group, 5-HT1Breceptor mRNA and protein in TNC and TG tissue of rats in single acupoint group and double acupoint group was increased significantly (P<0.05).ConclusionThe electroacupuncture could significantly improve the damage of rat dura mater of superior sagittal sinus in following electrical stimulation by releasing neurotransmitter, which may be the mechanisms of migraine treatment.
Electroacupuncture; Migraine; Dura mater; 5-HT1Breceptor
R245
A
10.3969/j.issn.1673-7202.2017.12.050
国家重点基础研究发展计划(973计划)项目(2014CB543203);北京市医院管理局临床医学发展专项经费资助项目(ZYLX201412);北京市自然科学基金资助项目(7154205)
朱玉璞(1992.06—),男,北京中医药大学2015级在读硕士研究生,研究方向:电针治疗偏头痛的临床及机理研究,E-mail:zyp1992@bucm.edu.cn
王麟鹏(1955.05—),男,本科,主任医师,教授,博士研究生导师,研究方向:中风及痛症的临床与机理研究,E-mail:wlp5558@sina.com
(2016-07-07收稿 责任编辑:杨觉雄)

