Hedgehog/Gli和PI3K/AKT信号通路的串话促进胃癌AZ521细胞上皮—间质转化
王雷,杜媛鲲,米源,廖海江,陈阁,张耀中,刘庆熠
(河北医科大学 1. 第四医院胸二科,石家庄 050011; 2. 期刊社,石家庄 050017)
我国每年新发生胃癌近50万例,占全球近半 数,并以每年1.6%的速度上升[1]。患者就诊时多属于进展期,即使采取手术为主、放化疗为辅的综合治疗,总体治愈率仍徘徊于20%~30%。Hedgehog/Gli信号通路在肺腺癌[2]、口腔鳞癌[3]、乳腺癌[4]和肝癌[5]等多种肿瘤中异常活化,与肿瘤的发生、发展及侵袭、转移密切相关,经典的刺猬因子 (Hedgehog,Hh) 信号转导通路是Hh配体与12跨膜受体蛋白(patched,PTCH) 受体结合,激活第2个跨膜蛋白7跨膜信号转导蛋白 (smoothened,SMO) ,活化的SMO进入细胞核内,激活下游核转录因子Gli,活化的Gli1和Gli2激发包括Wnt、CyclinD1等多种靶基因的表达,调控细胞的增殖、分化与凋亡[6]。既往抗肿瘤研究多针对通路上游SMO靶点,但近年来发现Gli在癌症发生、发展中的作用比SMO更重要[7]。
磷脂酰肌醇-3激酶 (phosphatidvlinositol-3-kinases,PI3K) 是一类特异的催化磷脂酰肌醇脂物质的激酶。蛋白激酶B (protein kinase B,AKT) 是PI3K/AKT信号转导通路的核心,作为PI3K下游的靶蛋白,与肿瘤发生、发展和转移关系密切[8-9]。促进转移的机制包括影响细胞外基质,降低细胞间黏附力,增加肿瘤细胞的运动能力等。近年的研究[10-12]发现,Hh信号通路可与PI3K/AKT信号通路通过交叉调控现象促进肿瘤进展,然而胃癌组织中Hh/Gli信号通路是否通过PI3K/AKT信号通路发挥促进转移作用尚缺乏直接证据。本研究拟探讨人胃癌细胞系AZ521中Gli表达和PI3K/AKT通路的关系,旨在进一步明确肿瘤的转移机制,以期为胃癌的靶向治疗提供新方法。
1 材料与方法
1.1 材料
1.1.1 细胞与试剂:人胃癌细胞系AZ521( 英国Sigma-Aldrich公司) ,胰酶和胎牛血清( 美国Gemini公司) ,总RNA提取试剂盒( 德国 Qiagen公司) ,cDNA合成试剂盒、Pierce-BCA蛋白分析试剂盒、Mini-PROTEAN TGX 预制胶、Tris/甘氨酸/电泳缓冲液( 美国伯乐公司) ,Ham和RPMI1640细胞培养液(美国Gibco公司) ,Taqman基因表达预混液( 美国应用生物系统公司) ,Gli1引物及探针( Hs00171790)、E-cadherin( CDH1) 引物及探针( Hs00958111_m1)、N-cadherin( CDH2) 引物及探针( Hs00983056_m1)、Gli2引物及探针( Hs01119974_m1)、内参GAPDH引物及探针( Hs02758991_g1) ( 美国生命技术公司) ,蛋白酶抑制剂( 德国罗氏公司) ,M-PER培养细胞总蛋白提取试剂、ECL试剂( 美国赛默飞公司) ,Gli1兔抗人多克隆抗体( ab49314) 和E-cadherin鼠抗人单克隆抗体( ab1416) ( 美国Abcam公司) ,AKT兔抗人单克隆抗体 (#9272)、p-AKT兔抗人单克隆抗体(Ser473, #4060) (美国 cell signaling公司) , Gli2鼠抗人单克隆抗体 (sc-271786)、N-cadherin 兔抗人单克隆抗体 (sc-7939)、GAPDH鼠抗人单克隆抗体 (sc32233)(美国Santa Cruz公司) ,matrigel基质胶 (美国BD公司) ,GANT61 (美国Selleckchem公司) ,N-Shh蛋白(美国EBioscience公司) 。
1.1.2 主要仪器:NanoDrop 8000全光谱紫外-可见光分光光度计 (美国赛默飞公司) ,小型 Trans-Blot®转印槽 (美国伯乐公司) ,ABI Prism 7900HT型荧光定量PCR仪 (美国应用生物系统公司) ,ELX800多功能酶标仪 (美国伯腾仪器有限公司)
1.2 方法
1.2.1 细胞培养及分组:AZ521细胞均培养于伊格尔氏最低限度必需介质培养基 (EMEM) ,其中含10%胎牛血清和100 mg/mL青-链霉素,37 ℃、5%CO2培养箱中孵育。将细胞分为4组,即DMSO组 (1%DMSO处理细胞24 h)、GANT61组 (10 μ mol/L GANT61处理细胞24 h)、N-Shh蛋白组 (0.5 mg/mL N-Shh处理细胞24 h)以及GANT61&N-Shh组 (10 μ mol/L GANT61处理细胞30 min后,0.5 mg/mL N-Shh处理细胞24 h) 。
1.2.2 实时荧光定量PCR:用0.25%胰酶消化培养瓶中生长状态良好的的细胞,离心和细胞计数后按0.1×106/孔铺于12孔板,待第2天细胞培养至70%~80%融合时,更换无血清培养基。按照试剂盒说明书提取各组细胞总RNA,经NanoDrop 8000全光谱紫外-可见光分光光度计检测浓度后,行cDNA反转录 (反应条件:25 ℃ 5 min,42 ℃ 30 min,85 ℃ 5 min) ,并用无RNase水稀释10倍。将反应体系 (cDNA 4.5 μ L,Gli1、Gli2、E-cadherin、N-cadherin和GAPDH各 自 的引物和探针0.5 μ L,Taqman基因表达预混液5 μ L) 混匀后,按10 μ L/孔加样于384孔板上,行PCR (反应条件:95 ℃ 10 s;60 ℃ 10 s;72 ℃ 10 s,共40 个循环) 。采用2-ΔΔCt法进行数据分析。
1.2.3 Western blotting:常规提取各组细胞总蛋白,用BCA法测定每组样本的总蛋白浓度。在Mini-PROTEAN TGX 预制胶中上样 (10 μ g蛋白/道) ,行SDS电泳 (200 V,40 min) 。冰水浴转移至PVDF膜 (100V,40 min) 。5% 脱脂奶粉/TBST液封膜1 h,分别加入一抗 (Gli11∶1 000稀释,Gli2 1∶250稀释,E-cadherin 1∶10 000稀释,N-cadherin 1∶250稀释、AKT 1∶1 000稀释,p-AKT 1∶1 000稀释,GAPDH 1∶ 20 000稀释) ,4 ℃过夜。次日更换二抗前后各用TBST洗膜3次,每次10 min,分别加入二抗 (羊抗兔或羊抗鼠均为1∶10 000稀释) ,室温孵育1 h。ECL显色5 min,X线曝光显影,用Image软件进行分析,实验重复3次。
1.2.4 transwell侵袭实验:将matrigel基质胶用细胞培养基稀释 (1∶4) 后铺于小室的聚碳酸酯膜表面,置于细胞培养箱固化。收集各组细胞并用无血清培养液制成单细胞悬液。分别将细胞悬液100 μ L(7.5×104个细胞) 和含10%血清培养液500 μ L加入上室和下室。于细胞培养箱中培养24 h后,将聚碳酸酯膜上的细胞固定、染色,倒置显微镜下随机选取4个视野 (×400) ,计数每组穿膜细胞数,取平均值。实验重复3次。
1.3 统计学分析
采用SPSS 19.0统计软件进行统计学处理。计量资料用x-±s表示,采用单因素方差分析进行数据分析,2组之间比较采用LSD方法。检验标准α= 0.05。
2 结果
2.1 实时PCR结果
实时PCR结果示:各组Gli1、Gli2、E-cadherin和N-cadherinmRNA表达水平有统计学差异 (均P<0.001) 。与DMSO组相比,GANT61组和GANT61&NShh组Gli1、Gli2、N-cadherinmRNA表达水平均降低,E-cadherinmRNA表达水平升高,差异有统计学意义(均P< 0.001) ;N-Shh组Gli1、Gli2、N-cadherinmRNA表达水平均升高,E-cadherinmRNA表达水平降低,差异有统计学意义 (均P< 0.001) 。GANT61&NShh组Gli1、Gli2和N-cadherinmRNA表达水平高于GANT61组 (P< 0.001,P< 0.001,P= 0.046) ;E-cadherinmRNA表达水平低于GANT61组 (P< 0.001) ,差异有统计学意义。见表1,图1。
2.2 Western blotting结果
Western blotting结果表明,各组Gli1、Gli2、p-AKT、E-cadherin、N-cadherin蛋白表达水平有统计学差异(均P< 0.001) ,AKT蛋白表达水平无统计学差异 (F=2.839,P= 0.106) ,见表2。与DMSO组相比,GANT61组和N-Shh处理组Gli1、 Gli2、 p-AKT和N-cadherin蛋白表达水平均显著降低 (均P< 0.001) ,E-cadherin蛋白表达水平升高 (均P< 0.001) ,差异有统计学意义;与DMSO对照组相比,GANT61&N-Shh组Gli1、Gli2、p-AKT和N-cadherin蛋白表达水平部分上调 (均P< 0.001) ,E-cadherin蛋白表达水平部分下调 (P=0.007) ,差异有统计学意义。GANT61&N-Shh组Gli1(P< 0.001)、 Gli2 (P< 0.001)、 p-AKT (P< 0.001) 和N-cadherin (P= 0.022) 蛋白表达水平高于GANT61组,E-cadherin蛋白表达水平低于GANT61组 (P<0.001) ,差异有统计学意义。见表2,图2。
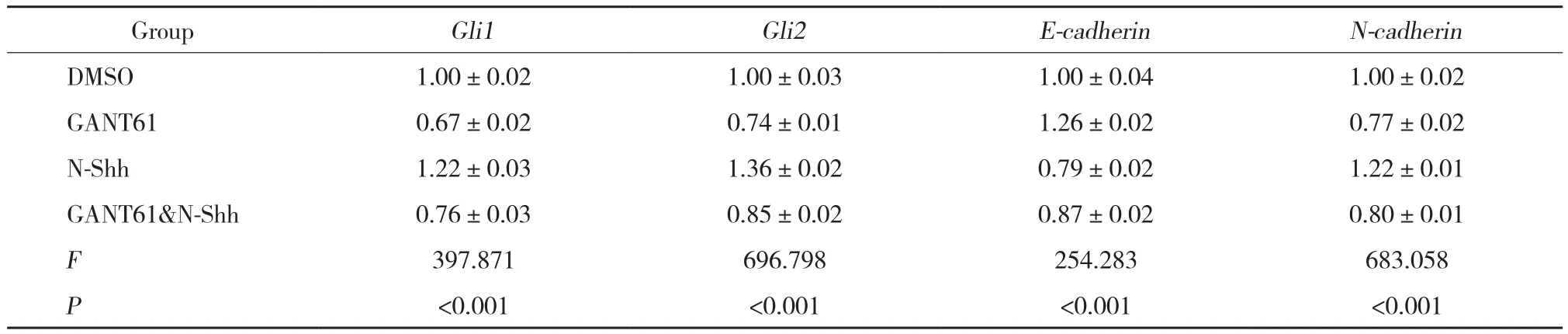
表1 实时PCR结果Tab.1 Results of real-time fluorescence quantitative PCR

图1 实时PCR结果Fig. 1 Real-time quantitative PCR results
2.3 transwell侵袭实验结果
transwell侵袭实验结果显示,各组穿膜细胞数差异有统计学意义 (F= 781.208,P< 0.001) 。与DMSO组 (137±2.52) 比较,GANT61组、GANT61&NShh组穿膜细胞数明显减少 (58±2.00,72±4.00,均P< 0.001) ,N-Shh组 穿 膜 细 胞 数 明 显 增 多(168±4.04,P< 0.001) 。GANT61&N-Shh组 穿 膜 细胞数较GANT61组穿膜细胞数增多 (P< 0.001) 。见图3。
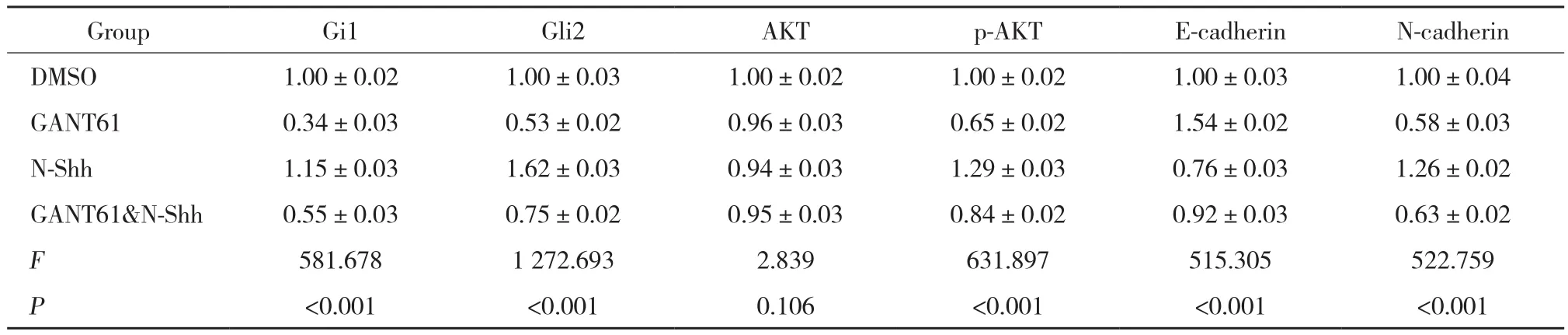
表2 各组Gli1、Gli2、p-AKT、E-cadherin、N-cadherin、AKT蛋白表达Western blotting结果Tab.2 Western blotting results of Gli1,Gli2,p-AKT,E-cadherin,N-cadherin,and AKT protein expression in gastric cancer AZ521 cells of each group
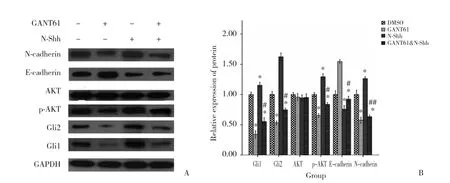
图2 AZ521中Gli1、Gli2 、p-AKT、AKT、E-cadherin和N-cadherin蛋白表达Western blotting检测结果Fig.2 Western blotting analysis of Gli1,Gli2,p-AKT,AKT,E-cadherin and N-cadherin protein expression in AZ521 cells
3 讨论
在肿瘤细胞中寻找特异性更强和灵敏度更高的标记物及靶标已成为目前抗肿瘤治疗的重要策略,研究表明Shh和Gli是Hh信号转导通路的关键因子,分别位于通路上下游的枢纽位置,两者表达水平的上调代表Hh信号通路的激活。近年来,研究[13-14]发现Gli作为核转录因子处于下游的核心位置,可调节多种靶基因的表达,从而影响肿瘤细胞的增殖、凋亡及侵袭转移,针对Gli靶点进行调控比抑制Hh上游SMO具有更高效的抗肿瘤作用,被认为是更有前途的治疗策略。
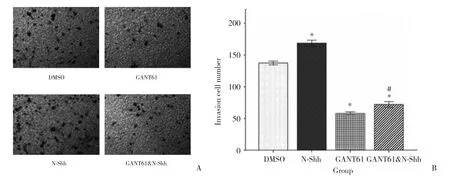
图3 Transwell侵袭实验检测各组AZ521细胞侵袭能力Fig.3 Transwell invasion assay to detect the invasive ability of each group of AZ521 cells
PI3K/Akt通路是细胞中最重要的细胞级联信号通路之一,主要参与调控细胞的增殖分化、凋亡和转移等过程,其通路中人第10号染色体磷酸酶 缺失、AKT及下游mTOR等磷酸化预示着肿瘤患者的预后较差,抑制PI3K通路可以降低肿瘤细胞的侵袭能力[15-17]。上皮-间质转化 (epithelial-mesenchymal transition,EMT) 是肿瘤细胞浸润和转移的重要机制之一。N-cadherin是间质细胞的重要标记之一,在多种上皮细胞来源的肿瘤中,N-cadherin高表达是EMT的重要特征,可以作为判断预后的指标,其高表达患者预后差,基因沉默N-cadherin可以抑制肿瘤细胞的增殖和转移[18-19]。E-cadherin属于Ⅰ型钙黏着蛋白,其表达缺失可导致细胞间黏附力下降,促进肿瘤细胞侵袭,与多种上皮恶性肿瘤的侵袭转移和预后存在密切关系[20-21]。ISLAM等[22]研究发现下调Shh/Gli信号通路可以下调EMT进程,从而抑制肿瘤细胞的增殖和转移。因此,本研究选取Gli1和Gli2的特异性抑制剂GANT61对胃癌细胞进行研究,初步探讨Gli是否通过激活PI3K通路影响胃癌细胞EMT进程、导致肿瘤细胞侵袭转移,并探讨其机制。
GANT61作为Gli1和Gli2的靶向抑制剂,可以通过调控细胞增殖、抑制EMT等过程,发挥良好的抗肿瘤效果[23-24]。本研究参考LIN等[25]应用GANT61抗髓母细胞瘤细胞的实验方法,采用GANT61处理AZ521细胞24 h并观察抗肿瘤效果,结果显示,GANT61可明显下调AZ521细胞Gli1、Gli2和N-cadherin基因表达以及Gli1、Gli2、p-AKT和N-cadherin蛋白表达,上调E-cadherin基因和蛋白表达,而AKT蛋白表达没有显著变化;采用N-Shh刺激Hh/Gli通路,可显著上调胃癌细胞的Gli1、Gli2和N-cadherin基因和蛋白表达和p-AKT蛋白表达,下调E-cadherin基因和蛋白表达。为了能更好地理解Gli和PI3K通路的关系,本研究进行了救援实验,即先应用GANT61抑制Hh/Gli通路后再应用N-Shh活化Hh/Gli通路,结果发现N-Shh可以部分恢复Gli1、Gli2 、p-AKT和N-cadherin蛋白表达。侵袭实验结果也进一步证实了抑制Gli的表达可以抑制胃癌细胞的侵袭,而刺激Shh/Gli通路可以明显促进肿瘤细胞侵袭转移。分析其原因可能是在胃癌AZ521细胞中存在Shh/Gli通路和PI3K/AKT通路同时激活,并且两者之间存在“串话”关系,PI3K/AKT信号通路在Shh信号通路调控胃癌细胞EMT的过程中可能发挥着重要作用,Gli通过活化p-AKT进而上调N-cadherin和下调E-cadherin的表达促进胃癌细胞发生EMT。
综上所述,胃癌的EMT进程与肿瘤微环境、转录因子以及多条信号转导通路之间密切相关,而这些通路之间的相互作用关系尚未完全阐明。本研究结果表明胃癌细胞中核转录因子Gli的异常活化和PI3K/AKT信号通路的表达之间存在密切联系,这种细胞信号通路之间的“串话”联系对于胃癌的发生发展和转移可能是一个关键机制。
[1] JEMAL A,BRAy F,CENTER MM,et al. Global cancer statistics [J].CA Cancer J Clin,2011,61 (2) :69-90. DOI:10.3322/caac.20107.
[2] LI H,yUE D,JIN JQ,et al. Gli promotes epithelial-mesenchymal transition in human lung adenocarcinomas [J]. Oncotarget,2016,7(49) :80415-80425. DOI:10.18632/oncotarget.11246.
[3] SHIMO T,MATSUMOTO K,TAKABATAKE K,et al. The role of sonic hedgehog signaling in osteoclastogenesis and jaw bone destruction [J]. PLoS One,2016,11 (3) :e0151731. DOI:10.1371/journal.pone.0151731.
[4] SONG L,WANG W,LIU D,et al. Targeting of sonic hedgehog-Gli signaling:a potential therapeutic target for patients with breast cancer [J]. Oncol Lett,2016,12 (2) :1027-1033. DOI:10.3892/ol.2016.4722.
[5] yAN Z,XU L,ZHANG J,et al. Aldehyde dehydrogenase 1A1 stabilizes transcription factorGli2and enhances the activity of Hedgehog signaling in hepatocellular cancer [J]. Biochem Biophys Res Commun,2016,471 (4) :466-473. DOI:10.1016/j.bbrc.2016.02.052.
[6] TAIPALE J,BEACHy PA. The Hedgehog and Wnt signalling pathways in cancer [J]. Nature,2001,411 (6835) :349-354.
[7] STECCA B,RUIZ IAA. Context-dependent regulation of the GLI code in cancer by HEDGEHOG and non-HEDGEHOG signals [J]. J Mol Cell Biol,2010,2 (2) :84-95. DOI:10.1093/jmcb/mjp052.
[8] AASRUM M,TJOMSLAND V,THORESENJ GH,et al. PI3K is required for both basal and LPA-induced DNA synthesis in oral carcinoma cells [J]. J Oral Pathol Med,2016,45 (6) :425-432. DOI:10.1111/jop.12384.
[9] FRASSON C,RAMPAZZO E,ACCORDI B,et al. Inhibition of PI3K signalling selectively affects medulloblastoma cancer stem cells [J].Biomed Res Int,2015,2015:973912. DOI:10.1155/2015/973912.
[10] ABERGER F,KERN D,GRIL R,et al. Canonical and noncanonical Hedgehog/GLI signaling in hematological malignancies [J].Vitam Horm,2012,88:25-54. DOI:10.1016/B978-0-12-394622-5.00002-X.
[11] DORMORy V,DANILIN S,LINDNER V,et al. The sonic hedgehog signaling pathway is reactivated in human renal cell carcinoma and plays orchestral role in tumor growth [J]. Mol Cancer,2009,8:123.DOI:10.1186/1476-4598-8-123.
[12] KERN D,REGL G,HOFBAUER SW,et al. Hedgehog/GLI and PI3K signaling in the initiation and maintenance of chronic lymphocytic leukemia [J]. Oncogene,2015,34 (42) :5341-5351. DOI:10.1038/onc.2014.450.
[13] GONNISSEN A,ISEBAEERT S,HAUSTERTERMANS K. Targeting the Hedgehog signaling pathway in cancer:beyond smoothened [J].Oncotarget,2015,6 (16) :13899-13913. DOI:10.18632/oncotarget.4224.
[14] ZHOU J,ZHU G,HUANG J,et al. Non-canonicalGLI1/2 activation by PI3K/AKT signaling in renal cell carcinoma:a novel potential therapeutic target [J]. Cancer Lett,2016,370 (2) :313-323. DOI:10.1016/j.canlet.2015.11.006.
[15] MAJUMDER PK,SELLERS WR. Akt-regulated pathways in prostate cancer [J]. Oncogene,2005,24 (50) :7465-7474. DOI:10.1038/sj.onc.1209096.
[16] AMIN H,WANI NA,FAROOQ S,et al. Inhibition of invasion in pancreatic cancer cells by conjugate of EPA with beta (3,3) -Pip-OH via PI3K/Akt/NF-kB pathway [J]. ACS Med Chem Lett,2015,6 (10) :1071-1074. DOI:10.1021/acsmedchemlett.5b00257.
[17] ABRAHAM J. PI3K/AKT/mTOR pathway inhibitors:the ideal combination partners for breast cancer therapies? [J]. Expert Rev Anticancer Ther,2015,15 (1) :51-68. DOI:10.1586/14737140.2015.961429.
[18] SUNG WJ,PARK KS,KWAK SG,et al. Epithelial-mesenchymal transition in patients of pulmonary adenocarcinoma:correlation with cancer stem cell markers and prognosis [J]. Int J Clin Exp Pathol,2015,8 (8) :8997-9009.
[19] yAN X,yAN L,LIU S,et al.N-cadherin,a novel prognostic biomarker,drives malignant progression of colorectal cancer [J]. Mol Med Rep,2015,12 (2) :2999-3006. DOI:10.3892/mmr.2015.3687.
[20] ATTRAMADAL CG,KUMAR S,BOySEN ME,et al. Tumor budding,emt and cancer stem cells in T1-2/N0 oral squamous cell carcinomas [J]. Anticancer Res,2015,35 (11) :6111-6120.
[21] PATIL PU,D’AMBROSIO J,INGE LJ,et al. Carcinoma cells induce lumen filling and EMT in epithelial cells through solubleE-cadherin-mediated activation of EGFR [J]. J Cell Sci,2015,128 (23) :4366-4379. DOI:10.1242/jcs.173518.
[22] ISLAM SS,MOKHTARI RB,NOMAN AS,et al. Sonic hedgehog(Shh) signaling promotes tumorigenicity and stemness via activation of epithelial-to-mesenchymal transition (EMT) in bladder cancer [J].Mol Carcinog,2016,55 (5) :537-551. DOI:10.1002/mc.22300.
[23] FU J,RODOVA M,ROy SK,et al. GANT-61 inhibits pancreatic cancer stem cell growth in vitro and in NOD/SCID/IL2R gamma null mice xenograft [J]. Cancer Lett,2013,330 (1) :22-32. DOI:10.1016/j.canlet.2012.11.018.
[24] SRIVASTAVA RK,KAyLANI SZ,EDRESS N,et al. GLI inhibitor GANT-61 diminishes embryonal and alveolar rhabdomyosarcoma growth by inhibiting Shh/AKT-mTOR axis [J]. Oncotarget,2014,5(23) :12151-12165. DOI:10.18632/oncotarget.2569.
[25] LIN Z,LI S,SHENG H,et al. Suppression of GLI sensitizes medulloblastoma cells to mitochondria-mediated apoptosis [J]. J Cancer Res Clin Oncol,2016,142 (12) :2469-2478. DOI:10.1007/s00432-016-2241-1.

