鲤鱼鱼鳞中甲壳素的提取
高倩倩
(吉林农业科技学院食品工程学院,吉林吉林132101)
甲壳素(Chitin)是一种天然高分子聚合物,它是属于直链的氨基多糖[1],别名为甲壳质或几丁质等。通常采用β-1,4糖苷键形式连接,也称为N-乙酰-葡萄糖胺的聚糖[2]。这种高分子聚合物不溶于水、稀酸、稀碱、浓碱,也不溶于一般的有机溶剂,可溶于浓HCl、H2SO4、H3PO4和无水HCOOH,主链易发生降解。甲壳素在食品、医药科学、材料、农业、微生物学、免疫学等方面应用广泛[3],具有提高人体免疫力、抗癌抑制癌、癌细胞转移等作用,另外,对于高血压、糖尿病、肝肾病、肥胖等症状也特别适用。
天然多糖的种类繁多,既可以显酸性也可以显碱性,其中一种多糖─壳聚糖,化学名称为:聚葡萄糖胺(1,4)-2-氨基-B-D,显碱性的,所以称之为碱性多糖,壳聚糖是由甲壳素脱乙酰基后得来的产物[4],主要包括糖类、维生素、脂肪、蛋白质和无机盐[5]。具有降血脂、降血糖、降血压等多种保健功效。
鲤鱼是一种淡水鱼,种类多、量产高、分布广,养殖历史悠久。副产物鱼鳞通常被废弃掉,不但浪费资源,也会污染环境[6-7]。鱼鳞中含有蛋白质及多种维生素和脂肪,也含有钙、铁、锌等微量元素,以及丰富的甲壳素和多种不饱和脂肪酸[8],对于减少胆固醇在血管壁上的累积有一定的作用,因此,在预防高血压、心脏病及动脉硬化等疾病方面有一定功效[9]。目前,工业化生产中,对于甲壳素/壳聚糖的提取,主要集中在虾蟹等原料上[10-12],如从小龙虾中提取甲壳素和壳聚糖,但是从鲤鱼鱼鳞中提取甲壳素/壳聚糖研究很少,至今未见报道。本试验以常见的鲤鱼鱼鳞为主要原料,采用酸碱法提取甲壳素,再脱乙酰基制备壳聚糖,通过不同的单因素确定甲壳素的最佳提取工艺,扩展了甲壳素和壳聚糖的来源,为全方位利用副产物鲤鱼鱼鳞提供重要参考依据。
1 材料与方法
1.1 试验材料
鲤鱼鱼鳞:吉林市西安路创业大市场;浓HCl、NaOH、KMnO4、草酸、乙醇(95%):文理学院化学实验室提供。
1.2 试验仪器
101A-2E型数显式电热恒温水浴锅:上海实验仪器厂有限公司;SX-2-4-10型箱式电阻炉:上海均珂仪器科技有限公司;ZHT型自动恒温电热套:常州金南仪器制造有限公司;DHG-9420A型电热恒温鼓风干燥箱:上海高致精密仪器有限公司;SHB-Ⅲ型循化水式多用真空泵:天津科诺仪器设备有限公司;FA1104N型电子天平:金诺天平仪器有限公司;PHB-4型酸度计:北京时代新维测控设备有限公司。
1.3 试验方法
1.3.1 甲壳素的提取
将鲤鱼鱼鳞反复冲洗,去除表面附着物,放入电热恒温鼓风干燥箱100℃烘干备用。
鱼鳞中的矿物质去除:将干鱼鳞在常温下分别与不同浓度的HCl溶液反应,用玻璃棒充分搅拌直至无气泡产生为止。倾去酸液,水洗至中性。
鱼鳞中的蛋白质去除:向平底烧瓶中加入不同浓度的NaOH溶液,水浴加热(T=70℃)。倾去碱液,静置冷却,水洗2次,酸度计调节溶液呈中性,抽滤,获得甲壳素粗品。
精制甲壳素:将KMnO4溶液加入到平底烧瓶中,用天平称取甲壳素粗品,每升KMnO4溶液(0.1 mol/L)中加入5 g粗品。浸泡1 h,漏斗过滤,洗涤,再向平底烧瓶中加入草酸溶液,每升草酸溶液中加入10 g粗品。将其置于水浴锅中加热(T=70℃),直到样品全部变为白色,静置,当烧瓶温度达到室温时,水洗至中性,将其置于恒温鼓风干燥箱中干燥(T=60℃,t=24 h),制得白色的甲壳素固体。
1.3.2 甲壳素提取条件的优化
设计单因素试验,分析各个因素:HCl、NaOH溶液浓度和处理时间对甲壳素提取率以及矿物质脱除率的影响。
1)HCl溶液浓度对提取率的影响:称取干鱼鳞5 g左右,分别取不同浓度(0.6、0.8、1.0、1.2、1.4 mol/L)的HCl溶液浸泡鱼鳞30 min,将HCl溶液倒掉,水洗至中性,烘干称重后放入平底烧瓶中,加入1.0 mol/L NaOH溶液,水浴加热(T=70℃,t=7 min),静置冷却,水洗至中性,加入 KMnO4溶液(5 g/L)浸泡 1 h,过滤,将样品水洗至瓶内水接近无色,再加入草酸溶液(10 g/L),水浴加热(T=70℃),使样品全部变为白色,静置冷却,置于恒温鼓风干燥箱中60℃干燥24 h,称重。计算此次操作中矿物质脱除率和甲壳素的提取率。
2)HCl溶液浸泡时间对提取率的影响:用1)中提取率最高的那组HCl溶液浓度(即1 mol/L)浸泡鲤鱼鱼鳞,分别在室温下浸泡 20、25、30、35、40 min,方法同上。
3)NaOH溶液浓度对提取率的影响:称取干鱼鳞5 g左右于烧杯中,用1 mol/L的HCl溶液浸泡去除矿物质,分别用 0.6、0.8、1.0、1.2、1.4 mol/L 的 NaOH 溶液在70℃水浴中处理蛋白质,静置,当烧瓶温度达到室温时,水洗至中性,其他方法同上。
4)NaOH溶液处理时间对提取率的影响:称取干鱼鳞5 g左右,1 mol/LHCl溶液浸泡,再用1 mol/L NaOH 在 70 ℃水浴中分别反应 6、7、8、9、10 min,静置,当烧瓶温度达到室温时,水洗至中性,方法同上,称重。计算此次操作中的甲壳素提取率。
1.3.3 甲壳素灰分的测定:参照文献[13]
①坩埚灼烧:取4支坩埚洗净,放入马弗炉(T=580℃)中灼烧0.5 h。断电冷却,T=250℃左右,用坩埚钳将坩埚取出,放入到干燥器(干燥剂为硅胶)中冷却0.5 h。②称样品(甲壳素)1 g~2 g左右。③样品的灼烧:将两支装有甲壳素的坩埚至于马弗炉内300℃灼烧1 h,使其完全炭化,再升高温度至580℃时加热1 h,冷却至250℃以下,再取出置于干燥器中,冷却1 h,用电子天平称重。根据公示计算灰分的含量。

式中:X为灰分含量,%;m1为坩埚与灰分的总质量,g;m2为坩埚的质量,g;m3为坩埚与样品的总质量,g。
1.3.4 甲壳素脂肪含量的测定:参照文献[14]
准确称取一定量的甲壳素样品置于索式提取器中,在圆底烧瓶中加入适量乙醇、人造沸石,安装索式抽提器。先通水后通电,将电热套调制200 V左右进行2 h的反应,蒸馏浓缩,回收乙醇,取样烘干并称重。根据公式计算脂肪的含量。(文献用乙醚,有毒)
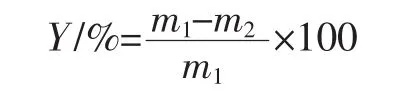
式中:Y为脂肪含量,%;m1为反应前甲壳素的质量,g;m2为反应后甲壳素的质量,g。
1.3.5 壳聚糖的制备
壳聚糖的制备参照乔德亮的方法并进行修改,具体过程如下:称取一定量按优化工艺提取的甲壳素,于烧杯中,加入1 mol/L NaOH溶液,水浴加热10 min,温度80℃[15],使甲壳素脱乙酰基,静止冷却至室温,将NaOH溶液倾倒掉,样品水洗至中性,用真空抽滤泵抽滤,烘干得到黄色的壳聚糖[16]。
2 结果与分析
2.1 提取甲壳素试验条件的优化分析
HCl溶液浓度对甲壳素提取率及矿物质脱除率的影响见图1。

图1 HCl溶液浓度对甲壳素提取率及矿物质脱除率的影响Fig.1 Effects of HCL concentration on chitin yield rate and mineral removal rate
由图1可知,在HCl溶液浓度增大的过程中,甲壳素的提取率出现了先升高后降低的现象,在1 mol/L处达到峰值。矿物质脱除率趋于稳定上升状态,增大HCl溶液的浓度有助于去除鲤鱼鱼鳞中的矿物质,但一直增大HCl溶液的浓度,甲壳素的提取率也随之下降,会破坏鲤鱼鱼鳞中甲壳素,因此单因素试验中1 mol/LHCl溶液浓度甲壳素提取率最高。
HCl溶液浸泡时间对甲壳素提取及矿物质脱除率的影响见图2。
由图2可知,随着HCl溶液处理鱼鳞时间增加,甲壳素的提取率先升高,在30 min处达到峰值,随后开始下降。矿物质脱除率趋于稳定上升状态,但在HCl溶液处理时间30 min处开始缓慢下降。由此而知HCl溶液处理时间增加有助于去除鲤鱼鱼鳞中的矿物质,但HCl溶液处理时间增加甲壳素的提取率也随之下降,会破坏鱼鳞中甲壳素,因此单因素试验中HCl溶液处理鲤鱼鱼鳞时间为30 min

图2 HCl溶液浸泡时间对甲壳素提取及矿物质脱除率的影响Fig.2 Effects of soaking time within HCL solution on chitin yield rate and mineral removal rate
NaOH溶液浓度对甲壳素提取率的影响见图3。

图3 NaOH溶液浓度对甲壳素提取率的影响Fig.3 Effects of NaOH concentration on chitin yield rate
由图3得知,NaOH浓度为0.6 mol/L~1.0 mol/L时,甲壳素的提取率逐渐上升,但是变化幅度不大。超过1 mol/L时,曲线变化幅度大,迅速降低。原因是鱼鳞中蛋白质等在NaOH溶液的作用下被分解。浓度越大,甲壳素也会被分解,由此可见,因此单因素试验中NaOH溶液浓度为1 mol/L时,甲壳素提取率最高。
NaOH溶液处理时间对甲壳素提取率的影响见图4。
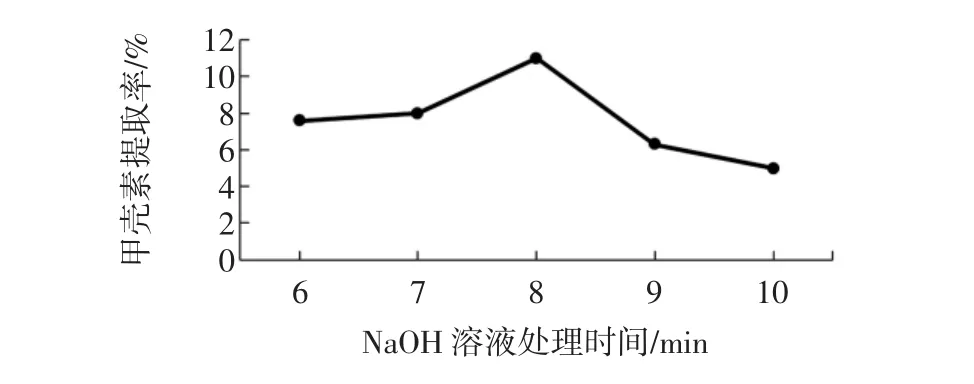
图4 NaOH溶液处理时间对甲壳素的影响Fig.4 Effects of processing time within NaOH solution on chitin
由图4可知,NaOH溶液处理时间在6 min~8 min时甲壳素提取率逐渐升高,但随着反应时间增加,曲线又有所下降,原因是鱼鳞中的蛋白质等被分解使其质量减少,甲壳素也会随着反应时间的增加而水解。所以单因素试验中鲤鱼鱼鳞在NaOH溶液中最佳处理时间为8 min,甲壳素提取率最高。
由上述4个图可知,鲤鱼鱼鳞中甲壳素的提取较佳工艺为用1 mol/L的HCl溶液在室温下浸泡30 min,1 mol/LNaOH溶液在70℃水浴中处理8 min,甲壳素提取率11.72%。
2.2 鲤鱼鱼鳞中甲壳素提取率的响应面试验优化分析
2.2.1 鲤鱼鱼鳞中甲壳素提取率的响应面试验结果
试验因素编码水平表见表1,响应面试验设计及结果见表2。

表1 响应面试验因素水平表Table 1 The response surface test factors level table

表2 响应面试验设计及结果Tabie 2 Design and results of the response test
利用Design Expert V 8.0.4响应面软件进行二次多元回归拟合,得出鲤鱼鱼鳞中甲壳素提取率对4个单因素的二次回归模型:
甲壳素提取率Y=+11.72+0.45A+0.63B+0.40C+0.29D-1.13AB-1.08AC-0.30AD-0.30BC-0.38BD-0.88CD-0.72A2-0.48B2-0.61C2-0.35D2
对甲壳素响应面设计模型进行响应面试验方差分析,分析结果见表3。
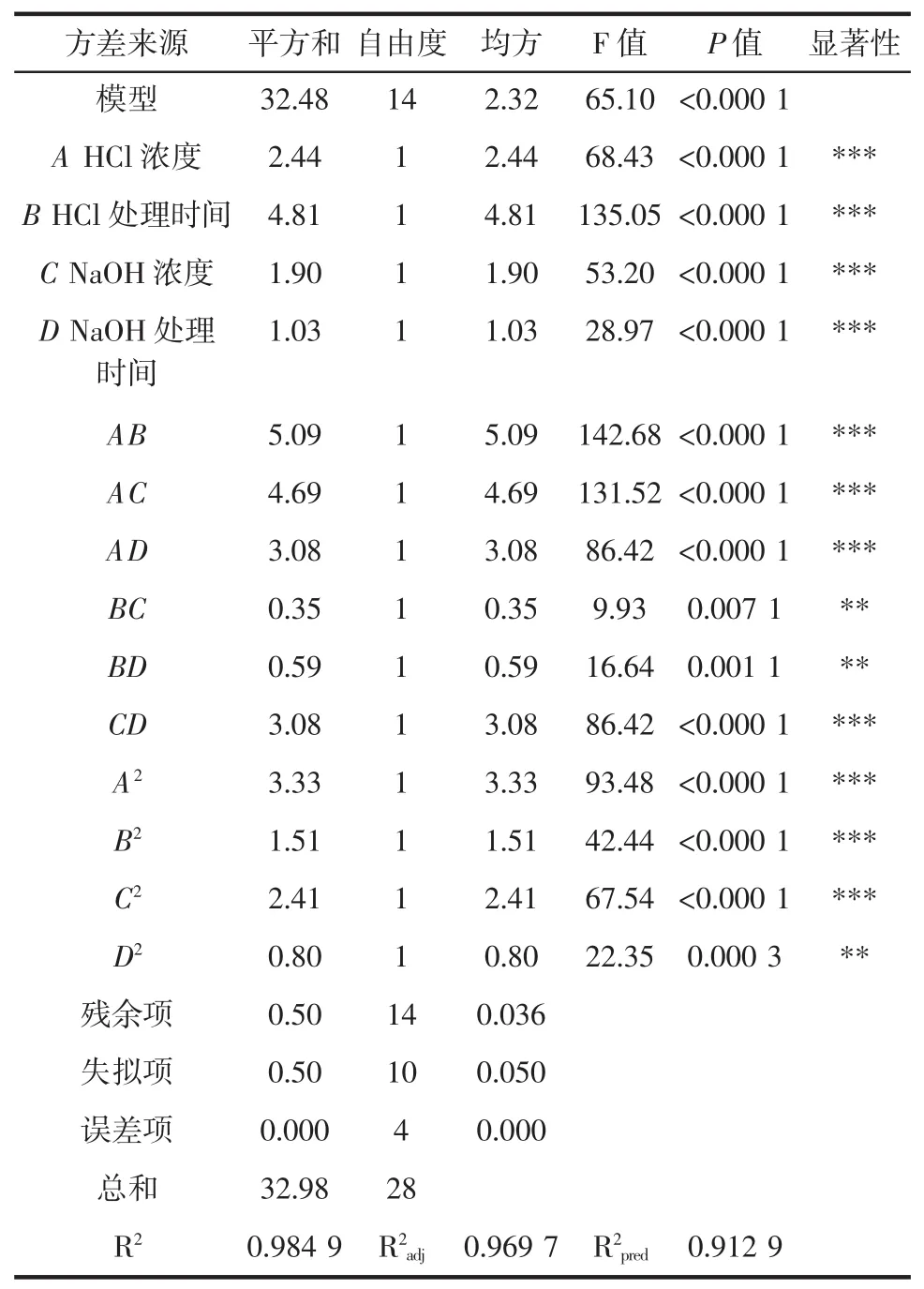
表3 响应面试验方差分析Table 3 Response surface analysis of variance
由表3可以看出,P<0.000 1,说明模型具有差异极显著水平,回归方程结果与试验结果比较吻合,误差项不明显,说明试验误差小。方差分析结果说明,回归模型中差异极显著项有 A、B、C、D、AB、AC、AD、CD、A2、B2、C2,差异高度显著项有 BC、BD、D2。模型的调整确定系数为98.49%,矫正决定系数为96.97%,修正决定系数为91.29%,R2adj与R2pred数值基本接近,说明响应值的变化有91%都可以通过该模型来解释,方程拟合程度较好。R2adj与R2pred的值是合理的。由P值和F值可以看出,鲤鱼鱼鳞中甲壳素提取率影响的4个因素顺序为:HCl溶液处理时间>HCl溶液浓度>NaOH溶液浓度>NaOH溶液处理时间。

图5 HCl溶液浓度与HCl溶液处理时间交互作用对甲壳素提取率的影响Fig.5 Effects of the interaction with HCL concentration and processing time within HCL solution on chitin yield rate

图7 HCl溶液浓度与NaOH溶液处理时间交互作用对甲壳素提取率的影响Fig.7 Effects of the interaction with HCL concentration and processing time within NaOH solution on chitin yield rate
2.2.2 响应面的曲面分析
响应面曲面分析见下图5至图10。
由图5至图10可以看出,HCl溶液处理时间对鲤鱼鱼鳞中甲壳素的提取率影响最为显著,曲线幅度变化最为明显;余下的3个因素,由于曲线相对平缓,且与响应面方差结论相一致。因此,可通过有形状的等高线来呈现其相互作用的强和弱。提取率变化明显的用椭圆来表示,变化不明显的用圆形来表示。从图6中可以看出HCl溶液浓度与NaOH溶液浓度交互作用显示椭圆形,交互作用显著。从图8中可以看出HCl溶液处理时间与NaOH溶液浓度交互作用显示为圆形,交互作用不显著。
根据响应面软件优化结果得出,鲤鱼鱼鳞最佳提取工艺条件为HCl溶液浓度1 mol/L,HCl溶液浸泡时间30 min,NaOH溶液浓度1 mol/L,NaOH溶液处理时间8 min,此时甲壳素提取率为11.72%。
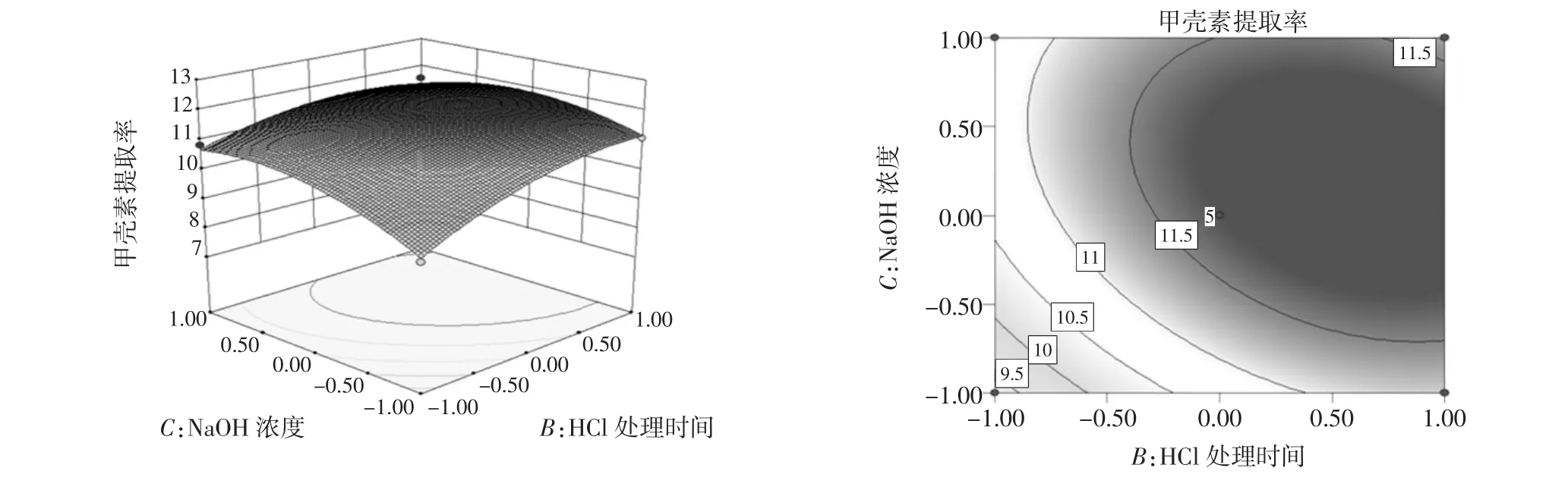
图8 HCl溶液处理时间与NaOH溶液浓度交互作用对甲壳素提取率的影响Fig.8 Effects of the interaction with processing time within HCL solution and NaOH concentration on chitin yield rate
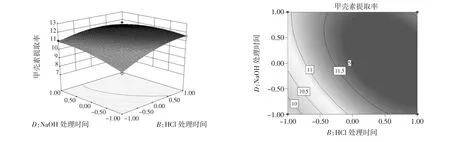
图9 HCl溶液处理时间与NaOH溶液处理时间交互作用对甲壳素提取率的影响Fig.9 Effects of the interaction with processing time within HCL solution and processing time within NaOH solution on chitin yield rate

图10 NaOH溶液浓度与NaOH溶液处理时间交互作用对甲壳素提取率的影响Fig.10 Effects of the interaction with NaOH concentration and processing time within NaOH solution on chitin yield rate
2.3 甲壳素灰分测定的结果
甲壳素灰分测定的结果见表4。
2.4 甲壳素脂肪含量测定的结果
甲壳素脂肪含量测定的结果见表5。

表4 灰分测定结果Table 4 Ash determination results
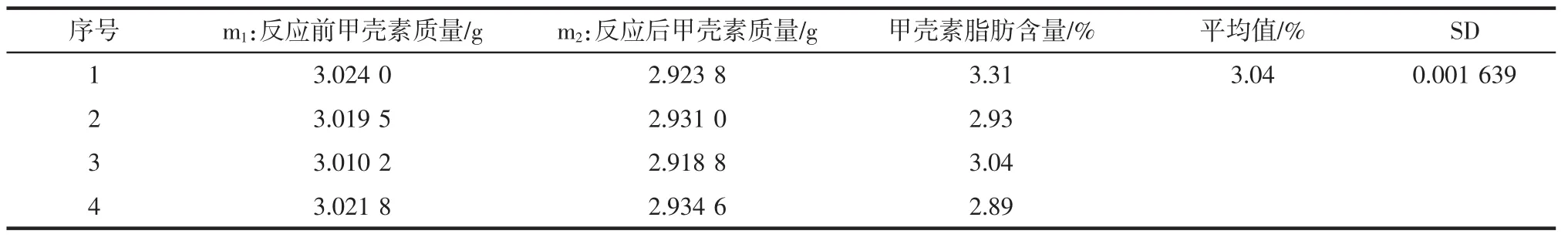
表5 脂肪含量测定结果Table 5 Fat content determination results
2.5 壳聚糖的制备结果
将壳聚糖从恒温鼓风干燥箱中取出,黄色,细丝状。
3 结论
本次试验以鲤鱼鱼鳞为主要原料提取甲壳素,通过不同的单因素试验来确定最佳工艺条件:HCl溶液浓度1 mol/L,HCl溶液浸泡时间30 min,NaOH溶液浓度1 mol/L,NaOH溶液处理时间8 min,提取率为11.72%,与文献[12]比较,甲壳素提取率基本相同,可以有效解决目前国内加工甲壳素存在的原料来源有限的问题,加大鲤鱼鱼鳞资源的有效利用。根据响应面方差分析和响应面软件优化结果得出影响提取率因素的大小:HCl溶液处理时间>HCl溶液浓度>NaOH溶液浓度>NaOH溶液处理时间。壳聚糖是由甲壳素在1 mol/L NaOH溶液中通过80℃水浴中加热10 min,制得的黄色丝状固体。
[1] 张文博,陈盛.甲壳素/壳聚糖的提取及其应用研究新进展[J].福建师大福清分校学报,2008(2):18-25
[2] 唐家林,吴成业,钟建业,等.甲壳素、壳聚糖生产工艺研究[J].福建水产,2010,6(2):38-42
[3] 唐振荣,谢志荣,宁方尧,等.甲壳素及其衍生物在食品工业清净的应用综述[J].轻工科技,2015,12(2):28-31
[4] 邓海萍,陈奇,李向红,等.不同电荷多糖添加物对鲢鱼鱼糜凝胶结构的影响[J].食品与机械,2014(3):39-41
[5] 王南平,何兰,曹俊,等.鱼鳞综合开发利用工艺与设备综述[J].渔业现代化,2014,2(9):421-430
[6] 苏广宇,刘四新,李从发.甲壳素/壳聚糖的研究与应用概况[J].广东农业科学,2008,5(8):78-83
[7] 李川,姚俊杰,姜海波,等.瓯江彩鲤鱼鳞的生化成分分析[J].西南农业学报,2010,23(4):1303-1307
[8] 顾杨娟,李杰,李富威,等.鱼鳞有效成分的研究进展[J].食品工业科技,2012(10):415-419
[9] 石维焕,许永安.鱼鳞利用的研究进展[J].渔业研究,2011,33(4):67-72
[10]张志红,张国华,王菊华,等.甲壳素及其衍生物在水产动物养殖上的应用现状[J].江西科学,2016,1(2):19-23
[11]王岸娜,王璋,许时婴.不同粒度甲壳素对所制备壳聚糖脱乙酰度和相对分子质量影响的研究[J].食品与机械,2007,23(3):28-31
[12]蔚鑫鑫,刘艳,吴光旭.小龙虾壳中甲壳素的提取及壳聚糖的制备[J].湖北农业科学.2013,52(13):3120-3123
[13]肖冰梅,刘义芳,刘彩虹,等.不同产地夏枯草果穗水分、灰分含量测定[J].中国民族民间医药,2015,24(4):26-27
[14]赵亮,柴平海.鱼肉制品中脂肪的测定[J].安徽农业科学,2015(20):285-287
[15]乔德亮.低聚糖的制备及其在功能食品中的应用[J].食品工业科技,2007,4(5):21-23
[16]廖戎.甲壳素制备壳聚糖脱乙酰度可控性的研究[J].四川化工,2007,10(2):14-17

