肥胖伴高脂血症患者血清食欲素A变化及其与胰岛素抵抗相关性研究
周 菁 钱玲华 胡碧群
肥胖和高脂血症作为代谢综合征(metabolic syndrome,MS)的重要组分,对心脑血管的潜在危害已成为全球性的公共卫生问题。研究[1]发现,超过70%的肥胖症患者存在高脂血症。目前公认胰岛素抵抗(insulin resistance,IR)及继发的高胰岛素血症是肥胖和高脂血症发生发展的重要病理基础[1-3]。食欲素A(orexin A)是由下丘脑合成和分泌的一种具有促进摄食作用的小分子神经多肽,近年研究[4-5]发现,orexin A与IR关系密切。本研究通过检测肥胖合并高脂血症患者血清orexin A水平,分析其与IR的关系,以期为肥胖和高脂血症的防治提供新途径和新靶点。
1 资料和方法
1.1 临床资料 选择2016年2月—2017年1月本院门诊或住院的肥胖伴高脂血症患者96例,其中男52例,女 44例,平均年龄(52.32±7.28)岁。纳入标准:(1)均符合中华医学会内分泌学分会肥胖学组制定的《中国成人肥胖症防治专家共识》中肥胖的诊断标准[6]:体质指数(BMI)≥28kg/m2,腰围男性>90cm,女性>85cm。(2)符合中国成人血脂异常防治指南修订联合委员会制定的《中国成人血脂异常防治指南(2016年修订版)》中血脂异常的诊断标准[7]:空腹血浆总胆固醇(TC)≥5.2mmol/L和(或)甘油三酯(TG)≥1.7mmol/L和(或)低密度脂蛋白(LDL-C)≥3.4mmol/L和(或)高密度脂蛋白(HDL-C)≤1.0mmol/L。(3)年龄 18~75 岁。(4)就诊前 2 个月未用胰岛素增敏剂、调脂药。(5)排除糖尿病、肝脏疾病、甲状腺功能异常、肿瘤等引起的继发性血脂异常及垂体瘤、库欣综合征引起的继发性肥胖者、年龄<18岁或>75岁者、妊娠哺乳期妇女。(6)患者或家属签署知情同意书。选取同期本院健康体检者78名作为对照组,均来源于门诊体检人员,年龄20~75岁,其中男43名,女 35 名,平均(49.50±9.25)岁,均无糖尿病、肥胖、高血压及高脂血症病史。观察组与对照组在年龄及性别构成比上差异无统计学意义(P>0.05);本研究经本院伦理委员会批准同意。
1.2 方 法 所有入组受试者均禁食10h以上,于次日清晨8:00—10:00空腹抽取肘静脉血8mL,置于EP管室温下放置1h后,4℃ 4000r/min离心10min,去上清液后取血清置-70℃冰箱保存待用,用于相关指标测定。
1.3 观察指标
1.3.1 体质指数(body mass index,BMI)及腰臀比(waist-to-hip ratio,WHR) 由经过培训的人员测量受试者身高、体质量、腰围、臀围以减少试验误差。腰围按照WHO推荐的肋骨下缘与髂嵴最高点连线的中点作为测量点,臀围以耻骨联合和背后臀大肌最凸处为测量点。所有受试者均脱鞋、免冠、仅穿内衣,取站立位在平静呼气状态下,用软尺水平环绕测量部位,松紧适度,测量过程中嘱受试者避免吸气,并保持软尺各部分处于水平位,分别以kg、cm为单位记录,数据精确到0.1kg或0.1cm(BMI=体质量/身高2,WHR=腰围/臀围)。
1.3.2 血清orexin A水平测定 采用酶联免疫吸附试验法(enzyme linked immunosorbent assay,ELISA)进行。人orexin A ELISA试剂盒由美国DSL公司提供(批号YS01201B)。采用AMR-100酶标仪测定各孔吸光度值,并根据绘制的标准曲线计算相对应的浓度。
1.3.3 胰岛素抵抗指数(homeostasis model assessment,HOMA-IR) 采用贝克曼库尔特AU5800全自动生化分析系统检测空腹血糖(fasting blood glucose,FBG)水平,采用放射免疫法检测空腹胰岛素(fasting blood insulin,FBIn)水平(人胰岛素放射免疫试剂盒由上海瑞齐生物试剂有限公司提供),采用稳态模型评价法(homeostatic model assessment,HOMA)计算胰岛素抵抗程度,将数据代入如下公式计算得出:HOMA-IR=(FBG×FBIn)/22.5。
1.3.4 血脂指标测定 采用贝克曼库尔特AU5800全自动生化分析系统检测。试剂盒由山东博科生物产业有限公司提供(批号A135464)。
1.4 统计学方法应用SPSS13.0软件进行统计分析,计量资料以均数±标准差(x±s)表示,性别比较采用χ2检验,正态分布数据经方差齐性检验后采用独立样本t检验,相关性分析采用Sperman检验,P<0.05表示差异有统计学意义。
2 结果
2.1 两组BMI、WHR比较 观察组BMI及WHR均较对照组明显升高,差异有统计学意义(P<0.05),见表1。
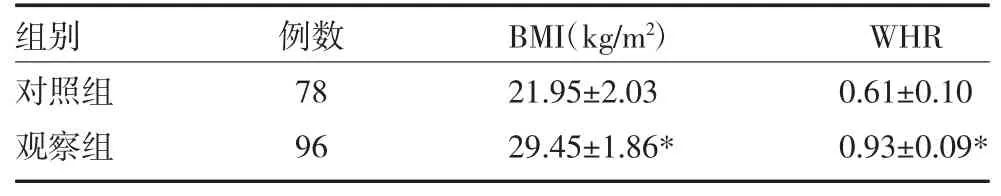
表1 肥胖伴高脂血症患者与对照组BMI、WHR比较(x±s)
2.2 两组血脂指标比较 观察组血清TC、TG、LDLC 水平均明显高于对照组(P<0.01,P<0.05),血清HDL-C则明显低于对照组,差异有统计学意义(P<0.05),见表 2。
2.3 两组血清orexin A水平及HOMA-IR比较 观察组血清orexin A较对照组明显下降(P<0.05),而HOMA-IR值较对照组显著升高(P<0.01),见表3。

表2 肥胖伴高脂血症患者与对照组血脂指标比较(mmol/L,x±s)
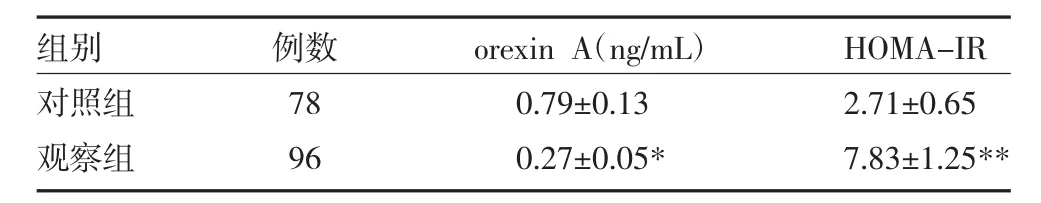
表3 肥胖伴高脂血症患者与对照组血清orexin A水平及HOMA-IR比较(x±s)
2.4 相关性分析 相关性分析表明,orexin A与BMI、WHR、TG、TC、LDL-C、HOMA-IR 均呈明显负相关 (r分别为-0.632、-0.648、-0.834、-0.756、-0.706、-0.547;P<0.01);与 HDL-C 呈明显正相关(r=0.818,P<0.01)。
3 讨论
IR已被证实是诱发肥胖和高脂血症的共同病理基础[1-3],肥胖症患者中多个环节如炎症、脂肪因子分泌异常、高游离脂肪酸血症及骨骼肌、肝脏的脂质异位沉积等都可干预胰岛素信号的转导,诱导IR的发生[8]。而IR情况下高胰岛素血症进一步刺激食欲增加,促进葡萄糖转化为脂肪,加重血脂代谢紊乱,促进肥胖发展[1]。
Orexin主要由涉及摄食行为的下丘脑区域合成分泌,包括Orexin A及Orexin B两种类型,其中orexin A含33个氨基酸多肽,是存在于神经元囊泡中的一种神经递质或调质,主要参与能量代谢、内分泌平衡及睡眠/唤醒行为等多种生理或病理过程,是机体能量平衡调节网络中的重要物质。Orexin A与IR的关系十分复杂,有可能依赖于血糖水平的变化。Orexin A神经元对循环中的葡萄糖水平十分敏感,单独给胰岛素介导低血糖对食欲素神经元产生明显刺激。Switońska 等[9]研究发现,Orexin A 对胰岛素的刺激呈剂量依赖性,且Orexin A和胰岛素的作用存在时相上的差异。国内赵玉岩等[10]研究发现,高脂膳食诱导的IR大鼠模型中Orexin A及受体表达明显下降。内源性Orexin及其受体信号可能介导了高脂饮食对糖代谢和肥胖的有害作用[11]。Orexin可强烈抑制食源性肥胖以及后续出现的IR[11]。因此在IR的发生和发展中,Orexin A及其受体的基因转录和翻译可能参与调节脂肪-胰岛轴的重要因素。Orexin系统、胰岛素和葡萄糖可能是相互调控、相互制约、密切相关的,它们之间的相互作用涉及整个脂肪-胰岛轴的平衡状态[10]。
目前,Orexin A在肥胖合并高脂血症中的作用仍鲜有报道,仅有的几项临床研究[4]发现,Orexin A是胰岛素抵抗及肥胖发生的重要标志。本研究结果显示,患者组肥胖指数(BMI、WHR)、HOMA-IR 指数及血脂指标(TG、TC、LDL-C)较对照组明显升高,血脂HDL-C水平则明显降低,提示肥胖合并高脂血症患者存在明显的IR。进一步研究发现,患者组血清Orexin A水平较对照组明显下降,这与国内赵玉红等的研究[4]相符。相关性分析提示Orexin A与BMI、WHR、TG、TC、LDL-C、HOMA-IR 均呈明显负相关,与HDL-C呈明显正相关,这提示肥胖合并高脂血症患者中Orexin A水平的减少与肥胖、脂代谢异常及IR密切相关。推测可能的机制是:外周胰岛素抵抗相关的高脂高糖抑制了下丘脑Orexin A的表达,而Orexin A有助于维持下丘脑胰岛素敏感性,Orexin A表达受到抑制后可导致胰岛素受体、瘦素受体及Orexin A受体信号中断,进一步加剧外周组织的IR,从而产生了下丘脑和胰岛素抵抗的恶性循环[12]。
综上所述,肥胖合并高脂血症患者存在明显的IR,Orexin A可能通过调控IR参与肥胖及脂代谢紊乱的发生发展,但其更深层次的机制仍需进一步扩大样本量深入研究。
[1]陈定宇,何凌,肖正华.肥胖伴高甘油三酯血症患者胰岛素抵抗的研究[J].中原医刊,2006,33(8):1-2.
[2] Stem MP.Diabetes and cardiovascular disease:the“common soil”hypothesis[J].Diabetes,1995,44(4):369-374.
[3]何凌,王燕,梁伟,等.肥胖伴高胆固醇血症患者胰岛素抵抗代谢指标的变化[J].解剖学研究,2010,32(3):194-199.
[4]赵玉红,吴丽霞,关心,等.血清增食欲素A与脂代谢相关性分析[J].中国公共卫生,2011,27(11):1502-1503.
[5]马丽娜,赵玉岩,常晓岑.胰岛素抵抗肥胖大鼠体内增食欲素A与丝氨酸蛋白酶抑制剂及脂代谢的相关性研究[J].中国医科大学学报,2015,44(2):105-108.
[6]中华医学会内分泌学分会肥胖学组.中国成人肥胖症防治专家共识[J].中华内分泌代谢杂志,2011,27(9):711-717.
[7]中国成人血脂异常防治指南修订联合委员会.中国成人血脂异常防治指南(2016年修订版)[J].中国循环杂志,2016,31(10):937-952.
[8]宋桉,赵家军.肥胖致胰岛素抵抗的机制研究新进展[J].中国老年学杂志,2013,33(43):4359-4361.
[9]Switońska MM,Kaczmarek P,Malendowicz LK,et al.Orexins and adipoinsular axis function in the rat[J].Regul Pept,2002,104(1-3):69-73.
[10]赵玉岩,郭磊,都健,等.增食欲素系统在胰岛素抵抗大鼠胰腺组织中的表达及意义[J].中国病理生理杂志,2009,25(1):160-162.
[11]翁盼,陆颖理.食欲素与血糖和能量代谢的调节[J].医学综述,2014,20(3):417-420.
[12]Ross R,Wang PY,Chari M,et al.Hypothalamic protein kinase C regulates glucose production[J].Diabetes,2008,57(8):2061-2065.

