棉花秸秆纤维素降解菌的筛选鉴定与降解棉秆效果研究
孙美娜,张凡凡,王永强,3,魏晓燕,4,鲁建江
(1.石河子大学化学化工学院/新疆兵团化工绿色工程重点实验室,新疆石河子 832000;2.石河子大学动物科技学院,新疆石河子 832000;3.河南科技学院动物科技学院,河南新乡 453000;4.武威市畜牧兽医科学研究院,甘肃武威 733000)
0 引 言
【研究意义】棉花是重要的纤维作物和油料作物,其涉及农业和轻工业纺织等国家支柱产业[1]。新疆是我国最大的产棉区,而当地棉秆利用效率极低,虽其具有开发生物能源和建筑材料等的潜力,但在实际生产中还未得到充分应用[2,3]。目前,随着新疆棉花种植区经济条件的不断完善,棉花秸秆作为燃料的使用量开始大幅减少,大量秸秆被闲置堆沤浪费或者直接焚毁,这样不仅污染环境,且易造成棉田因有机肥力的下降,从而限制新疆棉花产业的快速发展。随着当前科学技术的发展和人们环保意识的提高,将棉秆直接粉碎还田是合理有效利用资源的一条可行途径[4]。但由于棉秆木质化程度比较高,在短时期内难以腐熟成肥,且在长期连作条件下,土壤中积累的腐解物对棉花的生长有着自毒化感效应。所以如何促进棉秆的快速腐解,消除其负面影响,是当前新疆棉花产业可持续发展的重要保证之一[5]。【前人研究进展】棉秆富含多种营养成分,可为发酵微生物提供良好的营养物质,但棉秆中纤维素、木质素等含量较高,且结构致密不易腐烂分解变成肥料[6]。所以有效利用微生物手段降解棉秆纤维是目前亟需解决的问题[5,7]。目前,自然界中存在的某些细菌、放线菌和真菌等均存在降解纤维素的特性,而其中放线菌和细菌产酶含量低,放线菌生长速度慢,且其二者多产生胞内酶,难于分离,因此不易大规模生产。所以在工业生产中,主要利用木霉菌(Trichoderma. sp)和曲霉菌(aspergillus. sp)生产纤维素酶[7,8]。研究表明,如革盖菌属(Coriolus.sp)、卧孔菌属(Poria.sp)、原毛平革菌属(Phanerochaete.sp)及烟管菌属(Sjekandera.sp)等;另有青霉属(Penicillium.sp)、枝顶孢霉属(Acremonium.sp)、漆斑霉属(Myrothecium.sp)、脉孢霉属(Neurospora.sp)、毛壳霉属(Chaetomium.sp)等菌株对纤维素也具有较高的纤维分解能力,这些菌株为降解秸秆提供了大量的菌株资源[7,9,10]。【本研究切入点】由于棉秆表面附着大量真菌,且其中存在一定具有纤维降解能力的真菌,而目前对这些真菌的实际降解棉秆中纤维能力的研究不够完善。研究利用微生物学和分子生物学手段筛选和鉴定棉秆表面附着的真菌。【拟解决的关键问题】研究利用微生物学和分子生物学手段筛选和鉴定棉秆表面附着的真菌,获得具有高效纤维素分解能力的真菌,并对其进行了纤维素酶活性的分析,为进一步进行菌株的选育与改造,开展棉秆人工接种纤维素腐解菌剂研究及应用提供技术支持和理论指导。
1 材料与方法
1.1 材 料
1.1.1 棉秆
棉花秸秆样品采自石河子大学农学院实验基地。采集的棉花秸秆样品(鲜样)带回实验室粉碎,一份用作真菌的提取,另一份干燥(65℃,48 h)保藏。
1.1.2 主要仪器
生化培养箱(SPX-250B-Z 上海博迅医疗设备厂)、电泳仪(PowerPac Universal 美国BioRad公司)、PCR扩增仪(TC-512 英国Techne公司)、电热恒温干燥箱(GZX-DH-50×55-S 上海跃进医疗器械厂)、高速冷冻离心机(Fresco 21 Thermo 公司)、洁净工作台(SW-CJ-01FD 上海博讯医疗)、立式压力蒸汽灭菌器(LDZX-50KB 上海申安)、电子分析天平(AUY220 SHIMADZU)等;试剂主要为生工生物的真菌基因组DNA提取试剂盒、蜗牛酶、马铃薯葡萄糖培养基(PDA)、刚果红培养基(CRA)、无机盐琼脂培养基(ISAM)、以及北京路桥的PCR回收纯化试剂盒、T-载体PCR产物克隆试剂盒等。
1.2 方 法
将粉碎的棉花秸秆直接接种于PDA液体培养基中,有氧环境(28℃)培养7 d。平板划线纯化2次,将初步纯化的菌种分别接种于以粉碎干燥棉秆(过200目筛)为唯一C源的ISAM固体培养基中,筛选可利用C源(具有降解棉秆纤维能力)的菌种,再挑选单一菌落于PDA液体培养基中扩繁,将扩繁后的菌种点接至加入粉碎干燥棉秆的刚果红培养基中(CRA纤维素培养基)[11],选取水解圈直径较大菌种进行分子生物学鉴定[12],并连续5 d(24、48、72、96、120 h)测定其滤纸酶活性(FPA)和羧甲基纤维素钠(CMC-Na)糖化活力,具体方法同房兴堂[13]、傅力[14]等的测定方法。其中FPA代表纤维素酶中多种酶系组分协同作用后的总酶活,CMC-Na主要代表β-1,4-葡聚糖的活力。将分析后的菌种分别接种至PDA液体培养中扩繁(28℃ 培养3 d),将扩繁后的菌种分别接种于棉秆中(鲜样),接种量为10%,接种后连续观测25 d,期间每5 d测定棉花秸秆(纤维)的失重率,反映各菌种对棉秆纤维的实际降解效果。其中纤维的测定采用范式(Van Soest)洗涤法[15],失重率计算采用重量差减法:秸秆失重率% = (初始重量-接种菌种后重量)/ 初始重量×100%。
菌种分子生物鉴定:选用真菌通用引物对真菌26S rDNA的DD2区域进行PCR扩增[16],扩增体系为50 μL∶2 μL模板DNA,2 μL上游引物(NL1),2 μL下游引物(NL4),PCR Mix预混液25 μL,dd H2O 19 μL。引物序列为,NL1:5’- GCA TAT CAA TAA GCG GAG GAA AAG -3’和NL4:5'- GGT CCG TGT TTC AAG ACG G-3'。PCR扩增程序:95℃预变性10 min,(95℃变性30 s,56℃褪火30 s,72℃延伸30 s)38个循环,最终72℃延伸10 min[17]。采用1.2%的琼脂糖凝胶电泳检测提取效果。切下明亮条带进行回收、纯化(采用PCR回收纯化试剂盒)。连接T载体(采用T-载体PCR产物克隆试剂盒)后送至北京六合华大基因公司进行测序。测得的16S rDNA序列经过Genbank数据库进行Blast。
1.3 数据处理
数据采用Excel 2007整理,采用SPSS 22.0软件进行数据的F检验,当通过F检验后进行单因素(one- way ANOVA)方差分析,多重比较方法均采用Duncan法,差异性判断方法为P<0.05时差异显著,P>0.05时差异不显著[18]。
Genbak中选取相关特征序列,与研究测序结果一起采用Clustal W按照最大同源性(各结果采用DNA star对比分析同源性)原则进行多重序列对比[19],对比结果采用MEGA软件建立系统发育树。重复(Bootstrap)次数为1 000次[20]。
2 结果与分析
2.1 棉花秸秆降解菌的降解能力
根据透明圈直径大小筛选出降解效果最为明显的菌株,分别将其编号为SN-1、SN-2、SN-3、SN-4。4株降解菌的生长速率各不相同,CRA纤维素培养基中透明圈直径大的菌株其生长速率较快,降解效果较好,按水解圈直径按大小排序为,SN-1(3.48 cm)>SN-4(3.06 cm)>SN-3(2.38 cm)>SN-2(1.56 cm)(P=0.013,F=25.282)。图14株纤维素降解菌的CMC-Na糖化酶活和FPA酶的活随着培养时间的增加而上升,在培养24 h后CMC-Na酶活和FPA酶活呈快速上升的趋势,72 h时,酶活力达到最高值。当培养时间超过72 h后,酶活力开始下降,4菌株CMC-Na酶活和FPA酶活变化趋势基本一致。具体对于CMC-Na糖化酶活力,24~96 h时SN-1菌种均显著低于其它3个菌种(P<0.05),而在第120 h时,各菌种处理间差异不显著(P>0.05)。对于FPA活性,在第24和120 h时SN-1和SN-4菌种显著高于SN-2和SN-3菌种(P<0.05);其它时间点,各菌种按活性高低排序为:SN-1、SN-4>SN-3>SN-2(P<0.05)。
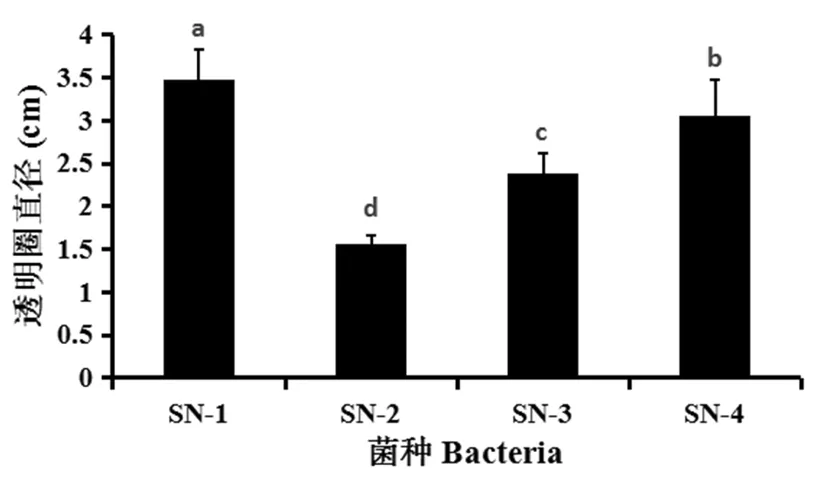
注:不同字母表示差异显著(P<0.05),下同
Note: Different letters show significant difference in the figure (P<0.05). The same as below
图1 4种菌种水解圈直径
Fig.1 The hydrolytic circle diameter of 4 species (cm)
对4株菌种棉花秸秆的失重率测定,研究表明,液体培养基培养第5、20和25 d各处理按棉花秸秆失重率高低排序为,SN-1、SN-4>SN-3>SN-2>CK(P<0.05),第10和15 d排序为,SN-1、SN-4>SN-2、SN-3>CK(P<0.05)。表1
2.2 棉花秸秆降解菌菌落形态
降解菌菌落形态鉴定显示,SN-1菌株菌落蔓延迅速,初为白色,后变成黑色厚绒状,表面黑色,粉末状,菌落生长快,经过乳酸-石碳酸染色后经过镜检可见,孢子梗顶端膨大成圆形或者是椭圆形,呈放射状排列。SN-2菌落呈圆形,粉红色的菌落,菌落表面为绒状,菌丝紧密隆起,菌丝纤细为白色,较易形成分生孢子,经过乳酸-石碳酸染色后经过镜检可见,分生孢子单胞或双胞,无色,椭圆形或长椭圆,大小不一,菌丝发达。SN-3菌落呈圆形,黑色的菌落,菌落表面为绒状,菌丝疏松隆起,生长迅速,扩散快,经过乳酸-石碳酸染色后经过镜检可见,分生孢子卵形、椭圆形或倒棒形,淡榄褐色至褐色,平滑,多有短或长喙,串生。SN-4菌株表面为青色,菌落成片生长,气生菌丝为白色,边缘不规则,菌落中央隆起,经过乳酸-石碳酸染色后经过镜检可见,分生孢子梗的顶端并不膨大,有指状分枝,且有可以再分的分枝[21]。图2
表1 不同培养时间4种酶活性变化规律及棉花秸秆失重率
Table 1 The analyzed of cotton stalks on loss rate and 4 kinds of enzyme activity in different culture time
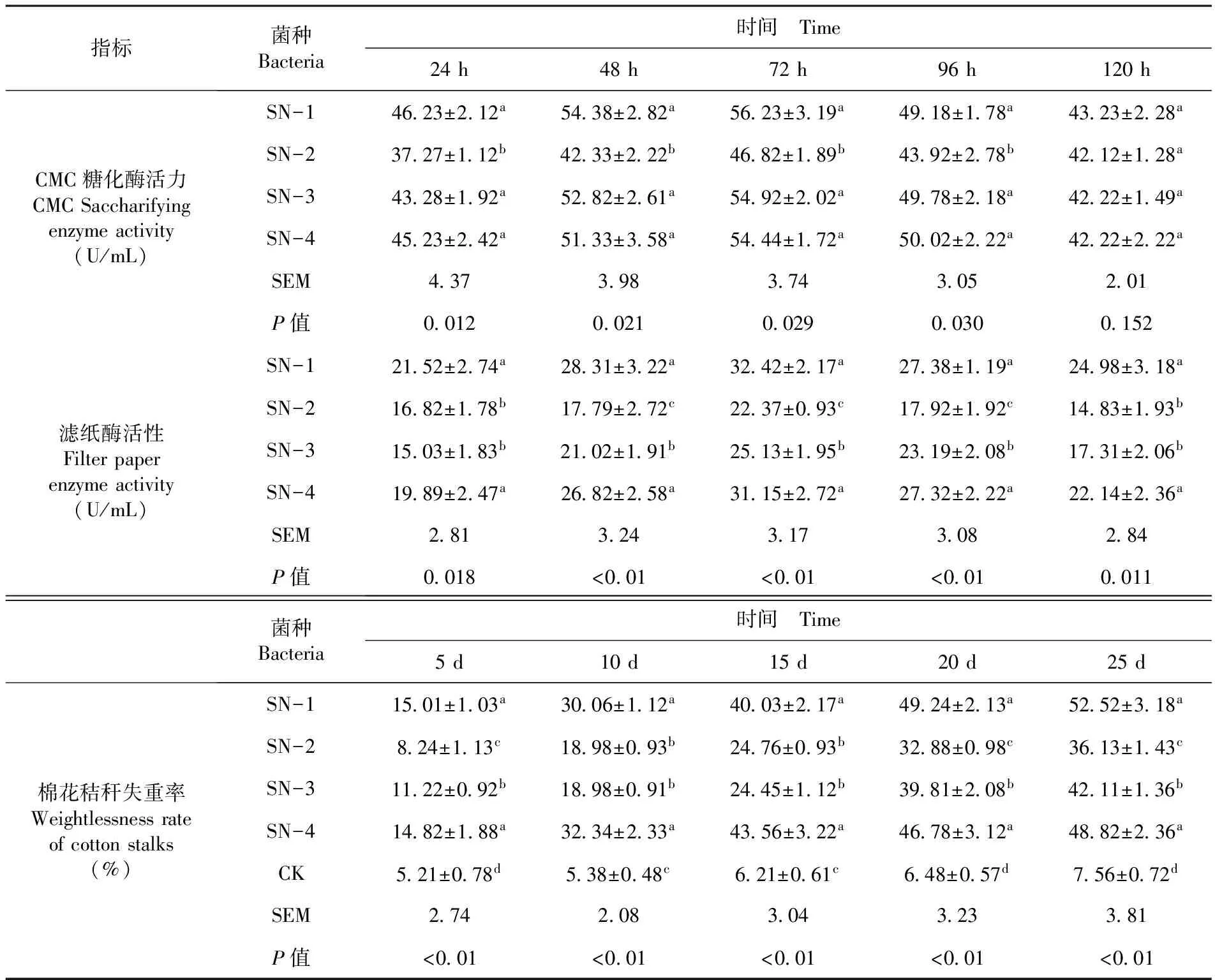
指标菌种Bacteria时间 Time24h48h72h96h120hCMC糖化酶活力CMCSaccharifyingenzymeactivity(U/mL)SN-14623±212a5438±282a5623±319a4918±178a4323±228aSN-23727±112b4233±222b4682±189b4392±278b4212±128aSN-34328±192a5282±261a5492±202a4978±218a4222±149aSN-44523±242a5133±358a5444±172a5002±222a4222±222aSEM437398374305201P值00120021002900300152滤纸酶活性Filterpaperenzymeactivity(U/mL)SN-12152±274a2831±322a3242±217a2738±119a2498±318aSN-21682±178b1779±272c2237±093c1792±192c1483±193bSN-31503±183b2102±191b2513±195b2319±208b1731±206bSN-41989±247a2682±258a3115±272a2732±222a2214±236aSEM281324317308284P值0018<001<001<0010011菌种Bacteria时间 Time5d10d15d20d25d棉花秸秆失重率Weightlessnessrateofcottonstalks(%)SN-11501±103a3006±112a4003±217a4924±213a5252±318aSN-2824±113c1898±093b2476±093b3288±098c3613±143cSN-31122±092b1898±091b2445±112b3981±208b4211±136bSN-41482±188a3234±233a4356±322a4678±312a4882±236aCK521±078d538±048c621±061c648±057d756±072dSEM274208304323381P值<001<001<001<001<001
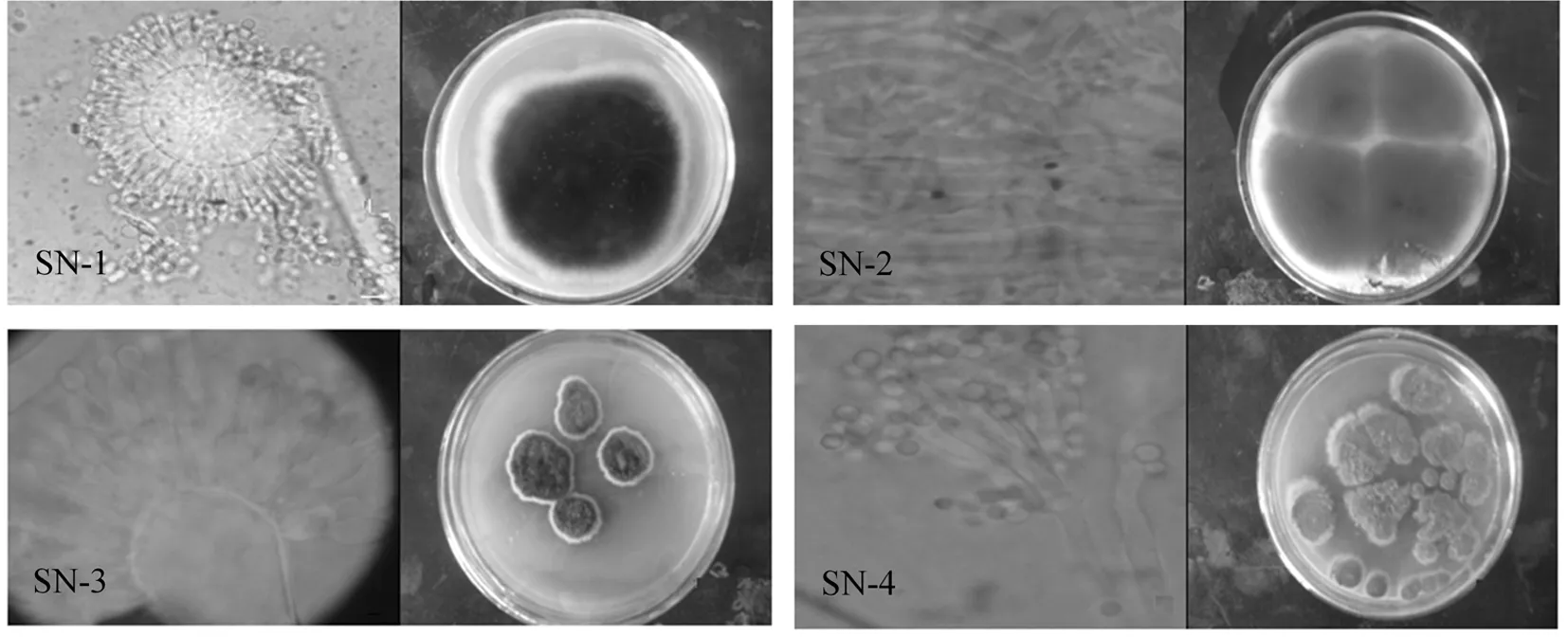
注:左图为各菌种镜检,右图为培养基中菌落形态
Note: The left image is a microscopic of the bacteria. The right image is colony shape in medium
图2 各降解菌株镜检及菌落形态
Fig.2 The microscopy and colony morphology of degrading bacteria strain
2.3 棉花秸秆降解菌株的鉴定
以NLl和NL4为通用引物特异扩增降解菌的26S rDNA,将得到的PCR扩增产物进行琼脂糖凝胶电泳检测,最后于紫外凝胶成像系统上观察并拍照,电泳结果显示PCR扩增产物均为单一的条带,无非特异扩增现象,根据Marker分子量大小得到4株降解菌的序列片段大小长度均为600 bp左右。图3
将基因序列提交NCBI检索系统,通过BLAST工具在GenBank数据库中基因序列进行同源性比对,以降解菌同源性最高的序列构建系统发育树。26S rDNA区域序列比较分析构建了主要降解菌菌株系统发育树。由系统发育树可以看出SN-1菌株与黑曲霉(Aspergillusniger)亲缘关系最近,基因序列同源性为99%。SN-2菌株与串珠状赤霉(Gibberellamoniliformis)亲缘关系最近,基因序列同源性为100%。SN-3菌株与交链孢霉(Alternarianees)亲缘关系最近,基因序列同源性为100%。SN-4菌株青霉菌(penicillium)亲缘关系最近,基因序列同源性为100%。图4
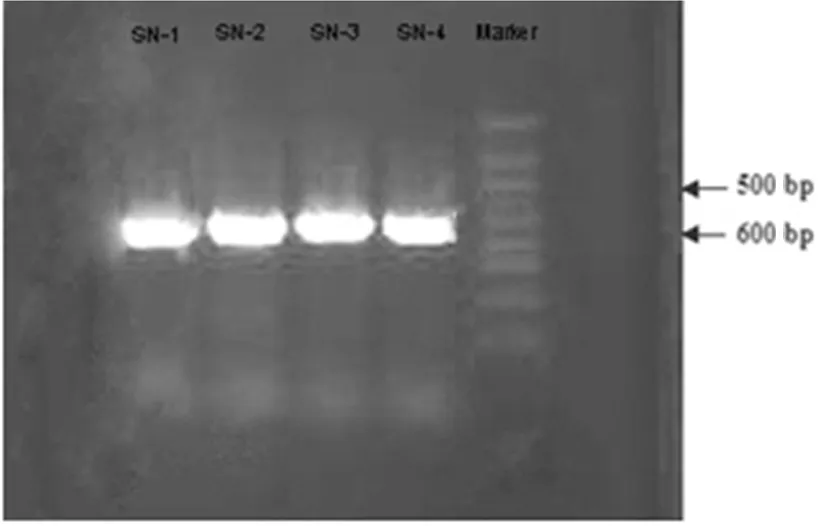
图3 各菌株PCR扩增产物琼脂糖凝胶电泳检测
Fig.3 The agarose gel electrophoresis test of PCR amplicon with all bacteria strain
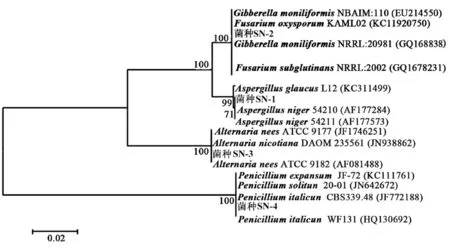
图4 4株菌种的系统发育树
Fig.4 The phylogenetic tree of 4 bacteria strain
3 讨 论
纤维素的有效降解已成为目前最为热门的话题,国内外学者对此项工作均开展过相关研究。试验采用纤维素初筛培养基及刚果红复筛培养基,从棉田土壤中筛选出4株能产生纤维素降解透明水解圈的菌株,通过纤维素降解出现透明圈的大小及时间,可以作为菌株产纤维素酶活大小的初选指标,这在降解菌纯培养纤维素酶活性测定及接种测定棉花秸秆的失重率结果均得到了很好的印证,说明用纤维素降解透明水解圈方法大量筛选纤维素降解菌快速、简便可行。通过对4株纤维素降解菌形态观察、镜检和26S rDNA基因序列分析同源性比对,由系统发育树进行分析初步确定SN-1属于黑曲霉(Aspergillusniger),SN-2属于赤霉(Gibberellamoniliformis),SN-3属于链格孢霉(Alternarianees),SN-4属于青霉菌(Penicilliumitalicum)。
研究采用透明圈筛选法识别产纤维素酶的菌株,其产酶能力和透明圈大小成正比。以此判断出4种真菌分解纤维素的能力按大小排序为黑曲霉、青霉菌优于交链孢霉和串珠状赤霉。通过对CMC糖化酶活力、滤纸酶活性的分析也得到相同的结果。向殿军等[11]从玉米秸秆中也分离出青霉菌,并且其纤维素酶活性最高。张恒芳等[22]从玉米秸秆中分离出2株纤维素分解菌,并且证实这两株菌在温度较低时也具有很强的纤维分解能力,但未鉴定出这2株菌的属种。郭艳等[23]从玉米秸秆还田的土壤中分离了一株纤维素分解菌为假单胞菌(Pseudomondaceae),其具有极强的分解有机物的能力,这表明某些细菌也具有较强的分解纤维素的能力。
研究通过对堆放的棉花秸秆中降解纤维素的微生物进行分离鉴定,主要发现4种真菌,在今后研究中,可将研究分离的这4株菌进行耐受性研究,以期筛选出极端环境下任具有纤维分解能力的菌株,并进行一定的定向诱变。此外,由于菌种功能性研究,尤其是对于秸秆的降解效率研究工程量较大,许多问题有待进一步深入研究。诸如提高降解效率,更为有效的利用微生物处理手段,更方便、更快捷高效的使用菌剂,延长棉花秸秆降解菌剂的保质期,进行棉花秸秆降解菌剂的安全性评价,使用菌剂还田解决棉花生长常见的枯萎病和黄萎病的问题等等[7]。
4 结 论
4.1 棉花秸秆表面分离提取鉴定出4种真菌分别为,黑曲霉(Aspergillusniger)、串珠状赤霉(Gibberellamoniliformis)、交链孢霉(Alternarianees)和青霉菌(Penicilliumitalicum)。
4.2 对于4种真菌降解棉花秸秆的理论效果,按抑菌圈大小排序为:黑曲霉>青霉菌>链格孢霉>赤霉。对于CMC-Na糖化酶活力、滤纸酶活性接种黑曲霉和青霉菌时活性在120 h之内均为最强。
4.3 实际降解棉秆25 d,降解效果表现最好的为黑曲霉和青霉菌。
)
[1] 张鹏忠, 王新江, 托乎提. 新疆棉花产业发展现状、存在问题及对策建议[J]. 新疆农业科学, 2008, 45(S2): 174-176.
ZHANG Peng-zhong, WANG Xin-jiang, TUO Hu-ti. (2008). The Development Present, Problems, Countermeasures and Suggestions in Xinjiang Cotton Industry [J].XinjiangAgriculturalSciences, 45(S2): 174-176. (in Chinese)
[2]孔庆平, 孔杰, 徐海江, 等. 新疆棉花集约高效生产技术研发策略[J]. 新疆农业科学, 2015, 52(7): 1 352-1 358.
KONG Qing-ping, KONG Jie, XU Hai-jiang, et al. (2015). Research and Development Strategy of Intensive and Efficient Production Technology in Xinjiang Cotton [J].XinjiangAgriculturalSciences, 52(7): 1,352-1,358. (in Chinese)
[3]黄乐平. 新疆棉花生物技术研究现状与发展前景探讨[J]. 新疆农业科学, 2007, 44(S3): 1-5.
HUANG Le-ping. (2007).The Research of Cotton Biotechnology on Present Situation and Development Prospects in Xinjiang [J].XinjiangAgriculturalSciences, 44(S3): 1-5. (in Chinese)
[4]杨丽娟. 农作物秸秆还田的方式及技术要求[J]. 现代农业, 2011, (5): 165.
YANG Li-juan. (2011). The Crop Straw Counters-Field Way and Technical Requirements [J].ModernAgriculture, 165(5): 165. (in Chinese)
[5]白宝伟, 张琴, 滕立平, 等. 一株棉秆纤维素分解真菌的分离筛选及酶学性质研究[J]. 新疆农业科学, 2012, 49(4): 701-707.
BAI Bao-wei, ZHANG Qin, TENG Li-ping, et al. (2012).Isolation of a Cotton Stalk Cellulose Decomposing Fungus and Its cellulase Properties [J].XinjiangAgriculturalSciences, 49(4): 701-707. (in Chinese)
[6]穆小民, 吴显荣. 纤维素酶分子生物学研究进展及趋向[J]. 草食家畜, 1994, 14(3):25-27.
MU Xiao-min, WU Xian-rong. (1994).The Research Progress and Trends of Cellulose Enzyme Molecular Biology [J].Grass-FeedingLivestock, 14(3):25-27. (in Chinese)
[7]刘娣. 秸秆纤维素高效降解真菌的筛选、鉴定及其纤维素酶基因克隆[D]. 北京: 中国农业科学院, 2008.
LIU Di. (2008).Screening,IdentificationandCellulaseGeneCloningofHighEffectiveStrawCellulose-DegradingFungusStrains[D]. Master Thesis. Chinese Academy of Agricultural Sciences, Beijing. (in Chinese)
[8]齐西珍, 赵军旗, 田朝光, 等. 真菌来源中碱性纤维素酶研究[C]//. 中国酶工程学术研讨会, 2013.
QI Xi-zhen, ZHAO Jun-qi, TIAN Chao-guang, et al. (2013).TheResearchofSourceofAlkalineCellulaseinFungi[C]//. Proceedings of Chinese Enzyme Engineering Academic Seminar, Naning, . (in Chinese)
[9]高静, 席琳乔, 马春晖. 土壤中棉秆纤维素降解菌的筛选[J]. 塔里木大学学报, 2010, 22(4): 6-10.
GAO Jing, XI Lin-qiao, MA Chun-hui. (2010). Solation of Cotton Straw Cellulose-degrading Fungi from Soil [J].JournalofTarimUniversity, 22(4): 6-10. (in Chinese)
[10]王璐, 张海红, 杨柳, 等. 3株纤维素分解真菌的分子鉴定[J]. 江苏农业科学, 2013, 41(8): 51-53.
WANG Lu, ZHANG Hai-hong, Yang Liu, et al. (2013). Molecular Identification of 3 strains of Cellulolytic Fungi [J].JiangsuAgriculturalSciences, 41(8): 51-53. (in Chinese)
[11]向殿军, 满丽莉, 张春凤,等. 玉米秸秆纤维素降解菌的分离及发酵条件优化[J]. 安徽农业科学, 2014, 42(4):1 159-1 161.
XIANG Dian-jun, MAN Li-li, ZHANG Chun-feng, et al. (2014). Optimization of the Separation and Fermentation Conditions of Corn Straw Cellulose-Degrading Fungus [J].JournalofAnhuiAgriculturalSciences, 42(4): 1,159-1,161. (in Chinese)
[12]陈天寿. 微生物培养基的制造与应用[M].北京: 中国农业出版社, 1995.
CHEN Tian-shou. (1995).ManufactureandApplicationofMicrobialCultureMedium[M]. Beijing: China Agriculture Press, 1995. (in Chinese)
[13]房兴堂, 陈宏, 赵雪锋, 等. 秸秆纤维素分解菌的酶活力测定[J]. 生物技术通讯, 2007, 18(4): 39-44.
FANG Xing-tang, CHEN Hong, ZHAO Xue-feng, et al. (2007). Determination of Enzyme Activity of Straw Cellulose- Decomposing Microorganisms [J].LettersinBiotechnology, 18(4): 39-44. (in Chinese)
[14]傅力, 丁友昉, 张篪. 纤维素酶测定方法的研究[J]. 新疆农业大学学报, 2000, 23(2): 45-48.
FU Li, DING You-fang, ZHANG Chi. (2000). The Study of Cellulase Method [J].JournalofXinjiangAgriculturalUniversity, 23(2): 45-48. (in Chinese)
[15]张凡凡, 于磊, 张前兵,等. 沙尔套山天然割草场主要豆科牧草营养价值综合评价研究[J]. 新疆农业科学, 2014, 51(10): 1 907-1 915.
ZHANG Fan-fan, YU Lei, ZHANG Qian-bing, et al. (2014). Comprehensive Assessment of the Main Legume Forages'Nutritional Value of Natural Mowing Steppe in Shaertao Mountain, Zhaosu, Xinjiang [J].XinjiangAgriculturalSciences, 51(10): 1,907-1,915. (in Chinese)
[16]Benson, D. A., Boguski, M. S., Lipman, D. J., Ostell, J., & Ouellette, B. F. (1998). Genbank.NucleicAcidsResearch, 26(1): 1.
[17]张莉莉, 张苓花. 利用氯化苄提取真菌基因组DNA及其分子生物学分析[J]. 大连工业大学学报, 2000, 19(1):36-39.
ZHANG Li-li, ZHANG Ling-hua. (2000). Isolation and molecular biological analyses of genomic DNAs from fungi using benzyl chloride [J].JournalofDalianInstituteofLightIndustry, 19(1): 36-39. (in Chinese)
[18]吴明隆. SPSS统计应用实务[M]. 北京: 科学出版社, 2003.
WU Min-long. (2003).TheSPSSStatisticalPractice[M]. Beijing: Science Press. (in Chinese)
[19]Thompson, J. D., Gibson, T. J., Plewniak, F., Jeanmougin, F., & Higgins, D. G. (1997). The clustal_x windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools.NucleicAcidsResearch, 25(25): 4,876-4,882.
[20]Kumar, S., Tamura, K., & Nei, M. (2004). Mega3: integrated software for molecular evolutionary genetics analysis and sequence alignment.BriefingsinBioinformatics, 5(2): 150-163.
[21]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[K]. 北京: 科学出版社, 2001: 353-370.
DONG Xiu-zhu, CAI Miao-ying. (2001).ManualoftheIdentificationofCommonBacterialSystem[K]. Beijing: Science Press: 353-370. (in Chinese)
[22]张恒芳, 李林, 史喜林, 等. 玉米秸秆低温纤维素分解菌的筛选及分解效果测定[J]. 玉米科学, 2013,(5): 147-150.
ZHANG Heng-fang, LI Lin, SHI Xi-lin, et al. (2013). Screening of Cellulose Degradation Bacteria Decomposing Maize Straw under Low Temperature and the Function Determining [J].JournalofMaizeSciences, (5): 147-150. (in Chinese)
[23]郭艳, 张进良, 王会平, 等. 玉米秸秆还田土壤中纤维素分解菌的分离筛选和鉴定[J]. 农业科学与技术, 2010, 11(4): 134-137.
GUO Yan, ZHANG Jin-liang, WANG Hui-ping, et al. (2010). Isolation, Screening and Identification of Cellulose Decomposing Strains in Straw amended Soil [J].AgriculturalScienceandTechnology, 11(4): 134-137. (in Chinese)

