银纳米线柔性电极的制备及电化学方法测定水中微量铜离子
杨海波 周文慧 甄 雪 马龙飞 申贵隽 孙 晶
(大连大学环境与化学工程学院, 大连 116622)
1 引 言
铜是《生活饮用水卫生标准》[1]规定必测的化学指标之一,过量摄入会对人体产生潜在的毒性,甚至引发疾病[2],也会对环境造成严重污染[3]。目前,铜的测定方法主要有原子吸收光谱法(AAS)[4]、原子发射光谱法 (AES)[5,6]、电感耦合等离子质谱法(ICP-MS)[7]及电化学分析法[8]。光谱分析和质谱分析法灵敏度高、特异性好,但仪器昂贵、耗时长,需要专业人员操作,不便于进行现场或特殊场所的即时检测; 电化学分析法因设备小型、操作简单、成本低、检测速度快,成为检测环境中重金属离子的重要方法[9,10],而灵敏度高、成本低、适用多种场所的即时检测电极对水中金属离子的测定具有重要的实际应用价值。
与传统的硬质电极相比,柔性电极因具有较好的拉伸强度、弯折后易复原、不易脱落等机械性能,有望用于一些特殊的测定对象和测定场所,是近年的研究热点[11,12]。银纳米材料因其自身的高导电性、低电阻和低成本, 使其在制备柔性电极方面得到了更多的关注[13],其中,银纳米线具有优良的成膜和导电性以及纳米尺寸效应。Xu等[14]在聚二甲基硅氧烷(Polydimethylsiloxane,PDMS)上嵌入纳米银制备了高导电性和高伸拉强度的导体,在0~50%的拉伸应变范围内,导电性仍稳定在5285 S/cm,经过多次机械负载后物理性能仍较稳定,可用于能伸缩的LED电路和电容式压力传感器。Lee等[15]用喷涂法制备了以PDMS为下层柔性基质, PEDOT: PSS(poly(3,4-ethylenedioxythiophene): poly(styrene sulfonate))为上层导电聚合物, 中间含有纳米银的双层伸缩电极,该电极在增加拉伸应力和伸缩次数后能够维持更稳定的电阻。这些研究结果表明,银纳米线柔性电极应用于有拉伸和扭曲应力的场合具有明显的优势和潜力,如触摸屏[16]、太阳能电池[17]、电子皮肤[18]和有机LED[19],然而,利用银纳米线柔性电极通过电化学方法测定环境中重金属离子的报道很少。
本研究以PDMS为柔性基底材料,银纳米线(AgNWs)为导电层,制备了一种银纳米线柔性电极,以其为工作电极,采用方波溶出伏安方法(Square wave stripping voltammetry,SWSV)测定水中的Cu2+。本方法为银纳米线柔性电极测定水中的其它微量金属以及即时测定一些特殊场合中的微量金属提供了参考。
2 实验部分
2.1 仪器与试剂
M-3手持式四探针电阻仪(苏州晶格有限公司); DZF-6050真空烘箱(上海一恒科学仪器); JELIGHT M紫外臭氧清洗机(上海Jelight公司); GM-0.33B隔膜真空泵(天津津腾实验设备有限公司); CHI660E电化学工作站(上海辰华仪器有限公司); Master-R超纯水机(上海和泰仪器有限公司); SU8220扫描电子显微镜(日本Hitachi公司); BSA224S万分之一分析天平(上海Sartorius公司); AP-1250X 照排机(日本Fujifilm公司); KW-4AH烤胶机(美国Chemat公司); 均胶机(美国Laurell公司); 紫外光源系统(美国Optical Associat公司)。
直径为90 nm、长度为60 μm的银纳米线溶液(20 mg/mL,南京先锋纳米材料科技有限公司); RTV615 聚二甲基硅氧烷 (PDMS, 迈图高新材料集团); 丙三醇(Glycerol,Gly,美仑生物有限公司); 聚乙烯醇(Polyvinyl alcohol,PVA)、无水乙醇、氯化铜、氯化铋、酒石酸、醋酸、柠檬酸、硝酸、氢氧化钠(国药集团化学试剂有限公司); 4英寸单面抛光硅片(开化县中塑单晶硅经营部); SU8 2050光刻胶(美国Microchem公司); 丙二醇甲醚醋酸酯(显影液,广州市金圣吉化工有限公司)。除特别标注外,所有试剂均为分析纯,实验用水为超纯水。
2.2 银纳米线柔性电极的制备
2.2.1PDMS基片的制作参照文献[20],采用光刻技术制作基片,如图1A所示,采用AutoCAD 2014软件设计电极图纸,并利用照排机将图纸打印为掩膜版; 然后在洁净的硅片表面旋涂光刻胶,遮蔽含有电极图形的掩膜版; 最后进行曝光及显影,得到硅片模板(一个硅片表面可光刻出12个电极模板)。将其置于一次性培养皿中,浇注质量比为10∶1[21]的PDMS混合溶液,真空除去溶液中的气泡; 在80℃的恒温烘箱中固化1 h,并切分成12个电极基片。制作好的基片用3M胶处理,清除表面附着的灰尘,然后放入紫外臭氧清洗机中清洗2 min,得到带有固定形状凹槽的PDMS基片。
2.2.2修饰PDMS亲水层参照文献[22]并稍作改进,如图1B所示,配制2%(m/m) PVA与5% (m/m)Gly的混合溶液; 将制备好的PDMS基片浸泡于混合溶液中20 min,在60℃真空干燥2 h; 重复浸泡两次,每次浸泡后在100℃真空烘箱中热固定20 min,得到表面亲水的PDMS基片。
2.2.3银纳米线柔性电极制备以无水乙醇-水(9∶1,V/V)混合溶液为溶剂,配制5 mg/mL的银纳米线溶液,均匀铺展在PDMS表面的凹槽内,室温下放置干燥1天以上,即得到银纳米线柔性电极。如图1C所示,其中Part 1为电极连接导线部分,Part 2 为电极浸入溶液部分。
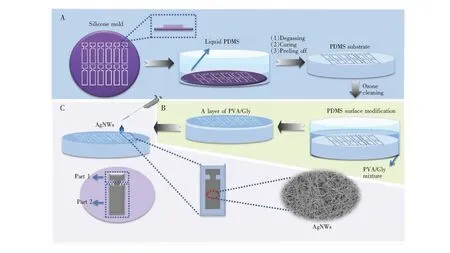
图1 银纳米线柔性电极制备过程示意图:(A)制作PDMS基片; (B)修饰PDMS亲水层; (C)银纳米线柔性电极制备Fig.1 Schematic diagram for the preparation of silver nanowires(AgNWs)flexible electrode. (A) Preparation of polydimethylsiloxane (PDMS) substrate, (B) Modification of PDMS hydrophilic layer, (C) Preparation of AgNWs flexible electrode. Gly, glycerol; PVA, polyvinyl alcohol
2.3 Cu2+的测定
以0.1 mol/L酒石酸-酒石酸钠缓冲溶液为支持电解质,配制0.5 mg/L Bi3+与不同浓度Cu2+的混合溶液。采用三电极体系,以制备的银纳米线柔性电极为工作电极、Ag/AgCl电极为参比电极、铂丝为辅助电极。方波溶出伏安法富集时间为600 s,富集电位为-0.6 V,静止时间30 s,记录-0.3~0.3 V电压范围内的Cu2+溶出伏安曲线,根据Cu2+的溶出峰电流值测定其含量。标准曲线绘制及样品测定实验均在室温和优化测定条件下进行。
3 结果与讨论
3.1 银纳米线柔性电极的表征
3.1.1表面形貌及导电性实验表明,银纳米线在柔性基底表面分布和均匀程度影响银纳米线柔性电极性能。由图2可见,银纳米线在柔性电极表面分布均匀,搭接紧密,利用四探针电阻仪测量其表面电阻为1.03 Ω, 说明此柔性电极的导电性良好。

图2 银纳米线柔性电极扫描电子显微镜形貌图Fig.2 Scanning electronic microscope (SEM) image of AgNWs flexible electrode
3.1.2交流阻抗分析图3为分别采用银纳米线柔性电极(红色曲线)和普通银电极(蓝色曲线)测试Cu2+标准溶液时的交流阻抗图谱。在低频区,银纳米线柔性电极无明显扩散阻抗; 在高频区,银纳米线柔性电极的半圆曲线直径(大小相当于电子传递阻抗)明显小于普通银电极的半圆直径,说明银纳米线柔性电极的阻抗小于普通银电极[23],电子在银纳米线柔性电极表面有更快的传递速度,这主要是由于其具有优良纳米尺寸效应和表面效应。
3.1.3机械性能测试为测试自制银纳米线柔性电极的机械性能,本实验测试了同一根电极拉伸和弯折前、重复100次90°弯折、弯折后再拉伸为原长度的125%时,对检测0.1 mg/L Cu2+标准溶液的影响。如图4所示,电极在弯折及拉伸后,溶出峰电流有微小的降低,其电流变化的RSD=3.3%,说明此电极具有良好的机械性能,并在弯折和拉伸后仍具有良好的电化学性能。
3.1.4精密度和准确度精密度和准确度是评价本实验自制电极性能的重要指标。采用5批次的自制电极,检测0.08 mg/L 标准Cu2+溶液的方波溶出伏安曲线,峰电流的批间RSD=6.8%,说明电极之间具有较好的精密度。同一个电极重复测定0.08 mg/L标准Cu2+溶液7次,批内峰电流的RSD=7.7%。表明此电极具有良好的准确性。
3.2 Cu2+在商品电极与自制电极表面电化学响应的比较
分别以银纳米线柔性电极、商品银电极和商品金电极为工作电极时,比较0.1 mg/L Cu2+标准溶液的方波溶出伏安电化学信号,结果如图5所示。Cu2+在银纳米线柔性电极表面的溶出峰电流大,峰形窄且尖锐,说明银纳米线柔性电极比商品银电极和商品金电极更有利于Cu2+的溶出。Sabri等[24]利用纳米金针修饰电极检测Hg2+,其峰电流大于纳米金薄层修饰电极的峰电流,且峰形更窄、更尖锐,与本实验所得结果相似,其原因可能是纳米材料具有较大的比表面积,增大了电化学响应信号。上述结果表明,自制银纳米线柔性电极电化学响应性能优于商品化金电极和银电极。
3.3 Cu2+测定条件的优化
除电极材料及其性能外,电镀膜材料、缓冲溶液种类、富集电位和富集时间等因素也可能影响测定的灵敏度和准确度。分别考察了上述因素对Cu2+测定的影响,所用Cu2+标准溶液的浓度均为0.1 mg/L。
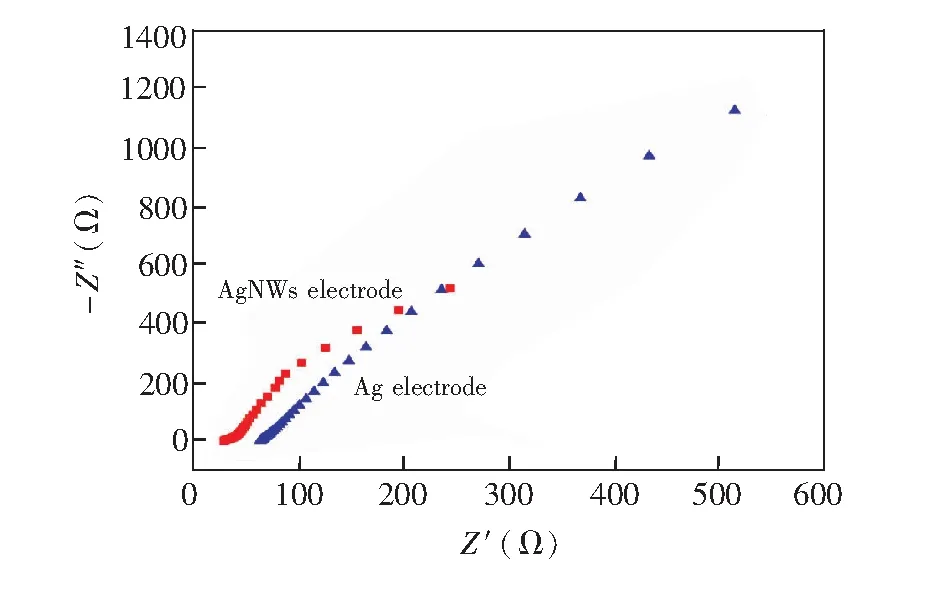
图3 银纳米线柔性电极与商品银电极的电化学阻抗谱图,频率范围为1~100 kHz,振幅0.005 VFig.3 Electrochemical impedance spectra of AgNWs flexible electrode and commercialized silver electrode. Frequency range is 1-100 kHz and amplitude is 0.005 V
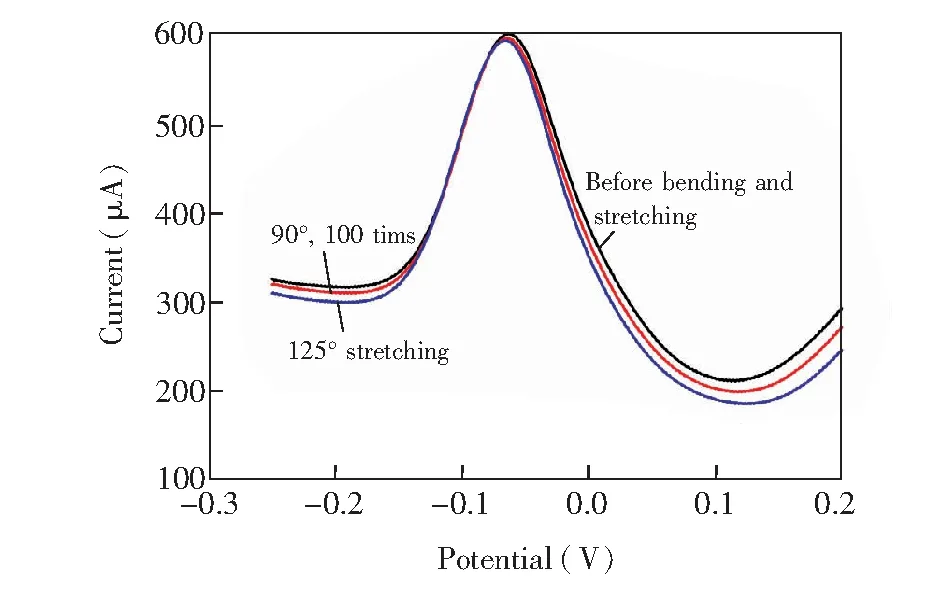
图4 弯折和拉伸前后电极检测0.1 mg/L Cu2+溶液的电化学性能比较Fig.4 Electrochemical property of the AgNWs flexible electrode before bending, after bending and after stretching in 0.1 mg/L of Cu2+ solution
3.3.1Bi3+浓度对Cu2+测定的影响传统溶出伏安法用汞和汞膜作为工作电极,但汞的毒性和挥发性对人体健康和环境有害。铋盐无毒、稳定,在溶出伏安分析中采用原位镀铋法,将铋与被测重金属生成二元或多元合金沉积在工作电极上,可提高检测的灵敏度[25]。
实验结果表明,电镀铋膜的厚度和均匀性直接影响Cu2+的测定结果。图6是镀铋液浓度不同时Cu2+的方波溶出峰电流值变化趋势曲线。当镀铋液浓度在0.1~0.5 mg/L之间时,Cu2+的溶出峰电流值随Bi3+浓度的增大而逐渐升高,之后呈逐渐降低趋势。这可能是Bi3+浓度较低时,形成的铋膜不致密,影响检测的灵敏度,而高浓度的镀铋液导致镀铋膜过厚,灵敏度下降。因此,后续实验选择0.5 mg/L Bi3+标准溶液。

图5 0.1 mg/L Cu2+在不同电极表面的方波溶出伏安曲线Fig.5 Stripping voltammetry curves of 0.1 mg/L Cu2+ using different electrodes
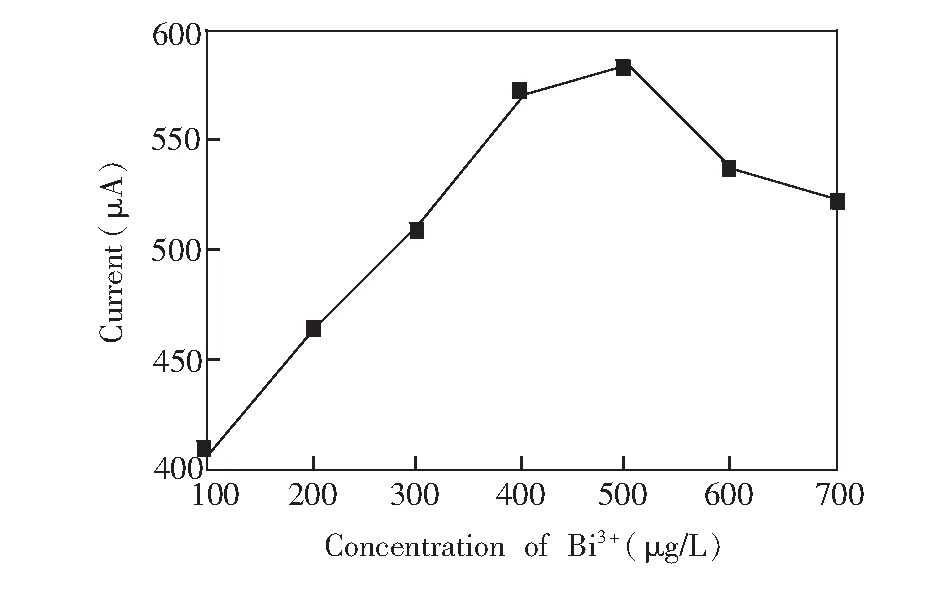
图6 Bi3+浓度对0.1 mg/L Cu2+溶出峰电流的影响Fig.6 Influence of Bi3+ concentrations on stripping peak currents of 0.1 mg/L Cu2+
3.3.2pH值对Cu2+测定的影响Bi3+和Cu2+在中性和弱碱性条件下会水解,测定缓冲溶液应为酸性。考察了pH值分别为3.6、4.0、4.4、4.8、5.2和5.6的酒石酸-酒石酸钠溶液中Cu2+溶出的峰电流变化趋势。当pH=3.6~4.8时,峰电流随pH值的增大而逐渐升高,之后逐渐减小,故本实验选择pH=4.8的缓冲溶液。
3.3.3缓冲溶液对Cu2+测定的影响缓冲溶液会影响氧化还原反应的速度,进而影响Cu2+测定的准确性。图7为柠檬酸-柠檬酸钠、酒石酸-酒石酸钠、醋酸-醋酸钠和硝酸-硝酸钠(浓度为0.1 mol/L,并用NaOH调至pH 4.8)作为缓冲溶液时0.1 mg/L Cu2+标准溶液的溶出伏安曲线。在酒石酸-酒石酸钠溶液中,Cu2+溶液的峰电流最大,其方波溶出伏安曲线的峰形最尖锐。其原因可能是在电场作用下,Cu2+与酒石酸发生了如图7所示的配合反应(R代表酒石酸)。在此反应过程中,酒石酸和银纳米线柔性电极对目标离子的还原反应都起到了催化作用,从而使峰电流增加。另外,酒石酸也可通过配位的形式成为Cu2+扩散的载体,进而加快了扩散速度,使峰电流增加。因此,本研究选择0.1 mol/L酒石酸-酒石酸钠缓冲溶液为支持电解质溶液。
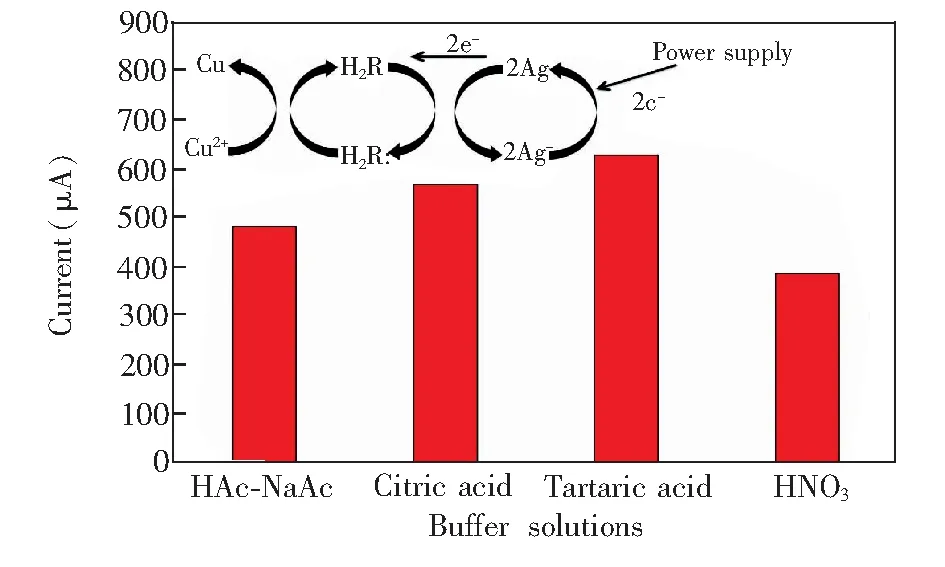
图7 缓冲溶液种类对0.1 mg/L Cu2+溶出峰电流的影响Fig.7 Influence of different buffer solutions on stripping peak currents of 0.1 mg/L Cu2+
3.3.4富集电位和富集时间对Cu2 +测定的影响考察了当富集电位为-0.4、-0.5、-0.6、-0.7和-0.8 V时0.1 mg/L Cu2+标准溶液的溶出峰电流的变化趋势。结果表明,富集电位从-0.4 V到-0.6 V,溶出峰电流不断增加,说明电位越负,溶液中的Cu2+越容易扩散到电极表面进行还原; 但当电位继续降低时,溶出峰电流则呈逐渐降低的趋势,这可能是更负的电位为溶液中的一些杂离子的析出提供了条件,影响了Cu2+的析出,因此选择-0.6 V为最佳富集电位。
分别测试了富集时间为400、500、600、700和800 s时 0.1 mg/L Cu2+标准溶液的溶出峰电流。结果表明,在富集过程中,随富集时间的延长,Cu2+在电极表面的析出量而逐渐增多,但富集时间过长将导致低浓度检测液中的铜在电极上达到富集饱和,检测范围变窄。当富集时间为600 s时,峰电流的RSD值最低(0.1%),精密度最好,故选择600 s为优化的富集时间。
3.4 共存离子的影响

图8 不同浓度Cu2+的方波溶出伏安曲线,插图为标准曲线Fig.8 Stripping voltammetry curves of different concentrations of Cu2+, inset is calibration curve
考察了其它金属离子对检测Cu2+的影响。在0.1 mg/L Cu2+标准溶液中加入10倍浓度干扰离子Ca2+、Fe3+、K+、Mg2+、Na+后测定Cu2+峰电流,其相对误差(n=5)均小于5.0%,干扰较小; 加入与Cu2+等量(0.1 mg/L)的Pb2+作为干扰离子时,得到的相对误差(n=5)为-5.9%,说明Pb2+对Cu2+的测定略有干扰,这可能是由于Pb2+和Cu2+在电极表面形成混合层,影响了Cu2+的溶出,导致Cu2+的溶出峰电流降低。当加入等量的Na2SO4作为掩蔽剂后,平均相对误差降低至0.4%,说明解除了Pb2+的干扰。
3.5 线性范围及检出限
在优化的实验条件下,测定不同浓度Cu2+标准溶液的方波溶出伏安曲线。如图8所示,Cu2+的溶出峰电流随着Cu2+浓度的增加而逐渐增大,与Cu2+的浓度在0.001~0.100 mg/L范围内呈线性关系。线性回归方程为ip(μA)=195.87+3651.39C(mg/L),相关系数R2=0.9954,检出限为9.27×10-5mg/L(3σ)。将本方法的检测性能与文献以及国标方法进行比较,结果见表1, 可见本方法的检测范围较宽,检出限低于文献和国家环境保护标准中Cu2+检测方法。
3.6 实际水样中Cu2+的测定
采用本法测定了实际水样中Cu2+的含量,结果见表2。3种水样中Cu2+的加标回收率分别为95.5%、 98.7%和 101.9%。10次平行测定的相对标准偏差RSD值分别为3.6%、0.2%和0.2%。其中,自来水满足《生活饮用水卫生标准》(GB5749-2006),校园内河水和校园景观湖水满足《地表水环境质量标准》(GB3838-2002)Ⅲ类标准。
表1 文献及国家环境保护标准中Cu2+的检测方法、检出限及线性范围
Table 1 Detection methods, detection limits and linear range of Cu2+in recent literatures
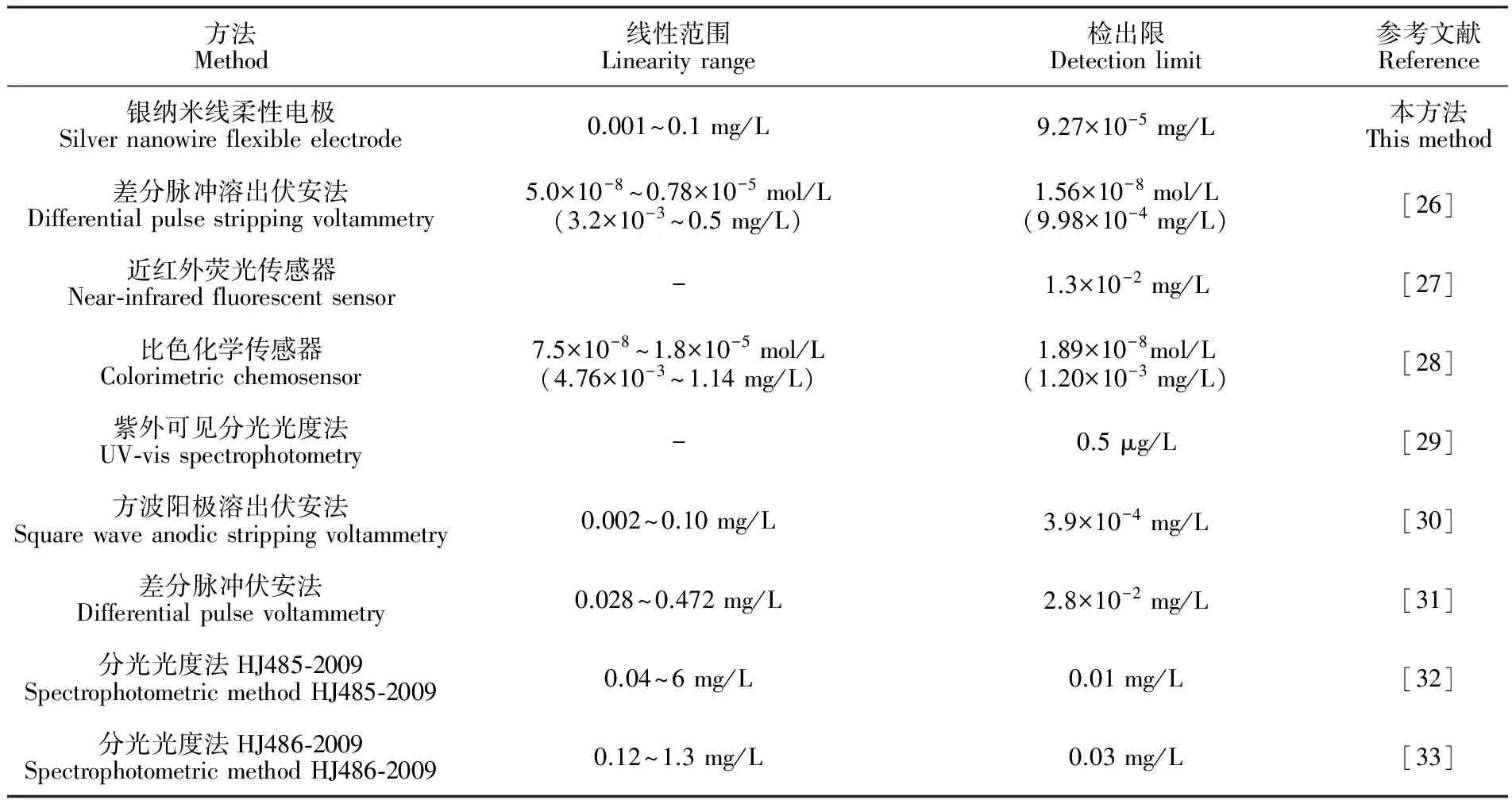
方法Method线性范围Linearityrange检出限Detectionlimit参考文献Reference银纳米线柔性电极Silvernanowireflexibleelectrode0.001~0.1mg/L9.27×10-5mg/L本方法Thismethod差分脉冲溶出伏安法Differentialpulsestrippingvoltammetry5.0×10-8~0.78×10-5mol/L(3.2×10-3~0.5mg/L)1.56×10-8mol/L(9.98×10-4mg/L)[26]近红外荧光传感器Near⁃infraredfluorescentsensor-1.3×10-2mg/L[27]比色化学传感器Colorimetricchemosensor7.5×10-8~1.8×10-5mol/L(4.76×10-3~1.14mg/L)1.89×10-8mol/L(1.20×10-3mg/L)[28]紫外可见分光光度法UV⁃visspectrophotometry-0.5μg/L[29]方波阳极溶出伏安法Squarewaveanodicstrippingvoltammetry0.002~0.10mg/L3.9×10-4mg/L[30]差分脉冲伏安法Differentialpulsevoltammetry0.028~0.472mg/L2.8×10-2mg/L[31]分光光度法HJ485⁃2009SpectrophotometricmethodHJ485⁃20090.04~6mg/L0.01mg/L[32]分光光度法HJ486⁃2009SpectrophotometricmethodHJ486⁃20090.12~1.3mg/L0.03mg/L[33]
表2 实际水样中Cu2+的测定结果
Table 2 Determination of Cu2+concentration in real water sample
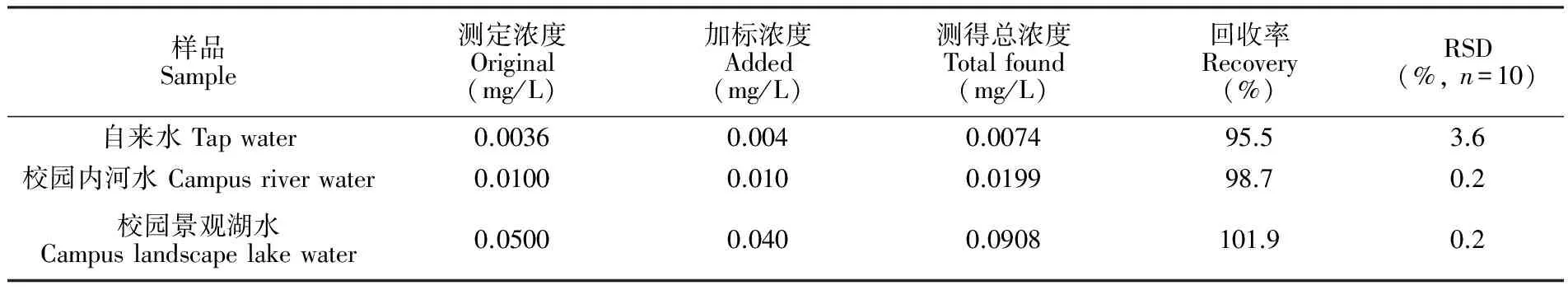
样品Sample测定浓度Original(mg/L)加标浓度Added(mg/L)测得总浓度Totalfound(mg/L)回收率Recovery(%)RSD(%,n=10)自来水Tapwater0.00360.0040.007495.53.6校园内河水Campusriverwater0.01000.0100.019998.70.2校园景观湖水Campuslandscapelakewater0.05000.0400.0908101.90.2
4 结 论
采用方波溶出伏安法,以自制的银纳米线柔性电极为工作电极,在0.1 mol/L 酒石酸-酒石酸钠缓冲溶液(pH 4.8)为支持电解质、Bi3+浓度为0.5 mg/L、富集电位为-0.6 V、富集时间600 s的优化实验条件下,建立了测定Cu2+的方法。本方法对Cu2+的检出限为9.27×10-5mg/L。与商品金电极和银电极相比,此电极对重金属离子具有更好的电化学响应,且所用基底材料PDMS本身具有良好的可塑性、可弯折性、可拉伸性及生物相容性。此银纳米线柔性电极具有良好的应用前景。
1 GBZ/T 5749-2006.StandardsforDrinkingWaterQuality. National Standards of the People's Republic of China
生活饮用水卫生标准. 中华人民共和国国家标准. GBZ/T 5749-2006
2 Valko M, Jomova K, Rhodes C J, Kucˇa K, Musílek K.Arch.Toxicol.,2016, 90(1): 1-37
3 Zhang M, Ye B C.Analyst,2011, 136(24): 5139-5142
4 Qing Z, Mao Z, Qing T, He X, Zou Z, He D.Anal.Chem.,2014, 86(22): 11263-11268
5 SU Yao-Dong, ZHU Wen-Ying, QIN Li, CHEN Long-Wu.SpectroscopyandSpectralAnalysis,2006, 26(5): 959-962
苏耀东, 朱文颖, 覃 俐, 陈龙武. 光谱学与光谱分析,2006, 26(5): 959-962
6 Amberger M A, Barth P, Förster O, Broekaert J A C.Microchim.Acta,2011, 172(3-4): 261-267
7 Djedjibegovic J, Larssen T, Skrbo A, Marjanovic' A, Sober M.FoodChem.,2012, 131(2): 469-476
8 Kopylovich M N, Mahmudov K T, Pombeiro A J L.J.Hazard.Mater.,2011, 186(2-3): 1154-1162
9 Yi W J, Li Y, Ran G, Luo H Q, Li N B.Sens.ActuatorsB,2012, 166-167(6): 544-548
10 Pujol L, Evrard D, Groenen-Serrano K, Freyssinier M, Ruffien-Cizsak A, Gros P.Front.Chem.,2014, 2: 19
11 Lee D, Lee H, Ahn Y, Jeong Y, Lee D Y, Lee Y.Nanoscale,2013, 5(17): 7750-7755
12 Liu W Y, Zhao M M, Guo X D, Tang J.J.MeasurementSci.Instrument.,2016, 7(4): 307-316
13 He W W, Ye C H.J.MeasurementSci.Instrument.,2015, 31(6): 581-588
14 Xu F, Zhu Y.Adv.Mater.,2012, 24(37): 5117-5122
15 Lee J Y, Shin D, Park J.ThinSolidFilms,2016, 608: 34-43
16 Madaria A R B M, Kumar A, Zhou C.Nanotechnology,2011, 22(24): 245201
17 Yusoff A, Mohd R, Lee S J, Shneider F K, da Silva W J, Jang J.Adv.EnergyMater,2014, 4(12): 1301989
18 Kim B S, Shin K Y, Pyo J B, Lee J H, Son J G, Lee S S, Park J H.ACSAppl.Mater.Interfaces,2016, 8(4): 2582-2590
19 Liu S, Liu W, Yu J, Zhang W, Zhang L, Wen X, Yin Y, Xie W.J.Mater.Chem.C,2014, 2(5): 835-840
20 WANG Wei-Xin, LIU Wei-Ping, WU Bin, LIANG Guang-Tie, LIU Da-Yu.ChineseJ.Anal.Chem.,2015, 43(5): 637-642
王伟鑫, 刘未平, 吴 斌, 梁广铁, 刘大渔. 分析化学,2015, 43(5): 637-642
21 Akter T, Kim W S.ACSAppl.Mater.Interfaces,2012, 4(4): 1855-1859
22 He T, Liang Q, Zhang K, Mu X, Luo T, Wang Y, Luo G.Microfluid.Nanofluid.,2011, 10(6): 1289-1298
23 HUANG Hui, ZHANG Wen-Kui, MA Chun-An, GE Zhong-Hua, LU Huan-Ming, ZHANG Xiao-Bin.Chem.J.ChineseUniversity,2002, 23(11): 2151-2154
黄 辉, 张文魁, 马淳安, 葛忠华, 卢焕明, 张孝彬. 高等学校化学学报,2002, 23(11): 2151-2154
24 Sabri Y M, Ippolito S J, Tardio J, Bansal V, O'Mullane A P, Bhargava S K.Sci.Rep.,2014, 4(4): 6741
25 Hwang G H, Han W K, Park J S, Kang S G.Talanta,2008, 76(2): 301-308
26 ZHANG Xing, XIAO Jian-Lin, LIU Jian-Yun.J.Anal.Sci.,2013, 29(3): 333-337
张 星, 肖健林, 刘建允. 分析科学学报,2013, 29(3): 333-337
27 Yordkhuan T, Sopida T, Adisri C, Jitnapa S, Kevin B, Nantanit W.DaltonTrans.,2017, 46: 16251-16256
28 Zohreh P, Pouya H, Milad J L Arash V.Ultrason.Sonochem.,2018, 41: 337-349
29 Wen X D, Yang Q L, Yan Z D, Deng Q W.Microchem.J.,2011, 97(2): 249-254
30 Mahsa M, Jahan B R, Sayed R H, Reza O.J.IranianChem.Soc.,2017, 14(6): 1263-1270
31 Shirley T P, Donald J S U, Michelle T N, Toni B G L.Mater.Res.Express,2017, 4(11): 116406
32 HJ 485-2009,WaterQuality-DeterminationofCopper-SodiumDiethydlthiocabamateSpectrophotometricMethod. National Standards of the People's Republic of China
水质铜的测定 二乙基二硫代氨基甲酸钠分光光度法. 中华人民共和国国家标准. HJ 485-2009
33 HJ 486-2009,WaterQuality-DeterminationofCopper-2,9-Dimethy-1,10-PhenanthrolineSpectrophotometricMethod. National Standards of the People's Republic of China
水质铜的测定 2,9-二甲基-1,10-菲吧啉分光光度法. 中华人民共和国国家标准. HJ 486-2009
34 GB 3838-2002,EnvironmentalQualityStandardsforSurfaceWater. National Standards of the People's Republic of China
地表水环境质量标准. 中华人民共和国国家标准. GB 3838-2002

