北京动物园3只亚成体大熊猫粪便菌群比较分析
刘 燕 王 曦 刘学锋 李林海郑常明 夏茂华 张成林*
(1.北京动物园,北京,100044;2.圈养野生动物技术北京市重点实验室,北京,100044;3.国家林业局林产工业规划设计院,北京,100010)
大熊猫(Ailuropodamelanoleuca)是我国特有的濒危珍稀物种。根据全国第4次大熊猫调查的结果,野生大熊猫分布在秦岭、岷山、邓峡山、大相岭、小相岭、凉山6大山系,共有1 862只。圈养大熊猫种群数量达到375只。北京动物园作为国内少数饲养有大熊猫的动物园之一,对大熊猫的饲养非常重视。
肠道菌群对大熊猫机体健康有重要影响[1-2],其菌群多样性也受到饮食结构和生活地域的影响[3]。3只大熊猫F、D和E出生后(其中大熊猫D和大熊猫E是1对双胞胎),一直饲养于成都,于2014年10月回到北京动物园饲养。3只大熊猫刚回到北京动物园饲养后,即14月龄时,采集新鲜粪便,并于2月后,3只大熊猫在北京动物园熊猫馆的生活已经基本稳定并已形成稳定的肠内菌群以后再次采集新鲜粪便,采用高通量测序技术对粪便内细菌多样性进行分析。本实验的目的就是研究3只大熊猫在14月龄时从成都回到北京动物园饲养后,粪便菌群是否发生较大变化,探讨其是否能很好地适应新的环境。
1 实验方法
1.1 样品采集
采集北京动物园3只亚成体圈养大熊猫粪便样本19份,其中刚从成都回到北京动物园时(14月龄)的新鲜粪便样本共10份(n=3),编号为F14_1、F14_2、F14_3、F14_4、F14_5,D14_1、D14_2、D14_3,E14_1、E14_2;2个月后新鲜粪便(16月龄)样本共9份(n=3),编号为F16_1、F16_2、F16_3,D16_1、D16_2、D16_3、D16_4,E16_1、E16_2。
粪便采集时,戴无菌一次性手套用无菌棉签,从新鲜粪便内部采集10 g左右,用液氮保存后到回实验室,放入-80℃冰箱保存待检。
1.2 测序准备
1.2.1 基因组DNA抽提
用E.Z.N.A.®Stool DNA Kit试剂盒提取大熊猫粪便中的基因组DNA。具体操作步骤按照说明书进行。然后利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。合格后放于-20℃冰箱保存备用。
1.2.2 16S rRNA基因扩增及测序
以大熊猫基因组DNA为模板,利用正向引物338F(ACTCCTACGGGAGGCAGCA),反向引物806R(GGACTACHVGGGTWTCTAAT),扩增16S rRNA基因的V3+V4区域。
PCR 扩增反应体系:5×FastPfu Buffer 4μL,2.5 mM dNTPs 2μL,上游引物(5μM)0.8μL,下游引物(5μM)0.8μL,FastPfu 聚合酶(5U/μL)0.4μL,模板DNA 10 ng,然后补ddH2O至20μL。PCR 仪为ABI GeneAmp®9700 型。PCR反应参数为:95℃3 min;95℃ 30 s,55℃ 30 s,72℃ 45 s;共27个循环,72℃ 10 min,最后保持在10℃。每个样本3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测PCR 产物,扩增产物3μl上样电泳检测。
1.2.3 扩增产物的纯化和回收
合格样本,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收纯化PCR产物。
2 高通量测序
2.1 测序
扩增产物送上海美吉生物医药科技有限公司,利用Illumina MiSeq测序平台进行高通量商业化测序。
2.2 数据分析
2.2.1 测序结果分析
经MiSeq测序得到的PE reads,根据Overlap关系进行拼接,然后对序列质量进行过滤和质控。
2.2.2 物种组成分析
应用软件Usearch(Version 7.0)在相似性为97%的条件下,对OUT的代表序列进行聚类分析和物种分类学分析。
2.2.3 Alpha多样性分析
应用Mothur软件(Version v.1.30.1)进行Chao、Coverage、Shannon、Simpson 4种常用指数的测定。基于OUT聚类分析的结果,再进行多样性指数分析和测序深度检测。
2.2.4 Beta多样性分析
应用QIIME软件(Version 1.9.1)进行分析。根据各个样品OUT的种类及丰度,根据Bray_curtis距离进行作图,R值越接近1表示组间差异越大于组内差异,R值越小则表示组间和组内没有明显差异。基于物种分类学分析的结果,在各个分类水平上,进行菌群结构的分析;在上述分析的基础上,对多样本的群落组成和系统发育信息进行多元分析和差异显著性检验等一系列深入的统计学以及可视化分析。
3 结果
3.1 测序结果
19份大熊猫粪便样品经过测序,共获得698 191条有效序列,平均每个样品含有36 746条序列,每条序列的平均长度是445 bp。这些序列共分属于9个门、16纲、27目、45科、75属、103种、138个OUT。其中124个OUT为14月龄和16月龄共享OUT(图1);大熊猫F、D和E共享OUT为90个(图2)。

图1 14月龄组和16月龄组粪样细菌OUT维恩图Fig.1 Venn diagram showing the OTUs of fecal bacteriabetween 14 months and 16 months

图2 大熊猫F、D和E粪样细菌OUT维恩图Fig.2 Venn diagram showing the OTUs of fecal bacteriaof panda F、D and E
3.2 物种组成分析
本次测定大熊猫粪便菌群主要属于变形菌门(Proteobacteria)平均占55.5%,厚壁菌门(Firmicutes)平均占42.5%和蓝菌门(Cyanobacteria)平均占1.68%。
在属水平上,大肠志贺氏杆菌属(Escherichiashigella)平均占50.1%,狭义梭菌属(Clostridiumsensustricto)平均占13.8%,链球菌属(Streptococcus)平均占11.7%,乳杆菌属(Lactobacillus)平均占4.9%,未分类的蓝细菌(Norank-c-Cyanobacteria)平均占1.7%。
14月龄和16月龄组间比较,发现乳球菌属(Lactococcus)差异显著(P<0.05),16月龄高于14月龄。其他属之间差异不显著(P>0.05)(图3),大熊猫F、D和E之间差异不显著(P>0.05)。
3.3 Alpha多样性分析
19份样品的序列覆盖率Coverage均达到99.9%以上。14月龄和16月龄组间4种指数差异不显著(P>0.05)。大熊猫F、D和E之间4种指数差异也都不显著(P>0.05)(表1)。
表1 19份样品多样性指数

Tab.1 Diversity estimation of nineteen samples

续表1

图3 14月龄和16月龄组间多物种差异检验柱形图Fig.3 Wilcoxon rank-sum test bar plot between 14 months and 16 months

图5 大熊猫粪便细菌PCoA聚类图(百分数代表了样品受主成分影响下的相似性距离)Fig.5 PCoA diagram reflecting clustering of fecal bacillus of panda(The percentages represented the similarity distance under influence of PC)
3.4 Beta多样性分析
从图4可以看出,其R值为0.074,说明组间和组内没有明显差异,但也可以说明大熊猫F和D、F和E之间的细菌群落差异性大于D和E之间的细菌群落差异性。
同时,样品进行了聚类分析并绘制了PCoA 聚类图(图5)。可以看出,除了样品E14_2外,其他18个样品聚集度非常高。无论是按照大熊猫个体分组,还是按照月份分组,样品在图上并没有依据其组别而表现出明显的组内聚集。再次印证14月龄和16月龄之间、大熊猫F、D和E之间差异不显著。
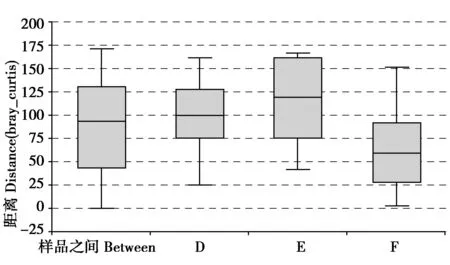
图4 在属水平大熊猫F、D和E组间距离盒状图Fig.4 Distance calculated on genus level of panda F、D and E
4 讨论
高通量测序技术,是近几年来才建立的一种研究菌群组成的全新技术[4-9],与以往的研究方法相比较,能够比较全面地反应出样品中微生物的种类[10-11]。很多珍稀濒危动物都通过该方法进行了肠道菌群分析。已有的研究表明人的优势菌门为厚壁菌门、拟杆菌门(Bacteroidetes division)、变形菌门[12-13];老虎肠道优势细菌为厚壁菌门、梭杆菌门(Fusobacteria)、拟杆菌门[14];健康成年川金丝猴(Rhinopithecusroxellana)粪样菌群以厚壁菌门和拟杆菌门为主[15];大熊猫肠道优势细菌为厚壁菌门、变形菌门、梭杆菌门[16];本研究发现,3只亚成体大熊猫优势菌群与以往研究基本相似,主要是变形菌门和厚壁菌门,但是变形菌门比例略高于厚壁菌门。一般当环境因子改变后1个月即可形成稳定菌群,为了结果更加准确,本实验选择2个月进行采样。结果发现,3只大熊猫在刚刚回到北京动物园和饲养2个月后,粪便菌群基本没有显著差异,说明14月龄的大熊猫肠道菌群已经基本稳定,可以适应一定程度的环境改变。同时也说明,北京动物园提供的饲料基本满足了其需要。乳球菌属是唯一有显著差异的属,所占比例从刚回园的0.79%,2个月后上升为2.73%。乳球菌属细菌比较常见,无致病性,是肠道内正常菌群之一。目前经常被用作轮状病毒、HBV、HCV和肠道病毒等消化道病毒疫苗的新型疫苗载体[17-18]。本例中乳球菌属比例的上升是大熊猫随着年龄的增长,肠道菌群正常发育的表现,还是环境改变所造成的还值得探讨。
[1] 鲍楠,刘成君,张和民,等.大熊猫肠道微生态的研究进展[J].畜牧与兽医,2005,37(4):57-59.
[2] 邹兴淮,曾鲁军,孙中武,等.大熊猫疾病死亡因素分析及其保护对策[J].东北林业大学学报,1998,26(1):53-56.
[3] Moore W E C,Holdeman L V.Discussion of current bacteriological investigations of the relationships between instestinal flora,diet,and colon cancer[J].Cancer Research,1975,35(11 Part 2):3418-3420.
[4] 王立志,徐谊英,蔡永华.高通量测序分析人工养殖成年林麝粪便古菌菌群多样性[J].动物营养学报,2016,28(2):477-484.
[5] 黄志涛,宋协法,李勋,等.基于高通量测序的石斑鱼循环水养殖生物滤池微生物群落分析[J].农业工程学报,2016,32(增刊1):242-247.
[6] 曹荣,刘淇,赵玲,等.基于高通量测序的牡蛎冷藏过程中微生物群落分析[J].农业工程学报,2016,32(20):275-280.
[7] 宋云龙,张金松,朱佳,等.基于高通量测序的微生物强化污泥减量工艺中微生物群落解析[J].中国环境科学,2016,36(7):2099-2107.
[8] 蔡言安,李冬,毕学军,等.基于不同测序技术的生物群落结构及功能菌分析[J].中国环境科学,2016,36(6):1830-1834.
[9] 滑留帅,王璟,徐照学,等.16S rRNA基因高通量测序分析牛粪发酵细菌多样性[J].农业工程学报,2016,32(增刊2):311-315.
[10] Sogin M L,Morrison H G,Huber J A,et al.Microbial diversity in the deep sea and the underexplored “rare biosphere”[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(32):12115-12120.
[11] Caporaso J G,Lauber C L,Walters W A,et al.Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample[J].Proceedings of the National Academy of Sciences of the United States of America,2011,108(Supplement 1):4516-4522.
[12] Wang Tingting,Cai Guoxiang,Qiu Yunping,et al.Structural segregation of gut microbiota between colorectal cancer patients and healthy volunteers[J].The ISME Journal,2012,6(2):320-329.
[13] 陈群,鲍大鹏.人及动物胃肠道正常微生物群的研究[J].安徽农业技术师范学院学报,1999,13(4):39-42.
[14] 田银平.人工饲养条件下虎肠道菌群结构研究[D].哈尔滨:东北林业大学,2013.
[15] 王剑,王强,曾东,等.健康和腹泻川金丝猴粪样菌群比较分析[J].中国兽医学报,2015,35(8):1232-1238.
[16] Zhu Lifeng,Wu Qi,Dai Jiayin,et al.Evidence of cellulose metabolism by the giant panda gut microbiome[J].Proceedings of the National Academy of Sciences of the United States of America,2011,108(43):17714-17719.
[17] 李文桂,陈雅棠.人乳头瘤病毒16型重组乳球菌疫苗的研制现状[J].中国感染控制杂志,2016,15(10):802-806.
[18] 李文桂,陈雅棠.乳球菌介导的重组细菌疫苗的研制现状[J].国外医学:医学地理分册,2016,37(1):1-12.

