氯化钠浓度对含猪血浆蛋白水解物的乳状液稳定性的影响
曹传爱,李月,商旭,刘骞
(东北农业大学食品学院,黑龙江哈尔滨150030)
乳状液是一种胶体分散体,其中一种不相容液体以小液滴的形式分散在另一种不相容液体中。食品工业中,这两种不混溶的液体通常是油和水,因此可以形成油包水(Water-in-oil,W/O)或水包油(Oil-in-water,O/W)型乳状液。O/W型乳状液在食品中广泛存在,但是容易发生絮凝、分层、聚集等不稳定现象。乳状液的稳定性取决于油滴的性质和相互作用。两亲性乳化剂,如蛋白质由于具有两亲性质和成膜能力,可以降低界面张力吸附在界面上,产生的油滴较小。同时,油滴之间的相互作用力对于储存过程中乳状液稳定性至关重要。吸引力(例如范德华力和疏水性)导致液滴聚集而不稳定,而排斥力(例如空间位阻)导致液滴比较稳定[1]。因此,通过添加乳化剂降低界面张力或增加油滴之间的斥力稳定乳状液。然而,研究发现一些食品级表面活性剂(比如吐温、斯潘、单甘酯等)能够与蛋白水解物协同作用在油滴表面,改善由蛋白水解物制备的乳化体系的稳定性[2]。适度水解的蛋白质相对于未水解蛋白来说,能够在一定程度上改善其自身的乳化活性,主要归因于长肽链灵活可变的构象以及由于水解而暴露出来的疏水核心[3]。Liu等[4]研究发现通过添加猪骨蛋白水解物(porcine bone protein hydrolysates,PBPH),O/W乳状液的氧化和乳化稳定性均提高。不同浓度PBPH乳液的EAI和ESI值均有所提高,这归因于Zeta-电位增大,粒径减小和界面层增强。含有0.75%PBPH的乳状液比其他浓度PBPH乳状液具有更紧密的界面膜,可以有效地防止液滴聚集,抑制乳液的脂质氧化。李月等[5]研究发现将不同浓度(0~20mg/mL)的PPPH添加到由Tween-20制备的O/W型乳状液中,添加猪血浆蛋白水解物(Porcine plasma protein hydrolysate,PPPH)能够显著提高整个乳状液的氧化稳定性。
蛋白质组成、pH值、温度和离子强度对乳状液的形成、稳定性和功能特性起着重要的作用[6-8]。蛋白质的吸附可以通过盐离子(例如NaCl,KCl和CaCl2)调节。盐离子能够破坏蛋白质表面的双电层并产生静电屏蔽作用,极大地消耗液滴之间的静电排斥力,是影响乳状液稳定性的重要因素。Delahaije等[9]研究发现离子浓度高于150 mmol/L时,乳状液发生絮凝。增加蛋白质表面的疏水基团可以抑制盐离子诱导的乳状液絮凝,可能是疏水性增加导致所带负电荷增加,使得离子强度造成的静电屏蔽作用减弱。Cui等[10]研究不同浓度的氯化钠对Tween-20制备的O/W乳状液稳定性的影响,NaCl浓度对乳状液滴大小没有影响,但是添加NaCl可以促进脂质氧化。至今为止,添加NaCl对于蛋白水解物制备的O/W型乳状液的研究较少。
因此,本试验以Tween-20和适度水解的PPPH联合制备O/W型乳化体系,通过添加不同浓度的NaCl分析乳状液的物理稳定性 [粒径、絮凝指数(Flocculation index,FI)、凝结指数(Condensation index,CI)、Zeta-电势、蛋白分配系数]和氧化稳定性[共轭二烯烃值(Conjugated diene,CD)、硫代巴比妥酸值(Thiobarbituric acid reactive substances,TBARS)],为在复杂食品乳化体系中的应用奠定理论基础。
1 材料与方法
1.1 材料与试剂
猪血浆蛋白粉(蛋白含量70%):黑龙江北大荒肉类有限公司;碱性蛋白酶(酶活为2.4 AU/g):丹麦Novozymes公司;菜籽油:哈尔滨九三油脂有限责任公司;十二烷基磺酸钠(SodiumDodecylSulfonate,SDS):Sigma公司;磷酸二氢钠、磷酸氢二钠:天津市巴斯夫化工有限公司;硫代巴比妥酸、三氯乙酸、盐酸、异辛烷、异丙醇(均为分析纯试剂):哈尔滨市万太生物药品公司;试验用水均为超纯水。
1.2 仪器与设备
JD500-2电子天平:沈阳龙腾电子称量仪器有限公司;AL-104型精密电子天平:上海梅特勒-托利多仪器设备有限公司;DK-8B电热恒温水浴锅:上海精宏实验设备有限公司;JB-2恒温磁力搅拌器:上海雷磁新泾仪器有限公司;GL-21M冷冻离心机:湖南湘仪实验室仪器开发有限公司;T18匀浆机:德国IKA公司;UT-1800紫外可见光分光光度计:北京普析通用仪器有限公司;SPCH-10高压均质机:安盛联合科技有限公司。
1.3 方法
1.3.1 猪血浆蛋白水解物的制备
参照Liu[11]等的方法将经过加热处理(95℃,5 min)的猪血浆蛋白水溶液(4%,pH 8.0)用碱性蛋白酶(酶与底物浓度质量比为2∶100)进行水解,水解温度为55℃,时间为1 h。水解过程中加入1 mol/L NaOH,保持溶液pH=8.0。水解结束后在95℃水浴中加热5 min灭酶,然后用1 mol/L HCl调节水解液pH值使其pH=7.0。水解物在7 500 r/min离心10 min除去悬浮物。
1.3.2 PPPH乳状液的制备
将菜籽油和水相溶液按照1∶9(质量比)的比例混合,用高速均质机在13 500 r/min下均质2 min,然后用高压均质机在35 MPa条件下均质两次。配制浓度为0、200、400、600 mmol/L 的 NaCl,乳状液用不同浓度的NaCl溶液按照相同体积比稀释至油相浓度5 wt%,加入0.03%叠氮钠进行抑菌。其中,水相为10mg/mL的Tween-20溶于最终浓度为2.5mg/mL的PPPH溶液。
1.3.3 粒径大小与分布
采用马尔文2000激光粒度散射仪测定乳状液粒径大小及分布。样品用去离子水和1%SDS溶液进行稀释,样品的遮蔽度稀释到10%~20%范围内,连续相和分散相的折射率分别为1.330和1.475。其中,d4,3表示体积平均粒径。
1.3.4 FI和CI
参照Intarasirisawat等[12]方法将乳状液溶于蒸馏水及1%SDS溶液中。FI计算公式如下:
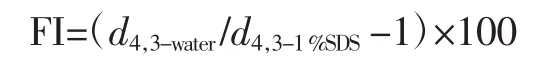
CI计算公式如下:
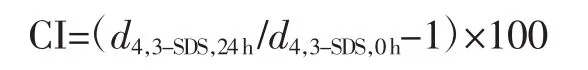
式中:d4,3-water、d4,3-1%SDS为含有去离子水和 1%SDS的乳状液的粒径,μm;d4,3-water,24h、d4,3-SDS,0h为含有 1%SDS的乳状液贮存24 h和0 h时的乳状液的粒径,μm。
1.3.5 Zeta-电势
采用Malvern Nano ZS 90型动态光散射仪在室温(大约22℃)下测定其各组乳状液的Zeta-电势。将制备的乳状液用去离子水稀释100倍,置于折叠的毛细管中,进行Zeta-电势的测定。
1.3.6 蛋白在乳状液中的分布
参照Li等[13]的方法测定新制备的乳状液中蛋白在各相的分布情况,取1 mL乳状液置于离心管中,25℃12 500 r/min条件下离心45 min,用一次性注射器吸取下层清液在相同条件下离心30 min,合并多个离心管中的下层清液过0.22 μm滤膜,使用Lowrys的方法测定蛋白含量。蛋白在两相中的分配系数计算公式如下:

式中:Vw为水的体积,mL;Vl为油的体积,mL;Wt为总蛋白含量,mg/mL;Ww为水相中的蛋白含量,mg/mL;所用油的密度为0.922 g/mL;水相中的蛋白含量占总蛋白含量的比例为(Ww/Wt);界面上吸附的蛋白含量所占的比例等于总的蛋白含量与水相中蛋白含量之差。
1.3.7 CD的测定
按照Viljanen等[14]的方法测定CD的含量。将0.1mL乳状液与1.5 mL异辛烷/异丙醇(3∶1,体积比)混合,振荡10 s(3次)。在456 r/min下离心5 min得到有机溶剂相,取0.2 mL有机相,4.8 mL异辛烷混匀,234 nm下测量吸光度,使用25 200/(mol/L·cm)作为摩尔消光系数来计算CD。计算公式如下:

式中:A为吸光值;b为光程长度,cm;ε为摩尔消光系数,25 200/(mol/L·cm)。
1.3.8 TBARS的测定
参考Mei等[15]的方法并稍作修改测量乳状液次级氧化产物TBARS的变化。硫代巴比妥酸溶液的配制:0.375 g硫代巴比妥酸,15 g三氯乙酸,1.76 mL 12 mol/L的浓盐酸和82.9 mL水混合,溶解后加入3 mL 2%的水杨酸溶液,混匀。取4 mL上述溶液,1 mL乳状液样品以及1 mL水混合,沸水浴加热15 min,冷却至室温,经过0.45 μm滤膜过滤得到滤液,然后在532 nm处测其吸光度。以1,1,3,3-四乙氧基丙烷做标准曲线,确定样品中的TBARS值。
1.4 统计分析
每个试验重复3次,结果表示为平均值±标准差。数据统计分析采用Statistix 8.1(分析软件,St Paul,MN)软件包中Linear Models程序进行,差异显著性(P<0.05)分析使用Tukey HSD程序,采用Sigmaplot 12.5软件作图。
2 结果与分析
2.1 乳状液的粒径及分布的变化
乳状液中液滴颗粒的大小会影响乳状液的物理稳定性和氧化稳定性。乳状液中的液滴颗粒越大,乳化体系越不稳定。不同浓度NaCl对O/W型乳状液粒径的影响见表1。
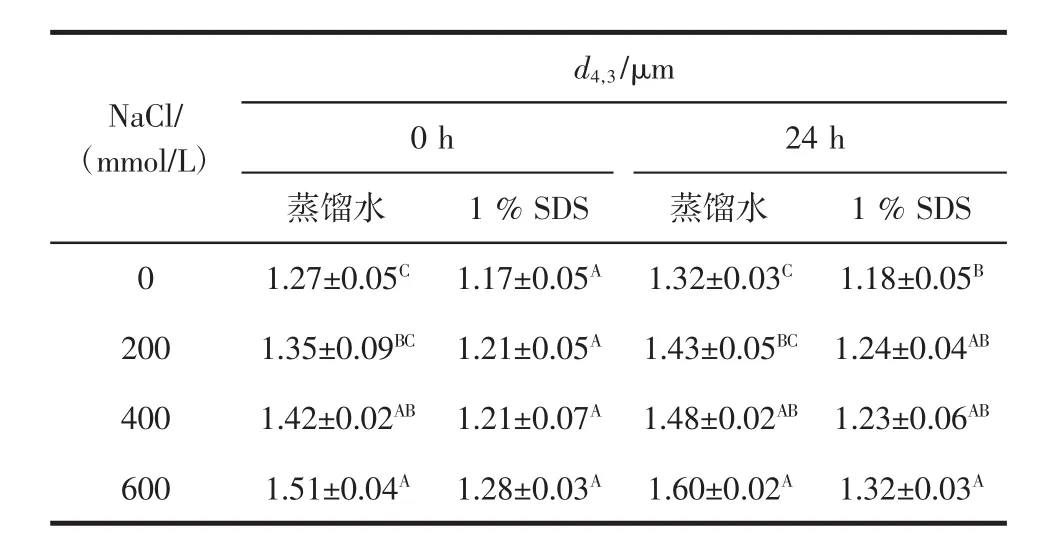
表1 不同浓度NaCl对O/W型乳状液粒径的影响Table 1 Effect of different concentrations of NaCl incorporation on particl of oil-in-water emulsion
由表1可知,不同浓度的NaCl对O/W型乳状液的粒径变化有显著影响。在研究中分别选择蒸馏水和1%SDS稀释乳状液,用蒸馏水稀释乳状液可以降低液滴周围的水溶液的离子强度,测量的粒度反映任何不可逆的絮凝[16];由于1%SDS破坏油滴的絮凝,因此用1%SDS作为分散剂得到d4,3,可以反映单个油滴的大小。随着添加NaCl浓度的增加,用蒸馏水稀释新制备的乳状液和用1%SDS稀释新制备的乳状液所测量的粒径均呈现逐渐增加的趋势(P<0.05)。在NaCl浓度为600 mmol/L时,乳状液的粒径最大,说明添加NaCl使得乳状液颗粒分布不均匀,乳化体系不稳定。Yu等[17]研究表明油滴粒径越大,对乳浊层的抵抗力越低,乳状液发生絮凝作用。Zhu等[18]研究发现,NaCl添加降低蛋白质表面上带相反电荷基团之间静电引力,降低油滴之间的交联。在较高盐含量下观察到一些液滴分层。这可能是由于油滴之间吸引力减弱,使得它们在重力作用下重新排列。当乳状液发生絮凝时,乳状液分散于1.0%SDS中所得的粒径相比于分散于蒸馏水中的将会减小。24 h时用蒸馏水稀释的乳状液测量的粒径随着添加NaCl浓度的增加而增加(P<0.05),这可能是由于乳状液发生絮凝作用所致。
2.2 乳状液的FI和CI的变化
FI可以用来评价乳状液物理稳定性,絮凝导致乳状液粒径变大而分层,或者由于液滴相互靠近而聚结[19]。CI表示乳状液在一段时间内对抗重力分离的稳定性,为乳状液液滴聚集程度提供间接信息[20],因此FI和CI是用来衡量乳状液稳定性的重要参数。不同浓度NaCl对O/W型乳状液絮凝指数和凝结指数的影响如表2所示。
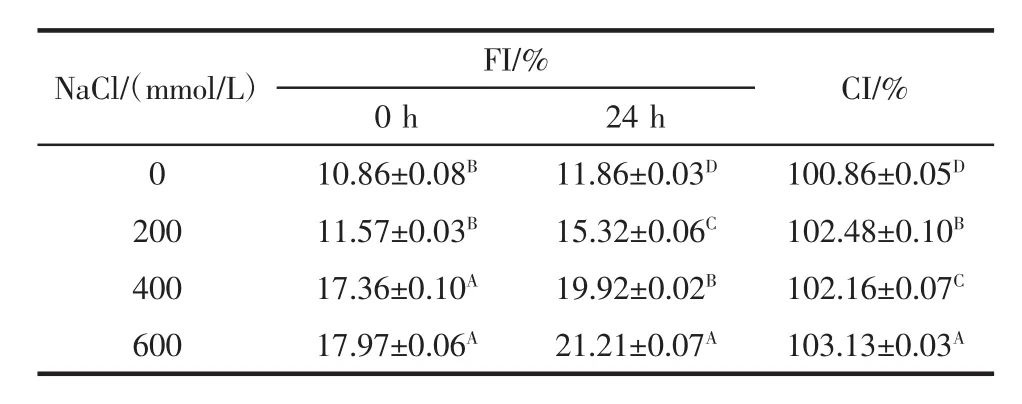
表2 不同浓度NaCl对O/W型乳状液絮凝指数和凝结指数的影响Table 2 Effect of different concentrations of NaCl incorporation on flocculation index and creaming index of oil-in-water emulsion
随着NaCl浓度的增加,FI和CI均呈上升趋势(P<0.05)。FI增加归因于O/W型乳状液油滴间的接触。由于PPPH界面膜受到抑制,油滴发生移动,油滴聚集,导致FI增加。随着添加NaCl,提高乳状液中水相的离子强度,降低粒子间的静电排斥力,诱发粒子絮凝或者聚合。CI增加归因于添加NaCl浓度的增加,除液滴粒径增大外,PPPH界面膜厚度降低,因此CI较高,乳状液不稳定。
2.3 乳状液的Zeta-电势的变化
不同浓度NaCl对O/W型乳状液Zeta-电势变化如图1所示。
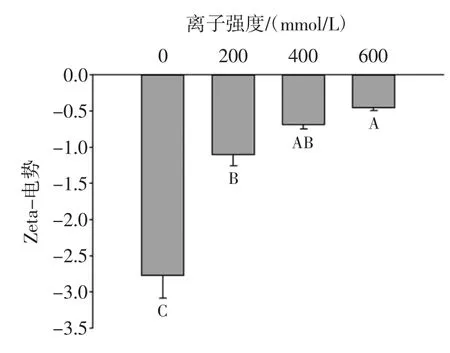
图1 不同浓度NaCl对O/W型乳状液Zeta-电势的影响Fig.1 Effect of different concentrations of NaCl incorporation on Zeta-potential of oil-in-water emulsion
由图1可知,不同NaCl浓度的乳状液Zeta-电势均小于0,即所有乳状液均带负电荷。未添加NaCl的乳状液电势为-2.7 mV,这是由于中性条件下,羧基和氨基未发生质子化,导致负电荷的产生[21]。随着NaCl浓度的增加,乳状液电势绝对值呈现降低趋势,即液滴表面所带负电荷逐渐减少(P<0.05),导致静电斥力减少。盐的筛选效果会显著降低聚电解质之间的静电斥力,最终导致液滴聚集[22]。这种效应是由于液滴表面上的阴离子基团(-COO-)周围的抗衡离子(Na+)的积累,由于静电屏蔽效应而减少液滴表面的净电荷。离子强度对液滴聚集有明显的影响,在低NaCl浓度下,液滴之间的静电斥力足以克服静电引力,抑制液滴聚集[23]。相反,在足够高的NaCl水平下,静电引力大于静电斥力,从而导致液滴聚集[24]。盐还可能改变蛋白质和肽的溶解度,可能导致液滴聚集并改变其形成和稳定乳液的能力[25]。另外,Zeta-电势的变化与NaCl浓度不是呈线性相关的,NaCl浓度从0 mmol/L增加到100 mmol/L时,电势绝对值显著降低,这可能是乳状液中的一些颗粒更容易被盐离子中和,因此少量的盐足以削弱静电相互作用。
2.4 乳状液蛋白分布的变化
不同浓度的NaCl对PPPH制备的O/W型乳状液中水相及界面中蛋白分布情况如表3所示。
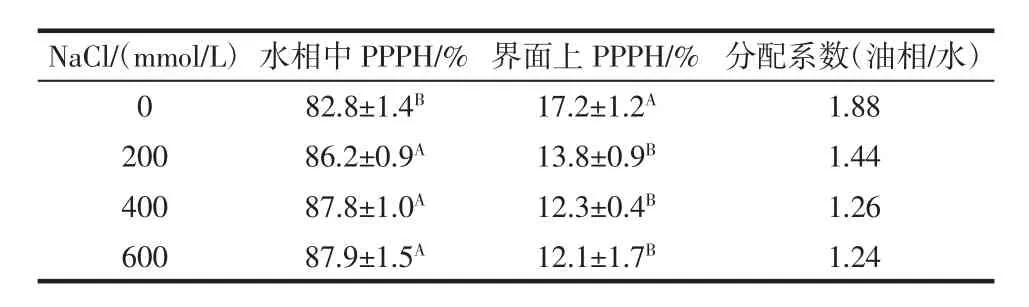
表3 不同浓度NaCl对O/W型乳状液中水相及界-面中蛋白分布的影响Table 3 Effect of different concentrations of NaCl incorporation on Interfacial protein distribution and partition coefficient of oilin-water emulsion
未添加NaCl的乳状液的PPPH在界面处的蛋白分布为17.2%,大部分PPPH分布在水相中。随着NaCl浓度的增加,PPPH在界面处的蛋白分布逐渐降低(P<0.05),NaCl浓度为 600 mmol/L 时,乳状液的界面蛋白分布率最低,其分配系数最低,仅为1.24。这说明增加NaCl浓度可以降低吸附在界面上的PPPH与Tween20竞争吸附在在界面上的能力,使得PPPH吸附到界面的能力减弱,导致界面蛋白含量降低,界面张力增加,界面膜较薄。也可能是由于Na+与PPPH结合,间接吸附到油滴的表面。
2.5 乳状液贮藏期间CD的变化
不同浓度NaCl添加对O/W型乳状液储藏期间CD值的变化如图2所示。
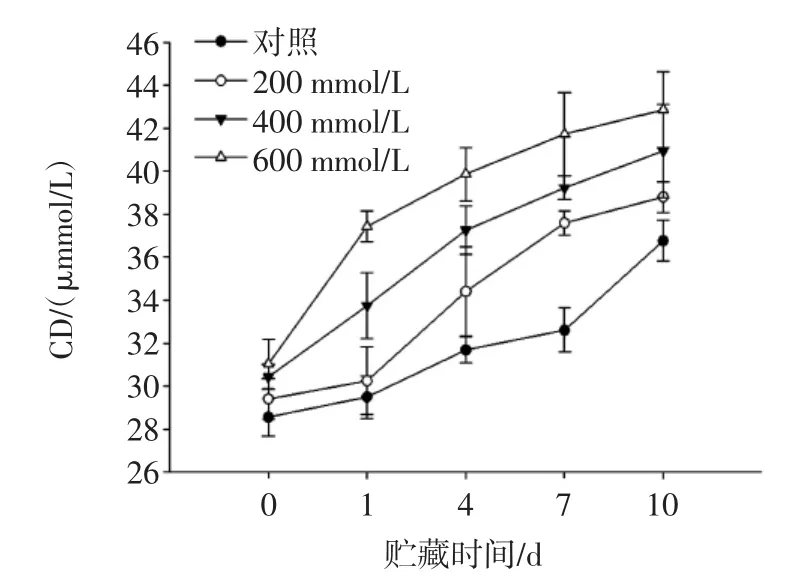
图2 不同浓度NaCl添加对O/W型乳状液储藏期间CD值的影响Fig.2 Effect of different concentrations of NaCl incorporation on CD of oil-in-water emulsion during storage
贮藏期间CD值的变化可以较可靠的反映乳状液油脂初级氧化的程度。CD值越大,表示乳化体系中油脂氧化程度越高,体系氧化稳定性越低。由图2可知,37℃贮藏10天期间内,所有样品的CD值均呈现上升的趋势,未添加NaCl的乳状液的CD值低于添加NaCl的乳状液,且随着NaCl浓度的增加,CD值逐渐增加。其中,NaCl浓度为600 mmol/L时,CD值在贮藏期间一直保持最高。结果表明添加NaCl在一定程度上促进了脂质氧化,导致初级氧化产物的生成,降低PPPH乳状液的氧化稳定性。PPPH具有一定的抗氧化性能,主要归因于清除自由基以及作为金属离子螯合剂等的协同作用[26],并且PPPH可以在油水界面处形成一层保护膜防止油脂氧化的进行[27]。随着添加NaCl浓度的增加,油水界面处的PPPH的覆盖率降低,暴露的疏水性基团减少,减少自由基与不饱和脂肪酸的接触,促进不饱和脂肪酸在一定条件下发生氧化。
2.6 乳状液贮藏期间TBARS的变化
脂质氧化通过自由基链式反应机制进行,其氧化过程中间产物较多,其中以醛类化合物-丙二醛研究最多。TBARS可以反映乳状液次级氧化产物的生成,进而反映脂质氧化的程度,体现乳状液的氧化稳定性。不同浓度NaCl添加对PPPH制备的O/W型乳状液在储藏期间TBARS值的变化如图3所示。
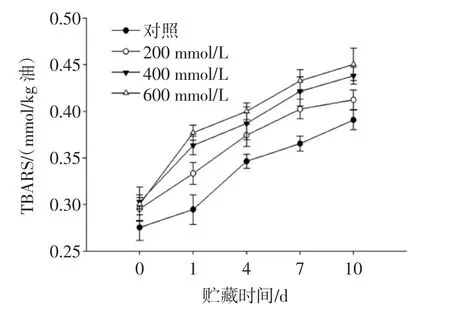
图3 不同浓度NaCl添加对O/W型乳状液在储藏期间TBARS值的影响Fig.3 Effect of different concentrations of NaCl incorporation on TBARS of oil-in-water emulsion during storage
随着贮藏期的延长,乳状液的TBARS值逐渐增加,这与CD值的变化趋势一致。与未添加NaCl的乳状液相比,随着NaCl浓度的增加,乳状液的TBARS值逐渐增加,NaCl浓度为600 mmo/L时达到最大值,且在贮藏期内,一直保持最大值。表明随着NaCl浓度的增加,促进PPPH乳状液的氧化,降低了乳化体系的稳定性。Wit等[28]的研究表明,高盐浓度使乳状液所带的负电荷减少,由于电荷屏蔽效应可能减弱蛋白质螯合金属离子的能力,导致抗氧化能力的减弱。
在O/W型乳化体系中,抗氧化剂的特定位置被认为是影响脂质氧化速率的一个重要因素。在不同的微环境中蛋白或多肽对延缓脂质氧化发挥重要作用。脂质氧化产生的初级氧化产物富集在O/W型乳状液的油水界面上,因此乳状液的氧化反应首先发生油水界面上[29-30]。自由基引发的链式反应是乳状液脂质氧化的主要途径。增加界面膜厚度和改变电势,阻断自由基生成以及清除自由基,可以抑制乳状液的氧化,提高乳液的稳定性[29]。随着NaCl浓度的增加,界面蛋白含量逐渐降低,界面膜变薄,使得添加NaCl的乳状液的稳定性较差。在前面的讨论中,随着NaCl浓度的增加,Zeta-电势绝对值逐渐降低,所带负电荷逐渐减少,和带正电荷的金属离子之间的静电吸附力逐渐降低,有利于乳状液氧化反应的进行。另外,未添加NaCl的乳状液,水相中的PPPH具有较高的ABTS+自由基清除能力,且具有一定的金属离子螯合能力和还原能力[31],因此PPPH可以阻碍自由基链式反应的进行,抑制过氧化物的分解,延缓乳状液氧化反应的进行。同时,在界面上的PPPH会形成一种物理屏障来防止过多的金属离子与脂质过氧化物发生作用[32]。因此添加NaCl促进乳状液的氧化,不利于乳化体系的稳定。
3 结论
本试验主要研究不同浓度NaCl添加对PPPH和Tween-20联合制备的O/W型乳状液物理稳定和氧化稳定性的影响。通过测量乳状液的物理稳定性(粒径、絮凝指数、凝结指数、Zeta-电势、蛋白分布)和氧化稳定性(CD值、TBARS值)发现,随着添加NaCl浓度的增加,乳状液的物理稳定性和氧化稳定性显著降低,同时界面蛋白分布情况直接验证了添加NaCl使得乳状液的物理稳定性降低。因此,本试验为乳状液在食品中的应用奠定一定的理论基础。
参考文献:
[1]Tan Y,Deng X,Liu T,et al.Influence of NaCl on the oil/water interfacial and emulsifying properties of walnut protein-xanthan gum[J].Food Hydrocolloids,2017,72:73-80
[2]Mcclements D J,Rao J.Food-grade nanoemulsions:formulation,fabrication,properties,performance,biological fate,and potential toxicity[J].Critical Reviews in Food Science&Nutrition,2011,51(4):285-330
[3]Adjonu R,Torley P,Agboola S.Whey protein peptides as components of nanoemulsions:A review of emulsifying and biological functionalities[J].Journal of Food Engineering,2014,122(1):15-27
[4]Liu H T,Li Y Y,Diao X P,et al.Effect of porcine bone protein hydrolysates on the emulsifying and oxidative stability of oil-in-water emulsions[J].Colloids and Surfaces A,2018,538:757-764
[5]李月,刘骞,陈益春,等.猪血浆蛋白水解物对水包油型乳状液氧化稳定性的影响[J].食品工业科技,2017,38(16):24-28
[6]Nguyen B T,Chassenieux C,Nicolai T,et al.Effect of the pH and NaCl on the microstructure and rheology of mixtures of whey protein isolate and casein micelles upon heating[J].Food Hydrocolloids,2017,70:114-122
[7]Wang P,Xu X,Huang M,et al.Effect of pH on heat-induced gelation of duck blood plasma protein[J].Food Hydrocolloids,2014,35(1):324-331
[8]Wang S,Shi Y,Tu Z,et al.Influence of soy lecithin concentration on the physical properties of whey protein isolate-stabilized emulsion and microcapsule formation[J].Journal of Food Engineering,2017,207:73-80
[9]Delahaije R J B M,Wierenga P A,Van N N H,et al.Protein concentration and protein-exposed hydrophobicity as dominant parameters determining the flocculation of protein-stabilized oil-in-water emulsions[J].Langmuir,2013,29(37):11567-11574
[10]Cui L,Cho H T,Mcclements D J,et al.Effects of salts on oxidative stability of lipids in Tween-20 stabilized oil-in-water emulsions[J].Food Chemistry,2016,197(Pt B):1130-1135
[11]Lam R A H,Nickerson M T.Food proteins:A review on their emulsifying properties using a structure function approach[J].Food Chemistry,2013,141(2):975-984
[12]Tanong A,Soottawat B,Wonnop V,et al.Antioxidative activity and emulsifying properties of cuttlefish skin gelatin modified by oxidised phenolic compounds[J].Food Chemistry,2009,117(1):160-168
[13]Li Y,Kong B,Liu Q,et al.Improvement of the emulsifying and oxidative stability of myofibrillar protein prepared oil-in-water emulsions by addition of zein hydrolysates[J].Process Biochemistry,2017,53(2):116-124
[14]Viljanen K,Kylli P,Kivikari R,et al.Inhibition of protein and lipid oxidation in liposomes by berry phenolics[J].Journal of Agricultural&Food Chemistry,2004,52(24):7419-7424
[15]Mei L,Mcclements D J,Wu J,et al.Iron-catalyzed lipid oxidation in emulsion as affected by surfactant,pH and NaCl[J].Food Chemistry,1998,61(3):307-312
[16]Tokle T,Mcclements D J.Physicochemical properties of lactoferrin stabilized oil-in-water emulsions:Effects of pH,salt and heating[J].Food Hydrocolloids,2011,25(5):976-982
[17]Yu C,Xiong Y L,Jie C.Antioxidant and emulsifying properties of potato protein hydrolysate in soybean oil-in-water emulsions[J].Food Chemistry,2010,120(1):101-108
[18]Zhu Y,Chen X,Mcclements D J,et al.PH-,ion-and temperaturedependent emulsion gels:Fabricated by addition of whey protein to gliadin-nanoparticle coated lipid droplets[J].Food Hydrocolloids,2018,77:870-878
[19]Dickinson E,Elverson D J,Murray B S.On the film-forming and emulsion-stabilizing properties of gum arabic:dilution and flocculation aspects[J].Food Hydrocolloids,1989,2(3):101-114
[20]Gómez-Mascaraque L G,López-Rubio A.Protein-based emulsion electrosprayed micro-and submicroparticles for the encapsulation and stabilization of thermosensitive hydrophobic bioactives[J].Journal of Colloid&Interface Science,2016,465:259
[21]Jiang J,Xiong Y L.Extreme pH treatments enhance the structurereinforcement role of soy protein isolate and its emulsions in pork myofibrillar protein gels in the presence of microbial transglutaminase[J].Meat Science,2013,93(3):469-476
[22]Kulmyrzaev A A,Schubert H.Influence of KCl on the physicochemical properties of whey protein stabilized emulsions[J].Food Hydrocolloids,2004,18(1):13-19
[23]Yang Y,Leser M E,Sher A A,et al.Formation and stability of emulsions using a natural small molecule surfactant:Quillaja saponin(Q-NaturaleⓇ)[J].Food Hydrocolloids,2013,30(2):589-596
[24]Qian C,Decker E A,Xiao H,et al.Comparison of Biopolymer Emulsifier Performance in Formation and Stabilization of Orange Oil-in-Water Emulsions[J].Journal of the American Oil Chemists Society,2011,88(1):47-55
[25]Xu H N,Liu Y,Zhang L.Salting-out and salting-in:competitive effects of salt on the aggregation behavior of soy protein particles and their emulsifying properties[J].Soft Matter,2015,11(29):5926
[26]Kaul S,Sharma S S,Mehta I K.Free radical scavenging potential of L-proline:evidence from in vitro assays[J].Amino Acids,2008,34(2):315-320
[27]Hirose A,Miyashita K.Inhibitory Effect of Proteins and their Hydolysates on the Oxidation of Triacylglycerols Containing Docosahexaenoic Acids in Emulsion[J].Nippon Shokuhin Kagaku Kogaku Kaishi,1999,46(12):799-805
[28]Wit D,Kessel J N.The effects of ionic strenght on the solubility of whey protein products:a colloid chemistry approach[J].Food Hydrocolloids,1996,10:143-149
[29]Elias R J,Kellerby S S,Decker E A.Antioxidant activity of proteins and peptides[J].Critical Reviews in Food Science&Nutrition,2008,48(5):430-441
[30]Frankel E N,Meyer A S.The problems of using one-dimensional methods to evaluate multifunctional food and biological antioxidants[J].Journal of the Science of Food&Agriculture,2000,80(13):1925-1941
[31]Wang L L,Xiong Y L.Inhibition of lipid oxidation in cooked beef patties by hydrolyzed potato protein is related to its reducing and radical scavenging ability[J].Journal of Agricultural&Food Chemistry,2005,53(23):9186-9192
[32]Yu C,Xiong Y L,Jie C.Antioxidant and emulsifying properties of potato protein hydrolysate in soybean oil-in-water emulsions.[J].Food Chemistry,2010,120(1):101-108

