植物内生菌应用于有害金属污染环境修复研究进展
张凯璇, 唐艳葵, 秦芷怡, 黄 以, 吴栋颢, 纳泽林, Thongsalak Saktikoun, 刘宇阳
(广西大学环境学院,广西南宁 530004)
城市化、工业化和集约农业的快速发展使土壤和江河湖泊均受到不同程度有害金属的污染。有害金属不仅通过直接饮用水或间接食用农产品和水产品危害人类健康,而且可能对生态系统有持久性影响[1-2]。但是,传统修复方法价格昂贵,难以处理大面积的污染,且对生态系统功能会产生一定程度的破坏[3-8]。生物修复技术因成本低廉且对生态环境友好而成为研究热点[9],主要包括植物修复、微生物修复及植物微生物联合修复技术[10]。然而,植物修复技术存在植物生长缓慢、只耐受或吸收1~2种有害金属等局限,制约该修复技术的推广应用[5,8,11-14]。微生物修复虽然具有生长快、吸附重金属速度快、吸附容量大、费用低等优点[15],但也面临着特异性差、重金属生物可利用性低、生存适应能力较差、高效菌种构建难度大、富集的金属难以从污染的水体或土壤中分离等问题[7,10,16-17]。
近年来,一些具有特定功能的内生菌从不同植物中被分离纯化出来,它们表现出可耐受、吸附、解毒重金属,促进宿主植物生长,提高植物耐受能力和增加植物对有害金属的吸收,促进有害金属在宿主植物体内转运等特点,因而成为最具有发展前景的生物修复方法[7-8,18-21]。尽管内生菌对植物生长和修复重金属环境污染的潜力已经被广泛研究,但植物-内生菌相互作用及内生菌在金属修复中潜在的作用,人们仍所知甚少。因此,本文总结植物内生菌在环境生物修复中作用的研究进展,尤其关注内生菌促进植物生长的机制,对重金属解毒、迁移及在植物体内积累的影响,及其作为生物材料在有害金属污染中的应用和前景,以期为内生菌修复技术应用于环境污染修复提供新思路。
1 有害金属耐受型内生菌的多样性
超富集植物体内累积大量的有害金属为其内生菌提供了特殊的生存环境,从而具有适应高浓度污染物的能力。目前,已从龙葵、东南景天、商陆等超富集植物体内分离出能耐受金属的内生菌。笔者所在课题组也从几种锰超富集植物的根、茎、叶等组织中分离出对锰及其他有害金属有耐受能力的内生菌(待发表)。由表1可知,近年来,从超富集植物中分离出有耐受重金属能力的内生菌,其植物修复主要应用于土壤修复,因此重金属超富集植物大部分为陆生植物,且植物内生菌大多从土壤等周边生存环境中的微生物入侵而来,能耐受重金属的内生菌以细菌为主,主要为芽孢杆菌属、不动杆菌属和假单胞菌属。
2 植物内生菌在有害金属污染环境生物修复中的作用及应用
微生物易变异的特点,使其在受到胁迫时,进化出有助于它们应对有污染胁迫时继续繁衍的能力[17]。其中一些生存手段已运用于实际的生物修复污染中,内生菌修复金属污染的机制如表2所示。
2.1 植物内生菌自身的污染修复作用及应用
2.1.1内生菌污染修复机制近年来,国内外对微生物吸附有害金属的研究取得了明显进展。研究表明,微生物吸附有害金属的机制主要通过静电、共价键、络合螯合作用、离子交换、无机微沉淀、氧化还原作用、甲基化作用等使有害金属转移、区隔或转化而失去毒性[36-37]。内生菌耐受重金属可通过不同途径将重金属吸附于其细胞表面或累积至内部,主要包括3种方式,即胞外络合、胞外沉淀、胞内积累。过程分2步进行:第1步是生物吸附,分为胞外富集或沉淀、细胞表面络合或吸附、胞内富集。微生物表面结构对重金属的吸附起着至关重要的作用,细胞壁和黏液层带有较多的负电荷,能直接通过螯合配位、离子交换和物理吸附等作用将金属离子吸附至细胞表面[38],细胞壁上主要结合的官能团有—OH、—NH2、—COOH 等[39]。微生物也会产生胞外蛋白和胞外多聚体等物质,与重金属离子发生络合作用。当重金属离子进入到细胞后,细胞内会形成金属硫蛋白,与重金属离子络合,降低重金属的毒性。在铜和镉胁迫下,双色蜡蘑菌(Laccariabicolor)分泌的胞外黏附物增加,且固定的重金属量占总量的50%,降低了毒性[40]。第2步为生物累积过程,是细菌富集金属离子的重要途径[4]。细菌先把金属运送至细胞体内,再通过区域化作用将其分布于液泡等代谢不活跃的区域,或与蛋白进行结合,降低毒性[41]。
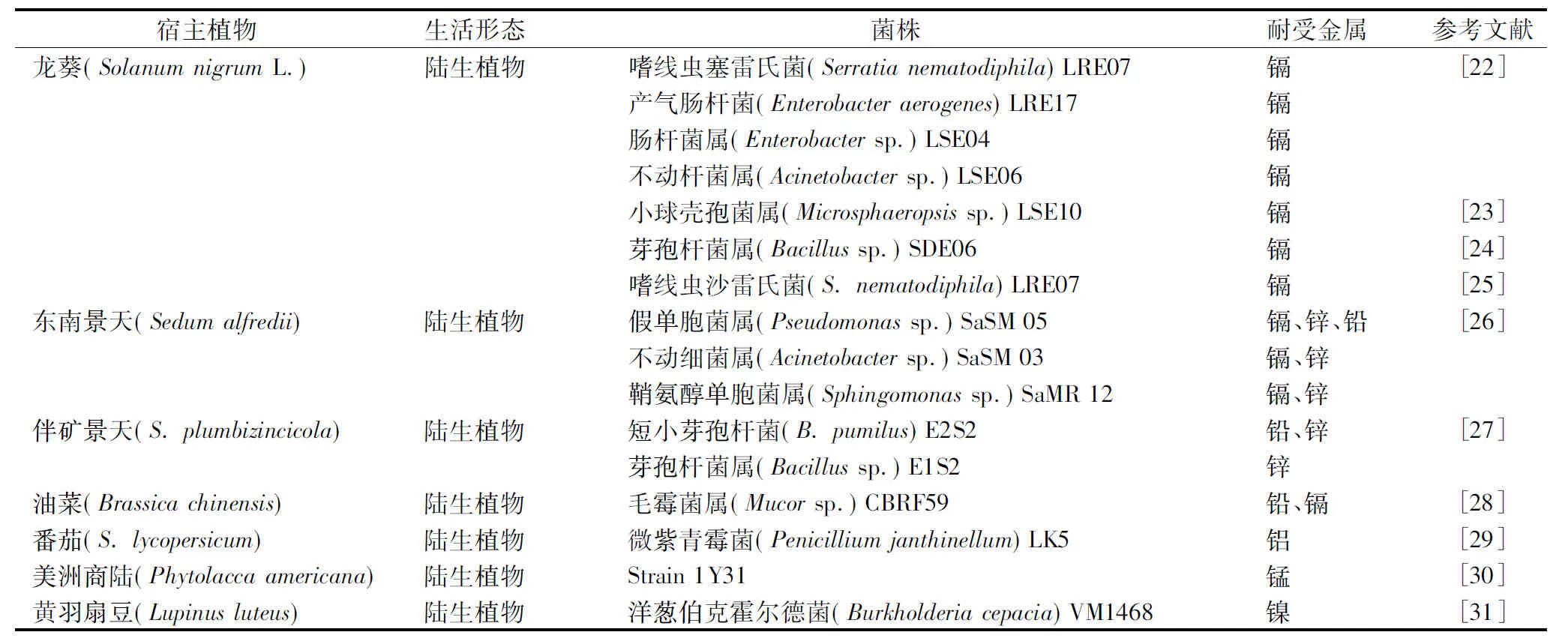
表1 近年来从超富集植物分离出具有耐受重金属能力的内生菌
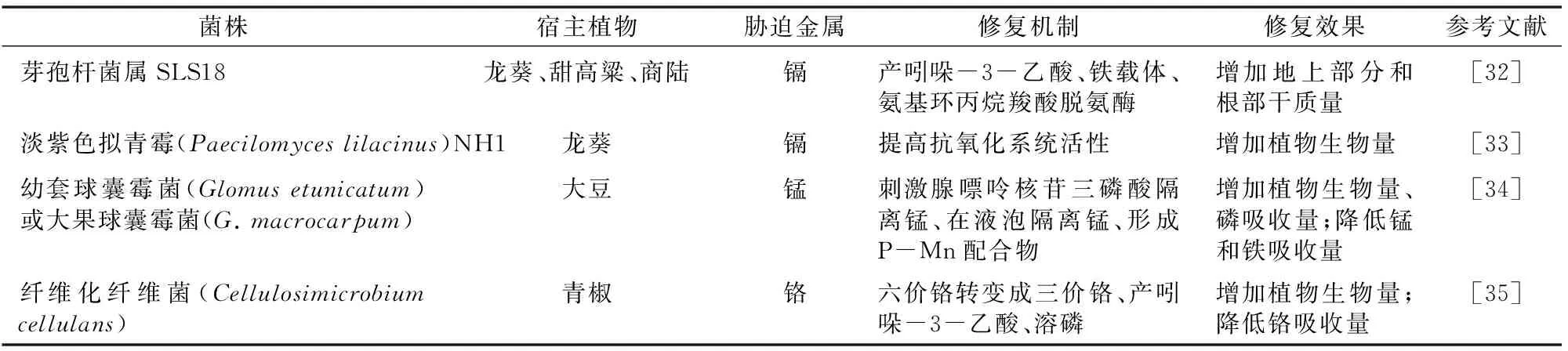
表2 内生菌修复金属污染的机制
2.1.2工程菌的构建及应用将分离得到的内生菌进行筛选,将具有去除重金属能力的活体或死体工程菌与其他材料联用[8,17,23,42]。从超富集植物中筛选出具有重金属耐受能力的内生菌,因其生长环境特殊,可能具有特殊的细胞表面结构,在处理有害金属废水方面有较大潜力[23,43]。Kampalanonwat等的研究结果表明,一些内生菌细胞表面带有氮基配体(如氨基、咪唑基、肼基等)的官能团能与有害金属离子形成配合物[44]。Guo等分别探索了超富集植物龙葵活体和死体内生菌对水体中Cd2+的吸附去除能力,结果表明死体内生菌小球壳孢菌属LSE10菌株比活体内生菌芽孢杆菌属L14菌株有更强的金属去除能力[17,23]。
除上述技术外,还有研究者运用紫外线、亚硝酸、原生质体诱变技术[45]及表面修饰技术等强化内生菌的修复能力。李晓洁使用层层修饰法将带有大量氨基的聚合物聚烯丙基胺(polyallylamine,简称PAA)逐层修饰到镉超富集植物龙葵的内生菌假单胞菌属Lk9菌株菌体表面,结果表明,经过PAA修饰后的Lk9菌株吸附能力大大增强,对有害金属离子Pb2+、Cd2+、Cu2+的最大吸附量分别是未经修饰Lk9菌株的4.96、10.60、10.00倍,且经过5次再生重复利用后仍有较好的去除率[46]。经过油菜秸秆与龙葵根部内生菌LKR02的2步处理,既克服了植物吸附材料有机物溶出和色度上升等问题,同时又解决了高浓度镉离子毒害内生菌且降低其吸附能力的问题[47]。
2.2 内生菌促进植物修复
相关研究表明,内生菌固有的能力可以通过促进植物生长,减轻金属的毒害等帮助宿主植物适应生长环境、提高植物修复效率、改变金属的生物可利用性和在土壤中的分布情况。定殖内生菌的植物相较未定殖的植物对宿主植物的种子发芽、分蘖生长、幼苗存活和生物量累积有更好的促进作用[48]。内生菌通过2种截然不同的方式促进植物修复重金属污染,即生产营养物质或传递代谢产物等增强植物耐受有害金属毒性的能力和提高生物量,改变金属在植物中的累积量[10,26,48]。
2.2.1促进植物生长超富集植物生物量是植物修复的关键因素,如果生物量较小,生长缓慢,难以采用机械收割,影响修复效率。当生长环境受到高浓度污染物胁迫时,植物的生物量会大大减少。然而,某些细菌被发现能帮助宿主植物克服污染物的胁迫压力,尤其是有益的植物内生菌受到研究者更多的关注。促进植物生长的机制主要分为2个方面:直接促进和间接促进。
2.2.1.1直接促生方式直接促进植物生长机制包括生产植物生长调节激素、合成铁载体、固氮、溶磷钾等[49-52]。
分泌植物生长调节激素:一些内生菌在有害金属的胁迫下,仍能产生植物激素(如分泌生长素、赤霉素、细胞分裂素等),增强营养积累、代谢和提高生物量,尤其是通过影响根系生长增加营养的吸收来保护植物[53-54]。作为主要的生长素,吲哚-3-乙酸刺激植物生长和组织分化作用在调节植物-内生菌相互作用中扮演着重要的角色。据报道,植物在重金属胁迫下诱导乙烯产生,导致根的伸长和根毛形成被抑制。氨基环丙烷羧酸脱氨酶作为内生菌操控其宿主植物的重要手段,通过抑制乙烯合成和降低乙烯浓度,能缓解对植物产生的不良反应,促进植物生长发育,如种子发芽、根系生长等[10]。徐涛英从商陆中筛选出的内生菌芽孢杆菌属SLS18菌株具有耐受多种重金属和促生长等特性,分别浸染商陆、龙葵、甜高粱后,均明显增加了在锰和镉复合胁迫下3种植株的生物量[55]。沈德龙等研究发现,水稻内生成团泛菌(Pantoeaagglomerans)YS19菌株能分泌4种不同的植物生长激素,它们共同调节水稻的生命活动,从而影响水稻乳熟期光合产物的分布[56]。
合成铁载体:铁是大多数生物体生长发育所必需的元素,是许多酶的组成成分,几乎所有的生物都需要含铁蛋白质参与蒸腾等生理活动和其他一系列的酶促反应。土壤中大多数的铁以氧化物、氢氧化物、磷酸盐和碳酸盐等高度不溶的形式存在,不能被植物直接吸收利用[57]。铁载体是微生物在缺铁条件下分泌的一类具有超强络合力的小分子有机化合物,对二价铁和三价铁均具有较高的螯合特性。植物生理学的相关研究表明,微生物铁载体比植物铁载体更具有亲和力,可作为生长在金属胁迫条件下植物累积铁元素的直接来源[58]。Barzanti等的研究表明,在重金属胁迫下,产铁载体内生菌通过增加铁的吸收减少金属对宿主植物伯士隆庭荠(Alyssumbertolonii)的毒性[59]。
生物固氮、溶磷钾:内生固氮菌对植物吸收氮素等营养成分有一定的促进作用[60-61]。Saravanan等报道,内生固氮醋杆菌(Acetobacterdiazotrophicus)能在甘蔗植株的各个器官组织中广泛定殖并成为优势菌,并成为甘蔗生物固氮系统中主要的贡献者[62]。磷是植物生长发育所必需的三大营养元素之一,在各种酶促反应中扮演着重要的角色,直接影响植物的生长和作物的产量[63]。重金属胁迫条件下,一些内生菌(特别是假单胞杆菌属、杆菌属和真菌的一些属)通过降低植物根际环境的pH值,溶解磷酸盐、螯合、离子交换、矿化有机磷、释放有机酸或胞外酸性磷酸酶,从而增强磷的植物可用性[63-64]。Sarma等研究发现,将印度梨形孢和荧光假单胞菌R81联合定殖至番茄植株,植株对氮、磷、钾的吸收能力分别提高178%、102%、126%[65]。Lopez等发现,内生菌能够从岩石中解吸大量的矿物质供鸡冠仙人掌吸收[66]。
2.2.1.2间接促生方式内生菌通过调整宿主植物的渗透压、调节抗氧化酶的活性、影响植物光合作用等方式间接促进植物的生长。
调整渗透压:在高盐、高金属离子环境胁迫下,植物含水量显著降低,体内渗透压平衡被打破,限制植物的生长[26]。多篇文献结果表明,植物内生菌通过增加植物中渗透调节物质(包括游离氨基酸、可溶性糖、脯氨酸、多胺、甜菜碱等[67-70])的浓度增强植物吸水能力,从而提高植物的鲜质量水平,改善植物体内的渗透胁迫[63]。此外,研究者还发现内生菌可以促进相关基因的表达,提高植物的吸水能力和水分的利用率[63,71]。
调节抗氧化酶的活性:受到环境胁迫后,活性氧大量累积对植物造成较大的危害,伤害细胞膜的完整性、体内各种酶的活性、光合作用相关的细胞器,植物体内的超氧化物歧化酶、过氧化氢酶、过氧化物酶、抗坏血酸过氧化物酶、谷胱甘肽还原酶等抗氧化酶,可将活性氧有效地消除[63]。Zhang等研究发现,醉马草接种内生真菌后,体内抗氧化酶活性、过氧化氢浓度、叶绿素a、叶绿素b水平增加,但脯氨酸和丙二醛含量下降[72]。同样的结果在内生肠杆菌属(Enterobactersp.)CBSB1菌株接种于芥菜的试验中得到验证[73],说明内生菌通过调节宿主植物的抗氧化酶活性,从而提高植株耐受有害金属的能力。
影响植物光合作用:在有害金属的胁迫下,植物叶绿素合成酶的活性和对营养物质的吸收均受到抑制,导致叶绿素合成量减少,影响光合作用[74]。研究发现,接种内生菌的植物中,几个与叶绿素合成相关的酶类未受到有害金属胁迫的影响;不仅如此,内生菌还能增加对镁、铁等矿物元素的吸收,间接促进叶绿素合成原料的供应和光合效应[75]。Li等对内生真菌定植水稻幼苗叶片的研究表明,内生真菌的定殖通过降低铅对光合系统Ⅱ中电子传输的抑制,提高了宿主的光合速率,促进了植物的生长[76]。
2.2.2促宿主植物污染修复能力植物修复依赖于植物生物量、耐金属能力及金属的生物可利用性。近年来,有文献运用乙二胺四乙酸、石灰等提高植物提取或植物固定效率;虽然效果显著,但这些化学试剂不仅对植物有毒,还破坏原位生态环境。通过筛选可耐受高浓度有害金属的内生菌,利用与宿主植物的协同关系提高植物修复效果具有可行性,比单一超富集植物修复时间更短、效果更显著;内生菌促进植物富集有害金属的机制主要为降低金属毒性,增加金属生物有效性[77-78]。微生物强化宿主植物富集有害金属的机制[50]如图1所示。
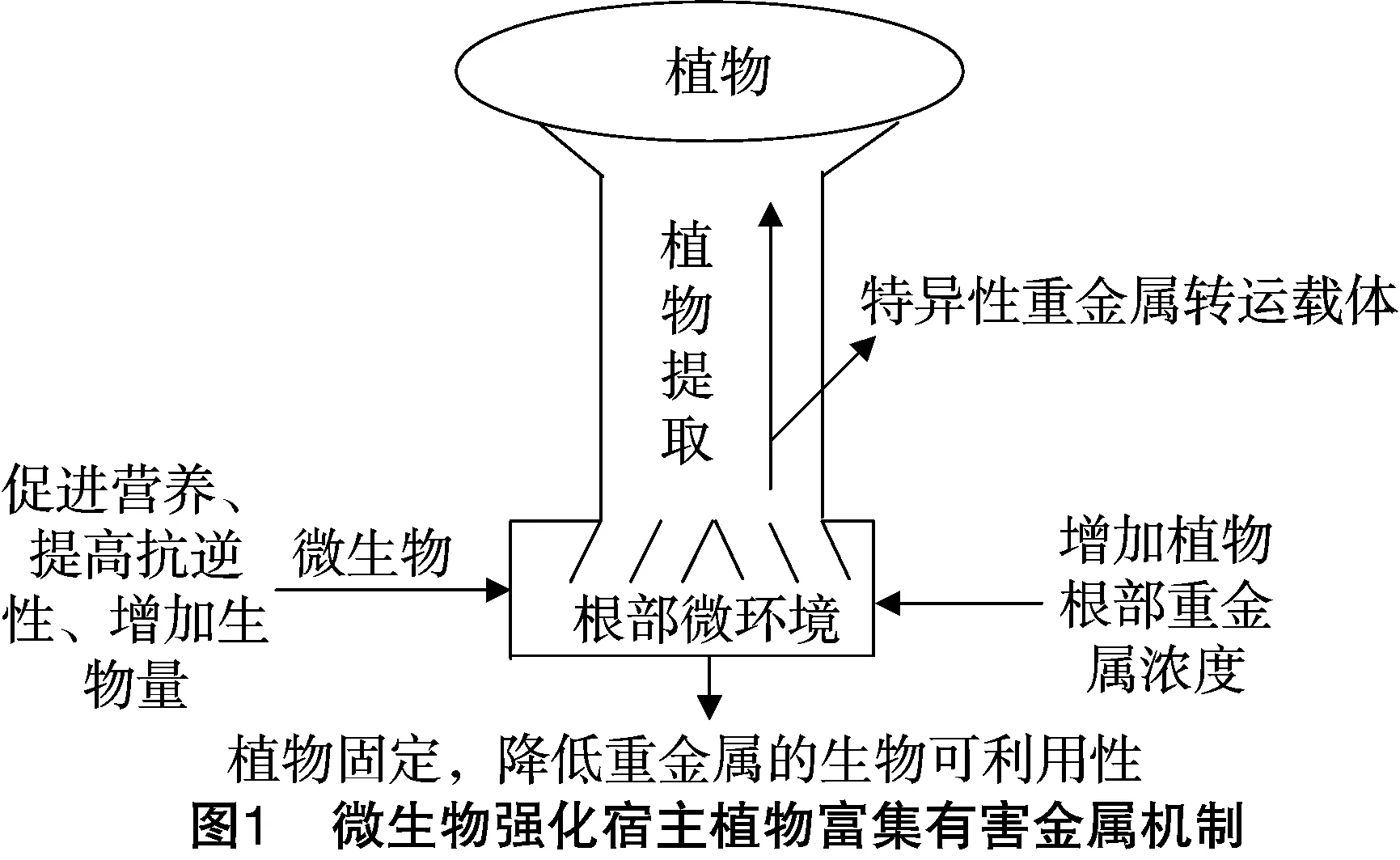
2.2.2.1缓解金属的胁迫压力金属毒性是影响植物修复的一个关键因素。植物内生菌通过固定化可以减少金属毒害[17,54],这些机制包括:将金属吸附到内生菌自身表面的化学功能基团或蛋白,减轻对植物的毒害[79-83];将透过细胞膜扩散到内生菌细胞内部的污染物包埋到细胞包囊中或通过细胞内的一系列结合蛋白沉淀、螯合重金属,甚至可能通过细胞内部的氧化还原作用来减轻重金属的毒害;分泌酶和有机酸等胞外物使金属沉淀,减少其毒性[17,84-85]。Shin等的研究表明,耐铅内生芽孢杆菌MN3-4通过胞内胞外积累铅来减少对赤杨皮的危害[86]。
土壤中有些重金属元素是以多种价态存在的,不同价态的重金属毒性不同。微生物通过直接氧化或还原作用,可以改变重金属的价态,降低重金属的毒性,从而达到解毒的效果。如微生物通过氧化作用可以分解含砷矿物;微生物也可以将Cr6+还原为Cr3+,大大降低其毒性[87]。
2.2.2.2增加金属的生物有效性植物从土壤中吸收重金属主要取决于金属在土壤中的生物有效性[88],影响因素包括养分、pH值、氧化还原电位、有机质含量和其他离子的存在[89]。内生菌通过释放金属螯合剂(如铁载体、生物表面活性剂、有机酸)、酸化土壤、氧化还原作用、磷酸盐溶解等作用可以促进植物利用重金属[89-90]。Sheng等认为荧光假单胞菌(P.fluorescens)G10和微杆菌属(Microbacteriumsp.)G16菌株生产铁载体或有机酸诱发对铅的增溶,均能促进油菜对铅的累积[74]。
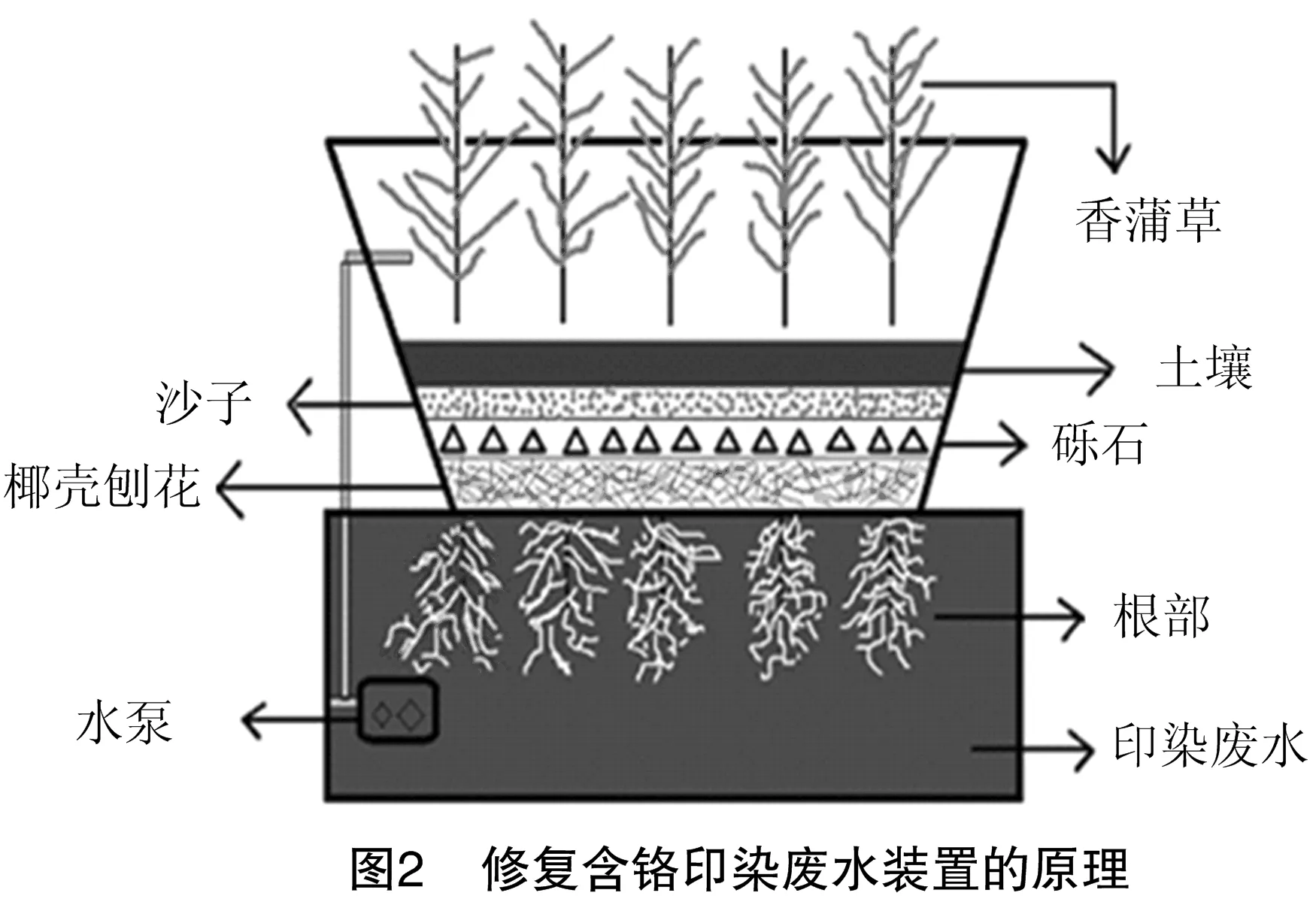
2.2.3内生菌与植物联合修复技术的应用多位学者研究表明,将具有重金属抗性的内生菌定殖宿主植物甚至是非原宿主植物,均可以提高植物对重金属的修复效率。万勇等从镉超富集植物龙葵中分离筛选出的耐镉内生菌提高了宿主植物修复有害金属污染土壤的能力[18,25]。将从镉超富集植物龙葵叶片中筛选到1株耐受镉浓度达200 mg/L的内生细菌DE5菌株以灌根的形式接种至青葙,结果表明,接种处理的青葙根部生物量(干质量)比对照组增加了125.0%,富集镉的总量约增加了81%,其强化效果优于浇施螯合剂乙二胺四乙酸[91]。内生菌与植物联合修复技术不仅能修复土壤中的重金属污染,还可以通过人工湿地系统[92]、浮岛[93]等方式修复污水、废水和地下水中的重金属污染[87]。修复含铬印染废水装置的原理[92]如图2所示。
3 结论与展望
目前,有益内生菌改善植物生长、生物控制及协助植物修复金属等特质使生物技术在环境污染应用中开辟了新的可能性。内生菌已被证明比根际菌与植物更亲密,性质更可靠,不仅在内生菌与植物联合作用中发挥重要作用,且其本身构建成的工程菌或生物材料也有着较好的修复效率。然而,了解内生菌与宿主植物、污染物之间的相互反应机制至关重要。随着研究的深入,有望找到更多内生菌及其应用手段。为了更好地了解细菌生物强化的机制及其在实际应用中的推广,未来应在以下5个方面深入研究:
(1)在亚细胞、细胞分子和基因水平上探究内生菌影响宿主调节金属形态变化,甚至影响植物生长和强化金属于植物体内累积、分布的机制。
(2)除生物吸附、累积作用外,内生菌在生物固化、生物解毒方面是否具有潜力。
(3)在强酸强碱、高盐、富营养、油类不利条件下,内生菌是否依然具有金属耐受与富集能力。
(4)有害金属与其他污染物复合污染环境时,内生菌是否仍然具有金属耐受与富集能力。
(5)可否将耐受重金属的内生菌定殖至水生植物并应用于污染水体的修复。
参考文献:
[1]许秀琴,朱勇,杨挺,等. 水体重金属的污染危害及其修复技术[J]. 污染防治技术,2007(4):67-69.
[2]Bai H J,Zhang Z M,Yang G E,et al. Bioremediation of cadmium by growingRhodobactersphaeroides:kinetic characteristic and mechanism studies[J]. Bioresource Technology,2008,99(16):7716-7722.
[3]王辛龙,万先达. 湿法磷酸净化的新进展[J]. 磷肥与复肥,2001,16(2):32-33.
[4]Malik A. Metal bioremediation through growing cells[J]. Environment International,2004,30(2):261-278.
[5]张丽娜,裴强,安亚明,等. 重金属污水处理的研究与发展[J]. 农业工程,2012,2(11):30-32.
[6]门彬,王东升. 重金属废水处理方法综述[J]. 水工业市场,2011(8):65-68.
[7]肖潇. 基于镉超累积植物内生菌的重金属污染修复研究[D]. 长沙:湖南大学,2011.
[8]李安明,邓青云,李德华,等. 内生细菌在植物修复中的应用[J]. 湖北农业科学,2011,50(19):3893-3896.
[9]周怀东,彭文启. 水污染与水环境修复[M]. 北京:化学工业出版社,2005:3-4.
[10]刘劲松,张健君,杨淑芳,等. 内生菌参与植物/微生物联合修复重金属污染土壤的研究进展[J]. 中国植保导刊,2014,34(2):27-30.
[11]李娜,靳晓洁. 含重金属废水处理技术的研究进展概述[J]. 电力科学与工程,2008,24(4):42-44.
[12]丁建,陈贝,袁建军. 植物修复重金属污染及内生细菌效应[J]. 微生物学通报,2011,38(6):921-927.
[13]张饮江,刘晓培,金晶,等. 沉水植物对水体净化的研究进展[J]. 科技导报,2012,30(27):72-79.
[14]魏树和,周启星,王新. 超积累植物龙葵及其对镉的富集特征[J]. 环境科学,2005,26(3):167-171.
[15]刘文钊. 几种大型真菌对重金属吸附特性的研究[D]. 长春:吉林农业大学,2011.
[16]薛高尚,胡丽娟,田云,等. 微生物修复技术在重金属污染治理中的研究进展[J]. 中国农学通报,2012,28(11):266-271.
[17]Guo H J,Luo S L,Chen L,et al. Bioremediation of heavy metals by growing hyperaccumulaor endophytic bacteriumBacillussp. L14[J]. Bioresource Technology,2010,101(22):8599-8605.
[18]万勇. 超积累植物龙葵内生菌强化镉植物修复的初步研究[D]. 长沙:湖南大学,2009.
[19]卢文显. 超富集植物商陆抗锰内生菌的筛选鉴定及其特性的研究[D]. 福州:福建师范大学,2015.
[20]郭函君. 超累积植物龙葵内生菌在重金属废水处理中的应用研究[D]. 长沙:湖南大学,2011.
[21]Shen M,Liu L,Li D W,et al. The effect of endophyticPeyronellaeafrom heavy metal-contaminated and uncontaminated sites on maize growth,heavy metal absorption and accumulation[J]. Fungal Ecology,2013,6(6):539-545.
[22]Chen L,Luo S L,Xiao X,et al. Application of plant growth-promoting endophytes (PGPE) isolated fromSolanumnigrumL. for phytoextraction of Cd-polluted soils[J]. Applied Soil Ecology,2010,46(3):383-389.
[23]Xiao X,Luo S L,Zeng G M,et al. Biosorption of cadmium by endophytic fungus (EF)Microsphaeropsissp. LSE10 isolated from cadmium hyperaccumulatorSolanumnigrumL.[J]. Bioresource Technology,2010,101(6):1668-1674.
[24]曹喆,罗胜联,曾光明,等. 一株龙葵内生细菌SDE06去除Cd2+的实验[J]. 微生物学通报,2009,36(3):328-333.
[25]万勇. 内生细菌在重金属植物修复中的作用机理及应用研究[D]. 长沙:湖南大学,2013.
[26]陈宝. 内生细菌促进东南景天Zn/Cd的提取效应及其机制研究[D]. 杭州:浙江大学,2015.
[27]Ma Y,Oliveira R S,Nai F J,et al. The hyperaccumulatorSedumplumbizincicolaharbors metal-resistant endophytic bacteria that improve its phytoextraction capacity in multi-metal contaminated soil[J]. Journal of Environmental Management,2015,156:62-69.
[28]Deng Z J,Cao L X,Huang H W,et al. Characterization of Cd- and Pb-resistant fungal endophyteMucorsp. CBRF59 isolated from rapes (Brassicachinensis)in a metal-contaminated soil[J]. Journal of Hazardous Materials,2011,185(2):717-724.
[29]Khan A L,Waqas M,Hussain J,et al. Phytohormones enabled endophytic fungal symbiosis improve aluminum phytoextraction in tolerantSolanumlycopersicum:an examples ofPenicilliumjanthinellumLK5 and comparison with exogenous GA3[J]. Journal of Hazardous Materials,2015,295:70-78.
[30]Zhang W H,Chen W,He L Y,et al. Characterization of Mn-resistant endophytic bacteria from Mn-hyper-accumulatorPhytolaccaamericanaand their impact on Mn accumulation of hybrid penisetum[J]. Ecotoxicology and Environmental Safety,2015,120:369-376.
[31]Weyens N,Van D D,Croes S,et al. Endophytic bacteria improve phytoremediation of Ni and TCE co-contamination[J]. Environmental Pollution,2010,158(7):2422-2427.
[32]Luo S L,Chen L,Chen J L,et al. Analysis and characterization of cultivable heavy metal-resistant bacterial endophytes isolated from Cd-hyperaccumulatorSolanumnigrumL. and their potential use for phytoremediation[J]. Chemosphere,2011,85(7):1130-1138.
[33]Gao Y,Miao C Y,Mao L,et al. Improvement of phytoextraction and antioxidative defense inSolanumnigrumL. under cadmium stress by application of cadmium-resistant strain and citric acid[J]. Journal of Hazardous Materials,2010,181(1/2/3):771-777.
[34]Nogueira M A,Nehls U,Hampp R,et al. Mycorrhiza and soil bacteria influence extractable iron and manganese in soil and uptake by soybean[J]. Plant and Soil,2007,298(1/2):273-284.
[35]Chatterjee S,Sau G B,Mukherjee S K. Plant growth promotion by a hexavalent chromium reducing bacterial strain,Cellulosimicrobiumcellulanskucr3[J]. World Journal of Microbiology & Biotechnology,2009,25(10):1829-1836.
[36]黄鹄飞,施泽明,熊超,等. 湖泊沉积物中重金属污染评价及生物修复方法的研究进展[J]. 科技信息,2013(8):137.
[37]孙静,李晔,刘联国,等. 地衣芽孢杆菌富集镉的特性及机理研究[J]. 核农学报,2013,27(11):1644-1651.
[38]Vijayaraghavan K,Yun Y S. Bacterial biosorbents and biosorption[J]. Biotechnology Advances,2008,26(3):266-291.
[39]Volesky B,May-Phillips H A. Biosorption of heavy metals bySaccharomycescerevisiae[J]. Applied Microbiology & Biotechnology,1995,42(5):797-806.
[40]柴立伟,黄艺. 外生菌根真菌通过分泌胞外粘性物质固定环境中过量重金属的机理研究[C]// 中国菌物学会2015年学术年会论文摘要集, 2015.
[41]马莹,骆永明,滕应,等. 内生细菌强化重金属污染土壤植物修复研究进展[J]. 土壤学报,2013,50(1):195-202.
[42]Afzal M,Khan Q M,Sessitsch A. Endophytic bacteria:prospects and applications for the phytoremediation of organic pollutants[J]. Chemosphere,2014,117(1):232-242.
[43]Wang J L,Chen C. Biosorbents for heavy metals removal and their future[J]. Biotechnology Advances,2009,27(2):195-226.
[44]Kampalanonwat P,Supaphol P. Preparation and adsorption behavior of aminated electrospun polyacrylonitrile nanofiber mats for heavy metal ion removal[J]. ACS Applied Materials & Interfaces,2010,2(12):3619-3627.
[45]周珊,虞方伯,郭明,等. 竹炭固定化紫外诱变假单胞菌处理间甲酚废水的研究[J]. 林业科学,2011,47(9):114-118.
[46]李晓洁. 基于植物内生菌Lk9重金属吸附剂的制备与应用[D]. 长沙:湖南大学,2014.
[47]饶婵. 天然植物油菜秸秆与内生菌联合修复镉污染废水的研究[D]. 长沙:湖南大学,2012.
[48]王晓洋,李明堂,景澄茗,等. 植物内生菌在环境污染修复中的应用研究进展[J]. 广州化工,2015(10):8-10.
[49]Aboushanab R A,Angle J S,Van B P. Chromate-tolerant bacteria for enhanced metal uptake byEichhorniacrassipes(Mart.)[J]. International Journal of Phytoremediation,2007,9(2):91-105.
[50]刘莉华. 龙葵与微生物联合修复Cd污染土壤研究[D]. 南昌:南昌航空大学,2013.
[51]江春玉,盛下放,何琳燕,等. 一株铅镉抗性菌株WS34的生物学特性及其对植物修复铅镉污染土壤的强化作用[J]. 环境科学学报,2008,28(10):1961-1968.
[52]张帅. 耐Cd、As、Pb重金属促生菌的筛选及Cd胁迫下植物促生菌对甜高粱生长的调控[D]. 南京:南京农业大学,2013.
[53]董睿智. 砷超累积植物内生菌对重金属砷,铅抗性及吸附性能的研究[D]. 南昌:南昌航空大学,2012.
[54]Ma Y,Rajkumar M,Zhang C,et al. Beneficial role of bacterial endophytes in heavy metal phytoremediation[J]. Journal of Environmental Management,2016,174:14-25.
[55]徐涛英. 商陆内生菌促进甜高粱生长和重金属土壤修复的研究[D]. 长沙:湖南大学,2011.
[56]沈德龙,冯永君,宋未. 内生成团泛菌YS19对水稻乳熟期光合产物在旗叶、穗分配中的影响[J]. 自然科学进展,2002,12(8):863-865.
[57]Chen K F,Lai Y Y,Sun H S,et al. Transcriptional repression of human cad gene by hypoxia inducible factor-1 alpha[J]. Nucleic Acids Research,2005,33(16):5190-5198.
[58]王平,董飚,李阜棣,等. 小麦根圈细菌铁载体的检测[J]. 微生物学通报,1994,21(6):323-326.
[59]Barzanti R,Ozino F,Bazzicalupo M A,et al. Isolation and characterization of endophytic bacteria from the nickel hyperaccumulator plantAlyssumbertolonii[J]. Microbial Ecology,2007,53(2):306-316.
[60]滕松山. 具ACC脱氨酶活性的碱蓬内生细菌对植物的解盐促生作用及其ACC脱氨酶基因的克隆[D]. 济南:山东师范大学,2011.
[61]Hurek T,Reinhold-Hurek B.Azoarcussp. strain BH72 as a model for nitrogen-fixing grass endophytes[J]. Journal of Biotechnology,2003,106(2/3):169-178.
[62]Saravanan V S,Madhaiyan M,Jabez O,et al. Ecological occurrence of gluconacetobacter diazotrophicus and nitrogen-fixing Acetobacteraceae members:their possible role in plant growth promotion[J]. Microbial Ecology,2008,55(1):130-140.
[63]陈亚平. 耐盐碱植物内生真菌的分离鉴定及促进作物耐盐菌株的筛选[D]. 杭州:浙江大学,2014.
[64]Rodriguez R J,White J,Arnold A E,et al. Fungal endophytes:diversity and functional roles[J]. New Phytologist,2009,182(2):314-330.
[65]Sarma M K,Kumar V,Saharan K,et al. Application of inorganic carrier-based formulations of fluorescentPseudomonadsandPiriformosporaindicaon tomato plants and evaluation of their efficacy[J]. Journal of Applied Microbiology,2011,111(2):456-466.
[66]Lopez B R,Tinoco-Ojanguren C,Bacilio M A,et al. Endophytic bacteria of the rock-dwelling cactusMammillariafraileanaaffect plant growth and mobilization of elements from rocks[J]. Environmental and Experimental Botany,2012,81(7):26-36.
[67]Evelin H,Kapoor R,Giri B. Arbuscular mycorrhizal fungi in alleviation of salt stress:a review[J]. Annals of Botany,2009,104(7):1263-1280.
[68]Berg G,Alavi M,Schmidt C S,et al. Biocontrol and osmoprotection for plants under salinated conditions[M]// Molecular Microbial Ecology of the Rhizosphere:Volume 1 & 2. New Jersey:John Wiley & Sons,Inc. 2013:587-592.
[69]Baltruschat H,Fodor J,Harrach B D,et al. Salt tolerance of barley induced by the root endophytePiriformosporaindicais associated with a strong increase in antioxidants[J]. New Phytologist,2008,180(2):501-510.
[70]Bano Q,Ilyas N,Bano A,et al. Effect ofAzospirilluminoculation on maize(ZeamaysL.)under drought stress[J]. Pakistan Journal of Botany,2013,45(5):13-20.
[71]Farzad J,Ricardo A,Rosa P,et al. Influence of salinity on the in vitro development of Glomus intraradices and on theinvivophysiological and molecular responses of mycorrhizal lettuce plants[J]. Microbial Ecology,2008,55(1):45-53.
[72]Zhang X X,Li C J,Nan Z B. Effects of cadmium stress on growth and anti-oxidative systems inAchnatheruminebrianssymbiotic withNeotyphodiumgansuense[J]. Journal of Hazardous Materials,2010,175(1/2/3):703-709.
[73]Qiu Z Q,Tan H M,Zhou S,et al. Enhanced phytoremediation of toxic metals by inoculating endophyticEnterobactersp. CBSB1 expressing bifunctional glutathione synthase[J]. Journal of Hazardous Materials,2014,267(1):17-20.
[74]Sheng M,Tang M,Chen H,et al. Influence of arbuscular mycorrhizae on photosynthesis and water status of maize plants under salt stress[J]. Mycorrhiza,2008,18(6/7):287-296.
[75]Zhu X C,Song F B,Xu H W. Arbuscular mycorrhizae improves low temperature stress in maize via alterations in host water status and photosynthesis[J]. Plant and Soil,2010,331(1/2):129-137.
[76]Li X E,Zhang L H. Endophytic infection alleviates Pb2+stress effects on photosystem II functioning ofOryzasativaleaves[J]. Journal of Hazardous Materials,2015,295:79-85.
[77]Evangelou M H,Ebel M,Schaeffer A. Evaluation of the effect of small organic acids on phytoextraction of Cu and Pb from soil with nicotiana tabacum [J]. Chemosphere,2006,63(6):996-1004.
[78]魏本杰,曾晓希,刘志成,等. 产铁载体菌的筛选鉴定及活化镉的性能探究[J]. 环境科学与技术,2014(11):26-31.
[79]Zouboulis A I,Loukidou M X,Matis K A. Biosorption of toxic metals from aqueous solutions by bacteria strains isolated from metal-polluted soils[J]. Process Biochemistry,2004,39(8):909-916.
[80]Chang J S,Law R,Cheng C C. Biosorption of lead,copper and cadmium by biomass ofPseudomonasaeruginosapu21[J]. Water Research,1997,31(7):1651-1658.
[81]Hu Q,Qi H Y,Bai Z H,et al. Biosorption of cadmium by a Cd2+-hyperresistantBacilluscereusstrain HQ-1 newly isolated from a lead and zinc mine[J]. World Journal of Microbiology & Biotechnology,2007,23(7):971-976.
[82]Sheng P X,Ting Y P,Chen J P,et al. Sorption of lead,copper,cadmium,zinc,and nickel by marine algal biomass:characterization of biosorptive capacity and investigation of mechanisms[J]. Journal of Colloid & Interface Science,2004,275(1):131-141.
[83]Cruz C V,Costa A D,Henriques C A,et al. Kinetic modeling and equilibrium studies during cadmium biosorption by deadSargassumsp. biomass[J]. Bioresource Technology,2004,91(3):249-257.
[84]Arland P,Isar J,Saran S,et al. Bioaccumulation of copper byTrichodermaviride[J]. Bioresource Technology,2006,97(8):1018-1025.
[85]Radhika V,Subramanian S,Natarajan K A. Bioremediation of zinc usingDesulfotomaculumnigrificans:bioprecipitation and characterization studies[J]. Water Research,2006,40(19):3628-3636.
[86]Shin M N,Shim J,You Y,et al. Characterization of lead resistant endophyticBacillussp. MN3-4 and its potential for promoting lead accumulation in metal hyperaccumulatorAlnusfirma[J]. Journal of Hazardous Materials,2012,199/200(2):314-320.
[87]Dimitroula H,Syranidou E,Manousaki E A,et al. Mitigation measures for chromium-VI contaminated groundwater - the role of endophytic bacteria in rhizofiltration[J]. Journal of Hazardous Materials,2015,281(SI):114-120.
[88]Glick B R. Using soil bacteria to facilitate phytoremediation[J]. Biotechnology Advances,2010,28(3):367-374.
[89]Lebeau T,Braud A,Jézéquel K. Performance of bioaugmentation-assisted phytoextraction applied to metal contaminated soils:a review[J]. Environmental Pollution,2008,153(3):497-522.
[90]Angela S,Melanie K,Petra K,et al. The role of plant-associated bacteria in the mobilization and phytoextraction of trace elements in contaminated soils[J]. Soil Biology & Biochemistry,2013,60(100):182-194.
[91]吴秉奇,刘淑杰,张淼,等. 接种耐镉细菌对青葙吸收积累土壤中镉的影响[J]. 生态学杂志,2014,33(12):3409-3415.
[92]Shehzadi M,Afzal M,Khan M U,et al. Enhanced degradation of textile effluent in constructed wetland system usingTyphadomingensisand textile effluent-degrading endophytic bacteria[J]. Water Research,2014,58:152-159.
[93]Ijaz A,Shabir G,Khan Q M,et al. Enhanced remediation of sewage effluent by endophyte-assisted floating treatment wetlands[J]. Ecological Engineering,2015,84(2):58-66.

