甜菊葡萄糖苷转移酶基因SrUGT76G1启动子的克隆及其功能的瞬时表达分析
杨永恒, 徐晓洋, 孙玉明, 原海燕, 刘清泉, 张永侠, 王银杰, 黄苏珍, 佟海英
(江苏省中国科学院植物研究所,江苏南京 210014)
甜菊(SteviarebaudianaBertoni)又称甜叶菊,是菊科(Asteraceae)甜菊属(Stevia)多年生草本植物,原产于南美洲巴拉圭等地。甜菊因其叶片可提取高甜度低热量的甜菊糖苷而从20世纪70年代开始受到人们的广泛关注[1]。甜菊叶片所含甜菊糖苷有多达30种组分,各组分的结构相似,性质迥异。甜菊苷(stevioside,St)和莱鲍迪苷A(rebaudioside A,R-A)是两大主要组分,占总糖苷含量的60%~80%。St苷的甜度为蔗糖的250~300倍,略带苦味,具有药用价值,R-A 苷的甜度为蔗糖的350~450倍,且具有更接近蔗糖的甜味[2],因此在甜菊种质创新研究中,为满足不同应用目的的需要,提高St苷、R-A苷等单一糖苷的生物积累及其在总苷中的比例成为甜菊育种学家竞相研究的热点。
在甜菊糖苷生物合成途径中,葡萄糖苷转移酶SrUGT76G1专一地对St苷的C-13位C-3′进行糖基化,将其转化为R-A苷[3],所以SrUGT76G1是St苷和R-A苷合成的关键基因。研究该基因的表达调控对了解R-A苷的生物合成和今后通过基因工程等手段人为调控R-A苷的合成具有重要意义,但是目前对SrUGT76G1的表达调控模式还不清楚。启动子作为基因表达调控的重要区域,研究SrUGT76G1启动子对于了解这一关键基因的表达调控具有重要意义,但在甜菊研究中目前尚无相关报道。
本试验在SrUGT76G1基因研究的基础上,根据已克隆到的SrUGT76G1基因DNA序列设计嵌套引物,扩增基因上游未知序列,通过启动子序列分析初步探究序列上的功能元件。为了更深入地研究该基因的表达调控,进一步构建植物表达载体,用1 989 bp的SrUGT76G1启动子取代pCAMBIA1301-220中的CaMV35S组成型启动子,连接GUS报告基因,构建pCAMBIA1301-220-SrUGT76G1P载体,通过农杆菌介导的基因瞬时表达的方法初步验证SrUGT76G1启动子的活性,为今后深入研究SrUGT76G1基因的表达调控和甜菊分子育种奠定基础。
1 材料与方法
1.1 材料
试验于2014年7月至2015年6月在江苏省中国科学院植物研究所进行。用于DNA提取的甜菊叶片取自本实验室甜菊种质资源圃。植物表达载体pCAMBIA1301-220由南京农业大学园艺学院菊花实验室惠赠;根癌农杆菌(Agrobacteriumtumefaciens)EHA105、大肠杆菌(Escherichiacoli)菌株TOP10、琼脂糖凝胶回收试剂盒、DNA Marker、测序载体pMD19-T Vector、TaqDNA polymerase、各种限制性核酸内切酶与试剂购自TaKaRa公司;氨苄青霉素(Amp)、卡那霉素(Kan)、IPTG、X-gal、Real Master Mix SYBR GreenⅠ、质粒提取试剂盒购自北京天根生化科技公司;GUS活性检测试剂购自Sigma公司;其他常用化学试剂为国产分析纯。
1.2 方法
1.2.1SrUGT76G1启动子的克隆采用改良CTAB法提取甜菊基因组DNA。以提取的甜菊基因组DNA为模板,根据已知的SrUGT76G1序列设计3个嵌套的特异性引物SP1、SP2、SP3。hiTAIL-PCR反应程序参照Liu等的方法[4]进行。第1轮PCR用特异性引物SP1与简并引物LAD1-1、LAD1-2、LAD1-3、LAD1-4组合,建立4个平行的25 μL PCR反应体系进行扩增;第2轮PCR将第1轮的PCR产物稀释50倍,取1 μL作为反应模板,用简并引物AC1与特异性引物SP2扩增;第3轮PCR将第2轮的PCR产物稀释50倍,取1 μL作为反应模板,用简并引物AC1与特异性引物SP3扩增,经过3轮PCR扩增得到SrUGT76G1的上游序列。根据第一次步移得到的序列设计特异性引物SP4、SP5、SP6,以相同方法进行第二次步移,将2次步移得到的序列拼接,并设计全长引物pro-1F、pro-1R,最终得到SrUGT76G1的启动子序列。试验所用引物序列及反应程序详见表1、表2。
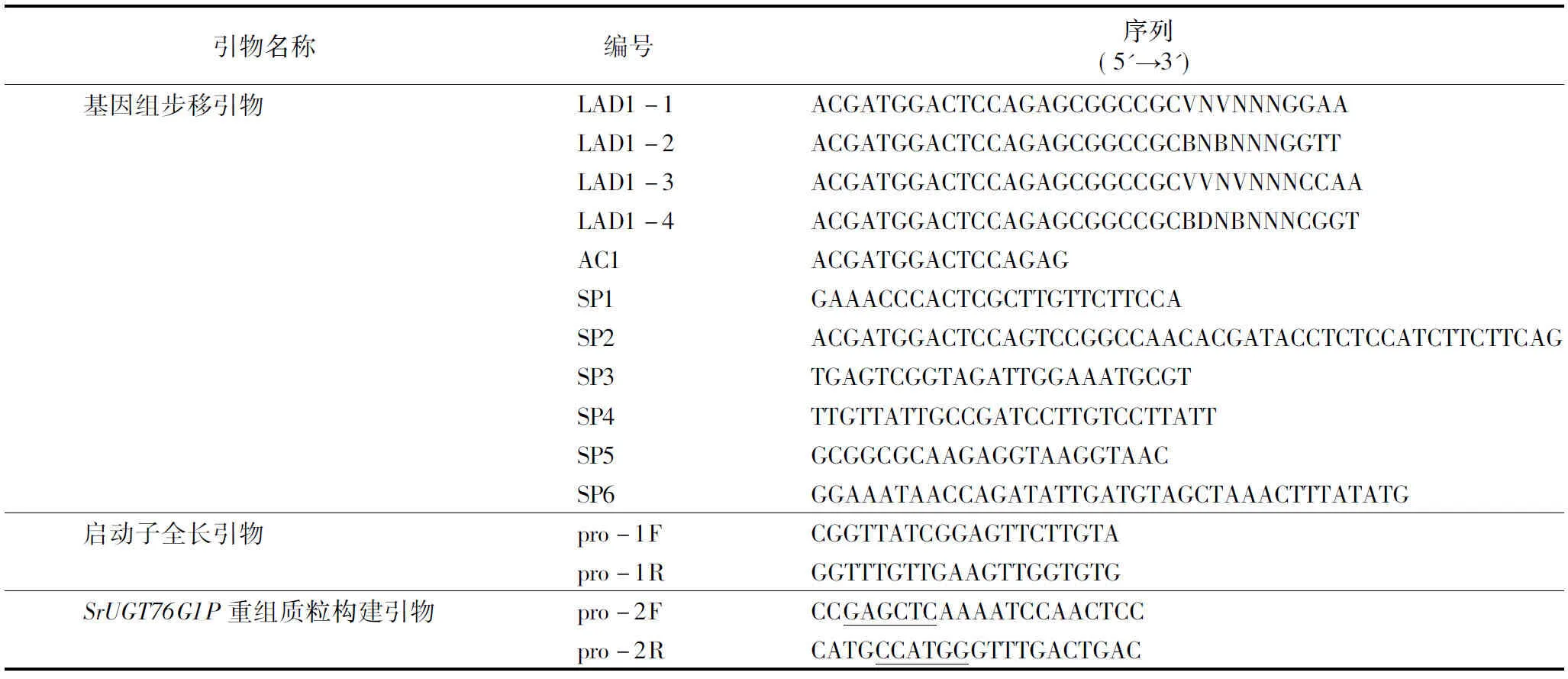
表1 甜菊SrUGT76G11启动子步移及分析引物
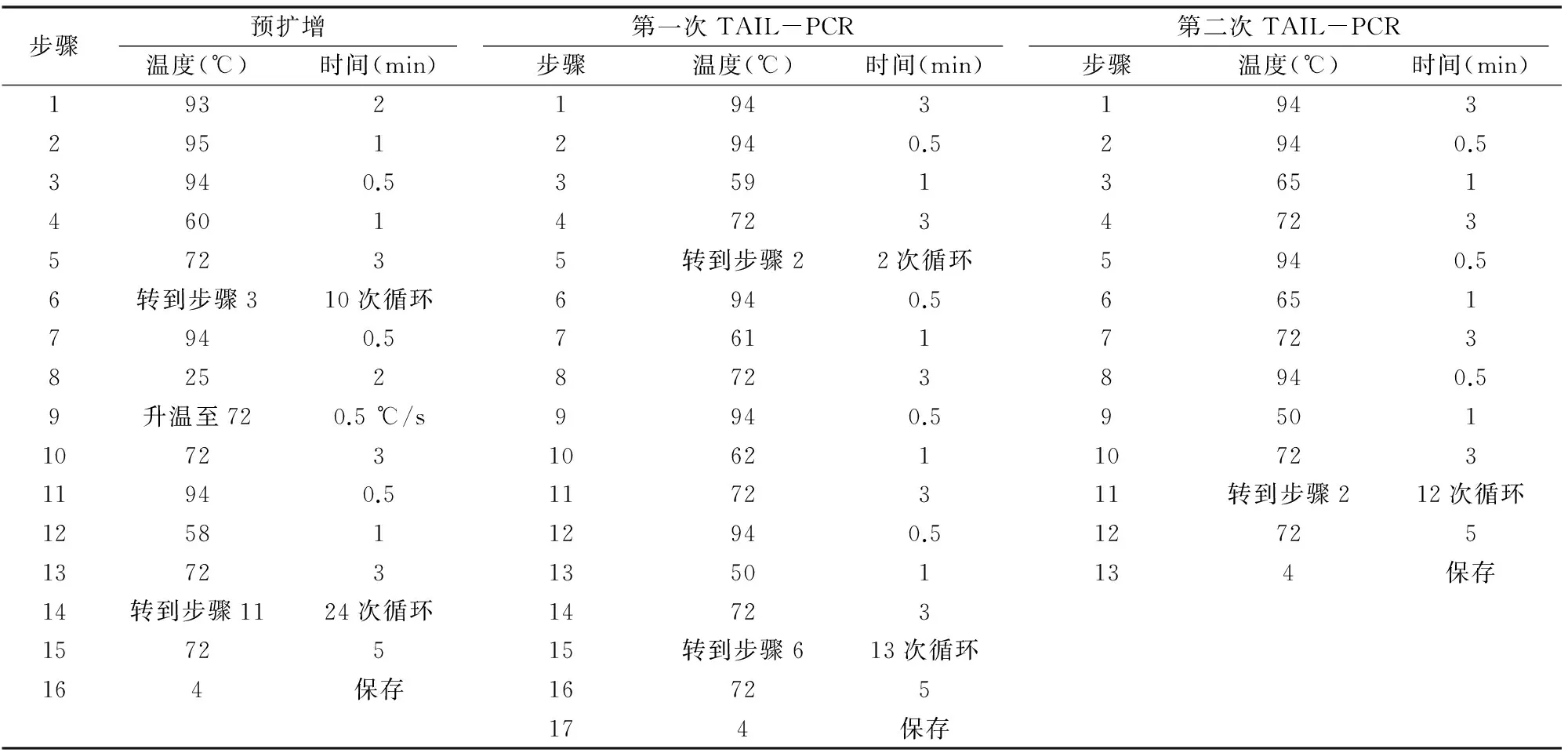
表2 hiTAIL-PCR反应程序
1.2.2SrUGT76G1启动子作用元件分析将甜菊SrUGT76G1启动子序列提交PLACE服务器(http://www.dna.affrc.go.jp/PLACE/signalscan.html),预测该启动子保守区域中潜在的顺式作用元件。
1.2.3植物表达载体构建植物表达载体pCAMBIA1301-220是含有CaMV35S启动子和GUS基因系统的双元载体。为了研究SrUGT76G1启动子的功能,本研究中用SrUGT76G1启动子取代pCAMBIA1301-220中的CaMV35S组成型启动子,连接GUS报告基因,构建植物表达载体pCAMBIA1301-220-SrUGT76G1P。将引物pro-2F和pro-2R(引物序列见表1,划横线处分别为限制性内切酶SacⅠ和NcoⅠ的酶切位点)扩增得到的含酶切位点的SrUGT76G1启动子片段连接到pMD19-T(2 692 bp)载体上,得到重组质粒pMD19-T-SrUGT76G1P。将重组质粒pMD19-T-SrUGT76G1P和质粒pCAMBIA1301-220分别用限制性内切酶SacⅠ和NcoⅠ进行双酶切,酶切产物用1%琼脂糖凝胶电泳分离,分别切胶回收pMD19-T-SrUGT76G1P小片段和pCAMBIA1301-220大片段,用T4 DNA连接酶连接2个目的片段,连接产物转化至大肠杆菌TOP10菌株感受态细胞中。将经蓝白斑筛选、PCR检验和SacⅠ、NcoⅠ双酶切鉴定都正确的重组质粒命名为pCAMBIA1301-220-SrUGT76G1P。
1.2.4SrUGT76G1启动子功能的瞬时表达分析将重组质粒pCAMBIA1301-220-SrUGT76G1P和质粒 pCAMBIA1301-220 分别转化至农杆菌EHA105中[5]。已转化的农杆菌在5 mL含利福平和卡那霉素的YEP液体培养基中28 ℃振荡培养24 h,取2 mL菌液转入10 mL含同样抗生素的新鲜培养液中,28 ℃振荡培养36~48 h,离心培养物并用5 mL MMA{1×MS,10 mmol/L MES[2-(N-morpholino)ethane sulfonic acid],200 μmol/L乙酰丁香酮,pH值5.6}重悬菌体,28 ℃保温3 h,5 000 min离心10 min,沉淀用2 mL 10 mmol/L 的MgCl2洗涤1次,菌体用2 mL 10 mmol/L的MgCl2悬起。取14 d左右的甜菊和拟南芥无菌幼苗分别浸没在含重组质粒pCAMBIA1301-220-SrUGT76G1P和质粒pCAMBIA1301-220的上述农杆菌菌液中,以10 mmol/L MgCl2溶液为空白对照,真空(10 Pa)处理30 min,然后用无菌水将幼苗冲洗3次,放置在铺有湿润滤纸的培养皿中,24℃、12 h/d光照培养。分别于2、4、6 d后取样进行GUS染色。GUS染色液的配制按照Jefferson等的方法[6]进行,将待测材料和对照材料放入1.5 mL的离心管中,加入GUS染色液,37 ℃保温24 h,将染色后的材料用70%、80%、90%、100%乙醇依次脱色,至空白对照为白色时用体视显微镜观察并拍照。
2 结果与分析
2.1 SrUGT76G1启动子序列的获得
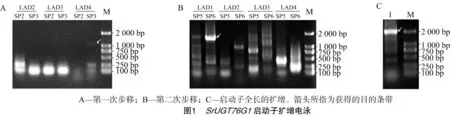
根据已知SrUGT76G1基因序列设计步移引物,采用Liu等的未知侧翼序列扩增的方法[4],第一次步移克隆到了 1 107 bp 的片段,经测序和NCBI blast比对,结果表明所得序列的3′端与数据库中SrUGT76G1基因5′序列完全重叠,得到了ATG前862 bp的序列。根据克隆到的序列再设计3个嵌套引物继续向5′端步移,得到1 580 bp片段,亚克隆后测序,比对结果显示其3′端与第一次步移所得序列的5′端重叠。将2次步移得到的序列进行拼接,并重新设计1对序列特异引物从甜菊基因组DNA中克隆完整的SrUGT76G1启动子区域,将扩增到的序列进行NCBI blast,结果表明该序列3′端与数据库中SrUGT76G1基因序列5′端同源,最终得到SrUGT76G1基因ATG前2 283 bp的启动子序列(图1)。
2.2 启动子顺式作用元件预测和序列分析
将克隆得到的启动子全长序列提交PLACE,进行顺式调控元件的分析,启动子序列正反向包含475个调控元件(表3),含有典型的启动子保守元件,有21个TATA box;如:TATABOX2、TATABOX3、TATABOX4、TATABOX5和TATAPVTRNALEU;36个CAATBOX1和9个CCAATBOX1,它们是CAAT box的基序;2个ACGTTBOX,ACGTTBOX是1个ACGT元件;有2个AMYBOX1,它是5′上游区域的保守序列;19个MYB结合位点的同源序列,如:MYB1AT、MYB2AT、MYB2CONSENSUSAT、MYBATRD22、MYBCORE、MYBCORE ATCYCB1和MYBST1等。有12个MYCCONSENSUSAT的同源序列,1个MYCATERD1和1个MYCATRD22,它们是MYC结合位点;发现有植物多腺苷酸化信号的保守序列,8个POLASIG1,3个POLASIG2和6个POLASIG3[7]。
除了以上所述的保守元件,该启动子序列还含有多个植物激素相关的顺式调控元件,1个SURECOREATSULTR11,它是硫和生长素的响应元件[8];ARFAT是ARF(植物生长素响应因子,auxin response factor)的结合位点;2个ASF1MOTIFCAMV同源序列,它是植物生长素和/或水杨酸响应元件,并参与光调控;3个WBOXATNPR1的同源序列,参与水杨酸(SA)信号转导;3个DPBFCOREDCDC3,是bZIP转录因子结合位点和受ABA诱导的[9];含有CPBCSPOR同源序列,是细胞分裂素增强蛋白(cytokinin-enhanced protein)结合的关键序列,最早在黄瓜POR(NADPH-protochlorophyllide reductase)基因启动子序列中被发现[10];以及乙烯响应元件ERELEE4、GCCCORE、LECPLEACS2和赤霉素响应元件GARE1OSREP1、GAREAT、PYRIMIDINEBOXHVEPB1、PYRIMIDINEBOXOSRAMY1A等。
该启动子序列还含有多个环境因子响应的顺式调控元件:有2个CBFHV同源序列,分别为ABRELATERD1和DRECRTCOREAT,它们是脱水响应元件;6个ACGTATERD1的同源序列,是erd1(early responsive to dehydration)基因[11]黄化诱导表达必需的。LTRECOREATCOR15是在拟南芥cor15a基因启动子中发现的低温响应元件LTRE的核心基序[12]。还有厌氧响应元件ANAERO1CONSENSUS,以及一些光调控元件,如:GT1CONSENSUS、IBOXCORE、INRNTPSADB、REALPHALGLHCB21、SORLIP1AT和SORLIP2AT等。其中GT1CONSENSUS是许多光调控基因保守的GT-1结合位点[13-14]。顺式调控元件10PEHVPSBD、CIACADIANLELHC和EVENINGAT参与生理节律调控[15-17]。
此外,还发现SrUGT76G1启动子序列含有一些组织特异性表达元件:有22个GATABOX的同源序列,它们参与光调控和组织特异性表达[18];ACGTOSGLUB1元件参与胚乳特异性表达;DPBFCOREDCDC3参与胚特异性表达;NTBBF1ARROLB参与组织特异性表达和植物生长素诱导[19];OSE1ROOTNODULE和OSE2ROOTNODULE为器官特异性表达元件,在根瘤感染细胞中被激活;POLLEN1LELAT52是2个相互依赖的花粉特异性表达的元件之一;RYREPEATBNNAPA是种子特异性表达元件;TAAAGSTKST1是保卫细胞特异表达调控元件。

表3 SrUGT76G1启动子序列上部分顺式调控元件
2.3 含双酶切位点SrUGT76G1基因启动子片段的获得
以含酶切位点的引物pro-2F和pro-2R克隆得到甜菊SrUGT76G1基因的启动子序列,其长度为1 989 bp,提交至NCBI GenBank,获得登录号为KM206772。序列分析结果见图2,除了TATA box等保守元件外,还有MYB、MYC识别位点,病原体和盐响应元件GT1GMSCAM4,钙响应元件ABRERATCAL,水杨酸响应元件WBOXATNPR1,糖响应元件WBOXHVISO1,赤霉素响应元件GAREAT和增强子CTRMCAMV35S等。
2.4 SrUGT76G1基因启动子植物表达载体的构建
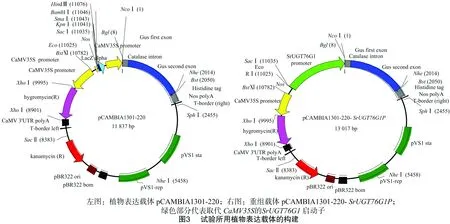
植物表达载体pCAMBIA1301-220是含有CaMV35S启动子和GUS基因系统的双元载体。为了验证所克隆的SrUGT76G1启动子序列是否具有活性,设计引物引入SacⅠ和NcoⅠ酶切位点,用SrUGT76G1启动子取代 pCAMBIA1301-220 中的CaMV35S组成型启动子,连接GUS报告基因,构建植物表达载体pCAMBIA1301-220-SrUGT76G1P(图3)。根据启动子全长序列设计质粒构建引物pro-2F(5′端带SacⅠ酶切位点)和pro-2R(3′端带NcoⅠ酶切位点),NcoⅠ酶切位点中的ATG是SrUGT76G1基因的起始密码子,同时也是载体上GUS基因起始密码子。
2.5 基因瞬时表达分析
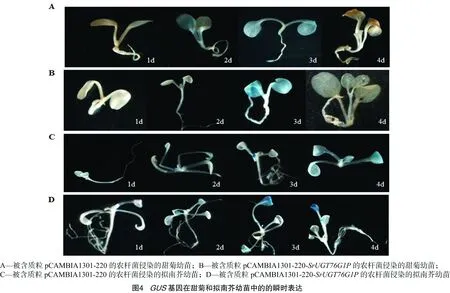
采用农杆菌渗透法分别转化拟南芥和甜菊幼苗,被侵染的甜菊和拟南芥幼苗分别在不同的处理时间取出(1 d、2 d、3 d 和4 d)进行GUS染色,结果用含质粒pCAMBIA1301-220和pCAMBIA1301-220-SrUGT76G1P的农杆菌侵染的幼苗都表现出GUS基因的有效表达(图4),说明所克隆到的SrUGT76G1基因启动子具有启动活性,可以用于下一步的研究。同时试验中发现,被侵染的甜菊幼苗在第3天GUS的表达到高峰,随后组织褐化;而在拟南芥中24 h后逐渐增强并在第3、第4天持续表达。

3 讨论与结论
基因的表达调控是基因功能的基本部分,基因启动子上关键元件是其表达调控的概况[20-21]。了解植物启动子非常有意义,并且在很多方面为通过生物技术控制基因表达提供可能[22-23]。尽管如此,目前甜菊基因启动子研究的报道还很少,仅有关于SrHDR基因启动子的研究[24]。甜菊SrUGT76G1基因是RA苷合成的关键基因[25-26],研究SrUGT76G1基因的表达调控对于了解植物体内甜菊糖苷积累的规律和今后通过生物技术手段进行甜菊育种都有重要的意义,但是目前尚无相关报道。本试验在研究SrUGT76G1基因的基础上,通过染色体步移的方法克隆了该基因的5′端侧翼序列,采用在线的启动子分析工具预测该SrUGT76G1启动子序列上的调控元件,结果显示双向序列包含475个调控元件,除了典型的启动子元件,如:TATA-box、CAAT-box、MYB结合位点等外,还有生长素、赤霉素、细胞分裂素、乙烯、ABA、水杨酸和茉莉酮酸酯等植物激素响应元件,和光、脱水、低温、厌氧等环境因子响应元件,以及芽、胚乳等组织特异性表达元件,可见SrUGT76G1表达调控的复杂性。
因为获得稳定的转基因植株耗时费力,为了快速验证克隆的启动子片段是否有活性,我们采用了农杆菌真空渗透的瞬时转化法[27]。结果表明SrUGT76G1启动子可以驱动GUS报告基因的表达,证明克隆到的5′侧翼序列具有启动子活性。启动子克隆、序列分析和启动子活性初步验证只是SrUGT76G1基因表达调控研究的开始,这些顺式元件的功能和对SrUGT76G1基因表达的调控作用等还有待深入研究,如进一步构建一系列5′端缺失启动子的表达载体,通过对拟南芥及甜菊中的遗传转化获得稳定的转基因植株,进而研究各顺式调控元件的功能及调控因子等。
甜菊糖苷的生物合成与赤霉素有着密切的关系,它们共用生物合成途径的起始阶段,直至共同的前体物质贝壳杉烯酸的合成[28]。因此我们曾推测SrUGT76G1的表达受赤霉素调控,正如我们所期望的,启动子顺式调控元件预测的结果表明该序列上有7个赤霉素响应元件,包括2个GARE1OSREP1、1个GAREAT、1个PYRIMIDINEBOXHVEPB 1和3个PYRIMIDINEBOXOSRAMY1A。GARE1OSREP1(TA ACAGA)是在水稻一个半胱氨酸蛋白酶(REP-1)基因启动子上发现的,该基因的表达受赤霉素的诱导[29]。GAREAT则是在拟南芥中发现的赤霉素响应元件[30];PYRIMIDINEBOXHVEPB1是一个嘧啶盒(Pyrimidine box),在大麦EPB-1(半胱氨酸蛋白酶)基因启动子上发现,并且确定为赤霉素诱导必需的元件[31];PYRIMIDINEBOXOSRAMY1A存在于水稻和大麦的α-淀粉酶基因启动子上,是转录因子GARE的赤霉素响应顺式调控元件,并部分参与糖抑制[32-33]。尽管在Kumar等的研究中SrUGT76G1基因的转录水平在GA3处理下并没有显著变化[24],但是鉴于甜菊糖苷与赤霉素共用很长一段生物合成路径,赤霉素对SrUGT76G1基因的表达调控还需深入研究。
在Kumar等的研究中发现甜菊糖苷主要在叶片中积累,尤其是顶部向下第三对叶,花和茎中含量次之,根中几乎没有,甜菊糖苷合成途径相关基因的转录水平也有相似的结果,表现出很强的组织相关性[24]。通过对SrUGT76G1启动子顺式元件的分析,确实发现该序列上存在一些组织特异性表达元件,且大多是芽特异性表达相关的。由于甜菊叶片中糖苷含量在现蕾期达到最高,开花后逐渐下降[34-35],我们推测一些关键基因受生理节律的调控。在SrUGT76G1启动子序列中也确实发现有生理节律调控相关元件,如:-10PEHVPSBD、CIACADIANLELHC和EVENINGAT。
目前,植物基因工程中常用的启动子仍以CaMV35S为主,CaMV35S是组成型启动子,不表现出时间或空间的特异性。组成型启动子驱动外源基因持续、稳定地表达,可能会使植物消耗过多的能量和物质,而且在研究中发现用相同的组成型启动子同时驱动2个或2个以上外源基因的表达可能引起基因沉默或共抑制[36];所以克隆甜菊自身基因的启动子,并研究其启动子的功能对未来甜菊的分子育种具有重要参考价值。
参考文献:
[1]舒世珍. 甜菊引种三十年[J]. 中国种业,2010(6):21-23.
[2]Yadav S K,Guleria P. Steviol glycosides fromStevia:biosynthesis pathway review and their application in foods and medicine[J]. Critical Reviews in Food Science and Nutrition,2012,52(11):988-998.
[3]Richman A,Swanson A,Humphrey T,et al. Functional genomics uncovers three glucosyltransferases involved in the synthesis of the major sweet glucosides ofSteviarebaudiana[J]. Plant Journal,2005,41(1):56-67.
[4]Liu Y G,Chen Y L. High-efficiency thermal asymmetric interlaced PCR for amplification of unknown flanking sequences[J]. Biotechniques,2007,43(5):649-654.
[5]Holsters M,de Waele D,Depicker A,et al. Transfection and transformation ofAgrobacteriumtumefaciens[J]. Molecular & General Genetics,1978,163(2):181-187.
[6]Jefferson R A,Kavanagh T A,Bevan M W. Gus fusions - beta-glucuronidase as a sensitive and versatile gene fusion marker in higher-plants[J]. The EMBO Journal,1987,6(13):3901-3907.
[7]Heidecker A G,Messing J. Structural analysis of plant genes[J]. Annual Review of Plant Physiology,1986,37(1):439-466.
[8]Maruyama-Nakashita A,Nakamura Y,Watanabe-Takahashi A A,et al. Identification of a novel cis-acting element conferring sulfur deficiency response inArabidopsisroots[J]. The Plant Journal,2005,42(3):305-314.
[9]Kim S Y,Chung H J,Thomas T L. Isolation of a novel class of bZIP transcription factors that interact with ABA-responsive and embryo-specification elements in the Dc3 promoter using a modified yeast one-hybrid system[J]. The Plant Journal,1997,11(6):1237-1251.
[10]Fusada N,Masuda T,Kuroda H,et al. Identification of a novel cis-element exhibiting cytokinin-dependent protein bindinginvitroin the 5′-region of NADPH-protochlorophyllide oxidoreductase gene in cucumber[J]. Plant Molecular Biology,2005,59(4):631-645.
[11]Simpson S D,Nakashima Kazuo,Narusaka Y,et al. Two different novel cis-acting elements of erd1,a clpA homologousArabidopsisgene function in induction by dehydration stress and dark-induced senescence[J]. The Plant Journal,2003,33(2):259-270.
[12]Baker S S,Wilhelm K S,Thomashow M F. The 5′-region ofArabidopsisthalianacor15ahas cis-acting elements that confer cold-regulated,drought-regulated and ABA-regulated gene-expression[J]. Plant Molecular Biology,1994,24(5):701-713.
[13]Terzaghi W B,Cashmore A R. Light-regulated transcription[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1995,46:445-474.
[14]Zhou D X. Regulatory mechanism of plant gene transcription by GT-elements and GT-factors[J]. Trends in Plant Science,1999,4(6):210-214.
[15]Piechulla B,Merforth N,Rudolph B. Identification of tomato Lhc promoter regions necessary for circadian expression[J]. Plant Molecular Biology,1998,38(4):655-662.
[16]Harmer S L,Hogenesch L B,Straume M,et al. Orchestrated transcription of key pathways inArabidopsisby the circadian clock[J]. Science,2000,290(5499):2110-2113.
[17]Thum K E,Kim M,Morishige D T,et al. Analysis of barley chloroplast psbD light-responsive promoter elements in transplastomic tobacco[J]. Plant Molecular Biology,2001,47(3):353-366.
[18]Reyes J C,Muro-Pastor M I,Florencio F J. The GATA family of transcription factors inArabidopsisand rice[J]. Plant Physiology,2004,134(4):1718-1732.
[19]Baumann K,de Paolis A,Costantino P,et al. The DNA binding site of the Dof protein NtBBF1 is essential for tissue-specific and auxin-regulated expression of the rolB oncogene in plants[J]. Plant Cell,1999,11(3):323-334.
[20]张春晓,王文棋,蒋湘宁,等. 植物基因启动子研究进展[J]. 遗传学报,2004,31(12):1455-1464.
[21]雒雅婧,李杰,张爽,等. 植物启动子研究进展[J]. 北方园艺,2015(22):186-189.
[22]Lescot M,Déhais P,Thijs G,et al. PlantCARE,a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences[J]. Nucleic Acids Research,2002,30(1):325-327.
[23]Shahmuradov I A,Gammerman A J,Hancock J M,et al. PlantProm:a database of plant promoter sequences[J]. Nucleic Acids Research,2003,31(1):114-117.
[24]Kumar H,Kumar S. A functional (E)-4-hydroxy-3-methylbut-2-enyl diphosphate reductase exhibits diurnal regulation of expression inSteviarebaudiana(Bertoni)[J]. Gene,2013,527(1):332-338.
[25]郭书巧,杨郁文,倪万潮. 甜叶菊葡糖基转移酶基因UGT76G2的克隆及生物信息学分析[J]. 基因组学与应用生物学,2009,28(3):422-428.
[26]Yang Y H,Huang S Z,Han Y L,et al. Base substitution mutations in uridinediphosphate-dependent glycosyltransferase 76G1 gene ofSteviarebaudianacauses the low levels of rebaudioside A:mutations inUGT76G1,a key gene of steviol glycosides synthesis[J]. Plant Physiology and Biochemistry,2014,80:220-225.
[27]Cook D,Dreyer D,Bonnet D,et al. Transient induction of a peroxidase gene inMedicagotruncatulaprecedes infection byRhizobiummeliloti[J]. Plant Cell,1995,7(1):43-55.
[28]Humphrey T V,Richman A S,Menassa R,et al. Spatial organisation of four enzymes fromSteviarebaudianathat are involved in steviol glycoside synthesis[J]. Plant Molecular Biology,2006,61(1/2):47-62.
[29]Sutoh K,Yamauchi D. Two cis-acting elements necessary and sufficient for gibberellin-upregulated proteinase expression in rice seeds[J]. Plant Journal,2003,34(5):635-645.
[30]Ogawa M,Hanada A,Yamauchi Y,et al. Gibberellin biosynthesis and response duringArabidopsisseed germination[J]. Plant Cell,2003,15(7):1591-1604.
[31]Cercós M,Gómezcadenas A,Ho T H. Hormonal regulation of a cysteine proteinase gene,EPB-1,in barley aleurone layers:cis-and trans-acting elements involved in the co-ordinated gene expression regulated by gibberellins and abscisic acid[J]. Plant Journal,1999,19(2):107-118.
[32]Morita A,Umemura T A,Kuroyanagi M,et al. Functional dissection of a sugar-repressed α-amylase gene(RAmy1A) promoter in rice embryos[J]. FEBS Letters,1998,423(1):81-85.
[33]Mena M,Cejudo F J,Isabellamoneda I,et al. A role for the DOF transcription factor BPBF in the regulation of gibberellin-responsive genes in barley aleurone[J]. Plant Physiology,2002,130(1):111-119.
[34]Bondarev N I,Sukhanova M A,Reshetnyak O V,et al. Steviol glycoside content in different organs ofSteviarebaudianaand its dynamics during ontogeny[J]. Biologia Plantarum,2004,47(2):261-264.
[35]Ceunen S,Geuns J M. Spatio-temporal variation of the diterpene steviol inSteviarebaudianagrown under different photoperiods[J]. Phytochemistry,2013,89:32-38.
[36]Kumpatla S P,Hall T C. Recurrent onset of epigenetic silencing in rice harboring a multi-copy transgene[J]. Plant Journal,1998,14(1):129-135.

