NRG-1对缺氧复氧心肌细胞凋亡及氧化损伤的影响*
王 军 范粉灵 张松林 王星烨 薛建颖
(西安交通大学第一附属医院结构性心脏病科,西安 710061)
急性心肌梗死是一种严重危害人类健康的常见心血管疾病,且近年在我国有增加趋势。尽早恢复冠脉血流是急性心肌梗死救治的关键,目前静脉溶栓术、冠状动脉介入治疗是急性心肌梗死早期再灌注治疗的有效手段[1]。但在心肌缺血后恢复血液流通也会导致心肌出现不可逆的损伤,称为心肌缺血再灌注损伤[2]。心肌缺血再灌注损伤的发生与氧化应激、钙超载、心肌细胞凋亡等有关,寻找有效的方法降低心肌缺血再灌注损伤是目前研究的重点[3]。神经调节蛋白1(Neuregulin-1,NRG-1)属于表皮生长因子,在心脏发育过程中发挥促进作用[4]。NRG-1基因突变的小鼠心脏发育缓慢,并且在胚胎发育的第10天死亡[5]。有研究报道NRG-1在小鼠心力衰竭、心肌肥厚、糖尿病心肌病、心肌缺血再灌注等发病过程中均发挥调控作用[6-8]。本研究以缺氧复氧心肌细胞为研究对象,在体外用NRG-1蛋白处理细胞,探讨NRG-1对缺氧复氧心肌细胞凋亡及氧化损伤的作用,以期为治疗心肌缺血再灌注损伤提供新思路。
1 材料与方法
1.1材料 人心肌细胞系HCM购自上海博谷生物细胞库;NRG-1为西安交通大学第一附属医院心内实验室合成并保存;DMEM-F12培养基、胰蛋白酶均为美国Sigma公司产品;胎牛血清为美国Gibco公司产品;黄嘌呤氧化法超氧化物歧化酶(Superoxide dismutase,SOD)活性检测试剂盒为上海索莱宝生物科技有限公司产品;硫代巴比妥酸比色法丙二醛(Malonaldehyde,MDA)含量检测试剂盒为北京百奥莱博公司产品;二硝基苯肼显色法乳酸脱氢酶(Lactate dehydrogenase,LDH)含量试剂盒为上海纪宁实业公司产品;活性氧簇(Reactive oxygen species,ROS)含量检测试剂盒为上海翊圣公司产品;抗蛋白激酶B(protein kinase B,Akt)多克隆抗体、抗磷酸化Akt(p-AktThr308)多克隆抗体、抗cleaved caspase-3多克隆抗体、辣根过氧化物酶标记的Ⅱ抗均为美国Abcam公司产品。
1.2方法
1.2.1细胞培养 HCM细胞用含有10%胎牛血清的DMEM-F12细胞培养液,于37℃、5%CO2培养箱中培养。细胞融合度达到90%时,倒掉细胞培养液,用0.125%的胰蛋白酶消化细胞后,1 000 r/min离心10 min,用细胞培养液悬浮细胞,接种到细胞培养瓶中继续培养,根据实验要求确定接种比例。
1.2.2细胞分组及处理 心肌细胞缺氧复氧模型的构建参照文献[9]。HCM细胞融合度超过60%时,将细胞培养液更换为不含有胎牛血清的DMEM-F12培养液,放在95%N2、5%CO2培养箱中孵育4 h。将细胞培养液更换为完全细胞培养液(含有胎牛血清),放在95%空气、5%CO2培养箱中孵育6 h,即为缺氧复氧心肌细胞模型。HCM细胞分为Control组、H/R组、NRG-1组,H/R组、NRG-1组进行缺氧复氧处理,NRG-1组细胞在缺氧处理前加入0.8 mg/L的NRG-1。Control组细胞不做处理。
1.2.3细胞活力检测 HCM细胞培养至对数期后,细胞接种到96孔细胞培养板中,细胞培养液中含有的细胞个数为1×106个/ml,每孔接种100 μl细胞。分别按照1.2.2中处理Control组、H/R组、NRG-1组的细胞,每组设置5个复孔。缺氧处理后,在每孔中加入噻唑蓝(Methylthiazolyldiphenyl-tetrazolium bromide,MTT)溶液20 μl(5 g/L)。在37℃孵育反应4 h。弃上清液,加入100 μl的二甲基亚砜溶液,酶标仪检测490 nm每孔的吸光度(A)值。
1.2.4细胞凋亡检测 Control组、H/R组、NRG-1组的细胞按照1.2.2中方法处理后,收集各组细胞,加入磷酸盐缓冲液(Phosphate buffered saline,PBS),调整细胞浓度为1×105个/ml。混合均匀后,取1 ml的细胞悬浮液,1 000 r/min离心10 min,去除上清,收集细胞,加入碘化丙啶(Propidium iodide,PI)和膜联蛋白 V-FITC(Annexin V-FITC)各5 μl,充分混合,放在室温环境下孵育反应15 min。用流式细胞术检测细胞凋亡情况。
1.2.5LDH水平检测Control组、H/R组、NRG-1组细胞按照1.2.2中方法处理后,收集各组细胞培养液,按照LDH含量检测试剂盒检测培养液上清中LDH水平,步骤参照LDH含量检测试剂盒(二硝基苯肼显色法)。
1.2.6ROS、MDA、SOD水平的检测Control组、H/R组、NRG-1组的细胞按照1.2.2中方法处理后,收集各组细胞,按照ROS含量检测试剂盒检测ROS水平,步骤参照ROS含量检测试剂盒(DCFH-DA法)。同时检测MDA、SOD水平,步骤分别参照MDA含量检测试剂盒(硫代巴比妥酸比色法)和SOD含量检测试剂盒(黄嘌呤氧化法)。
1.2.7Western blot检测Akt、p-Akt、cleaved caspa-se-3的蛋白水平Control组、H/R组、NRG-1组的细胞按照1.2.2中方法处理后,加入含有苯甲基磺酰氟(Phenylmethylsulfonyl fluoride,PMSF)的裂解液,放在冰上裂解反应30 min。12 000 r/min,4℃离心20 min,吸取蛋白上清液至EP管中。二喹啉甲酸(Bicinchoninic acid,BCA)蛋白定量试剂盒检测提取的蛋白浓度。将蛋白样品与2×loading buffer(2∶1)充分混合后,放在100 ℃煮沸5 min。蛋白凝胶上样孔中每孔加入50 μl的变性蛋白样品,80 V电压电泳30 min 后,120 V电压电泳至结束。蛋白凝胶在4℃,100 V电压转印至硝酸纤维素膜上,用5%牛血清白蛋白封闭(37℃孵育90 min)后,依次与抗Akt、p-AktThr308、cleaved caspase-3的Ⅰ抗(800倍稀释,4℃孵育过夜)、辣根过氧化物酶标记的Ⅱ抗(1 000倍稀释,37 ℃孵育90 min)结合后,转移至暗室中,滴加显色液,显影,定影后,曝光,分析p-Akt/Akt水平和cleaved caspase-3/GAPDH水平。

2 结果
2.1NRG-1拮抗缺氧复氧对细胞活力的抑制作用 结果见图1和表1所示,Control组、H/R组、NRG-1组的细胞活力3组间比较差异具有统计学意义(P<0.01),H/R组、NRG-1组细胞的A值均明显低于Control组,差异具有统计学意义(P<0.01)。NRG-1组细胞的A值明显高于H/R组,差异具有统计学意义(P<0.05)。
2.2NRG-1抑制缺氧复氧诱导的细胞凋亡 结果见图2和表2所示,Control组、H/R组、NRG-1组的细胞凋亡率经单因素方差分析,3组间比较差异具有统计学意义(P<0.01),H/R组、NRG-1组的细胞凋亡率均明显高于Control组,差异具有统计学意义(P<0.01)。NRG-1组的细胞凋亡率明显低于H/R组,差异具有统计学意义(P<0.01)。Cleaved caspase-3/GAPDH的蛋白水平经单因素方差分析,3组间比较差异具有统计学意义(P<0.01),NRG-1组细胞cleaved caspase-3水平明显高于Control组,差异具有统计学意义(P<0.01)。NRG-1组细胞的cleaved caspase-3水平明显低于H/R组,差异具有统计学意义(P<0.01)。
2.3NRG-1降低缺氧复氧后的细胞培养液上清中LDH水平 结果见图3和表3所示,Control组、H/R组、NRG-1组LDH水平经单因素方差分析,3组间比较差异具有统计学意义(P<0.01),H/R组、NRG-1组的LDH水平均明显高于Control组,差异具有统计学意义(P<0.01)。NRG-1组LDH水平明显低于H/R组,差异具有统计学意义(P<0.01)。
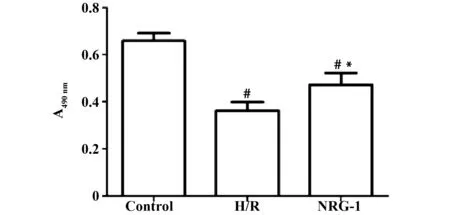
图1 NRG-1对心肌细胞活力的影响Fig.1 Effect of NRG-1 on viability of myocardial HCM cellsNote: Mean±SD.n=3.#.P<0.01 vs Control group;*.P<0.05 vs H/R group.
2.4NRG-1降低缺氧复氧后细胞中ROS水平 结果如图4和表4所示,细胞中荧光强度越高,ROS水平越高。Control组、H/R组、NRG-1组荧光强度经单因素方差分析,3组间比较差异具有统计学意义(P<0.01),H/R组、NRG-1组ROS水平均明显高于Control组,差异具有统计学意义(P<0.01)。NRG-1组ROS水平明显低于H/R组,差异具有统计学意义(P<0.01)。
2.5NRG-1降低缺氧复氧后细胞中MDA水平,增加细胞中SOD水平 结果见图5和表5所示,Control组、 H/R组、 NRG-1组的MDA水平和SOD水平经单因素方差分析,3组间差异的比较均具有统计学意义(P<0.01)。H/R组、NRG-1组的MDA水平均明显高于Control组,而SOD水平均明显低于Control组,差异具有统计学意义(P<0.05)。NRG-1组的MDA水平明显低于H/R组,而SOD水平明显高于H/R组,差异具有统计学意义(P<0.01)。



GroupsSampleCellviabilityControl30.66±0.05H/R30.36±0.031)NRG-130.47±0.041)2)F41.460
Note:1)P<0.01 vs Control;2)P<0.01 vs H/R.

图2 NRG-1对心肌细胞凋亡的影响Fig.2 Effect of NRG-1 on cardiomyocyte apoptosisNote: A. The images of flow cytometry for analyzing the apoptosis of cardiomyocytes;B.The apoptotic rate was quantitatively analyzed;C.The quantitative analysis of the protein levels of cleaved caspase-3.Mean±SD.n=3.#.P<0.01 vs Control group;*.P<0.01 vs H/R group.
2.6NRG-1增加缺氧复氧后细胞中p-AktThr308/Akt水平 结果见图6和表6所示,Control组、H/R组、NRG-1组的p-AktThr308/Akt水平经单因素方差分析,3组间比较差异具有统计学意义(F=30.179,P<0.01)。H/R组、NRG-1组的p-AktThr308/Akt水平均组,差异具有统计学意义(P<0.05)。



GroupsnApoptosisrate(%)CleavedCaspase-3/GAPDHControl34.62±0.970.25±0.02H/R329.07±3.431)0.49±0.031)NRG-1319.76±3.411)2)0.35±0.011)2)F56.32393.429
Note:1)P<0.01 vs Control;2)P<0.01 vs H/R.

图3 NRG-1对LDH水平的影响Fig.3 Effect of NRG-1 on LDH levels in cardiomyocytesNote: Mean±SD.n=3.#.P<0.01 vs Control group;*.P<0.01vs H/R group.



GroupsnLDH(U/L)Control320.63±4.05H/R395.47±6.091)NRG-1344.28±5.041)2)F166.951
Note:1)P<0.01 vs Control;2)P<0.01 vs H/R.
明显低于Control组,差异具有统计学意义(P<0.01)。NRG-1组的p-Akt/Akt水平明显高于H/R
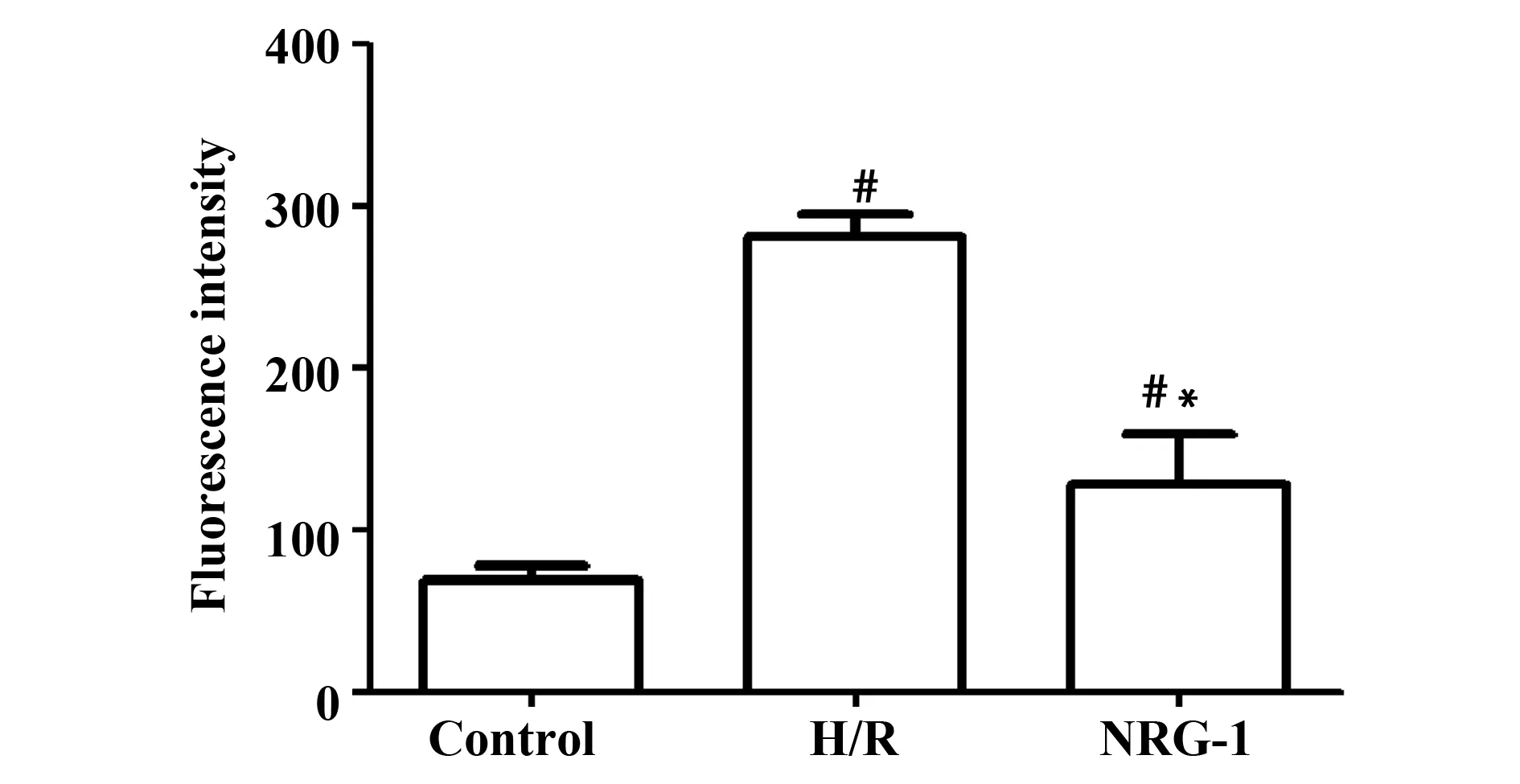
图4 NRG-1对心肌细胞ROS水平的影响Fig.4 Effect of NRG-1 on ROS levels in cardiomyocytesNote: Mean±SD.n=3.#.P<0.01 vs Control group;*.P<0.01 vs H/R group.


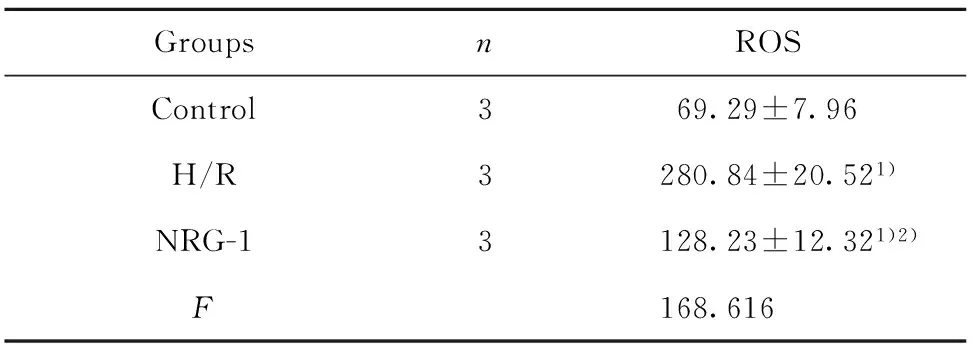
GroupsnROSControl369.29±7.96H/R3280.84±20.521)NRG-13128.23±12.321)2)F168.616
Note:1)P<0.01 vs Control;2)P<0.01 vs H/R.

图5 NRG-1对心肌细胞MDA、SOD水平的影响Fig.5 Effect of NRG-1 on MDA and SOD levels in cardiomyocytesNote: A.MDA level;B.SOD level.Mean±SD.n=3.#.P<0.01 vs Control group;*.P<0.05 vs H/R group.

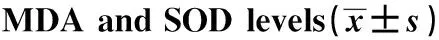

GroupsSampleMDA(nmol/mg)SOD(U/ml)Control30.97±0.08187.85±12.58H/R32.29±0.191)124.39±8.751)NRG-131.47±0.131)2) 160.31±11.011)2)F67.29325.598
Note:1)P<0.01 vs Control;2)P<0.01 vs H/R.



GroupsSamplep-AktThr308/AktControl30.54±0.09H/R30.12±0.021)NRG-130.28±0.071)2)F30.179
Note:1)P<0.01 vs Control;2)P<0.01 vs H/R.

图6 NRG-1对心肌细胞Akt、p-AktThr308蛋白水平的影响Fig.6 Effect of NRG-1 on protein levels of Akt and p-AktThr308 in cardiomyocytesNote: Mean±SD.n=3.#.P<0.01 vs Control group;*.P<0.05 vs H/R group.
3 讨论
研究表明,心肌缺血后恢复血流通不仅不能及时恢复心脏正常功能,而且会加重心肌组织的损伤,引起心肌细胞凋亡,扩大心肌梗死面积[10]。对于心肌缺血再灌注损伤的发病机制研究较多,大致可以总结为:氧自由基生成过多、心肌细胞大量凋亡、钙超载等,但是其具体的发病机制目前尚不十分清楚[11-15]。NRGs蛋白家族含有4个成员,这4个成员都含有表皮生长因子结构域、免疫球蛋白结构域,能够特异性地激活酪氨酸激酶受体[16]。NRG-1是目前已经证实的与心脏发育有关的NRGs蛋白家族成员,在胎儿心脏发育过程中由心内膜内皮细胞产生[17]。NRG-1能够影响心肌细胞生长和存活,调节肌节组织结构发育[18]。Lemmens等[19]的研究表明,在心肌缺血再灌注后,冠状动脉血管内皮细胞能够大量产生NRG-1从而减轻心肌缺血再灌注损伤。
心肌缺血再灌注损伤与心肌细胞凋亡发生有关。心肌组织缺血后,细胞内的钙离子大量聚集,同时缺血再灌注期间细胞内会有ROS大量产生,这会引起细胞膜通透性发生改变,促进细胞凋亡发生[20-24]。LDH是一种存在于细胞浆内的蛋白酶,心肌缺血再灌注发生后,细胞内的脂质过氧化生成MDA,而细胞内脂质过氧化后,细胞膜通透性发生改变,细胞内LDH大量外泄,检测细胞外LDH水平可以间接反映细胞膜的完整性及细胞氧化损伤程度[25]。SOD是细胞内氧自由基的清除剂,具有维持细胞内氧化平衡状态的功能[26]。有研究表明,NRG-1重组蛋白可以减少心肌细胞凋亡[27]。本研究结果显示,心肌细胞缺氧复氧后细胞凋亡率升高,细胞活力下降,而NRG-1处理后心肌细胞凋亡率有所下降,细胞活力部分恢复。这提示,NRG-1能够抑制缺氧复氧诱导的心肌细胞凋亡。
Akt信号通路在心脏组织中广泛表达,是NRG-1调控的下游信号通路之一,具有广泛的生物学功能,与组织生长、疾病发生等有关,弃激活后能够抑制心肌细胞凋亡的发生,促进心肌细胞生长[28]。有研究表明,Akt信号通路与细胞内线粒体呼吸有关,参与细胞摄取葡萄糖过程,在NRG-1调控心肌细胞凋亡过程中发挥重要作用[29]。之前的研究报道显示,NRG-1可以通过调控Akt信号通路在体外降低衣霉素和二硫苏糖醇作用后的心肌细胞内质网应激标志蛋白的表达水平,降低内质网应激,减少心肌细胞损伤,还可以在体内减轻心肌缺血再灌注损伤,降低心脏的内质网应激[30]。本研究结果显示,心肌细胞缺氧复氧后细胞中p-AktThr308/Akt水平降低,而NRG-1处理后心肌细胞p-AktThr308/Akt水平升高,NRG-1通过影响Akt信号通路抑制缺氧复氧心肌细胞凋亡。本研究结果与之前的报道同时说明了NRG-1在心肌缺血再灌注损伤中具有保护作用,并且NRG-1对心肌缺血再灌注损伤的保护作用可能是多方面的,除了与心肌细胞内质网应激有关,还与心肌细胞凋亡和氧化损伤有关。综上所述,NRG-1能够部分逆转缺氧复氧诱导的心肌细胞凋亡及氧化损伤,升高p-AktThr308/Akt表达水平。本研究为NRG-1治疗心肌缺血再灌注损伤提供了理论基础,为后续探讨心肌缺血再灌注损伤的发病机制奠定了基础。本研究存在一定的局限性,在以后的实验中会对NRG-1在心肌缺血再灌注损伤心肌细胞凋亡与Akt信号通路的相互作用进行进一步验证,同时会继续探讨心肌缺血再灌注损伤中NRG-1与其他相关信号通路的关系。
参考文献:
[1] Sharp WW,Fang YH,Han M,etal.Dynamin-related protein 1 (Drp1)-mediated diastolic dysfunction in myocardial ischemia-reperfusion injury: therapeutic benefits of Drp1 inhibition to reduce mitochondrial fission[J].FASEB J,2014,28(1):316-326.
[2] Fernández-Jiménez R,García-Prieto J,Sánchez-González J,etal.Pathophysiology underlying the bimodal edema phenomenon after myocardial ischemia/reperfusion[J].J Am Coll Cardiol,2015,66(7):816-828.
[3] Hocher B,Sharkovska Y,Mark M,etal.The novel DPP-4 inhibitors linagliptin and BI 14361 reduce infarct size after myocardial ischemia/reperfusion in rats[J].Int J Cardiol,2013,167(1):87-93.
[4] Sun Y,Ikrar T,Davis MF,etal.Neuregulin-1/ErbB4 signaling regulates visual cortical plasticity[J].Neuron,2016,92(1):160-173.
[5] Rentschler S,Zander J,Meyers K,etal.Neuregulin-1 promotes formation of the murine cardiac conduction system[J].Proc Natl Acad Sci USA,2002,99(16): 10464-10469.
[6] Gao R,Zhang J,Cheng L,etal.A Phase II,randomized,double-blind,multicenter,based on standard therapy,placebo-controlled study of the efficacy and safety of recombinant human neuregulin-1 in patients with chronic heart failure[J].J Am Coll Cardiol,2010,55(18):1907-1914.
UV-1800分光光度计,岛津;D-3752冷冻离心机(Thermo Fisher Scientific);XMTD-6000型数显恒温水浴锅,余姚金电仪表有限公司;DYY-6D型电泳仪,北京市六一仪器厂;德国IKA A11 basic分析研磨机,上海川翔生物科技有限公司;PCR仪,德国耶拿分析仪器股份公司;Nano Drop 2000微量分光光度计,北京科誉兴业科技发展有限公司;凝胶成像仪,上海创萌生物科技有限公司;Light Cycler 480Ⅱ实时荧光定量PCR系统。
[7] Matsukawa R,Hirooka Y,Ito K,etal.Central neuregulin-1/ErbB signaling modulates cardiac function via sympathetic activity in pressure overload-induced heart failure[J].J Hypertens,2014,32(4):817-825.
[8] Zhou F,Xia Z,Liu K,etal.Exogenous neuregulin-1 attenuates STZ-induced diabetic peripheral neuropathic pain in rats[J].Acta Cir Bras,2017,32(1): 28-37.
[9] Boccalini G,Sassoli C,Formigli L,etal.Relaxin protects cardiac muscle cells from hypoxia/reoxygenation injury: involvement of the Notch-1 pathway[J].FASEB J,2015,29(1):239-249.
[11] Savchenko AS,Borissoff JI,Martinod K,etal.VWF-mediated leukocyte recruitment with chromatin decondensation by PAD4 increases myocardial ischemia/reperfusion injury in mice[J].Blood,2014,123(1):141-148.
[12] 李 强,郭壮波,伍光颖,等.阿托伐他汀对急性心肌梗死大鼠内皮微颗粒及心肌细胞凋亡的影响[J].中国病理生理杂志,2015,31(2):359-363.
Li Q,GuO ZB,Wu GY,etal.Effects of atorvastatin on release of endothelial microparticles and myocardial apoptosis in rats with acute myocardial infarction[J].Chin J Pathophysiol,2015,31(2):359-363.
[13] Ling H,Gray CBB,Zambon AC,etal.Ca2+/Calmodulin-dependent protein kinase II δ mediates myocardial ischemia/reperfusion injury through nuclear factor-κBNovelty and significance[J].Circ Res,2013,112(6):935-944.
[14] Yu L,Liang H,Dong X,etal.Reduced silent information regulator 1 signaling exacerbates myocardial ischemia-reperfusion injury in type 2 diabetic rats and the protective effect of melatonin[J].J Pineal Res,2015,59(3):376-390.
[15] Wang JX,Zhang XJ,Li Q,etal.MicroRNA-103/107 regulate programmed necrosis and myocardial ischemia/reperfusion injury through targeting FADD [J].Circ Res,2015,117(4):352-363.
[16] Bartus K,Galino J,James ND,etal.Neuregulin-1 controls an endogenous repair mechanism after spinal cord injury[J].Brain,2016,139(5):1394-1416.
[17] Fukazawa R,Miller TA,Kuramochi Y,etal.Neuregulin-1 protects ventricular myocytes from anthracycline-induced apoptosis via erbB4-dependent activation of PI3-kinase/Akt[J].J Mol Cell Cardiol,2003,35(12):1473-1479.
[18] Mendes-Ferreira P,De Keulenaer GW,Leite-Moreira AF,etal.Therapeutic potential of neuregulin-1 in cardiovascular disease[J].Drug Discov Today,2013,18(17):836-842.
[19] Lemmens K,Segers VFM,Demolder M,etal.Role of neuregulin-1/ErbB2 signaling in endothelium-cardiomyocyte cross-talk[J].J Biol Chem,2006,281(28):19469-19477.
[20] Ma S,Wang Y,Chen Y,etal.The role of the autophagy in myocardial ischemia/reperfusion injury[J].Biochim Biophys Acta,2015,1852(2):271-276.
[21] Wei B,Li WW,Ji J,etal.The cardioprotective effect of sodium tanshinone IIA sulfonate and the optimizing of therapeutic time window in myocardial ischemia/reperfusion injury in rats[J].Atherosclerosis,2014,235(2):318-327.
[22] Song L,Yang H,Wang HX,etal.Inhibition of 12/15 lipoxyg-enase by baicalein reduces myocardial ischemia/reperfusion injury via modulation of multiple signaling pathways[J].Apoptosis,2014,19(4):567-580.
[23] Zhu L,Wei T,Gao J,etal.The cardioprotective effect of salidroside against myocardial ischemia reperfusion injury in rats by inhibiting apoptosis and inflammation[J].Apoptosis,2015,20(11):1433-1443.
[24] Koshinuma S,Miyamae M,Kaneda K,etal.Combination of necroptosis and apoptosis inhibition enhances cardioprotection against myocardial ischemia-reperfusion injury[J].J Anesth,2014,28(2):235-241.
[25] Arslan F,Lai RC,Smeets MB,etal.Mesenchymal stem cell-derived exosomes increase ATP levels,decrease oxidative stress and activate PI3K/Akt pathway to enhance myocardial viability and prevent adverse remodeling after myocardial ischemia/reperfusion injury[J].Stem Cell Res,2013,10(3):301-312.
[26] 程勇军,寿张飞,王文龙,等.硫辛酸对腹膜透析患者氧化应激,炎症及营养状况的影响[J].中国免疫学杂志,2015,31(4): 541-544.
Cheng YJ,Shou ZF,Wang WL,etal.Effect of lipoic acid on oxidative stress,inflammation and nutritional status in peritoneal dialysis patients[J].Chin J Immunol,2015,31(4): 541-544.
[27] Liu X,Gu X,Li Z,etal.Neuregulin-1/erbB-activation improves cardiac function and survival in models of ischemic,dilated,and viral cardiomyopathy[J].J Am Coll Cardiol,2006,48(7):1438-1447.
[28] 陈立强,徐振宇,韩摇曦,等.生长激素释放肽6 对心衰模型大鼠心肌细胞PI3K/Akt/Caspase-9信号通路蛋白表达的影响[J].中国老年学杂志,2015,35(21):6005-6007.
Chen LQ,Xu ZY,Han X,etal.The effects of GHRP-6 on PI3K/Akt/Caspase-9 signaling pathway in myocardial cells of heart failure rats[J].Chin J Gerontol,2015,35(21):6005-6007.
[29] Timolati F,Ott D,Pentassuglia L,etal.Neuregulin-1 beta attenuates doxorubicin-induced alterations of excitation-contraction coupling and reduces oxidative stress in adult rat cardiomyocytes[J].J Mol Cell Cardiol,2006,41(5): 845-854.
[30] Fang SJ,Li PY,Wang CM,etal.Inhibition of endoplasmic reticulum stress by neuregulin-1 protects against myocardial ischemia/reperfusion injury[J].Peptides,2017,88(2): 196-207.