罗哌卡因对结肠癌细胞增殖和裸鼠人结肠癌皮下瘤生长的影响
高 聪 林大勇 韩 勇 刘 兵
(四川省人民医院急诊科,成都 610072)
外科肿瘤切除术是治疗结肠癌的主要方法[1]。研究表明,手术期是癌症发展最易受影响的阶段[2]。手术期间肿瘤血管的破裂和手术操作不当都可能导致癌细胞进入体循环,造成癌症的转移和复发[2,3]。此外,手术期间全麻药物的使用可导致机体免疫功能抑制,进一步增加癌症转移和复发的风险[4]。近年研究表明,在肿瘤切除手术期间使用局麻药物能降低乳腺癌、卵巢癌和前列腺癌等多种癌症的复发率[5-7]。有数据分析指出,在结肠癌手术期间使用局麻药物的患者预后明显优于使用全麻药物的患者[8]。罗哌卡因是临床常用的局麻药物之一[8]。研究表明,罗哌卡因可通过调控Na+通道的开放明显抑制结肠癌细胞的侵袭和转移能力[9],但其对结肠癌细胞增殖能力的影响及作用机制还较少见报道。因此,本文将从体内体外两方面探讨罗哌卡因对结肠癌细胞增殖和肿瘤生长的影响,以进一步阐明局麻药物罗哌卡因影响结肠癌患者预后的作用机制。
1 材料与方法
1.1材料 DMEM/F12培养基、胎牛血清和0.25%胰蛋白酶购自美国Gibco公司。CO2培养箱购自德国Binder公司,流式细胞仪购自美国BD公司,垂直电泳仪和半干转膜仪购自美国Hoefer公司。CCK8试剂盒、BCA试剂盒和Tunel试剂盒购自中国碧云天生物科技公司。Ki67、增殖细胞核抗原(Proliferating cell nuclear antigen,PCNA)和细胞周期蛋白A (Cyclin A) 抗体购自美国CST公司,caspase-3、caspase-9、p53和磷酸甘油醛脱氢酶 (Glyceraldhyde-phosphate dehydrogenase,GAPDH) 抗体购自美国Millipore公司。
1.2方法
1.2.1细胞培养 人结肠癌细胞系SW480购自中国科学院上海细胞所细胞库。将SW480细胞用含10%胎牛血清、100 U青霉素和100 mg/L链霉素的DMEM培养基培养于37℃,5%CO2的恒温培养箱中,隔天换液。
1.2.2CCK8检测细胞活性 当细胞汇合率达到80%时,将细胞传代接种至96孔板中,并用不同浓度的罗哌卡因 (0、1、2、5、10、20、50、100、200、400、800 μg/ml) 处理SW480细胞。48 h后按照CCK8试剂盒说明书加入CCK8试剂,孵育2 h后,用酶标仪于450 nm检测细胞吸光度。
1.2.3肿瘤成球实验 将结肠癌细胞传代接种于低黏附六孔板中,每孔5 000个细胞。将细胞随机分为Ropivacaine 0、20、50和100 μg/ml组,每组6个复孔。用含相应浓度罗哌卡因的培养液处理细胞48 h后,用含有4 μg/ml 肝素的DMEM培养液进行培养,两周后用结晶紫染色,每孔随机选取六个视野拍照统计。
1.2.4Western blot 用罗哌卡因处理细胞48 h,每孔加入2 ml预冷的蛋白裂解液提取细胞总蛋白,BCA试剂盒测定蛋白浓度。每组各取蛋白样品30 μg 用12% SDS-PAGE分离并转移蛋白至PVDF膜。用5%的脱脂奶粉室温封闭2 h后,加入一抗封闭过夜 (Ki67,1∶1 000;PCNA,1∶850;cleaved caspase-3,1∶700;cleaved caspase-9,1∶900;p53,1∶1 000;Cyclin A,1∶800) 。一抗封闭完成后,TBST清洗3次,室温封闭对应HRP标记二抗1 h,最后加入ECL显色液于暗室曝光显影。
1.2.5流式细胞术检测细胞周期 用罗哌卡因处理细胞48 h后,用胰酶消化收集细胞,加入70%乙醇4℃固定过夜。第二天用PBS清洗除去乙醇,加入1 mg/ml的 RNase A室温孵育30 min。30 min后加入PI,室温避光孵育15 min后用流式细胞仪检测细胞周期。
1.2.6流式细胞术检测细胞凋亡 用罗哌卡因处理细胞48 h,用0.25%的胰酶消化收集细胞,PBS清洗三次后,用70%乙醇4℃固定1 h。固定结束后加入PI和PE-Annexin V室温孵育15 min,流式细胞仪检测细胞凋亡情况。
1.2.7Xenograft模型建立 雄性BALB/C裸鼠购自北京实验动物中心。适应性喂养3 d后,将裸鼠随机分为SW480组、Ropiv (5 mg/kg BW) 组、Ropiv (10 mg/kg BW) 组和Ropiv (20 mg/kg)组 ,每组12只。除SW480组外,其余组裸鼠于腹股沟皮下注射对数期的SW480细胞,细胞密度为1×107个/ml。以有肿瘤长出视为造模成功。Ropiv (5 mg/kg BW) 组、Ropiv (10 mg/kg BW) 组和Ropiv (20 mg/kg) 组分别连续腹腔注射给予5、10和20 mg/kg的罗哌卡因5 d,每天一次,SW480组给予等量溶媒。分别于造模后的1、3、7、10、14、18、21、24、28和32 d测量记录肿瘤长径(a)和短径(b),计算肿瘤体积 (肿瘤体积=a×b2/2),并统计裸鼠存活情况,计算存活率 (存活率=存活数/裸鼠总数×100%) 。
1.2.8Tunel检测细胞凋亡 将裸鼠连续喂养32 d后,处死动物并取出肿瘤组织,用4%多聚甲醛固定过夜后,制作冰冻切片并保存于液氮中备用。根据Tunel试剂盒说明书检测肿瘤组织的细胞凋亡情况。用4%多聚甲醛室温固定肿瘤切片30 min后,加入0.5%的TritonX-100室温通透15 min。用2%过氧化氢室温孵育5 min,滴加含TdT酶的Tunel反应液37℃孵育1 h,1 h后终止反应,最后用0.05%的DAB染色液进行复染,于显微镜下随机选取6个视野记录统计。

2 结果
2.1罗哌卡因对结肠癌细胞活性的影响 为了探究罗哌卡因对SW480活性的影响,确定后续实验用药浓度,我们用CCK8法检测了细胞活性。实验结果表明,当罗哌卡因浓度低于100 μg/ml时,对结肠癌细胞的活性无明显影响,浓度达到200 μg/ml时,细胞活性降至80%以下 (图1) 。因此,我们选择了对细胞无显著毒性的低中高 (20、50、100 μg/ml) 三个剂量进行后续试验。
2.2罗哌卡因对结肠癌细胞增殖的影响 为了探究罗哌卡因对结肠癌细胞增殖的作用,我们检测了SW480细胞的成球情况及增殖标记蛋白的表达情况。肿瘤成球实验结果表明,与Ropivacaine 0 μg/ml组比较,Ropivacaine 20、50和100 μg/ml组成球细胞数明显减少(图2) ,并具有量效关系;同时,罗哌卡因 (20、50、100 μg/ml) 还能明显抑制细胞增殖标记蛋白Ki67和PCNA的表达(图3) ,表明罗帕卡因能抑制结肠癌细胞增殖。
2.3罗哌卡因对结肠癌细胞凋亡的影响 流式细胞术实验结果表明,当罗哌卡因浓度为50和100 μg/ml时,能显著促进结肠癌细胞凋亡 (图4) 。与Ropivacaine 0 μg/ml组比较,Ropivacaine 50 μg/ml组和Ropivacaine 100 μg/ml组结肠癌细胞凋亡标记蛋白Cleaved caspase-3的表达水平明显升高(图3);同时,罗哌卡因(20、50、100 μg/ml)还可明显促进Cleaved caspase-9的表达(图3)。
2.4罗哌卡因对结肠癌细胞周期的影响 用不同浓度罗哌卡因处理细胞48 h后,与Ropivacaine 0 μg/ml组比较,20 μg/ml组的G0/G1期细胞数减少,G2/M期细胞数增多,但差异没有统计学意义;Ropivacaine 50 μg/ml组 (37.6%) 和100 μg/ml组 (32.2%) 的G0/G1期结肠癌细胞数较0 μg/ml组 (46.3%) 比较均明显减少,G2/M期细胞数均显著增多,并且随浓度的增高作用逐渐增强(图5);此Cyclin A的表达(图3) ;浓度为50和100 μg/ml时还能明显促进p53的表达(图5) ,以上结果均提示罗哌卡因可诱导SW480细胞发生G2期阻滞,从而抑制结肠癌细胞的生长。
2.5罗哌卡因对肿瘤生长的影响 为了探究罗哌卡因对肿瘤生长的影响,我们复制结肠癌Xenograft模型,并统计了肿瘤的生长情况及结肠癌小鼠的存活情况。实验结果表明,连续喂养裸鼠28 d后,Ropiv 10组和Ropiv 20 mg/kg BW组裸鼠的肿瘤组织体积较SW480组比较明显减小(图6) ;同时,连续饲养32 d,罗哌卡因(5、10、20 mg/kg)可明显抑制肿瘤细胞的生长(图2) ;此外,罗哌卡因还能提高裸鼠生存率,并体现出量效关系(图6)。
2.6罗哌卡因对肿瘤组织细胞凋亡的影响 进一步研究结果表明,与SW480组比较,Ropiv 10和20 mg/kg BW组肿瘤组织的凋亡小体明显增多(图7),表明罗哌卡因能诱导结肠癌细胞凋亡,进而抑制肿瘤的生长。

图1 罗哌卡因对结肠癌细胞活性的影响Fig.1 Effect of ropivacine on cell viability of colon cancerNote: Cells were seeded in 96-well plates and treated with ropivacaine at different concentrations;A.The chemical structure of ropivacaine;B.CCK8 assay was performed for cell viability of SW480 cell.All experiment were repeated at least three times.n=6.
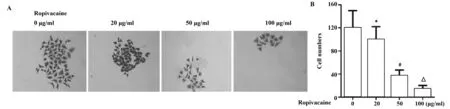
图2 罗哌卡因对结肠癌细胞集落形成的影响Fig.2 Effect of ropivacaine on colony formation of colon cancer cellNote: *.P<0.05,#.P<0.01,△.P<0.001 versus Ropivacaine 0 μg/ml group.

图3 罗哌卡因对结肠癌细胞凋亡的影响Fig.3 Effect of ropivacaine on apoptosis of colon cancer cellNote: A.Flow cytometry was performed for apoptosis;B.Quantification of Fig.3A.#.P<0.01 versus Ropivacaine 0 μg/ml group.

图4 罗哌卡因对结肠癌细胞周期的影响Fig.4 Effect of ropivacaine on cell cycle of colon cancer cellNote: A.Cell cycle was detected by flow cytometry;B.Quantification of Fig.4A.#.P<0.01 versus Ropivacaine 0 μg/ml group.
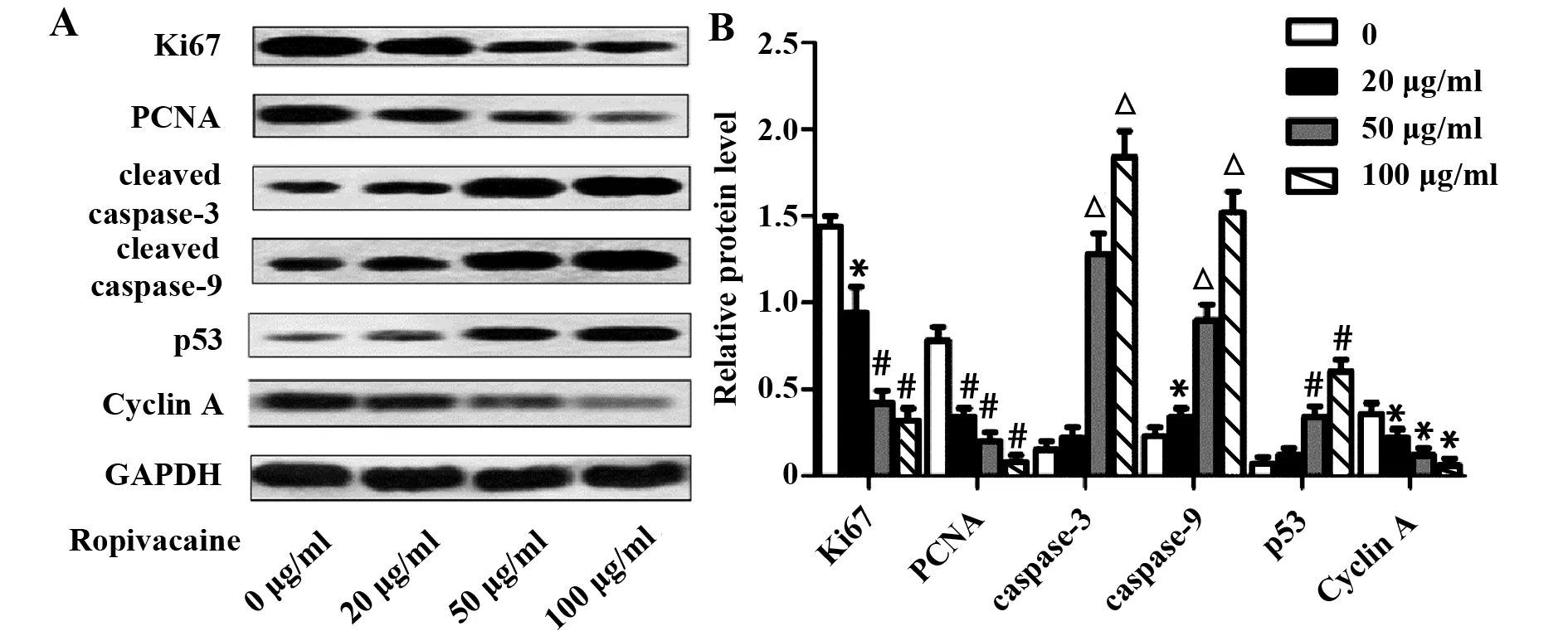
图5 罗哌卡因对细胞增殖标记蛋白、凋亡标记蛋白和细胞周期标记蛋白表达的影响Fig.5 Effect of ropivacaine on proliferation-,apoptosis-and cell cycle-related proteinsNote: GAPDH was used as a loading control.*.P<0.05,#.P<0.01,△.P<0.001 versus Ropivacaine 0 μg/ml group.
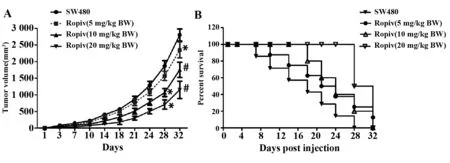
图6 罗哌卡因对肿瘤生长的影响Fig.6 Effect of ropivacaine on growth of tumorNote: Xenograft model of colon cancer was employed and mice were treated with ropivacaine for 5 days.All experiments were performed after 32 days.A.Growth cave of colon tumor;B.Survival cave of mice with colon cancer.*.P<0.05,#.P<0.01 versus SW480 group.

图7 罗哌卡因对肿瘤组织细胞凋亡的影响Fig.7 Effect of ropivacaine on apoptosis in colon tumorNote: A.Apoptosis of colon tumor was measure by Tunnel assay;B.Quantification of Fig.7A.#.P<0.01,△.P<0.001 versus SW480 group.
3 讨论
机体自身免疫应答是影响癌症发生发展的重要因素[10]。研究表明,在肿瘤切除手术过程中,全麻药物的使用会降低机体免疫力,从而增加癌细胞转移的风险[3]。如挥发性麻醉药物和阿片类药物能通过抑制NK细胞活性从而发挥对免疫系统的负向调控作用[11,12]。近年来局麻药物的使用较大程度上避免了这一弊端。大量研究表明,局麻药物可抑制癌细胞增殖,诱导癌细胞凋亡[13-15]。利多卡因可诱导淋巴瘤T细胞凋亡,布比卡因可诱导成神经细胞瘤及结肠癌细胞的凋亡,抑制癌细胞增殖[16-18]。也有研究表明,罗哌卡因可抑制结肠癌细胞侵袭和迁移,大剂量的罗哌卡因可抑制结肠癌细胞增殖[8,18]。本文研究表明,罗哌卡因可抑制结肠癌细胞SW480集落的形成,同时还能抑制细胞增殖标记蛋白Ki67、PCNA的表达,并随浓度升高,抑制作用逐渐增强。此外,罗哌卡因还能抑制裸鼠结肠癌皮下瘤的生长,提高了裸鼠的存活率。进一步证明罗哌卡因能通过抑制结肠癌细胞增殖和结肠癌皮下瘤生长减缓结肠癌的发展。
细胞凋亡是指由基因调控的细胞自主性的程序性死亡,其在维持内环境稳定中发挥了重要的作用。研究表明,细胞凋亡抑制是癌症的一个重要特征[19]。在癌症发展过程中,细胞凋亡的抑制能促进癌细胞的增殖和肿瘤的生长[20]。研究表明,局麻药物罗哌卡因可通过促进细胞凋亡抑制血清诱导的HT29、CaCO2结肠癌细胞增殖[21]。在无血清培养条件下,罗哌卡因也可促进结肠癌细胞凋亡,抑制癌细胞生长[22]。本文研究结果表明,罗哌卡因可诱导结肠癌细胞SW480凋亡,能明显促进凋亡标记蛋白Cleaved caspase-3和Cleaved caspase-9的表达,同时还可显著促进结肠癌Xneograft模型小鼠肿瘤组织凋亡小体的形成,进一步表明罗哌卡因可促进结肠癌细胞凋亡,从而抑制结肠癌细胞增殖。
研究表明,细胞周期的调控与癌细胞的增殖和凋亡密切相关[23]。细胞周期分为四个阶段,包括G1期、S期、G2期和M期。G1期是细胞对增殖正调控或负调控做出应答的阶段,DNA复制主要发生在S期,G2期DNA复制终止并开始合成大量的RNA和蛋白质,为M期细胞的分裂做准备[24]。本文研究发现,罗哌卡因可显著减少处于G0/G1的结肠癌细胞,处于G2/M期的细胞明显增多,S期细胞数无明显变化,表明罗哌卡因可能通过诱导结肠癌细胞发生G2期阻滞而抑制癌细胞的增殖,诱导癌细胞凋亡。细胞周期是由多种细胞因子共同调控的结果。其中Cyclin A是细胞周期起始阶段最重要的蛋白之一,其在整个G1期和S期都大量表达,主要参与DNA的复制,因此在多种癌症中均呈现高表达状态[25,26]。p53是一类抑癌基因,能诱导癌细胞凋亡和细胞周期阻滞,在调控DNA修复和维持染色体完整性的过程中也发挥了重要的作用[27,28]。我们的研究表明,罗哌卡因可促进SW480细胞p53的表达,同时抑制细胞周期蛋白Cyclin A 的表达,提示罗哌卡因诱导结肠癌细胞发生细胞周期阻滞与调控细胞周期相关蛋白p53和Cyclin A的表达有关。
综上所述,罗哌卡因可抑制结肠癌细胞增殖,诱导癌细胞凋亡,并且可能与其诱导SW480细胞发生细胞周期阻滞有关。同时,罗哌卡因还能通过抑制肿瘤生长及促进肿瘤组织细胞凋亡而提高结肠癌裸鼠的生存率。本研究阐明了罗哌卡因对结肠癌的作用,可能为罗哌卡因应用于结肠癌手术麻醉,降低结肠癌的复发率提供了新的理论依据,但其作用机制还有待进一步探讨。
参考文献:
[1] Denis MG,Lipart C,Leborgne J,etal.Detection of disseminated tumor cells in peripheral blood of colorectal cancer patients[J].Interna J Cancer,1997,74:540-544.
[2] Goldfarb Y,Ben-Eliyahu S.Surgery as a risk factor for breast cancer recurrence and metastasis:mediating mechanisms and clinical prophylactic approaches[J].Breast Disease,2006,26:99-114.
[3] Gottschalk A,Sharma S,Ford J,etal.Review article:the role of the perioperative period in recurrence after cancer surgery[J].Anesthesia Analgesia,2010,110:1636-1643.
[4] Cata J,Hernandez M,Lewis V,etal.Can regional anesthesia and analgesia prolong cancer survival after orthopaedic oncologic surgery?[J].Clin Orthop Relat Res,2014,472:1434-1441.
[5] Exadaktylos AK,Buggy DJ,Moriarty DC,etal.Can anesthetic technique for primary breast cancer surgery affect recurrence or metastasis?[J].Anesthesiology,2006,105:660-664.
[6] Kim MY,Oskarsson T,Acharyya S,etal.Tumor self-seeding by circulating cancer cells[J].Cell,2009,139:1315-1326.
[7] Biki B,Mascha E,Moriarty DC,etal.Anesthetic technique for radical prostatectomy surgery affects cancer recurrence:a retrospective analysis[J].Anesthesiology,2008,109:180-187.
[8] Vogelaar FJ,Lips DJ,van Dorsten FR,etal.Impact of anaesthetic technique on survival in colon cancer:a review of the literature[J].Gastroenterology Report,2016,4:30-34.
[9] Baptista-Hon DT,Robertson FM,Robertson GB,etal.Potent inhibition by ropivacaine of metastatic colon cancer SW620 cell invasion and NaV1.5 channel function[J].Bri J Anaest,2014,113(Suppl 1):i39-i48.
[10] Silver D,Sinyuk M,Vogelbaum M,etal.The intersection of cancer,cancer stem cells,and the immune system:therapeutic opportunities[J].Neuro-oncology,2016,18:153-159.
[11] Maher DP,Wong W,White PF,etal.Association of increased postoperative opioid administration with non-small-cell lung cancer recurrence:a retrospective analysis[J].Br J Anaesth,2014,113(Suppl 1):i88-i94.
[12] Nguyen J,Luk K,Vang D,etal.Morphine stimulates cancer progression and mast cell activation and impairs survival in transgenic mice with breast cancer[J].Br J Anaesth,2014,113(Suppl 1):i4-i13.
[13] Chang YC,Hsu YC,Liu CL,etal.Local anesthetics induce apoptosis in human thyroid cancer cells through the mitogen-activated protein kinase pathway[J].PloS One,2014,9:e89563.
[14] Sakaguchi M,Kuroda Y,Hirose M.The antiproliferative effect of lidocaine on human tongue cancer cells with inhibition of the activity of epidermal growth factor receptor[J].Anesthesia Analgesia,2006,102:1103-1107.
[15] Le Gac G,Angenard G,Clement B,etal.Local anesthetics inhibit the growth of human hepatocellular carcinoma cells[J].Anesthesia Analgesia,2017,125:1600-1609.
[16] Werdehausen R,Fazeli S,Braun S,etal.Apoptosis induction by different local anaesthetics in a neuroblastoma cell line[J].Bri J Anaest,2009,103:711-718.
[17] Boselli E,Duflo F,Debon R,etal.The induction of apoptosis by local anesthetics:a comparison between lidocaine and ropivacaine[J].Anesthesia and Analgesia,2003,96:755-756.
[18] Bundscherer A,Malsy M,Gebhardt K,etal.Effects of ropivacaine,bupivacaine and sufentanil in colon and pancreatic cancer cells in vitro[J].Pharmaco Res,2015,95-96:126-131.
[19] Favaloro B,Allocati N,Graziano V,etal.Role of apoptosis in disease[J].Aging (Albany NY),2012,4:330-349.
[20] Hassan M,Watari H,AbuAlmaaty A,etal.Apoptosis and molecular targeting therapy in cancer[J].Bio Med Res Intern,2014,2014:150845.
[21] Martinsson T.Ropivacaine inhibits serum-induced proliferation of colon adenocarcinoma cells in vitro[J].J Pharmacol Exper Therap,1999,288:660-664.
[22] Kontargiris E,Kolettas E,Vadalouca A,etal.Ectopic expression of clusterin/apolipoprotein J or Bcl-2 decreases the sensitivity of HaCaT cells to toxic effects of ropivacaine[J].Cell Res,2004,14:415-422.
[23] Nørøxe D,Poulsen H,Lassen U.Hallmarks of glioblastoma:a systematic review[J].ESMO Open,2016,1:e000144.
[24] Chen J.The cell-cycle arrest and apoptotic functions of p53 in tumor initiation and progression[J].Cold Spring Harbor Pers Med,2016,6:a026104.
[25] Bretones G,Delgado MD,León J.Myc and cell cycle control[J].Biochim Biophys Acta,2015,1849:506-116.
[26] Dachineni R,Ai G,Kumar D,etal.Cyclin A2 and CDK2 as novel targets of aspirin and salicylic acid:a potential role in cancer prevention[J].Mol Cancer Res,2016,14:241-52.
[27] Vousden KH,Prives C.Blinded by the light:the growing complexity of p53[J].Cell,2009,137:413-431.
[28] Finlay CA,Hinds PW,Levine AJ.The p53 proto-oncogene can act as a suppressor of transformation[J].Cell,1989,57:1083-1093.