高压二氧化碳处理对鲜切哈密瓜微生物与品质的影响
侯志强,黄绪颖,王永涛*,廖小军
哈密瓜属葫芦科植物,是甜瓜的一个变种。我国哈密瓜的主要产区在新疆、甘肃敦煌和内蒙古阿拉善盟等地[1-2]。哈密瓜有“瓜中之王”的美称,其营养丰富,药用价值高,具有浓郁的香气,并含有大量人体所需的维生素、有机酸及矿物质,是深受人们喜爱的传统夏令水果[3-4]。
随着人们生活水平的提高,消费者越来越倾向选择更加天然而又方便的食品。鲜切果蔬以其新鲜、方便、营养等特点,特别受到欧美、日本等国家消费者的喜爱,近年来在我国也开始受到关注[5-6]。果蔬经切分后,由于切割所造成的机械损伤会引发一系列不利于贮藏的生理生化反应,如呼吸加快、褐变加剧等,同时由于切割造成细胞破裂、营养物质流失,易发生微生物侵染,这些变化都会加剧鲜切果蔬品质的下降,缩短货架期,大大降低鲜切果蔬的商品价值[7-8]。近年来人们努力寻找新的技术,期望可以在抑制微生物生长和有效钝化内源酶活性的同时减少加工造成的品质破坏。
高压二氧化碳(high pressure carbon dioxide,HPCD)是一种压力结合二氧化碳作用的非热杀菌技术,在处理过程中形成高压、高酸环境,从而达到杀菌钝酶的效果[9],同时由于处理温度低,能够很好地保持产品原有的品质。Sims等[10]研究发现HPCD处理(7.5 MPa/5.2 min)可以使Escherichia coli菌落总数下降8.7(lg(CFU/g)),肖维[11]研究发现HPCD处理(10~30 MPa/15~60 min)可以有效抑制胡萝卜汁的酶促褐变。桂芬琦[12]研究发现HPCD处理可以有效抑制苹果浊汁的褐变。另外,HPCD技术具有的无毒无害、廉价易得、节能环保等优点,使其具有极大的发展潜力。目前HPCD在食品应用中的研究对象主要集中于果蔬汁,对鲜切果蔬的研究较少。
本实验以新鲜哈密瓜为研究对象,将HPCD技术应用到鲜切哈密瓜加工中,优化清洗和杀菌工艺后,研究HPCD对鲜切哈密瓜在4 ℃贮藏期间微生物和品质的影响,为开发鲜切哈密瓜产品和推动HPCD技术在鲜切蔬菜加工中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
哈密瓜品种为‘长香玉’,购于中国农业大学家属区院内。
平板计数培养基、孟加拉红培养基 北京奥博星生物技术有限责任公司;氯化钠、二氧化氯、愈创木酚、过氧化氢、磷酸二氢钠、磷酸氢二钠(均为分析纯)北京化学试剂公司。
1.2 仪器与设备
高压二氧化碳设备 海安石油科研仪器有限公司;PB-10标准型pH计 德国Sartorius公司;WAY-2S数字式阿贝折射仪 上海精密科学仪器有限公司;T6紫外分光光度计 北京普析通用有限公司;质构仪 英国Stable Micro Systems公司;CR21GIII型离心机 日本Hitachi公司。
1.3 方法
1.3.1 预处理
1.3.1.1 鲜切哈密瓜预处理
选取无病虫、无机械损伤、成熟度一致、大小均一的新鲜哈密瓜,自来水清洗5 min后,去皮,切成2 cm×2 cm×2 cm块状,作为实验材料。
1.3.1.2 清洗处理
清洗方式分别为超声波、ClO2(10、25、50 mg/L和100 mg/L)、强酸电解水(有效氯浓度(available chlorine concentration,ACC)为(27.10±4.03)mg/L、pH值为3.46±0.06、氧化还原电位(oxidation reduction potential,ORP)为(803.0±1.8)mV)和弱酸电解水(ACC为(19.41±3.66)mg/L、pH值为(5.78±0.66)、ORP为(667.05±38.30)mV)清洗。ClO2清洗和电解水清洗:将样品直接放入溶液中浸泡;超声清洗:将样品放入装有去离子水的烧杯中。将烧杯置于超声波清洗机中,清洗时间分别为5、15、25 min。对照处理为使用自来水清洗5、15、25 min。
1.3.2 HPCD杀菌处理
预先使用酒精将处理釜消毒,鲜切哈密瓜清洗后用已灭菌纱布擦干哈密瓜表面水,置于处理釜内,并盖上处理釜盖。经过0~1 min的升压过程,压力达到预设参数后开始计时,到达预定时间后,进行卸压,卸压完成后取出样品,装入聚乙烯袋(10 cm×15 cm,厚度0.08 mm,6 块样品/袋)后使用热封机密封。所有样品置于4 ℃冷库中避光贮藏。在贮藏期间第0、2、4、6、8天测定微生物及品质指标。
处理参数:1)处理压力:2.5、3.5、4.5 MPa;2)保压时间:8 min;3)处理温度:室温(20±2)℃;4)卸压速率:0.5 MPa/min。未处理组样品不进行任何处理。
1.3.3 指标测定
1.3.3.1 微生物菌落数测定
选取菌落总数、霉菌和酵母菌作为微生物检测指标,根据GB 4789.2—2010《食品安全国家标准 食品微生物学检验 菌落总数测定》[13]及GB 4789.15—2010《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》[14]的相关操作进行菌落总数及霉菌和酵母菌的计数。
平板计数培养基的制备:准确称取23.5 g平板计数培养基,加入1 L蒸馏水,加热煮沸至完全溶解,分装到500 mL三角瓶中,121 ℃高压灭菌20 min,冷却后放置于4 ℃备用。
孟加拉红培养基的制备:准确称取36.6 g平板计数培养基,加入1 L蒸馏水,加热至完全溶解,分装到500 mL三角瓶中,121 ℃高压灭菌20 min,冷却后放置于4 ℃备用。
菌落总数、霉菌和酵母菌总数的测定均采用平板计数法。称取(5.00±0.05)g样品于含有45 mL无菌生理盐水和玻璃球的锥形瓶中,摇匀后浸泡1 h作为稀释了10 倍的样品匀液,在每个平板中倒入1 mL的样品悬浮液和20 mL左右对应培养基,分别放置合适温度下培养、计数。其中菌落总数测定于37 ℃下培养48 h,霉菌和酵母总数测定于28 ℃下培养72 h以上。
1.3.3.2 pH值和可溶性固形物含量的测定
哈密瓜样品置于研钵中研磨,用4 层纱布过滤取其滤液作为待测液。用pH计和数字式阿贝折射仪分别测定pH值和可溶性固形物含量。
1.3.3.3 质构测定
采用质构仪测定样品质构。测定模式采用质构剖面分析法(texture profile analysis,TPA)。测定参数:样品尺寸1cm×1cm×1 cm,最大量程250 N,采用P/38(直径38 mm)圆柱平板探头,测试速率30 mm/min,压缩比例30%,起始力0.5 N,每组测6个样品,由测试获得质地特征曲线,经Texture Lab Pro软件分析得到硬度值。
1.3.3.4 质量损失率的测定
用电子天平称取未处理样品的质量,计为贮藏期第0天样品质量(m0),贮藏期间取出样品,沥干表面水分后称其质量,计为贮藏期样品质量(m),按照式(1)计算质量损失率。

1.3.3.5 VC含量测定
参照GB 6195—1986《水果、蔬菜维生素C含量测定法(2,6-二氯靛酚滴定法)》[15]测定哈密瓜中VC含量。
1.3.3.6 多酚氧化酶和过氧化物酶活力的测定
多酚氧化酶(polyphenoloxidase,PPO)活力的测定参照Keenan等[16]的方法并稍作修改。称取30 g样品,加入预冷的pH 6.8、0.05 mol/L的磷酸盐缓冲溶液100 mL,研磨成匀浆,于4 ℃、10 000 r/min条件下冷冻离心30 min,收集上清液作为酶提取液,低温保存备用。吸取pH 6.8磷酸盐缓冲液1 mL,加入l mL 0.1 mol/L邻二苯酚,先于40 ℃保温10 min,再加入0.2 mL酶提取液,以缓冲溶液为参比于420 nm波长处测定吸光度。以每分钟吸光度变化0.001定义为一个酶活力单位(U)。以未经HPCD处理的样品所测PPO活力规定为100%,经HPCD处理后所测酶活力为残余活力。
过氧化物酶(peroxidase,POD)活力的测定参照Igual等[17]的方法并稍作修改。POD反应底物的配制:于200 mL磷酸盐缓冲液中加入愈创木酚112 μL,加热搅拌直至完全溶解,待溶液冷却后,加入30%过氧化氢56 μL,混合均匀。取2.9 mL反应底物加入0.1 mL粗酶液摇匀后迅速倒入比色皿中,于470 nm波长处测定吸光度。以每分钟吸光度变化0.001定义为一个酶活力单位。以未经HPCD处理的样品所测POD活力定义为100%,经HPCD处理后所测酶活力为残余活力。
1.3.3.7 感官评价
感官评价小组由20 名成员组成(10 名男性,10 名女性),所有感官评价员均至少经过1 次感官评价培训。感官评价小组按照鲜切哈密瓜感官评分标准(表1),采用9 分制打分法对样品的风味、质地、外观以及综合情况进行评分,分数高代表对该属性的嗜好程度强。鲜切哈密瓜分装到塑料盘中并随机编号呈送给感官评价员,同时每个评价员提供一杯饮用水以清除品尝不同样品间的干扰。

表1 鲜切哈密瓜感官评价评分标准Table 1 Criteria for sensory evaluation of fresh-cut Hami melon
1.4 数据统计分析
所有实验均重复3 次。不同处理方法间的数据使用SPSS 22软件的邓肯法进行显著性差异分析,显著性水平为0.05。使用OriginPro 8.5软件进行绘图。
2 结果与分析
2.1 不同清洗方式对鲜切哈密瓜菌落总数、霉菌和酵母总数和感官品质的影响
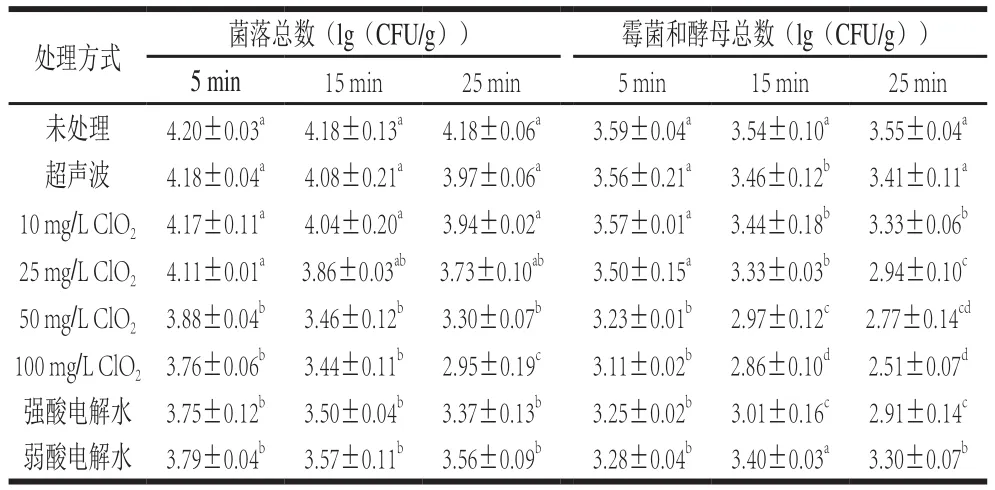
表2 不同清洗方式对鲜切哈密瓜菌落总数和霉菌酵母总数的影响Table 2 Effects of cleaning treatments on total aerobic bacteria and total yeast and mold counts of fresh-cut Hami melon
由表2可知,经过不同方式预清洗后,鲜切哈密瓜的菌落总数下降了0.02~1.23(lg(CFU/g))。对于超声波处理,杀菌效果随时间延长而增加,但与未处理相比无显著效果。
对于ClO2处理,杀菌效果随着ClO2质量浓度提高和杀菌时间延长而增加,其中经过100 mg/L ClO2处理25 min后,鲜切哈密瓜的菌落总数、霉菌和酵母总数分别下降1.23(lg(CFU/g))和1.04(lg(CFU/g)),杀菌效果最好。ClO2被广泛用于食品的杀菌中,徐斐燕[18]使用100 mg/L ClO2处理鲜切西兰花15 min,可以使其菌落总数下降2.97(lg(CFU/g))。ClO2对鲜切哈密瓜的杀菌效果随着其质量浓度升高而显著提高(P<0.05),但并没有随着处理时间的延长而显著提高。
对于电解水清洗处理,相同处理时间,强酸电解水杀菌效果要好于弱酸电解水,处理时间25 min时,与未处理组相比,经强酸电解水和弱酸电解水处理后的哈密瓜菌落总数分别下降0.81(lg(CFU/g))和0.62(lg(CFU/g)),这可能是由强酸电解水较低的pH值和较高的ORP环境所致。武龙等[19]使用强酸电解水(pH 2.8、ORP 1145 mV、ACC 162 mg/kg)处理葡萄后,其菌落总数比弱酸电解水组(pH 6.7、ORP 860 mV、ACC 53 mg/kg)多下降了0.91(lg(CFU/g))。

表3 不同清洗方式对鲜切哈密瓜感官评价得分的影响Table 3 Effects of cleaning treatments on sensory evaluation of fresh-cut Hami melon分
4 种清洗方式中超声波清洗的效果最差,ClO2清洗的效果最好,但100 mg/L ClO2处理25 min后的感官分析结果(表3)显示鲜切哈密瓜产生了严重的异味。因此选择强酸电解水处理25 min作为最佳清洗方式进行后续研究,其清洗后菌落总数下降了0.81(lg(CFU/g))。
2.2 不同HPCD处理对鲜切哈密瓜微生物的影响


图1 HPCD处理对鲜切哈密瓜菌落总数(a)及霉菌和酵母总数(b)的影响Fig. 1 Effects of HPCD treatments on total aerobic bacteria (a) and total yeast and mold counts (b) of fresh-cut Hami melon
如图1所示,未处理鲜切哈密瓜的初始菌落总数、初始霉菌和酵母菌总数分别为4.03(lg(CFU/g))和3.85(lg(CFU/g))。HPCD处理对鲜切哈密瓜有较好的杀菌效果,处理后菌落总数、霉菌和酵母菌总数分别下降0.17~0.53(lg(CFU/g))和0.02~0.17(lg(CFU/g))。
在处理时间相同时,在实验范围内压力越高,HPCD对鲜切哈密瓜微生物的杀菌效果越好。2.5、3.5 MPa和4.5 MPa处理0 min后菌落总数分别降低0.17、0.36(lg(CFU/g))和0.53(lg(CFU/g)),霉菌和酵母菌总数分别降低0.02、0.08(lg(CFU/g))和0.17(lg(CFU/g))。Spilimbergo等[20]使用HPCD处理鲜切胡萝卜时发现,处理时间相同时,12 MPa处理组的胡萝卜菌落总数比10 MPa处理组多下降了3(lg(CFU/g))。
在处理压力相同时,在实验范围内处理时间越长,HPCD对鲜切哈密瓜微生物的杀菌效果越好。处理压力4.5 MPa时,处理时间从0 min延长到8 min时,菌落总数下降的数量也由0.53(lg(CFU/g))增加到0.77(lg(CFU/g))。BI Xiufang等[21]使用HPCD处理鲜切胡萝卜时发现5 MPa压力下处理5 min时,胡萝卜菌落总数下降0.5(lg(CFU/g)),而处理时间为20 min时,菌落总数下降了2(lg(CFU/g))。
HPCD处理后杀菌效果随时间延长和压力增加而增加的主要原因是,CO2压强增大和时间延长会引起更强的“麻醉效应”和“爆破作用”,从而导致细胞膜破坏程度增加,CO2更易渗透进入细胞,细胞内部pH值降低幅度增加,细胞内部新陈代谢过程改变加剧[22-24],微生物死亡数量增加。根据上述结果,选取2.5、3.5 MPa和4.5 MPa处理8 min作为后续贮藏期实验条件进行研究。
2.3 不同HPCD处理对贮藏期鲜切哈密瓜微生物及品质的影响
2.3.1 不同HPCD处理对贮藏期鲜切哈密瓜微生物的影响
贮藏期间不同HPCD处理组(均处理8 min)鲜切哈密瓜菌落总数和霉菌酵母的变化如图2所示。菌落总数、霉菌和酵母菌总数均随贮藏时间的延长而显著增加(P<0.05)。贮藏至第6天时,2.5 MPa处理组的菌落总数达到5.07(lg(CFU/g)),超过未处理组的5.00(lg(CFU/g))。贮藏至第8天时,3.5 MPa处理组的菌落总数达到5.90(lg(CFU/g)),也超过了未处理组。4.5 MPa处理组的菌落总数在贮藏期间一直低于未处理组。由此可以看出,较低压力较短时间的HPCD处理在较短时间(2d)内能够有效抑制菌落总数的增长,但由于HPCD处理并不能完全杀灭微生物,残余的微生物会在贮藏期间逐渐繁殖,同时由于HPCD处理破坏了哈密瓜的质构,汁液流出加剧,也为微生物的后期快速繁殖创造了有利条件。Spilimbergo等[20]使用HPCD处理(12 MPa/15 min)鲜切胡萝卜时也发现,HPCD处理对胡萝卜质构造成了破坏,胡萝卜贮藏1周后菌落总数从2(lg(CFU/g))增加到4(lg(CFU/g))。所有处理组样品的霉菌和酵母菌总数在贮藏期间均呈上升趋势,贮藏结束时所有处理组的霉菌和酵母菌数量都低于未处理组。

图2 不同压力处理8 min后的鲜切哈密瓜在贮藏期间菌落总数(a)、霉菌和酵母总数(b)的变化Fig. 2 Changes in total aerobic bacteria (a) and total yeast and mold counts (b) of fresh-cut Hami melon HPCD-treated at different pressure for 8 min during storage
从上述结果可以看出,HPCD处理能够有效降低鲜切哈密瓜中微生物的数量,并能在贮藏期抑制微生物数量的增长,一定程度上延长产品的货架期。但较为温和的HPCD处理只能在较短时间内(6 d)发挥抑制作用,如果想要有效抑制微生物数量在贮藏期内的增长,建议选择较高压力的HPCD处理条件。
2.3.2 不同HPCD条件对贮藏期鲜切哈密瓜pH值和可溶性固形物含量的影响
如图3所示,HPCD处理后哈密瓜的pH值降低。保压时间为8 min时,2.5、3.5 MPa和4.5 MPa处理组的pH值分别从未处理组的6.19下降到6.13、6.02和6.11。Spilimbergo等[20]也研究发现HPCD处理(12 MPa/15 min)使鲜切胡萝卜的pH值下降0.5。这可能是由于二氧化碳溶于水形成的碳酸根离子解离成氢离子导致的。贮藏期间HPCD处理组的pH值逐渐下降,贮藏第8天时2.5、3.5 MPa和4.5 MPa处理组分别下降0.89、0.62和0.64,这很可能是贮藏期间微生物生长过程中产酸所致。

图3 不同压力处理8 min贮藏期间鲜切哈密瓜pH值(a)和可溶性固形物含量(b)的变化Fig. 3 Changes in pH (a) and TSS (b) of fresh-cut Hami melon HPCD-treated at different pressure for 8 min during storage
HPCD处理后哈密瓜的可溶性固形物含量下降,2.5、3.5 MPa和4.5 MPa处理组分别从未处理组的8.4 °Brix下降到6.7、7.0 °Brix和7.2 °Brix,这可能是由于HPCD处理破坏了哈密瓜质构,使得汁液流出造成的。但Valverde等[25]使用HPCD(10 MPa/10 min)处理鲜切梨时,其可溶性固形物含量却没有显著变化。贮藏期间可溶性固形物含量持续下降,贮藏至第8天时2.5、3.5 MPa和4.5 MPa处理组分别下降6.1、6.2 °Brix和6.1 °Brix。
2.3.3 不同HPCD条件对贮藏期鲜切哈密瓜质量损失率和硬度的影响
如图4a所示,鲜切哈密瓜经HPCD处理后,质量损失率迅速上升,原因可能是HPCD处理对质构造成破坏,导致汁液流失。样品质量损失率随贮藏期延长而增加,经过4 ℃贮藏8 d后,未处理组的质量损失率仅为2%,而2.5、3.5、4.5 MPa处理组的质量损失率分别达到了16.45%、28.75%、42.70%。
如图4b所示,2.5、3.5、4.5 MPa处理8 min后,鲜切哈密瓜的硬度分别下降28.06%、41.92%和50.13%。Bi Xiufang等[21]使用HPCD处理(5 MPa/15 min)鲜切胡萝卜后,硬度下降7.9%,本研究中硬度下降较多的原因可能是哈密瓜原料的硬度较小。贮藏期结束时,2.5、3.5、4.5 MPa处理组硬度分别下降30.38%、48.17%和48.97%,硬度持续下降的原因可能是贮藏期间微生物的生长和质构的破坏。Spilimbergo等[20]使用HPCD(12 MPa/15 min)处理鲜切胡萝卜,其贮藏两周后硬度也下降了95%。
2.3.4 不同HPCD条件对贮藏期鲜切哈密瓜VC含量的影响

图5 不同压力处理8 min后的鲜切哈密瓜贮藏期间VC含量的变化Fig. 5 Change in ascorbic acid content of fresh-cut Hami melonHPCD-treated at different pressure for 8 min during storage
由图5可以看出,HPCD处理后鲜切哈密瓜VC含量下降,2.5、3.5 MPa和4.5 MPa处理组VC含量分别下降22.52%、47.56%和61.50%,下降的原因可能是HPCD处理压力加大了鲜切哈密瓜质构的破坏程度,使得汁液流出增加,带走更多的VC。贮藏期间VC含量持续下降,与第0天相比,贮藏至第8天时未处理组和2.5、3.5、4.5 MPa处理组分别下降95.90%、96.34%、96.25%和96.73%;原因可能是随着贮藏时间的延长,质构的破坏继续加剧造成VC的持续流失和降解。另外,HPCD处理组VC含量出现下降,但下降幅度(速率)却低于未处理组,Chen Jiluan等[26]使用HPCD(8~35 MPa/5~60 min)处理哈密瓜汁时也发现了这一现象,分析原因可能是HPCD处理降低了样品中的pH值,使VC有更好的稳定性。
2.3.5 不同HPCD条件对贮藏期鲜切哈密瓜PPO和POD活力的影响

图6 不同压力处理8 min后的鲜切哈密瓜贮藏期间PPO(a)和POD(b)活力的变化Fig. 6 Changes in residual activity of polyphenol oxidase (a) and peroxidase (b) in fresh-cut Hami melon HPCD-treated at different pressure for 8 min during storage
从图6a可以看出,HPCD处理后鲜切哈密瓜PPO活力下降,2.5、3.5 MPa和4.5 MPa处理组分别下降40%、53%和67%,表明HPCD对PPO有一定的钝化作用。刘野等[27]研究发现HPCD处理(10 MPa/60min)可以使PPO残存活力下降60%。贮藏期间PPO活力持续上升,这种现象可能是由于切割后,植物产生应激反应,乙烯释放增加[28-30]。
从图6b可以看出,经HPCD处理后鲜切哈密瓜的POD活力下降,2.5、3.5 MPa和4.5 MPa处理组分别下降11%、40%和45%,表明HPCD对POD有一定的钝化作用。Gui Fenqi等[31]研究也发现,HPCD对POD有钝化作用,而且压力越大,钝化效果越好,当处理条件为30 MPa/0 min时,POD残留活力仅为12%。随着贮藏期的延长,POD活力总体呈降低趋势,POD活力的降低表明植物组织抗逆性减弱,可能由于HPCD处理导致鲜切哈密瓜组织结构破坏,加速其衰老。
PPO和POD活力下降有利于产品在贮藏期间保持较好的颜色,因此,HPCD处理对产品颜色保持具有积极的作用。
2.3.6 不同HPCD条件对贮藏期鲜切哈密瓜感官品质的影响
由表4可知,未处理组组织结构完好,没有汁液流出,4 项得分均高于处理组。4.5 MPa处理组由于HPCD处理压力较大,组织细胞结构被破坏,汁液流出,质地变软最严重,感官接受度也最低。2.5、3.5 MPa处理组虽然处理条件压力较低,但质构仍被压力破坏,导致感官接受度下降,但综合评分高于4.5 MPa处理组。

表4 不同压力处理8 min后的鲜切哈密瓜在贮藏期第8天感官评价得分Table 4 Sensory evaluation of fresh-cut Hami melon HPCD-treated at different pressure for 8 min after 8 days of storage分
3 结 论
通过不同清洗方式的对比,最终选取强酸电解水处理25 min为鲜切哈密瓜的最佳清洗条件。杀菌条件筛选中发现,随着HPCD处理压力的增加和处理时间的延长,杀菌效果增加,确定2.5、3.5 MPa和4.5 MPa处理8 min为杀菌工艺。贮藏期间,样品微生物数量显著上升,但HPCD处理能够有效抑制微生物数量的增长,一定程度上延长产品的货架期。由于经过HPCD处理后,鲜切哈密瓜的质构一定程度遭到破坏,导致汁液流失,贮藏期间可溶性固形物含量下降,质量损失率显著升高,硬度下降,VC含量降低,感官接受度显著低于未处理组。但HPCD处理后哈密瓜的PPO、POD活力下降,说明HPCD对钝化哈密瓜中内源酶有一定的作用,这有利于产品在贮藏期间保持较好的色泽。
综合以上结果,HPCD处理能够抑制微生物生长,钝化内源酶,有效延长鲜切哈密瓜的货架期;但由于HPCD处理对鲜切哈密瓜组织结构有一定的破坏,使得产品在贮藏期中的感官品质下降明显。因此,在未来的研究中,应该对原料品种进行筛选(选取硬度较大的品种),并优化HPCD处理条件(降低处理的卸压速率、处理压力和时间),进一步探索其在鲜切果蔬产品中的应用。
参考文献:
[1] 何玺. 新疆哈密瓜标准化生产基地模式研究[D]. 乌鲁木齐: 新疆农业大学, 2012: 17-22.
[2] 相炎红, 王垚, 杨明俊, 等. 哈密瓜乳饮料的工艺研究[J]. 中国乳品工业, 2011, 39(1): 56-58.
[3] 杜娟. 新疆哈密瓜贮藏质量安全影响因素与对策研究[D]. 乌鲁木齐: 新疆农业大学, 2014: 14-20.
[4] 陈新艳. 1-MCP抑制哈密瓜果实采后软化机理的研究[D]. 乌鲁木齐:新疆农业大学, 2015: 10-11.
[5] OLIVEIRA M, ABADIAS M, USALL J, et al. Application of modified atmosphere packaging as a safety approach to fresh-cut fruits and vegetables: a review[J]. Trends in Food Science & Technology, 2015,46(1): 13-26. DOI:10.1016/j.tifs.2015.07.017.
[6] 罗婵, 陈安均, 崔慧玲, 等. 鲜切果蔬清洗杀菌剂的研究现状[J]. 食品与发酵科技, 2013, 49(3): 84-88.
[7] 罗海波, 何雄, 包永华, 等. 鲜切果蔬品质劣变影响因素及其可能机理[J]. 食品科学, 2012, 33(15): 324-330.
[8] SIROLI L, PATRIGNANI F, SERRAZANETTI D I, et al. Innovative strategies based on the use of bio-control agents to improve the safety,shelf-life and quality of minimally processed fruits and vegetables[J].Trends in Food Science & Technology, 2015, 46(2): 302-310.DOI:10.1016/j.tifs.2015.04.014.
[9] 侯志强, 赵凤, 饶雷, 等. 高压二氧化碳技术的杀菌研究进展[J]. 中国农业科技导报, 2015, 17(5): 40-48. DOI:10.13304/j.nykjdb.2015.534.
[10] SIMS M, ESTIGARRIBIA E. Continuous sterilization of aqueous pumpable food using high pressure carbon dioxide[C]//Proceedings of the 4thInternational Symposium on High Pressure Process Technology and Chemical Engineering. Venice: Italian Association of Chemical Engineering, 2002: 921-927.
[11] 肖维. 高压二氧化碳钝化胡萝卜果胶甲基酯酶与对胡萝卜汁品质影响[D]. 北京: 中国农业大学, 2008: 35-36.
[12] 桂芬琦. 高密度二氧化碳技术对酶活性和苹果浊汁颜色影响分析[D].北京: 中国农业大学, 2006: 41-56.
[13] 卫生部. 食品安全国家标准 食品微生物学检验 菌落总数测定: GB 4789.2—2010[S]. 北京: 中国标准出版社, 2010: 1-4.
[14] 卫生部. 食品安全国家标准 食品微生物学检验 霉菌和酵母计数:GB 4789.15—2010[S]. 北京: 中国标准出版社, 2010: 1-4.
[15] 国家标准局. 水果、蔬菜维生素C含量测定法(2,6-二氯靛酚滴定法): GB 6195—1986[S]. 北京: 中国标准出版社, 1986: 1-4.
[16] KEENAN D F, RÖβLE C, GORMLEY R, et al. Effect of high hydrostatic pressure and thermal processing on the nutritional quality and enzyme activity of fruit smoothies[J]. LWT-Food Science and Technology, 2012,45(1): 50-57. DOI:10.1016/j.lwt.2011.07.006.
[17] IGUAL M, SAMPEDRO F, MARTÍNEZ-NAVARRETE N, et al.Combined osmodehydration and high pressure processing on the enzyme stability and antioxidant capacity of a grapefruit jam[J]. Journal of Food Engineering, 2013, 114(4): 514-521. DOI:10.1016/j.jfoodeng.2012.09.006.
[18] 徐斐燕. 鲜切西兰花的保鲜技术研究[D]. 杭州: 浙江大学, 2006:45-53.
[19] 武龙, 肖卫华, 李里特, 等. 酸性电解水用于葡萄杀菌保鲜的试验研究[J]. 食品科技, 2004, 29(9): 81-83.
[20] SPILIMBERGO S, KOMES D, VOJVODIC A, et al. High pressure carbon dioxide pasteurization of fresh-cut carrot[J]. The Journal of Supercritical Fluids, 2013, 79: 92-100. DOI:10.1016/j.supflu.2012.12.002.
[21] BI Xiufang, WU Jihong, ZHANG Yan, et al. High pressure carbon dioxide treatment for fresh-cut carrot slices[J]. Innovative Food Science and Emerging Technologies, 2011, 12(3): 298-304. DOI:10.1016/j.ifset.2011.04.001.
[22] DAMAR S, BALABAN M O. Review of dense phase CO2technology:microbial and enzyme inactivation, and effects on food quality[J]. Journal of Food Science, 2006, 71(1): 1-11. DOI:10.1111/j.1365-2621.2006.tb12397.x.
[23] GARCIA-GONZALEZ L, GEERAERD A H, SPILIMBERGO S, et al.High pressure carbon dioxide inactivation of microorganisms in foods:the past, the present and the future[J]. International Journal of Food Microbiolgy, 2007, 117: 1-28. DOI:10.1016/j.ijfoodmicro.2007.02.018.
[24] 廖红梅, 廖小军, 胡小松. 高压二氧化碳杀菌机理研究进展[J]. 食品工业科技, 2012, 33(19): 387-390. DOI:10.13386/j.issn1002-0306.2012.19.074.
[25] VALVERDE M T, MARÍN-INIESTA F, CALVO L. Inactivation of Saccharomyces cerevisiae in conference pear with high pressure carbon dioxide and effects on pear quality[J]. Journal of Food Engineering, 2010,98(4): 421-428. DOI:10.1016/j.jfoodeng.2010.01.022.
[26] CHEN Jiluan, ZHENG Xiaoji, DONG Juan, et al. Effect of dense phase carbon dioxide on inactivation of polyphenol oxidase and peroxidase in Hami melon juice[J]. Advanced Materials Research, 2013,634/635/636/637/638: 1441-1448. DOI:10.4028/www.scientific.net/AMR.634-638.1441.
[27] 刘野, 张超, 赵晓燕, 等. 高压二氧化碳和超高压对多酚氧化酶和果胶甲酯酶结构的影响[J]. 食品科学, 2011, 32(11): 83-87.
[28] CARVALHO R L, CABRAL M F, GERMANO T A, et al. Chitosan coating with trans-cinnamaldehyde improves structural integrity and antioxidant metabolism of fresh-cut melon[J]. Postharvest Biology and Technology, 2016, 113: 29-39. DOI:10.1016/j.postharvbio.2015.11.004.
[29] PLAZA L, ALTISENT R, ALEGRE I, et al. Changes in the quality and antioxidant properties of fresh-cut melon treated with the biopreservative culture Pseudomonas graminis CPA-7 during refrigerated storage[J].Postharvest Biology and Technology, 2016, 111: 25-30. DOI:10.1016/j.postharvbio.2015.07.023.
[30] REMORINI D, LANDI M, TARDELLI F, et al. Effect of chlorine dioxide and ascorbic acid on enzymatic browning and shelf life of fresh-cut red delicious and granny smith apples[J]. Journal of Food Processing and Preservation, 2015, 39(6): 2925-2934. DOI:10.1111/jfpp.12544.
[31] GUI Fenqi, CHEN Fang, WU Jihong, et al. Inactivation and structural change of horseradish peroxidase treated with supercritical carbon dioxide[J]. Food Chemistry, 2006, 97(3): 480-489. DOI:10.1016/j.foodchem.2005.05.028.

