NO介导的Ca2+信号对渗透胁迫下紫花苜蓿幼苗光合特征及抗性的影响
赵颖,弋钦,魏小红,辛夏青,韩厅,岳凯,王方琳
(甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
紫花苜蓿(Medicagosativa)是一种多年生优质豆科草本植物,在草地畜牧业生产中的地位无可替代,在实际生产中干旱已成为苜蓿高产的主要限制性因素之一。干旱引起的渗透胁迫直接导致光合作用的原料水的缺乏,植物通过关闭气孔减少蒸腾作用,阻碍CO2进入叶片,严重时甚至使光合机构受损,光合面积扩展受抑,光合色素的合成受阻而分解加强[1-2]。此外,干旱环境还会损伤植物细胞、组织及器官,如氧化损伤使植物新陈代谢发生紊乱[3]。
一氧化氮(nitric oxide, NO)是植物体内一种重要的生物活性分子,主要由一氧化氮合酶(nitric oxide synthase, NOS)和硝酸还原酶(nitrate reductase, NR)催化合成[4],参与植物的呼吸作用、光形态发生、根和叶的发育、延缓衰老等生理过程[5-6]。Ca2+作为偶联胞外信号与胞内生理生化的信号载体,通过钙调素、钙依赖蛋白激酶和膜联蛋白增强植物生理系统功能[7-8]。研究表明,NO通过活化鸟苷酸环化酶(guanylate cyclase, GC)升高细胞内第二信使环鸟苷酸(cyclic guanosine, cGMP)水平,从而促进环式ADP-核糖与细胞内Ca2+通道结合活化Ca2+释放机制,使得细胞质内Ca2+浓度升高[9-10]。因此,在细胞内信号转导途径中,NO作为胞内和胞间信号分子,还会参与基因与蛋白的表达和植物对逆境胁迫的生理应答过程[11]。而亚甲基蓝(methylene blue, MB)是GC和NOS的强效抑制剂[12],可使cGMP含量降低[13],从而抑制NO的调控作用。植物体NOS的活性需要Ca2+作为辅助因子[14],外施SNP 可提高胞质内Ca2+浓度来控制气孔的开闭降低蒸腾作用[15],提升抗氧化酶活性缓解氧化损伤[16]。植物应对非生物胁迫中NO与Ca2+存在复杂的调控关系,已有研究表明,干旱胁迫下,Ca2+参与NO诱导水稻(Oryzasativa)不定根的形成[17],促进苜蓿种子萌发[18]。
已知低浓度的NO能够缓解非生物胁迫下紫花苜蓿幼苗的氧化损伤,但NO与Ca2+对渗透胁迫下紫花苜蓿幼苗光合作用和抗氧化能力的影响及其与Ca2+信号之间的关系尚不清楚。为此,本试验利用SNP、CaCl2、LaCl3及MB溶液处理渗透胁迫下紫花苜蓿幼苗,通过对其叶片光合色素组成、光合作用参数、抗氧化酶活性及MDA、脯氨酸含量的测定,以探讨NO介导的Ca2+信号在提升紫花苜蓿幼苗抗旱能力中的作用,为干旱环境下紫花苜蓿的种植提供理论依据。
1 材料与方法
1.1 实验材料与处理
试验于2015年6-9月在甘肃农业大学生命科学技术学院植物生理实验室进行,供试紫花苜蓿品种‘阿尔冈金’(M.sativacv. Algonquin)购于甘肃农业科学院种子公司。
选取颗粒饱满、无病虫害的紫花苜蓿种子消毒、催芽后挑选露白一致的种子播种在装有等量营养土的花盆中(口径12 cm),在(25±1) ℃,14 h光照/10 h黑暗恒温培养,光照强度4000 lx,每隔2 d使用称重法补充水分,培养50 d后每盆保留20株生长一致且健康的苜蓿植株。分别量取40 mL蒸馏水、SNP、CaCl2、SNP+CaCl2、SNP+LaCl3、CaCl2+MB(两种处理液比例为1∶1)处理液喷施于叶面进行预处理,每24 h喷施1次,连续喷施3次。然后在土壤中浇40 mL 15% PEG-6000进行渗透胁迫处理,每天浇1次,连续处理6 d,对照加等量蒸馏水。具体试验设计为:CK:蒸馏水;PEG:15% PEG;SNP+PEG:0.1 mmol/L SNP+15% PEG;CaCl2+PEG:10 mmol/L CaCl2+15% PEG;SNP+CaCl2+PEG:0.1 mmol/L SNP+10 mmol/L CaCl2+15% PEG;SNP+LaCl3+PEG:0.1 mmol/L SNP+10 μmol/L LaCl3+15% PEG;CaCl2+MB+PEG:10 mmol/L CaCl2+5 μmol/L MB+15% PEG,每组处理重复3次。在胁迫前(0 d)和胁迫后第2,4,6天取幼苗叶片测定光合色素、光合气体交换参数、MDA、脯氨酸含量以及抗氧化酶活性并做POD同工酶电泳,测定重复3次。
1.2 测定指标与方法
1.2.1叶绿素含量的测定 参照邹琦[19]的分光光度法。
1.2.2光合气体交换参数的测定 采用CI-340 手持式光合作用测量系统在9:00-11:00(晴天)测定幼苗倒数第2~3片功能叶的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)。气孔限制值Ls=1-Ci/Ca(Ca为大气中CO2浓度)。
1.2.3生理指标测定 丙二醛(malonaldehyde,MDA)、脯氨酸含量测量参照刘文瑜等[20]方法,超氧化物歧化酶(superoxide dismutase,SOD)采用NBT显色法测定[21];过氧化物酶(peroxide,POD)采用愈创木酚氧化法测定[22];过氧化氢酶(Catalase,CAT)采用紫外吸收法测定[23]。
1.2.4POD同工酶分析 采用不连续系统聚丙烯酰胺凝胶垂直板电泳;染色采用改良的联苯胺染色法[20]。
1.3 数据分析
每组数据最少设定3个重复,采用Microsoft Excel 2010整理分析数据,采用SPSS 19.0进行方差分析比较差异显著性。
2 结果与分析
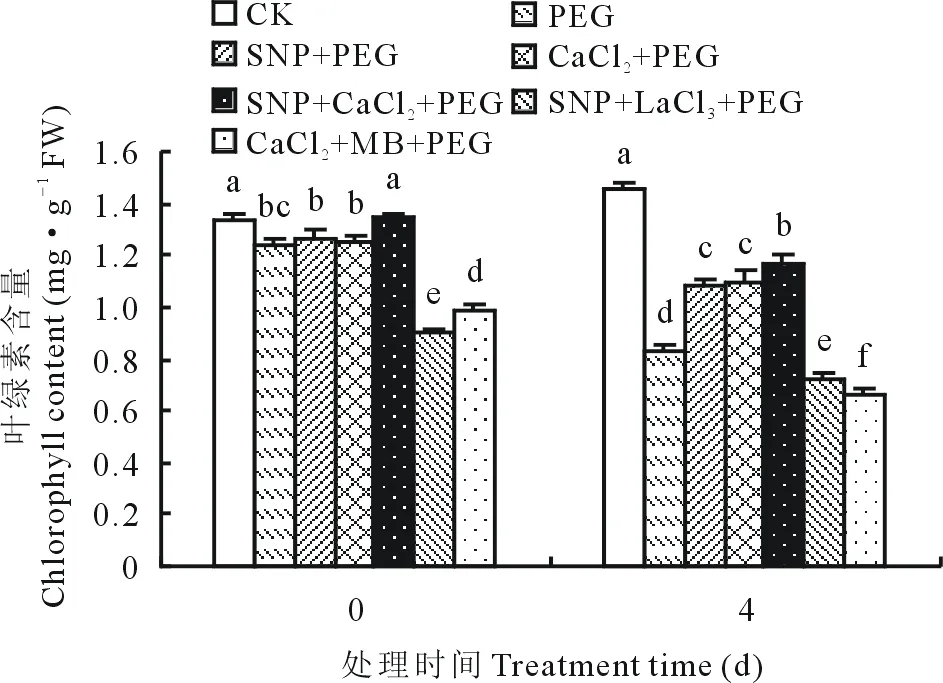
图1 外源NO与Ca2+对渗透胁迫下紫花苜蓿幼苗叶片叶绿素含量变化的影响Fig.1 Effects of exogenous nitric oxide and Ca2+ on chlorophyll content of alfalfa seedling leaves under osmotic stress
2.1 外源NO与Ca2+对渗透胁迫下紫花苜蓿幼苗光合色素的影响
光合色素参与光能的吸收、传递和转换从而影响植物光合作用。如图1所示,与胁迫前(0 d)相比,渗透胁迫第4天各处理叶绿素含量降低,CK处理叶绿素含量比胁迫前叶绿素含量增加了8.68%。第4天时,15% PEG处理下的紫花苜蓿幼苗叶绿素含量与CK相比下降了42.8%,外源施加NO供体SNP和Ca2+信号试剂CaCl2均能够有效缓解渗透胁迫引起的叶绿素含量的降低,其中,SNP+PEG、CaCl2+PEG和SNP+CaCl2+PEG处理下叶绿素含量较单一PEG处理分别提高了30.26%,31.80%和40.81%。施加抑制剂LaCl3或MB抑制了该缓解作用,SNP+LaCl3+PEG处理与SNP+PEG、PEG处理相比叶绿素含量分别降低了33.8%和13.80%, CaCl2+MB+PEG处理与CaCl2+PEG、PEG处理相比叶绿素含量分别下降了40.03%和20.97%。说明渗透胁迫下阻断Ca2+信号通道或者抑制NO信号通路的传导均会使紫花苜蓿幼苗叶片叶绿素的合成受阻。
由表1可知,渗透胁迫前,SNP、CaCl2、SNP+CaCl2处理下紫花苜蓿幼苗叶片叶绿素b(chl b)含量显著高于CK,分别比CK增加了33.18%,31.17%和54.04%,而对应相同处理下紫花苜蓿叶片叶绿素a(chl a)含量却显著低于CK,分别比CK降低了3.99%,4.38%和3.60%。渗透胁迫第4天紫花苜蓿幼苗叶片光合色素组分含量均降低,PEG处理chl a和chl b含量分别比对照组降低了43.46%和41.97%,类胡萝卜素增加了52.50%。渗透胁迫下施加SNP、CaCl2或SNP+CaCl2后chl a含量分别比PEG处理下提高了49.55%,47.92%和63.11%,chl b含量分别提高了8.40%,13.52%和15.36%。说明渗透胁迫下同时施加SNP+CaCl2比单一喷施SNP或CaCl2处理更有利于叶片叶绿素的合成。
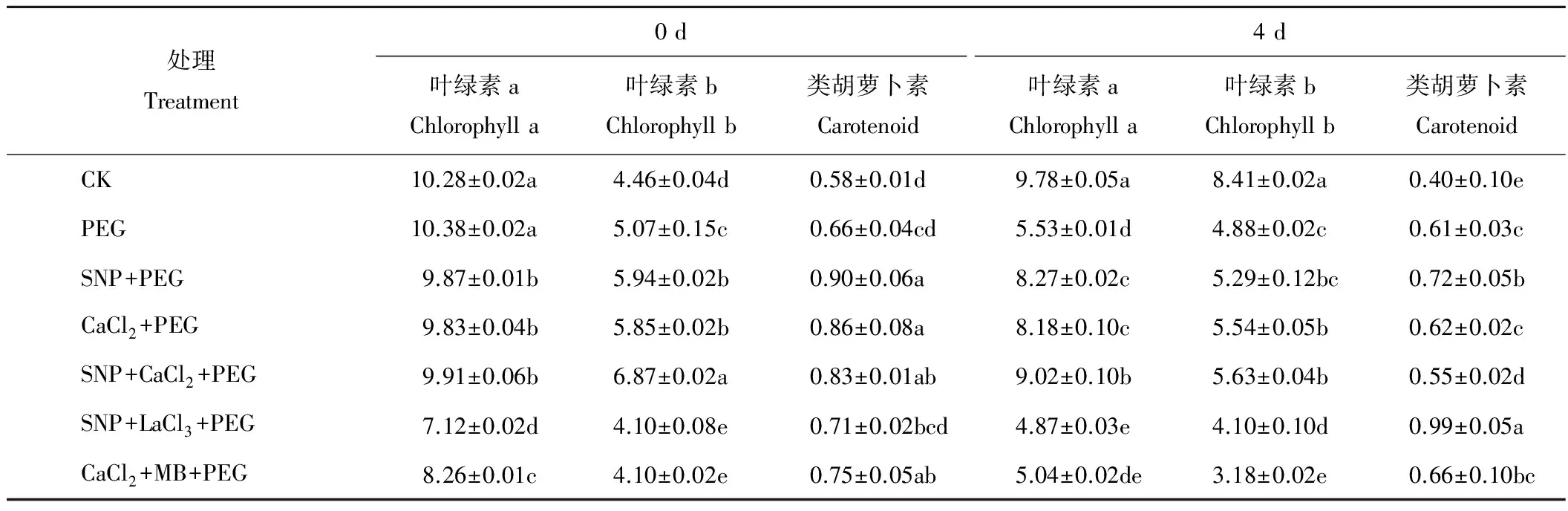
表1 外源NO及Ca2+对渗透胁迫下紫花苜蓿叶片光合色素含量影响Table 1 Effects of exogenous nitric oxide and Ca2+ on photosynthetic pigment contents of alfalfa seedling leaves under osmotic stress (mg·L-1)
2.2 外源NO与Ca2+对渗透胁迫下紫花苜蓿幼苗叶片光合作用参数的影响
由表2可知,PEG处理下紫花苜蓿幼苗叶片净光合速率(Pn)、气孔导度(Gs)和气孔限制值(Ls)显著低于对照,而胞间CO2浓度(Ci)显著升高(P<0.05)。外源喷施SNP、CaCl2及SNP+CaCl2均抑制了PEG胁迫下Pn、Gs和Ls的降低及Ci的升高。SNP、CaCl2和SNP+CaCl2处理与PEG处理比较,Pn分别提高了42.42%,52.52%和81.82%,Gs分别提高了42.11%,52.63%和70.18%,Ci分别降低了11.42%,13.76%和18.07%。SNP+LaCl3与SNP处理相比叶片Pn、Gs、Ls分别降低了51.06%、40.74%、75.00%,Ci升高了11.21%;而CaCl2+MB与CaCl2处理相比Pn、Gs、Ls分别降低了40.00%,40.23%,46.67%,Ci提升了8.03%。SNP+LaCl3和CaCl2+MB处理均使Pn、Gs和Ls值减小,Ci增加。如表3所列,对紫花苜蓿幼苗光合参数进行相关性分析,Pn与Gs、Ls存在极显著的相关性(P<0.01),Gs与Ci、Gs与Ls及Ci与Ls间也存在极显著相关性(P<0.01),而Pn与Ci之间呈显著相关(P<0.05)。
2.3 外源NO与Ca2+对渗透胁迫下紫花苜蓿幼苗抗氧化酶活性的影响
2.3.1外源NO和Ca2+对渗透胁迫下紫花苜蓿幼苗SOD活性的影响 从图2可以看出,SOD活性随着渗透胁迫时间的延长而升高,CK变化平缓,在第6天时各处理SOD活性均达到最大值,SNP、CaCl2和SNP+CaCl2处理下SOD活性均显著高于PEG处理。第2天时,各处理间差异显著(P<0.05),其中施加SNP、CaCl2及SNP+CaCl2与PEG处理相比SOD活性分别提高了16.13%,30.17%和46.74%;SNP+LaCl3和CaCl2+MB处理与PEG处理相比SOD活性降低了7.09%和23.26%。第6天时,SNP、CaCl2、SNP+CaCl2、SNP+LaCl3和CaCl2+MB处理分别比15%PEG处理时SOD活性增加了29.10%,24.17%,39.29%,11.95%和3.10%。说明SNP可能通过促进Ca2+含量的增加对植物渗透胁迫进行生理调控,当Ca2+通道被阻断时,外源NO供体SNP可通过非依赖cGMP途径进行信号传导,而NO信号通路被抑制,Ca2+信号单独作用时对SOD活性的增强效果较弱。
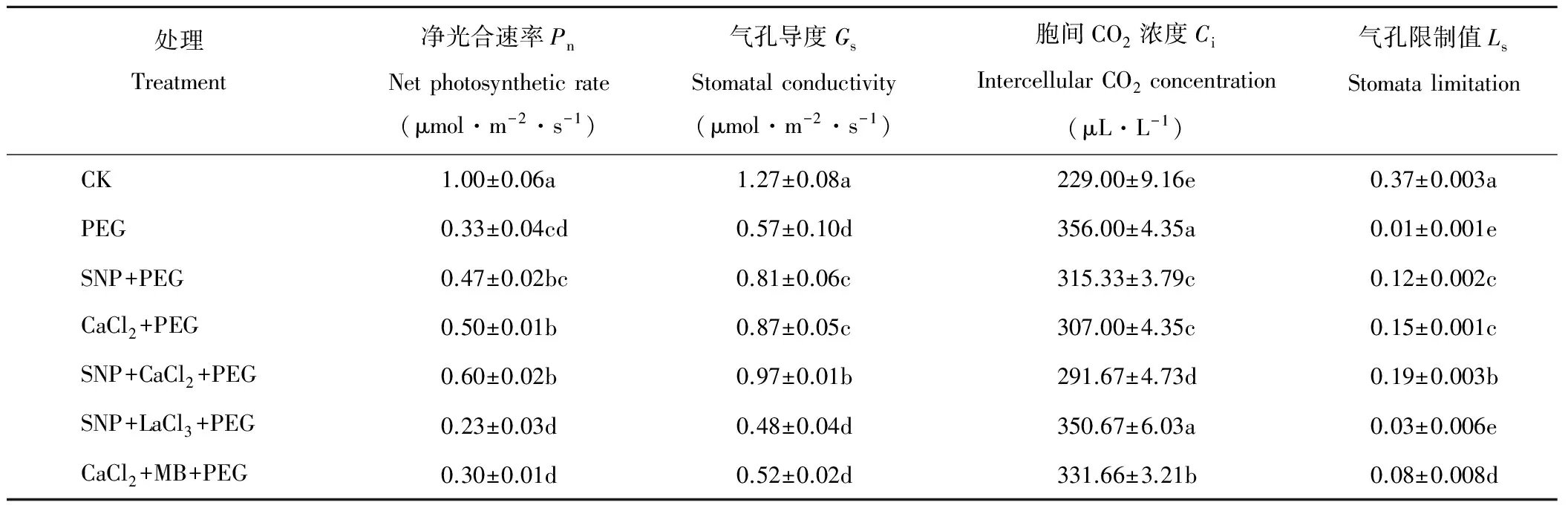
表2 外源NO及Ca2+对渗透胁迫下紫花苜蓿叶片光合气体交换参数的影响Table 2 Effects of exogenous nitric oxide and Ca2+ on photosynthetic gas exchange parameters in leaves of alfalfa seedlings under osmotic stress

表3 外源NO及Ca2+对渗透胁迫下紫花苜蓿光合交换参数的相关性分析Table 3 Correlation analysis of photosynthetic parameters in alfalfa under exogenous nitric oxide and Ca2+ treatment
2.3.2外源NO和Ca2+对渗透胁迫下紫花苜蓿幼苗POD活性的影响 如图3所示,POD活性随着渗透胁迫时间的增加呈现先增高后降低的变化趋势,第4天时各处理SOD活性达到最大值,SNP、CaCl2和SNP+CaCl2处理均能显著提高渗透胁迫下POD活性。第0和2天时,SNP、CaCl2和共处理间差异不显著。第4天时,施加SNP或CaCl2促进了POD活性的增加,其中SNP、CaCl2和SNP+CaCl2处理较PEG处理POD活性分别增加了11.19%,19.94%和30.41%,而添加抑制剂LaCl3和MB后降低了叶片POD活性,分别比PEG处理减少了2.41%和3.71%。
2.3.3外源NO和Ca2+对渗透胁迫下紫花苜蓿幼苗CAT活性的影响 由图4可知,CAT活性随着渗透胁迫时间的延长呈现先升高后降低的变化趋势,CK处理下酶活性变化相对平缓。渗透胁迫第4天时各处理CAT活性均达到最大值,SNP、CaCl2和SNP+CaCl2处理比PEG处理紫花苜蓿幼苗叶片CAT活性分别增加了36.62%,49.70%和56.24%。SNP+LaCl3与SNP处理相比CAT活性降低了23.78%,CaCl2+MB比CaCl2处理CAT活性降低了36.13%。
2.4 外源NO与Ca2+对渗透胁迫下紫花苜蓿幼苗MDA和脯氨酸含量的影响
由图5可知,丙二醛含量随渗透胁迫时间的延长而逐渐增加,渗透胁迫下MDA含量显著高于CK。第2天时,15%PEG处理下MDA含量比CK显著提高了95.81%(P<0.05),外源添加SNP和CaCl2均能降低MDA的含量,从而缓解渗透胁迫对幼苗叶片细胞膜造成的损伤,其中SNP、CaCl2和SNP+CaCl2处理比PEG胁迫下丙二醛含量分别降低了23.54%,28.24%和31.15%,而添加外源SNP和CaCl2的同时添加抑制剂LaCl3和MB后抑制了MDA含量的降低,SNP+LaCl3和CaCl2+MB处理下MDA含量比PEG处理降低了2.29%和13.12%。第6天时CaCl2+MB处理下MDA含量为最大值,比PEG处理提高了9.84%,SNP、CaCl2和SNP+CaCl2处理比PEG处理时MDA含量降低了21.07%,15.57%和22.93%。
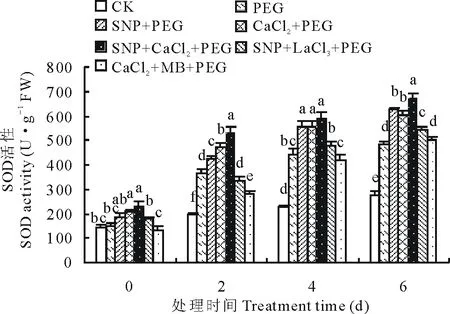
图2 SNP及Ca2+对渗透胁迫下紫花苜蓿幼苗SOD活性变化的影响Fig.2 Effects of SNP and Ca2+ on SOD activity in leaves of alfalfa seedlings under osmotic stress
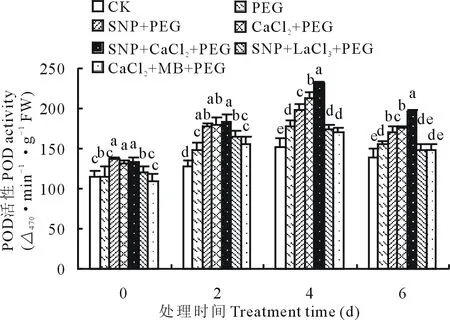
图3 SNP及Ca2+对渗透胁迫下紫花苜蓿幼苗POD活性变化的影响Fig.3 Effects of SNP and Ca2+ on POD activity in leaves of alfalfa seedlings under osmotic stress
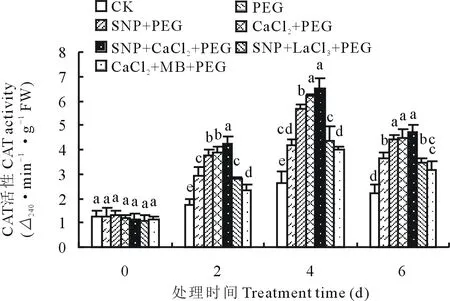
图4 SNP及Ca2+对渗透胁迫下紫花苜蓿幼苗CAT活性变化的影响Fig.4 Effects of SNP and Ca2+ on CAT activity in leaves of alfalfa seedlings under osmotic stress
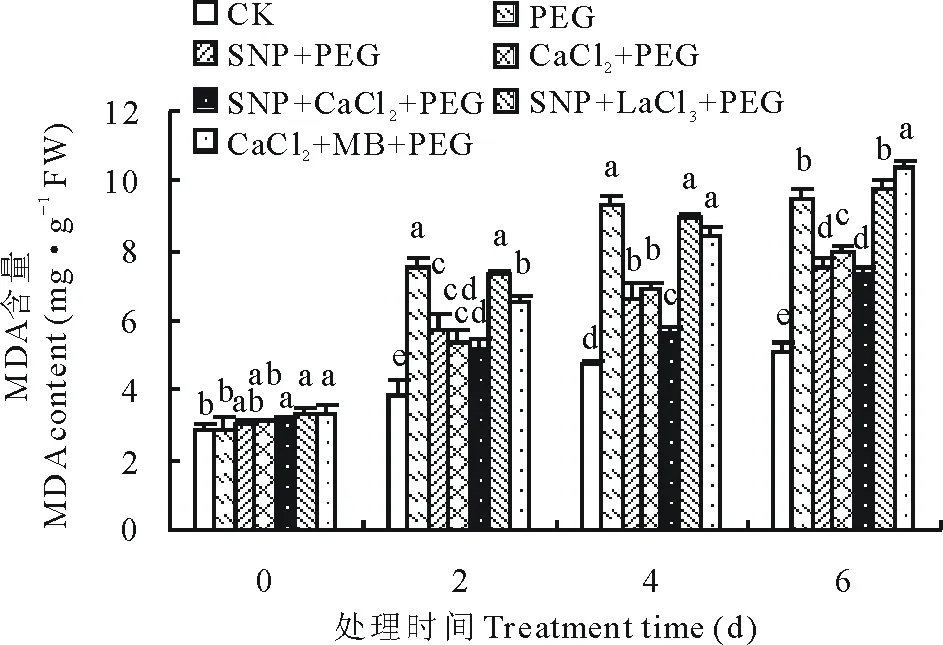
图5 SNP及Ca2+对渗透胁迫下紫花苜蓿幼苗MDA含量变化的影响Fig.5 Effects of SNP and Ca2+ on MDA content in leaves of alfalfa seedlings under osmotic stress
如图6所示,紫花苜蓿幼苗叶片脯氨酸含量随着渗透胁迫时间的延长而逐渐升高(CK变化缓慢)。第0天时各处理脯氨酸含量差异不显著(P>0.05),渗透胁迫后各处理间脯氨酸含量变化差异显著(P<0.05)。第2天时,SNP+CaCl2共处理下脯氨酸含量显著提高,SNP与CaCl2处理间无差异显著性,SNP、CaCl2和SNP+CaCl2处理分别比PEG处理显著提高了20.52%,19.49%和33.76%。第6天时各处理叶片脯氨酸含量达到最大值,PEG处理比CK处理下叶片脯氨酸含量提高了43.70%,SNP、CaCl2和SNP+CaCl2处理分别较PEG处理时显著提高了23.69%,17.14%和30.92%,而SNP+LaCl3处理比PEG和SNP处理分别降低了7.25%和25.01%,CaCl2+MB处理比PEG和CaCl2处理分别降低了13.05%和25.77%。
2.5 外源NO与Ca2+对渗透胁迫下紫花苜蓿幼苗POD同工酶的影响

图6 SNP及Ca2+对渗透胁迫下紫花苜蓿幼苗脯氨酸含量变化的影响Fig.6 Effects of SNP and Ca2+ on proline content in leaves of alfalfa seedlings under osmotic stress
如图7所示,POD同工酶电泳共出现7条酶带,其中A5、A6为共有酶带,随着PEG胁迫时间的延长POD同工酶组分发生变化,且在第4天时酶带颜色最深且种类最多。PEG胁迫前,外源添加SNP、CaCl2及抑制剂MB、CaCl3的处理与CK相比出现A3酶带。第4天时,与PEG处理相比,SNP、CaCl2及SNP+PEG处理使A1、A5和A6酶带颜色加深,SNP+CaCl2处理下出现新酶带A7,且A6酶带颜色最深,A3酶带消失;SNP+LaCl3处理下出现A2、A4酶带,A1、A3酶带颜色加深。第6天时,各处理POD活性降低,A3酶带消失,SNP处理下A1、A5和A6酶带颜色加深,CaCl2处理下A1酶带消失,A5和A6酶带颜色变浅。
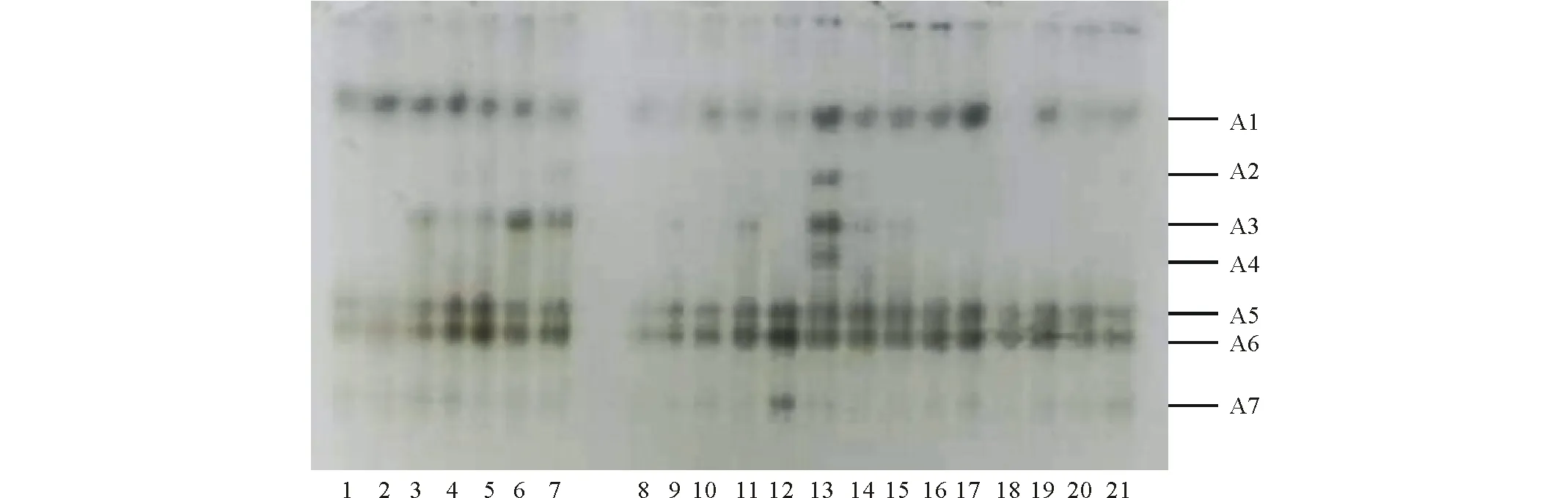
图7 外源NO与Ca2+调控渗透胁迫下紫花苜蓿幼苗叶片POD同工酶电泳图谱Fig.7 Exogenous NO and Ca2+ regulate the POD isoenzyme electrophoresis atlas of alfalfa seedling leaves under osmotic stress
3 讨论
3.1 NO介导的Ca2+信号是紫花苜蓿适应渗透胁迫的重要机制
植物受到干旱胁迫时,体内形成多种机制来适应和抵御逆境,如清除活性氧、产生抗逆蛋白、积累渗透调节物质。其中NO是一种重要的逆境胁迫反应物质,其对植物抵御干旱胁迫具有重要作用[24]。NO对植物抗逆调节途径有:1) NO通过cGMP依赖途径激活胞质Ca2+通道调节胞内Ca2+的浓度来提高抗氧化酶活性,降低自由基的积累和膜脂氧化作用而缓解逆境胁迫。2) NO活化钙依赖性蛋白激酶(CDPKs)而级联放大信号调节抗逆基因的表达[25-26]。SNP是一种外源NO常用的供体,0.05 mmol·L-1SNP约能释放2 μmol·L-1的NO[27]。有研究表明,外施SNP可提高胞内Ca2+浓度诱导蚕豆(Viciafaba)保卫细胞气孔关闭[28],促进甘蔗(Saccharumofficinarum)类囊体膜色素蛋白复合体的装配[29],维持玉米(Zeamays)叶绿体结构稳定性[30],提高黑麦草(Loliumperenne)光合色素和光能利用率[31]。此外,Ca2+在干旱下通过参与ABA信号通路诱导SOD、POD、APX以及GR等相关抗氧化酶基因的表达[32],调节活性氧清除系统和渗透调节作用等使植物适应干旱胁迫[33-34]。
3.2 NO介导的Ca2+信号对渗透胁迫下紫花苜蓿光合色素及光合作用的调控
植物进行光合作用的能量来自光合色素捕获的光能,所以光合色素含量的高低与光合功能密切相关[35]。光合色素中叶绿素a是光反应的中心色素分子,而叶绿素b是补光色素分子。类胡萝卜素一方面作为光合色素吸收光能并传递给反应中心,参与光合作用;又作为细胞内源氧化剂吸收剩余光能,防止细胞膜脂过氧化[36]。本试验表明,渗透胁迫下单一施加SNP或Ca2+能显著缓解紫花苜蓿幼苗叶片叶绿素a及叶绿素b含量的下降,提高类胡萝卜素含量,SNP与Ca2+共处理时效果最佳,而添加Ca2+抑制剂La3+和NO抑制剂MB后缓解作用受到抑制,说明NO介导的Ca2+能够促进光合色素的合成,也可能防止细胞膜脂过氧化。其主要原因可能是光合色素含量的增加提高了紫花苜蓿叶片的有效光合面积; 同时类胡萝卜素含量的升高增强了对活性氧的猝灭,使细胞内氧自由基的积累减少,缓解叶绿体结构和功能的损伤,从而增强光能的吸收与传递。光合速率降低的原因包括气孔和非气孔因素,Ci降低和Ls升高,气孔因素是主要的;Ci升高和Ls下降则非气孔因素是主要的[37]。本研究表明,渗透胁迫下紫花苜蓿幼苗叶片随着Gs降低,Ci升高和Ls降低,导致Pn下降,表明净光合速率的降低主要由非气孔限制引起,这可能与渗透胁迫引起紫花苜蓿叶片中叶绿体结构破坏,光合细胞活性降低有关[38]。渗透胁迫下外施SNP、CaCl2及SNP+CaCl2共处理显著抑制幼苗叶片Gs和Ls的降低和Ci的升高,而施加抑制剂后该作用相反,说明NO及Ca2+信号使叶片气孔扩张,导致外界CO2向细胞内扩散的阻力减小,光合碳固定的底物增加,从而使净光合速率提高[39]。这与刘建新等[31]的外源NO对渗透胁迫下黑麦草幼苗光合和生物发光特性的影响试验结果一致。由此可知,外源NO介导的Ca2+信号缓解了渗透胁迫对紫花苜蓿叶片叶绿体和光合系统的伤害。
3.3 NO介导的Ca2+信号对渗透胁迫下紫花苜蓿抗氧化系统的调控
水分亏缺时植物的生长及体内生理代谢发生变化,如活性氧的大量积累导致植物抗氧化系统失调,促使膜脂过氧化作用增强,从而破坏膜的结构和功能[40-41]。SOD、POD和CAT是细胞抵抗活性氧的重要保护酶,SOD能以O2-·为基质发生歧化反应清除O2-·起到解毒作用,SOD与O2-·歧化产生的H2O2由POD和CAT转化为H2O和O2[42]。之前的研究发现,NO介导的Ca2+信号可增加干旱下紫花苜蓿种子萌发率,主要通过提高抗氧化酶活性和渗透调节物质含量[18]。本试验结果表明,渗透胁迫下外源施加SNP可提高紫花苜蓿幼苗叶片SOD、POD、CAT活性、抑制MDA的产生,使植物体内活性氧的产生与清除处于平衡状态,减缓膜脂氧化损伤,这与姜义宝等[43]的研究结果一致,外源施加CaCl2也具有相同的作用。逆境胁迫下植物体内会迅速积累脯氨酸,通过渗透调节作用维持细胞含水量和膨压,还可以清除活性氧,降低细胞酸性,解除氨毒等[44]。添加SNP或CaCl2均提高了叶片中脯氨酸含量,且随着胁迫时间的延长脯氨酸含量逐渐增加,SNP+CaCl2处理促进效果最显著。当添加SNP同时添加Ca2+通道阻断剂LaCl3,SOD、POD、CAT活性和脯氨酸含量均降低,MDA含量增加,施加CaCl2的同时施加NO抑制剂MB后,以上效果也会减弱,且抑制效果强于增施LaCl3,这与胞质内Ca2+浓度密切相关。说明NO介导的Ca2+通路在调控渗透胁迫下紫花苜蓿叶片抗氧化酶活性、膜脂结构损伤及渗透平衡过程中有重要的作用,增强了紫花苜蓿幼苗抗逆能力。
POD同工酶电泳试验中,与CK相比各处理POD组分发生明显变化,第4天时酶种类变化差异最显著,这与图3中 POD活性在第4天各处理均达到最大值相一致。第4天时SNP+CaCl2共处理使A7条带下小分子量酶蛋白的合成增加,较大分子量的酶蛋白(A1、A2、A3)合成受到抑制。施加SNP的同时添加Ca2+通道阻断剂LaCl3可以使A1~A4条带下酶含量增加,且A2和A4为新出现酶带,添加NO抑制剂A1条带下酶的合成增加,说明阻断NO介导的Ca2+信号通路改变了苜蓿适应胁迫的生理应答路径。因此可知,Ca2+参与NO信号传导且Ca2+与NO存在着交叉作用来调节PEG胁迫下紫花苜蓿幼苗生理应答并起到保护作用。
参考文献References:
[1] Fan L X, Liu G B, Xue S,etal. Synergistic effects of doubled CO2concentration and drought stress on photosynthetic characteristics ofMedicagosativa. Acta Agrestia Sinica, 2014, 22(1): 85-93.
樊良新, 刘国彬, 薛萐, 等. CO2浓度倍增及干旱胁迫对紫花苜蓿光合生理特性的协同影响. 草地学报, 2014, 22(1): 85-93.
[2] Ghotbi-Ravandi A A, Shahbazi M, Shariati M,etal. Effects of mild and severe drought stress on photosynthetic efficiency in tolerant and susceptible barley (HordeumvulgareL.) Genotypes. Journal of Agronomy & Crop Science, 2015, 200(6): 403-415.
[3] Jaleel C A, Riadh K, Gopi R,etal. Antioxidant defense responses: physiological plasticity in higher plants under abiotic constraints. Acta Physiologiae Plantarum, 2009, 31(3): 427-436.
[4] Wendehenne D, Pugin A, Klessig D F. Nitric oxide comparative synthesis and signaling in animal and plant cells. Trends in Plant Science, 2001, 6(4): 177-183.
[5] Beligni M V, Lamattina L. Nitric oxide stimulates seed germination and de-etiolation, and inhibits hypocotyl elongation, three light-inducible responses in plants. Planta, 2000, 210(2): 215-221.
[6] Procházková D, Haisel D, Wilhelmová N,etal. Effects of exogenous nitric oxide on photosynthesis. Photosynthetica, 2013, 51(4): 483-489.
[7] Hao G P, Xing Y, Zhang J H. Role of nitric oxide dependence on nitric oxide synthase-like activity in the water stress signaling of maize seedling. Journal of Integrative Plant Biology, 2008, 50(4): 435-442.
[8] Lamotte O, Courtois C, Dobrowolska G,etal. Mechanisms of nitric-oxide-induced increase of free cytosolic Ca2+concentration inNicotianaplumbaginifoliacells. Free Radical Biology & Medicine, 2006, 40(8): 1369-1376.
[9] Zhang Y Y, Liu Y L. Source and function of nitric oxide in plants. Acta Botanica Boreali-Occidentalia Sinica, 2004, 24(5):921-929.
张艳艳, 刘友良. 一氧化氮在植物体内的来源和功能. 西北植物学报, 2004, 24(5): 921-929.
[10] Khan M N, Mohammad F, Mobin M,etal. Tolerance of plants to abiotic stress: a role of nitric oxide and calcium. Switzerland: Springer International Publishing, 2014: 225-242.
[11] Liu J X, Wang J C, Wang R J,etal. Exogenous nitric oxide elevated alkali tolerance ofAvenanudaseedlings. Acta Prataculturae Sinica, 2015, 24(8): 110-117.
刘建新, 王金成, 王瑞娟, 等. 外源一氧化氮提高裸燕麦幼苗的耐碱性. 草业学报, 2015, 24(8): 110-117.
[12] Ozkan D, Kara P, Kerman K,etal. DNA and PNA sensing on mercury and carbon electrodes by using methylene blue as an electrochemical label. Bioelectrochemistry, 2002, 58(1): 119-126.
[13] Kawabata A, Umeda N, Takagi H. L-arginine exerts a dual role in nociceptive processing in the brain: involvement of the kyotorphin-Met-enkephalin pathway and NO-cyclic GMP pathway. British Journal of Pharmacology, 1993, 109(1): 73-79.
[14] Kaczmarek M, Fedorowicz-Strońska O, Gowacka K,etal. CaCl2treatment improves drought stress tolerance in barley (HordeumvulgareL.). Acta Physiologiae Plantarum, 2017, 39(1): 41.
[15] Zottini M, Costa A, De Michele R,etal. Salicylic acid activates nitric oxide synthesis inArabidopsis. Journal of Experimental Botany, 2007, 58(6): 1397-1405.
[16] Shi J, Fu X Z, Peng T,etal. Spermine pretreatment confers dehydration tolerance of citrusinvitroplants via modulation of antioxidative capacity and stomatal response. Tree Physiology, 2010, 30(7): 914-922.
[17] Chen Y H, Kao C H. Calcium is involved in nitric oxide-and auxin-induced lateral root formation in rice. Plant Cell Reports, 2012, 249: 187-195.
[18] Yi Q, Wei X H, Qiang X,etal. Investigation into the mechanism of NO-mediated Ca2+signaling during seed germination and antioxidation inMedicagosativaunder drought stress. Acta Prataculturae Sinica, 2016, 25(11): 57-65.
弋钦, 魏小红, 强旭, 等. NO介导的Ca2+信号在干旱胁迫下紫花苜蓿种子萌发及抗氧化酶中的传导作用研究. 草业学报, 2016, 25(11): 57-65.
[19] Zou Q. Guide of plant physiological experiments. Beijing: China Agricultural Press, 2000: 72-74.
邹琦. 植物生理学实验指导. 北京: 中国农业出版社, 2000: 72-74.
[20] Liu W Y, Yang H W, Wei X H,etal. Effects of exogenous nitric oxide on seed germination, physiological characteristics and active oxygen metabolism ofMedicagotruncatulaunder NaCl stress. Acta Prataculturae Sinica, 2015, 24(2): 85-95.
刘文瑜, 杨宏伟, 魏小红, 等. 外源NO调控盐胁迫下蒺藜苜蓿种子萌发生理特性及抗氧化酶的研究. 草业学报, 2015, 24(2): 85-95.
[21] Ji X, Liu G, Liu Y,etal. The bZIP protein fromTamarixhispida, ThbZIP1, is ACGT elements binding factor that enhances abiotic stress signaling in transgenicArabidopsis. BMC Plant Biology, 2013, 13(3): 1-13.
[22] Deuner S, Alves J D, Zanandrea I,etal. Stomatal behavior and components of the antioxidative system in coffee plants under water stress. Scientia Agricola, 2011, 68(1): 77-85.
[23] Aebi H. Catalaseinvitro. Methods in Enzymology, 1984, 105: 121-126.
[24] Zhang L, Zhao X, Wang Y J,etal. Crosstalk of NO with Ca2+in stomatal movement inViciafabaguard cells. Acta Agronomica Sinica, 2009, 35(8): 1491-1499.
张霖, 赵翔, 王亚静, 等. NO与Ca2+对蚕豆保卫细胞气孔运动的互作调控. 作物学报, 2009, 35(8): 1491-1499.
[25] Gao H B, Chen G L, Han L H,etal. Calcium influence on chilling resistance of grafting eggplant seedling. Journal of Plant Nutrition, 2005, 27(8): 1327-1339.
[26] Jeandroz S, Lamotte O, Astier J,etal. There’s more to the picture than meets the eye: nitric oxide cross talk with Ca2+signaling. Plant Physiology, 2013, 163(2): 459-470.
[27] Delledonne M, Xia Y J, Dixon R A,etal. Nitric oxide functions as a signal in plant disease resistance. Nature, 1998, 394: 585-588.
[28] Astier J, Besson-Bard A, Wawer L,etal. Nitric oxide signaling in plant: cross-talk with Ca2+, protein kinases and reactive oxygen species. Annual Plant Reviews, 2011, 42: 147-170.
[29] Silveira N M, Frungillo L, Marcos F C,etal. Exogenous nitric oxide improves sugarcane growth and photosynthesis under water deficit. Planta, 2016, 244(1): 181-190.
[30] Shao R X, Li L L, Zhang H F,etal. Effects of exogenous nitric oxide on photosynthesis if maize seedlings under drought stress. Scientia Agriculture Sinica, 2016, 49(2): 251-259.
邵瑞新, 李蕾蕾, 郑会芳, 等. 外源一氧化氮对干旱胁迫下玉米幼苗光合作用的影响. 中国农业科学, 2016, 49(2): 251-259.
[31] Liu J X, Wang J C, Wang R J,etal. Effects of exogenous nitric oxide on photosynthetic and bioluminescent characteristics in ryegrass seedling under osmotic stress. Acta Prataculturae Sinica, 2013, 22(1): 210-216.
刘建新, 王金成, 王瑞娟, 等. 外源一氧化氮对渗透胁迫下黑麦草幼苗光合和生物发光特性的影响. 草业学报, 2013, 22(1): 210-216.
[32] Sang J, Zhang A, Lin F,etal. Cross-talk between calcium-calmodulin and nitric oxide in abscisic acid signaling in leaves of maize plants. Cell Research, 2008, 18(5): 577-588.
[33] Fan Q J, Liu J H. Nitric oxide is involved in dehydration/drought tolerance in poncirus trifoliata seedlings through regulation of antioxidant systems and stomatal response. Plant Cell Reports, 2012, 31(1): 145-154.
[34] Xu Z Z, Zhou G S. Responses of leaf stomatal density to water status and its relationship with photosynthesis in a grass. Journal of Experimental Botany, 2007, 59(12): 3317-3325.
[35] Li X G, Meng Q W, Jiang G Q,etal. The susceptibility of cucumber and sweet pepper to chilling under low irradiance is related to energy dissipation and water-water cycle. Photosynthetica, 2003, 41(2): 259-265.
[36] Yang Z X, Ding Y F, Zhang X Q,etal. Impacts of alternaria stress on characteristics of photosynthesis and chlorophyll fluorescence in two tobacco cultivars with different resistances. Acta Ecologica Sinica, 2015, 35(12): 4146-4154.
杨志晓, 丁燕芳, 张小泉, 等. 赤星病胁迫对不同抗性烟草品种光合作用和叶绿素荧光特性的影响. 生态学报, 2015, 35(12): 4146-4154.
[37] Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology, 1982, 33(3): 317-345.
[38] Mu L, He C G, Jiang H,etal. The effects of drought and heat stress on the photosynthetic characteristics of alfalfa. Acta Agrestia Sinica, 2014, 22(3): 550-555.
牟兰, 何承刚, 姜华, 等. 干热胁迫对紫花苜蓿光合特性的影响. 草地学报, 2014, 22(3): 550-555.
[39] Lu C M, Qiu N W, Wang B S,etal. Salinity treatment shows no effects on photosystem Ⅱphotochemistry, but increase the resistance of photosystem Ⅱ to heat stress in halophyteSuaedasalsa. Journal of Experimental Botany, 2003, 54: 851-860.
[40] Hosseini Boldaji S A, Khavari-Nejad R A, Hassan Sajedi R,etal. Water availability effects on antioxidant enzyme activities, lipid peroxidation, and reducing sugar contents of alfalfa (MedicagosativaL.). Acta Physiologiae Plantarum, 2012, 34(3): 1177-1186.
[41] Quan W L, Liu X, Wang H Q,etal. Comparative physiological and transcriptional analyses of two contrasting drought tolerant alfalfa varieties. Frontiers in Plant Science, 2015, 6: 1256.
[42] Li X, Wu Y J, Sun L X. Growth and physiological responses of three warm-season turfgrasses to lead stress. Acta Prataculturae Sinica, 2014, 23(4): 171-181.
李西, 吴亚娇, 孙凌霞. 铅胁迫对三种暖季型草坪草生长和生理特性的影响. 草业学报, 2014, 23(4): 171-181.
[43] Jiang Y B, Yang Y R, Zheng Q H. Effects of exogenous nitric oxide on antioxidase and chlorophyll fluorescence of seedling of alfalfa under drought stress. Agricultural Research in Arid Areas, 2008, 26(2): 65-68.
姜义宝, 杨玉荣, 郑秋红. 外源一氧化氮对干旱胁迫下苜蓿幼苗抗氧化酶活性和叶绿素荧光特性的影响. 干旱地区农业研究, 2008, 26(2): 65-68.
[44] Liu Z J, Zhang X L, Bai J G,etal. Exogenous paraquat changes antioxidant enzyme activities and lipid peroxidation in drought-stressed cucumber leaves. Scientia Horticulturea, 2009, 121(2): 138-143.
张宇君, 赵丽丽, 王普昶, 等. 盐旱交互对燕麦种子萌发及幼苗生理特性的影响. 草业学报, 2018, 27(5): 141-152.
Zhang Y J, Zhao L L, Wang P C,etal. Effects of interaction between Ca2+salt and drought stress on seed germination and seedling physiology of oats. Acta Prataculturae Sinica, 2018, 27(5): 141-152.

