莲房原花青素低聚体纳米脂质体的制备及其稳定性、抗氧化性分析
尹 浩,陈 娅,陶 涛,谢笔钧,孙智达*
(华中农业大学食品科学技术学院,湖北 武汉 430070)
莲房是莲子加工过程中的副产物,因其富含原花青素,而具有应用价值[1]。莲房原花青素是继葡萄籽原花青素后又一重要的原花青素来源。莲房原花青素低聚体(lotus seedpods oligomeric procyanidins,LSOPC)平均聚合度为3.2,大部分以儿茶素或表儿茶素为结构单元,通过C4—C8或C4—C6键连接,其延伸单元也可同没食子儿茶素相连,为B型原花青素[2-3]。原花青素低聚体具有优良的生物活性,如抗氧化[4]、抗辐射[5]、调节血糖[6]、提高记忆力[7]、抗癌[8]、延缓衰老[9]等。但是原花青素低聚体在体内的生物利用率很低,而且相当不稳定,极易受到环境因素的影响,如温度、光照、pH值、氧化还原剂等[10]。此外,原花青素低聚体的亲水性也在很大程度上限制了其在脂质体系中抗氧化活性的发挥。为了提高其生物利用度和稳定性,扩大其在油脂体系中的应用范围,故而构建LSOPC脂质体运载体系[11-12]。脂质体是一种具有类细胞结构的微型囊泡,由双亲性脂质壁材组成,因为其生物相容性以及可以同时包埋亲水性和疏水性物质的特性,成为食品和医药领域研究的热点[13]。此外,脂质体还具有粒径小、具有靶向性、制备简单、吸收性好等特点[14]。在过去的10年间,脂质体在食品领域的应用研究大量增加,包埋的食品相关物质包括酶、维生素、功能肽等[15]。但欲获得平均粒径较小,且包埋率大的理想脂质体却是目前脂质体研究的难题。为此,本实验采用逆向蒸发法与超声波处理相结合,制备LSOPC纳米脂质体,并考察LSOPC纳米脂质体稳定性和抗氧化性,以提高LSOPC的生物利用率和稳定性,并扩大其应用范围,为其在食品工业和保健品行业的利用提供基础和实验参考。
1 材料与方法
1.1 材料与试剂
莲房采自武汉市汤逊湖,品种为武植2号;葡萄籽原花青素标准品(纯度为95%) 天津市尖峰天然产物研究开发有限公司;AB-8大孔吸附树脂 南开大学化工厂。
大豆卵磷脂、胆固醇、水溶性VE(Trolox)、偶氮二异丁基脒盐酸(2,2’-azobis (2-methyl-propanimidamide)dihydrochloride,AAPH)、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azino-bis (3-ethylbenzthiazoline-6-sulfonic acid) diammonium salt,ABTS) 美国Sigma公司;吐温80、十二水合磷酸氢二钠、二水合磷酸二氢钠、氯仿、碘化钾、无水乙醇、过硫酸钾、铁氰化钾、三氯乙酸(trichloroacetic acid,TCA)、三氯化铁、氯化钠、氯化钾、氯化锌、氯化铜、氯化镁、氯化铝、醋酸铅、氯化亚铁、氯化铁、葡萄糖、蔗糖、苯甲酸钠、山梨酸钾(均为分析纯试剂) 国药集团化学试剂有限公司。
1.2 仪器与设备
H-7650透射电子显微镜 日本日立有限公司;Mastersizer 2000激光粒度分布仪 英国Malvern仪器有限公司;RE-3000旋转蒸发仪 上海亚荣生化仪器厂;UV-9100紫外-可见分光光度计 北京瑞利分析仪器公司;Microfuge 20R台式微量离心机 日本贝克曼库尔特商贸有限公司;DF-101S集热式恒温加热磁力搅拌器武汉科尔仪器设备有限公司;分析天平 上海伦捷机电仪表公司;FS-600N超声波分散仪 上海超析仪器有限公司。
1.3 方法
1.3.1 LSOPC的提取
提取方法参考文献[16]。新鲜莲房剪碎后,按料液比1∶10(g/mL)加入体积分数70%乙醇溶液,55 ℃遮光恒温浸提2 h,减压旋蒸回收乙醇,然后将浓缩液过AB-8大孔树脂,用蒸馏水洗去杂质,再用70%乙醇溶液洗脱,减压浓缩洗脱液,真空冷冻干燥,得莲房原花青素提取物粉末。将得到的粉末经乙酸乙酯萃取,即可得到LSOPC。
1.3.2 LSOPC纳米脂质体的制备
采用逆向蒸发法制备LSOPC纳米脂质体[17-18]。用氯仿溶解一定比例的大豆卵磷脂和胆固醇,在超声的同时加入用磷酸盐缓冲液(phosphate buffered saline,PBS;50 mmol/L,pH 7.4)溶解的LSOPC,旋转蒸发除去氯仿,然后加入30 mL含有吐温80的PBS,继续旋转水化20 min。冰浴超声处理(超声时间5 min,超声功率350 W,脉冲5 s/5 s)后得到LSOPC纳米脂质体。
1.3.3 单因素试验
1.3.3.1 大豆卵磷脂-胆固醇质量比对脂质体平均粒径的影响
固定LSOPC添加量0.33 mg/mL、吐温80添加量3.3 mg/mL,选择大豆卵磷脂-胆固醇质量比为1∶1、2∶1、3∶1、4∶1、5∶1,以脂质体的平均粒径为评价指标,研究大豆卵磷脂-胆固醇质量比对脂质体平均粒径的影响[14]。
1.3.3.2 LSOPC添加量对脂质体平均粒径的影响
固定大豆卵磷脂-胆固醇质量比3∶1、吐温80添加量3.3 mg/mL,选择LSOPC添加量为1、0.50、0.33、0.25、0.20 mg/mL,以脂质体的平均粒径为评价指标,研究LSOPC添加量对脂质体平均粒径的影响[14]。
1.3.3.3 吐温80添加量对脂质体平均粒径的影响
固定大豆卵磷脂-胆固醇质量比为3∶1、LSOPC添加量0.33 mg/mL,选择吐温80添加量为3.3、6.7、10.0、13.3、16.7、20.0 mg/mL,以脂质体的平均粒径为评价指标,研究吐温80添加量对脂质体平均粒径的影响[17]。
1.3.4 LSOPC纳米脂质体制备的正交试验
为优化脂质体的制备条件,以大豆卵磷脂-胆固醇质量比、LSOPC添加量、吐温80添加量为变量,以脂质体的平均粒径作为衡量指标,进行3因素3水平的L9(33)正交试验,各自变量水平的选取根据单因素试验结果进行确定,具体见表1。

表1 正交试验因素与水平Table 1 Coded levels of independent variables used in orthogonal array design
1.3.5 指标测定
1.3.5.1 粒径的测定
将待测样品稀释适当倍数,取1 mL装入聚苯乙烯比色皿中,(25±0.1)℃保温3 min,进行测定,记录平均粒径和多分散指数(polydispersity index,PDI)[19]。
1.3.5.2 包埋率、有效载量的计算
游离LSOPC的测定采用有机溶剂萃取法[20]。取适量LSOPC纳米脂质体于试管中,加入乙酸乙酯,涡旋混合,5 000 r/min 离心5 min,取上层乙酸乙酯液,重复操作2 次,合并乙酸乙酯液,继续用乙酸乙酯定容至10 mL,用可见分光光度计法测定其含量。包埋率、载量和有效载量的计算按公式(1)~(3)进行计算:

1.3.5.3 微观结构观察
用超纯水稀释样品至脂质达到合适的浓度。将稀释液滴入铜网中,用磷钨酸染色,用滤纸吸干多余的液体,在室温下干燥滴有样品的铜网,待铜网干燥后,用透射电子显微镜(transmission electron microscope,TEM)观察样品[21]。
1.3.5.4 弱碱(pH 7.4)条件下的稳定性
原花青素在碱性条件中非常不稳定[10],但是为了模拟小肠和体液的pH值环境,脂质体常选择pH值为7.4的缓冲液[22]。所以研究LSOPC脂质体在弱碱性环境(pH 7.4)的稳定性非常有必要。用PBS(pH 7.4,50 mmol/L)溶解LSOPC,将LSOPC溶液与LSOPC纳米脂质体在37 ℃孵育一定时间,于430 nm波长下测定其吸光度。
1.3.5.5 温度对LSOPC纳米脂质体稳定性的影响
将LSOPC纳米脂质体分装于具塞试管中,分别置于40、60、80、100 ℃的水浴锅中,每隔1.0 h取样,测量平均粒径[23]。另取LSOPC纳米脂质体,分别存放于4 ℃和37 ℃的环境中进行长期贮藏,隔7 d取样,测量平均粒径,并按公式(4)计算平均粒径变化率:

1.3.5.6 金属离子对LSOPC纳米脂质体稳定性的影响
配制不同质量浓度的AlCl3、MgCl2、BaCl2、KCl、CaCl2、NaCl、CuCl2、FeCl2、FeCl3、ZnCl2、(CH3COO)2Pb溶液,取1 mL LSOPC纳米脂质体,加入等量的金属离子溶液,混合均匀。在40 ℃的水浴锅中保温2 h后测量平均粒径,以纯水作为空白对照[24]。
1.3.5.7 糖和防腐剂对LSOPC纳米脂质体稳定性的影响
配制不同质量分数的蔗糖、葡萄糖溶液,取1 mL LSOPC纳米脂质体,加入等量的糖溶液,混合均匀后在40 ℃的水浴锅中保温2 h,测量平均粒径,以纯水作为空白对照[25]。山梨酸钾和苯甲酸钠溶液对脂质体稳定性的测量方法同糖溶液。
1.3.5.8 ABTS+·清除率的测定
用纯水配制含ABTS(7 mmol/L)与过硫酸钾(2.45 mmol/L)的混合溶液,置于暗处孵育12~16 h。稀释基液至其在波长734 nm处吸光度为0.700±0.005。取0.1 mL不同浓度受试物溶液与3.9 mL稀释液混合,23 ℃孵育6 min,测定样品在734 nm波长处的吸光度,纯水作空白对照[26]。按公式(5)计算ABTS+·清除率:

式中:A1为加入样品和ABTS的吸光度;A2为纯水空白对照组的吸光度。
1.3.5.9 铁还原能力的测定
参照文献[27]方法:取1 mL样品,加入1 mL铁氰化钾(2.5 g/100 mL),在50 ℃水浴中反应20 min。快速冷却,加入5 mL TCA(10 g/100 mL),充分混匀后过滤。取滤出液2 mL,加入2 mL蒸馏水和0.5 mL氯化铁(0.1 g/100 mL),混合均匀,静置10 min后在700 nm波长下测定吸光度(A700nm)。用吸光度表征铁还原能力,吸光度越大,表示还原能力越强。
1.3.5.10 氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)法对纳米脂质体总抗氧化能力的评价
参考相关文献[28]:荧光素钠盐、AAPH、Trolox用75 mmol/L PBS(pH 7.2)溶解并稀释。在黑色荧光酶标板的微孔中分别加入25 μL不同浓度的样品溶液,然后向各微孔中加入150 μL浓度为8.61×10-5mmol/L的荧光素钠盐溶液,中速振摇2 min,37 ℃孵育10 min后,加入25 μL 153 mmol/L的AAPH溶液并迅速启动反应,测定荧光强度(激发波长(485±20)nm,发射波长(530±20)nm)。整个体系保持37 ℃,每隔2 min测定一次荧光强度,且每次测定前要中速振动孔板10 s。数据处理参考相关文献[29-30]。
1.3.5.11 抗脂质过氧化能力的测定
LSOPC的抗脂质过氧化能力可以通过测定体系中与硫代巴比妥酸反应的底物(thiobarbituric acid reactive substance,TBARS)变化率来表征。参考文献[15]方法:在试管中分别加入1 mL样品、1 mL 400 μmol/L三氯化铁和1 mL 400 μmol/L VC,混合均匀。在避光的条件下,37 ℃水浴60 min,然后加入5 mL TCA-TBA-HCl混合液(TCA 37.5 g、TBA 0.925 g、浓HCl 5.25 g溶于超纯水,80 ℃水浴并搅拌溶解,冷却后用超纯水定容至250 mL,过滤备用),随后100 ℃沸水浴10 min,冰浴冷却,离心后取上清液在535 nm波长处测定吸光度。空白管以1 mL超纯水分别代替VC和三氯化铁溶液,测定吸光度。按公式(6)计算TBARS变化率:

式中:As为加入VC和三氯化铁后测得的吸光度;Ac为以纯水代替VC和三氯化铁后测得的吸光度。
2 结果与分析
2.1 单因素试验结果
2.1.1 大豆卵磷脂-胆固醇质量比对脂质体平均粒径的影响

图1 大豆卵磷脂-胆固醇质量比对脂质体平均粒径的影响Fig. 1 Effect of ratio of phosphatidylcholine to cholesterol on the average size of LSOPC nanoliposome
脂质体的膜材主要是由胆固醇和卵磷脂构成的,两者的比例对脂质体的粒径影响显著[17]。由图1可知,当大豆卵磷脂-胆固醇质量比小于3∶1时,随着大豆卵磷脂比例的增加,脂质体的平均粒径变小,当二者质量比大于3∶1时,脂质体平均粒径变化趋于平稳。当两者质量比为3∶1时,脂质体平均粒径最小,为(92.05±0.63)nm。故选择大豆卵磷脂-胆固醇质量比为2∶1、3∶1、4∶1进行正交试验。PDI可以反映脂质体粒径的分布情况,脂质体PDI均小于0.3,这说明脂质体内部颗粒分散均匀性良好[17]。
2.1.2 LSOPC添加量对脂质体平均粒径的影响

图2 LSOPC添加量对脂质体平均粒径的影响Fig. 2 Effect of LSOPC concentration on the average size of LSOPC nanoliposome
LSOPC添加量会影响脂质体的平均粒径,LSOPC添加量过多或过少都会导致LSOPC包埋不成功,从而导致脂质体的粒径发生变化。由图2可知,随着LSOPC添加量的增加,脂质体平均粒径先减小后增加,当LSOPC添加量为0.33 mg/mL时,脂质体的平均粒径达到最小,为(87.95±0.62)nm,且此时PDI也最小,为0.17±0.01。因此,选择LSOPC添加量0.25、0.33、0.5 mg/mL进行正交试验。
2.1.3 吐温80添加量对脂质体平均粒径的影响

图3 吐温80添加量对脂质体平均粒径的影响Fig. 3 Effect of Tween 80 concentration on the average size of LSOPC nanoliposome
由图3可知,吐温80添加量对脂质体粒径有明显的影响。脂质体的平均粒径随着吐温80的加入逐渐降低,当吐温80添加量为16.7 mg/mL时,脂质体的平均粒径达到最小值。这表明高亲水亲油值的乳化剂有利于亲水性的LSOPC紧密结合,从而促进了与其他脂质膜材料的结合而减小了脂质体的粒径。当继续加入吐温80时,脂质体的平均粒径基本保持不变,故选择吐温80添加量为10、13.3、16.7 mg/mL进行正交试验。
2.2 正交试验结果
由表2、3可知,3 个因素对脂质体平均粒径影响的主次顺序为C>A>B,即吐温80添加量>大豆卵磷脂-胆固醇质量比>LSOPC添加量。正交试验的最佳工艺条件为A2B2C3,即大豆卵磷脂-胆固醇质量比3∶1、LSOPC添加量0.33 mg/mL、吐温80添加量16.7 mg/mL。以此工艺条件制备LSOPC纳米脂质体进行验证实验,测量的平均粒径为(35.57±0.08)nm、PDI为0.153±0.01,粒径分布如图4所示。在本试验所取的因素和水平下,吐温80添加量对脂质体平均粒径具有显著影响,是影响脂质体平均粒径的主要因素。

表2 正交试验设计与结果Table 2 Orthogonal array design with experimental results

表3 方差分析Table 3 Analysis of variance

图4 LSOPC纳米脂质体粒径分布图(n=3)Fig. 4 Particle size of the optimized LSOPC nanoliposome (n = 3)
2.3 LSOPC纳米脂质体的包埋能力

图5 LSOPC纳米脂质体在不同载量时包埋率和有效载量Fig. 5 Encapsulation efficiency and effective loading of LSOPC nanoliposome at different initial loading levels
除了粒径外,衡量脂质体应用价值的重要指标还有包埋率和有效载量。包埋率和有效载量能反映体系中LSOPC的保留率和表观溶解性[17]。由图5可知,在所考察的载量范围(0.25%~2%)内,脂质体的包埋率维持在70%左右,在载量为1%时有最高值,达(71.97±0.42)%。而且随着LSOPC添加量的增加,有效载量呈直线上升,这说明在此载量范围(0.25%~2%)内,LSOPC能够有效地包埋在脂质双分子层中。
2.4 LSOPC纳米脂质体的微观结构观察

图6 LSOPC纳米脂质体电镜图Fig. 6 TEM micrographs of LSOPC nanoliposome
由图6可以看出,LSOPC纳米脂质体为球形或近似球形的囊泡结构,粒径小(10~100 nm),彼此分散且较为均一。
2.5 弱碱(pH 7.4)条件下的稳定性

图7 LSOPC溶液和LSOPC纳米脂质体在pH 7.4、温度37 ℃条件下的稳定性Fig. 7 Stability profiles of LSOPC solution and nanoliposome in hydrogen phosphate buffer at pH 7.4 (37 ℃)
由图7可知,在0 h时,LSOPC溶液和LSOPC纳米脂质体的吸光度均较小,分别为0.217±0.01、0.143±0.01。两者的吸光度都随着贮存时间的延长而增大,且LSOPC溶液的吸光度明显高于LSOPC纳米脂质体。在0~6 h,两者的吸光度之差随着时间的延长而增大,6 h后,两者吸光度差异维持在3 倍左右。到24 h时,两者的吸光度分别达到1.458±0.05、0.529±0.05。以上结果可以说明,脂质体能显著地降低LSOPC的氧化速率,提高LSOPC在弱碱(pH 7.4)条件下的稳定性。
2.6 温度对LSOPC纳米脂质体稳定性的影响
由图8可知,随着温度的升高,LSOPC纳米脂质体的平均粒径呈明显的增大趋势。当温度为40 ℃和60 ℃时,脂质体的粒径无明显变化。在80 ℃时,脂质体平均粒径变化较小,而100 ℃时其粒径则发生显著变化。LSOPC纳米脂质体在80 ℃和100 ℃水浴放置7 h后平均粒径分别达到(59.93±1.04)、(486.43±25.35)nm。长期贮藏实验结果说明,脂质体在低温环境里平均粒径变化率更小,低温有利于脂质体的长期贮藏。在4 ℃贮藏7 周后,其平均粒径变化率仅为0.239。
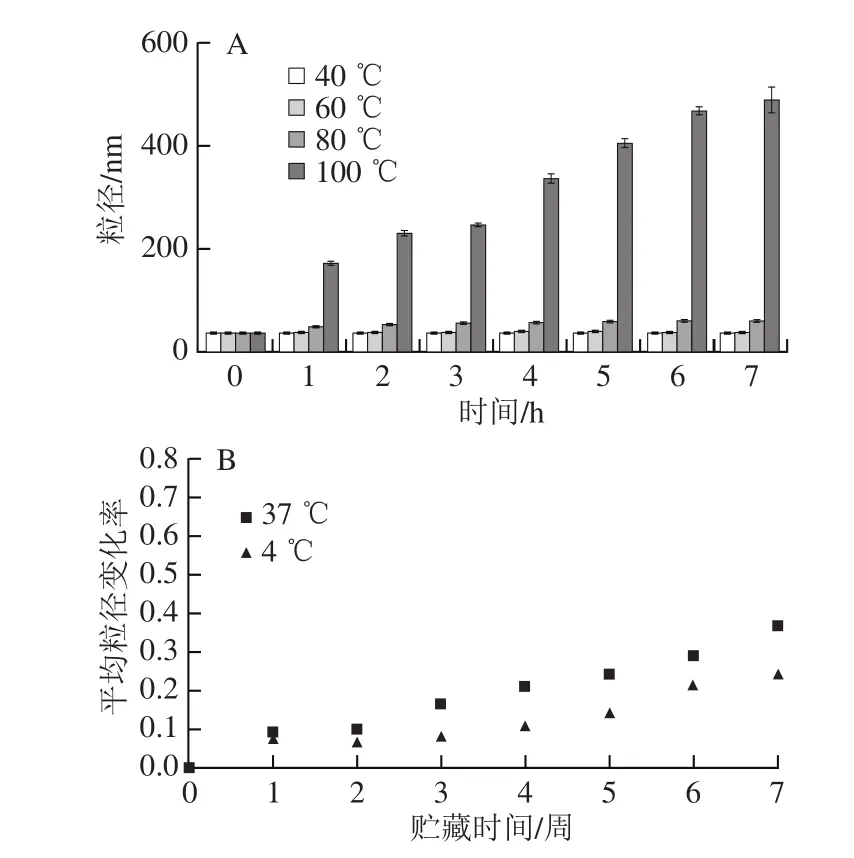
图8 温度对LSOPC纳米脂质体稳定性的影响Fig. 8 Effect of temperatures on stability of LSOPC nanoliposome
2.7 金属离子对LSOPC纳米脂质体稳定性的影响

图9 金属离子对LSOPC纳米脂质体稳定性的影响Fig. 9 Effect of metal ions on stability of LSOPC nanoliposome
由图9可知,在实验所考察的金属离子中,Fe3+、Cu2+、Zn2+、Pb2+的加入对脂质体的粒径有显著性影响,脂质体的粒径随着金属离子质量浓度的增加而增大。此外,Fe2+的加入虽对粒径影响不大,但是会改变脂质体体系的颜色。所以LSOPC纳米脂质体在实际应用中要避免与这些金属离子共存,防止遭到破坏,影响其应用。
2.8 糖对LSOPC纳米脂质体稳定性的影响
由图10可知,当葡萄糖和蔗糖的质量分数达到10%时脂质体的粒径发生变化,达到20%时脂质体的粒径显著增大。这可能是由于糖是一种极性物质,高浓度的糖会降低水的活度,从而导致脂质体的粒径发生改变[31]。

图10 糖对LSOPC纳米脂质体稳定性的影响Fig. 10 Effect of sugars on stability of LSOPC nanoliposome
2.9 防腐剂对LSOPC纳米脂质体稳定性的影响

图11 防腐剂对LSOPC纳米脂质体稳定性的影响Fig. 11 Effect of preservatives on stability of LSOPC nanoliposome
由图11可知,在实验考察的质量浓度范围内,随着苯甲酸钠和山梨酸钾的加入,LSOPC纳米脂质体的粒径几乎没有变化,这说明苯甲酸钠和山梨酸钾对脂质体的稳定性无显著影响。
2.1 0 LSOPC纳米脂质体的抗氧化能力
2.10.1 ABTS+·清除能力和铁还原能力
由图12A可知,制备初期的LSOPC纳米脂质体和同质量浓度LSOPC溶液的ABTS+·清除率IC50值分别为44.68、38.55 μg/mL,脂质体ABTS+·清除能力要低于LSOPC溶液。可能的原因是LSOPC包埋进脂质体后其供电子能力会受到磷脂双分子层的干扰,导致其清除ABTS+·能力下降[22]。但是在4 ℃避光环境中贮藏7 d后,两者的IC50值分别变为69.91、84.94 μg/mL。这说明,尽管包埋之后的LSOPC清除ABTS+·的能力没有提高,但是LSOPC的稳定性却显著的提高了。同样的,由图12B可知,在制备初期,相同质量浓度的LSOPC纳米脂质体和LSOPC溶液铁还原力相差不大。但是经过在4 ℃贮藏7 d后,LSOPC溶液的铁还原能力相对于脂质体显著地降低。

图12 LSOPC纳米脂质体和LSOPC溶液ABTS ·清除能力(A)和铁还原能力(B)Fig. 12 ABTS scavenging activity (A) and reduction power (B) of LSOPC nanoliposome and LSOPC solution
2.10.2 总抗氧化能力

图13 Trolox系列浓度标准溶液荧光衰减图Fig. 13 The attenuation curve of fluorescence intensity of Trolox series standard solution
ORAC法是目前国际上普遍采用的评价总抗氧化能力的方法。选择ORAC法对LSOPC纳米脂质体进行总抗氧化能力评价。Trolox系列标准溶液的荧光衰减图如13所示,以时间为横坐标,净面积为纵坐标,可以得到Trolox系列标准溶液标准曲线方程:y=0.429x+1.463 6(R2=0.995 3)。图14为不同质量浓度LSOPC纳米脂质体和LSOPC溶液在制备初期和在4 ℃贮藏7 d后的荧光衰减趋势图。由图14可知,两者都能明显延缓荧光物质被活性氧自由基猝灭的速度,而且质量浓度越高,荧光衰减的速度越慢,即总抗氧化能力越强。在制备初期,包埋于脂质体中的LSOPC相比于单独存在的LSOPC溶液有更强的抗氧化活性,其ORAC值分别为24 462.31、17 245.24 μmol TE/g(以水溶性VE当量计),这可能是由于大豆卵磷脂也发挥了一部分抗氧化能力。在4 ℃避光环境贮藏7 d后,两者的ORAC值变为21 592.97、11 703.36 μmol TE/g,分别降低了11.73%和32.14%,这说明LSOPC纳米脂质体不仅总抗氧化能力更强,而且稳定性更好。

图14 不同质量浓度的LSOPC溶液和LSOPC纳米脂质体荧光衰减图Fig. 14 Attenuation curves of fluorescence intensity of LSOPC nanoliposome and LSOPC solution
2.1 1 抗脂质过氧化能力

图15 LSOPC对Fe3+/VC诱导的脂质过氧化物产物丙二醛的影响Fig. 15 Effect of LSOPC on the inhibition of TBARS formation induced by Fe3+/VC
如图15所示,在Fe3+/VC诱导的脂质过氧化反应中,空白脂质体中TBARS增加了(103±2.39)%。随着LSOPC的加入,TBARS明显减少,这说明LSOPC的存在能有效的减少TBARS的形成。但是TBARS变化率与LSOPC的载量没有明显的剂量效应关系。
3 结 论
本研究在单因素试验结果的基础上,经正交试验优化,得到了LSOPC纳米脂质体制备的最佳条件:大豆卵磷脂-胆固醇质量比3∶1、LSOPC添加量0.33 mg/mL、吐温80添加量为16.7 mg/mL。确定了各因素对脂质体平均粒径影响的主次顺序:吐温80添加量>大豆卵磷脂-胆固醇质量比>LSOPC添加量。最终得到了粒径分布范围在10~100 nm之间,平均粒径为(35.57±0.08)nm的LSOPC纳米脂质体。当LSOPC的载量为1%时,脂质体有最高包埋率,为(71.97±0.42)%。研究还发现LSOPC纳米脂质体能提高LSOPC在弱碱(pH 7.4)环境中的稳定性。食品中常用的食品添加剂,如葡萄糖、蔗糖、防腐剂,对LSOPC纳米脂质体的稳定性影响较小,只有当葡萄糖、蔗糖的质量分数达到10%以上时,脂质体的粒径才会发生变化,而苯甲酸钠和山梨酸钾在所考察的质量浓度范围内对脂质体的稳定性没有显著性影响。不同金属离子对LSOPC纳米脂质体影响不同,Fe3+、Cu2+、Zn2+、Pb2+的加入对脂质体的粒径有明显的影响。通过抗氧化实验发现,LSOPC脂质体在制备初期清除ABTS+·和铁还原能力不如LSOPC。但是经过贮藏后,LSOPC溶液的抗氧化能力显著下降,脂质体的抗氧化能力明显高于LSOPC溶液。在ORAC法测总抗氧化能力实验中,无论是在制备初期还是经过贮藏后,脂质体的抗氧化能力都要优于LSOPC溶液。通过抗脂质过氧化实验发现LSOPC能够有效的减少TBARS的生成。
参考文献:
[1]肖俊松, 谢笔钧, 曹雁平, 等. 莲房原花色素的纯化分级和结构鉴定[J].食品科学, 2012, 33(19): 172-177.
[2]李肖朋, 隋勇, 关亚飞, 等. 莲原花青素低聚体对菜籽油抗氧化性的影响[J]. 华中农业大学学报, 2015, 34(1): 115-122. DOI:10.13300/j.cnki.hnlkxb.2015.01.019.
[3]XIAO J S, XIE B J, SUN Z D, et al. Characterization of oligomeric procyanidins and identification of quercetin glucuronide from lotus(Nelumbo nucifera Gaertn.) seedpod[J]. Journal of Agricultural and Food Chemistry, 2012, 60(11): 2825-2829. DOI:10.1021/jf205331e.
[4]KIM M J, SHIN H S. Antioxidative effect of lotus seed and seedpod extracts[J]. Food Science Biotechnology, 2012, 21(6): 1761-1766.DOI:10.1007/s10068-012-0234-7.
[5]DUAN Y Q, ZHANG H, XIE B J, et al. Whole body radioprotective activity of an acetone-water extract from the seedpod of Nelumbo nucifera Geartn. seedpod[J]. Food and Chemical Toxicology, 2010,48(12): 3374-3384. DOI:10.1016/j.fct.2010.09.008.
[6]LI X P, SUI Y, LI S Y, et al. A-type procyanidins from litchi pericarp ameliorate hyperglycaemia by regulating hepatic and muscle glucose metabolism in streptozotocin (STZ)-induced diabetic mice fed with high fat diet[J]. Journal of Functional Foods, 2016, 27: 711-722.DOI:10.1016/j.jff.2016.08.010.
[7]XU J Q, RONG S, XIE B J, et al. Rejuvenation of antioxidant and cholinergic systems contributes to the effect of procyanidins extracted from the lotus seedpod ameliorating memory impairment in cognitively impaired aged rats[J]. European Neuropsychop Harmacology, 2009,19(12): 851-860. DOI:10.1016/j.fct.2010.09.008.
[8]KOLECKAR V, KUBIKOVA K, REHAKOVA Z, et al. Condensed and hydrolysable tannins as antioxidants influencing the health[J].Mini Reviews in Medicinal Chemistry, 2008, 8(5): 436-437.DOI:10.2174/138955708784223486.
[9]WU Q, CHEN H, LV Z, et al. Oligomeric procyanidins of lotus seedpod inhibits the formation of advanced glycation end-products by scavenging reactive carbonyls[J]. Food Chemistry, 2013, 138(2):1493-1502. DOI:10.1016/j.foodchem.2012.10.111.
[10]汪志慧, 孙智达, 谢笔钧. 莲房原花青素的稳定性及热降解动力学研究[J]. 食品科学, 2011, 32(7): 77-82.
[11]MCCLEMENTS D J. Design of nano-laminated coatings to control bioavailability of lipophilic food components[J]. Food Science, 2010,75(1): 30-42. DOI:10.1111/j.1750-3841.2009.01452.x.
[12]GONG K J, SHI A M, LIU H Z, et al. Preparation of nanoliposome loaded with peanutpeptide fraction: stability and bioavailability[J].Food & Function, 2016, 7(4): 2034-2042. DOI:10.1039/c5fo01612f.
[13]EDWARDS K A, BAEUMMER A J. Analysis of liposomes[J]. Talanta,2006, 68(5): 1432-1441. DOI:10.1016/j.talanta.2005.08.031.
[14]胡博, 姚薇薇, 刘宁. 原花青素脂质体的制备条件优化[J]. 东北农业大学学报, 2010, 41(9): 106-111. DOI:10.3969/j.issn.1005-9369.2010.09.020.
[15]TAN C, XUE J, FENG B, et al. Liposome as a delivery system for carotenoids: comparative antioxidant activity of carotenoids as measured by ferric reducing antioxidant power, DPPH assay and lipid peroxidation[J]. Journal of Agricultural & Food Chemistry, 2014,62(28): 6726-6735. DOI:10.1021/jf405622f.
[16]WU Q, LI S Y, YANG T, et al. Inhibitory effect of lotus seedpod oligomeric procyanidins on advanced glycation end product formation in a lactose-lysine model system[J]. Electronic Journal of Biotechnology, 2015, 18(2): 68-76. DOI:10.1016/j.ejbt.2014.10.005.
[17]LUO X B, GUAN R F, CHEN X, et al. Optimization on condition of epigallocatechin-3-gallate (EGCG) nanoliposomes by response surface methodology and cellular uptake studiesin Caco-2 cells[J]. Nanoscale Research Letters, 2014, 9(1): 291. DOI:10.1186/1556-276X-9-291.
[18]谭晨. 类胡萝卜素脂质体的研究[D]. 无锡: 江南大学, 2015: 36-46.
[19]WU Z P, GUAN R F, LYU F, et al. Optimization of preparation conditions for lysozyme nanoliposomes using response surface methodology and evaluation of their stability[J]. Molecules, 2016,21(6): 741. DOI:10.3390/molecules21060741.
[20]XIA S Q, XU S Y, ZHANG X M. Optimization in the preparation of coenzyme Q10 nanoliposomes[J]. Journal of Agricultural and Food Chemistry, 2006, 54(17): 6358-6366. DOI:10.1021/jf060405o.
[21]CRISTIAN M B P, ADRIANO B. Antimicrobial activity of nanoliposomes co-encapsulating nisin and garlic extract against Grampositive and Gram-negative bacteria in milk[J]. Innovative Food Science and Emerging Technologies, 2016, 36: 287-293. DOI:10.1016/j.ifset.2016.07.017.
[22]邹立强. 多酚脂质体的物化稳定性及生理活性研究[D]. 南昌: 南昌大学, 2015: 14-28.
[23]朱芸, 刘金荣, 成玉怀, 等. 新疆西伯利亚白刺果红色素稳定性的研究[J]. 食品科学, 2008, 29(3): 113-115. DOI:10.3321/j.issn:1002-6630.2008.03.017.
[24]李颖畅, 孟宪军, 周艳, 等. 金属离子和食品添加剂对蓝莓花色苷稳定性的影响[J]. 食品科学, 2009, 30(9): 80-84. DOI:10.3321/j.issn:1002-6630.2009.09.019.
[25]曹伙旺, 曾秋平, 劳永民, 等. 食品添加剂对荔枝果皮花色素苷稳定性影响的研究[J]. 食品科学, 2006, 27(5): 1552-1556. DOI:10.3321/j.issn:1002-6630.2006.05.031.
[26]ZENG W C, ZHANG Z, GAO H, et al. Chemical composition,antioxidant, and antimicrobial activities of essential oil from pine needle (Cedrus deodara)[J]. Journal of Food Science, 2012, 77(7):824-829. DOI:10.1111/j.1750-3841.2012.02767.x.
[27]XIA S, XU S, ZHANG X, et al. Effect of coenzyme Q(10)incorporation on the characteristics of nanoliposomes[J]. The Journal of Physical Chemistry B, 2007, 111(9): 2200-2207. DOI:10.1021/jp066130x.
[28]HUANG D J, OU B, HAMPSCH-WOODILL M, et al. Highthroughput assay of oxygen radical absorbance capacity (ORAC)using a multichannel liquid handing system coupled with a microplate fluorescence reader in 96-well format[J]. Journal of Agricultural and Food Chemistry, 2002, 50(16): 4437-4444. DOI:10.1021/jf0201529.
[29]OU B, HAMPSCH-WOODILL M, PRIOR R L, et al. Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe[J]. Journal of Agricultural and Food Chemistry, 2001, 49(10): 4619-4626.DOI:10.1021/jf010586o.
[30]续洁琨, 姚新生, 栗原博. 抗氧化能力指数(ORAC)测定原理及应用[J]. 中国药理学通报, 2006, 22(8): 1015-1021. DOI:10.3321/j.issn:1001-1978.2006.08.029.
[31]郑卫东, 阴文姬, 王光慈, 等. 添加物对食品乳状液稳定性的影响[J].食品科学, 2000, 21(4): 26-28. DOI:10.3321/j.issn:1002-6630.2000.04.006.

