坛装黄酒贮存过程中污染微生物的分离鉴定
李 慧,陈历水*,刘 洋,何 景,刘 蕾,张连慧,杨海莺
(中粮营养健康研究院 老年营养食品研究北京市工程实验室,北京 102209)
黄酒是以稻米、黍米等为主要原料,经蒸煮、加曲、糖化、发酵、压榨、过滤、煎酒、贮存、勾兑而成的酿造酒。酿造黄酒煎酒灌坛后,要经过一定时间的贮存,以增加香气和提高酒的醇厚感、协调性和增加酒体的稳定性[1]。
由于黄酒是多菌种参与的开放式酿造低度酒,富含营养物质和氨基酸,是微生物的良好培养基,因此,贮存期成为了污染微生物繁殖的最佳时期[2]。尤其在黄酒生产过程中,生产工具及贮藏容器消毒不过关,生产原料、生产用水微生物污染,煎酒工艺处理不彻底,贮藏环境控制不严格,贮藏时发生漏坛等都可以造成污染菌的引入[3-4]。
造成黄酒陈酿变质的污染微生物,包括芽孢菌、霉菌、酵母、乳酸菌及其他细菌[5],这些污染菌对黄酒的品质及安全将会造成严重影响。谢广发等[6]对酸败袋装黄酒中污染微生物进行检测和分析,确认污染菌主要有假单胞菌属,占总克隆数的92.3%,其次为无色杆菌属,占总克隆数的7.7%。TERASAKI M等[7]也在日本清酒中分离出假单胞菌属细菌。章银珠等[8]从变质传统发酵陈化黄酒中分离了5株乳酸杆菌,4株酵母(分别是酵母属、汉逊氏酵母属、球拟酵母属和毕赤酵母属)和4株霉菌(分别是1株曲霉、2株青霉和1株侧孢霉),这些微生物是引起陈化黄酒变质的主要原因。KIM S A等[9]在韩国米酒中分离出蜡样芽孢杆菌,认为污染了这种条件致病菌的米酒具有潜在的食品安全风险。章志超等[10]利用形态学观察、生理生化和分子生物学手段从酸败黄酒中分离出食果糖乳杆菌,为评估黄酒酸败严重程度及解决相关食品安全问题提供了参考方法。
本研究针对性的选择并优化分离条件,采用形态学观察、生理生化鉴定和分子生物学法对分离纯化的污染微生物进行菌种鉴定,以期为有效控制或者降低坛酒霉变的概率提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
黄酒及黄酒污染物样品:浙江某酒厂仓库贮藏坛酒(坛外表面有明显污染)。
1.1.2 培养基
马铃薯-葡萄糖琼脂(potato dextrose agar,PDA)培养基、孟加拉红琼脂培养基、察氏培养基、营养琼脂、MRS培养基、MC培养基、革兰氏染色液、细菌芽孢染色液:北京陆桥技术有限责任公司。
1.1.3 化学试剂
酵母基因组脱氧核糖核酸(deoxyribonucleicacid,DNA)提取试剂盒(DP307)、细菌基因组DNA提取试剂盒(DP302)、聚合酶链式反应(polymerase chain reaction,PCR)产物纯化试剂盒:天根生化科技有限公司;脱氧核糖核苷三磷酸deoxy-ribonucleoside triphosphate,dNTP)、Taq酶(5 U/μL)及Buffer:宝生物工程(大连)有限公司;引物:英潍捷基上海贸易有限公司合成;VITEC GN卡、GP卡、YST卡、API 50 CHB/E试剂盒:法国梅里埃公司。
1.2 仪器与设备
IPP260低温培养箱:德国Memmert公司;ATBTM New ATB自动微生物鉴定系统、VITEK 2 Compact全自动微生物生化鉴定系统:法国梅里埃公司;Scope A1正置相差显微镜:德国ZEISS公司;SQ510C立式压力蒸汽灭菌器:日本YAMATO公司;Mini-Beadbeater-16研磨珠均质器:美国Biospec公司;Veriti梯度PCR仪:美国LifeTechnologies公司;Nano Drop 2000超微量分光光度计:美国Thermo Fisher公司;XR System凝胶成像系统:美国Bio-Rad公司。
1.3 实验方法
1.3.1 污染菌种的分离和纯化
将黄酒10倍梯度稀释至10-6。另取坛底沉淀物25 g,置于盛有225 mL磷酸盐缓冲液的无菌均质袋中,拍击式均质器拍打1~2 min,制成1∶10的样品匀液,然后将此样品进行10倍梯度稀释至10-6。取各梯度稀释样品匀液1 mL于无菌平板中,将15~20 mL冷却至46℃的孟加拉红琼脂培养基、营养琼脂、MRS培养基、MC培养基倾注平皿,并转动平皿使其混合均匀。
孟加拉红琼脂培养基倒置于28℃恒温培养箱中需氧培养3~5d。营养琼脂、MRS培养基、MC培养基倒置于37℃恒温培养箱中分别需氧和厌氧培养2~3 d。根据菌落生长形态,大小及颜色的不同,挑选不同的单菌落接种于相应的固体培养基中进行纯化,直至得到单一微生物。
1.3.2 形态学观察
将分离得到的细菌分别在营养琼脂、MRS琼脂、MC琼脂上进行划线,于37℃条件下需氧和厌氧培养24 h后观察菌落生长情况及菌落形态,通过革兰氏染色、显微镜观察菌体形态。将分离得到的真菌在PDA培养基、察氏培养基上三点接种,于28℃条件下培养3~5 d后观察菌落生长情况及菌落形态并镜检。
1.3.3 生理生化鉴定
细菌:挑取平板的单菌落,使用法国生物梅里埃公司VITECGN卡、GP卡,芽孢菌鉴定使用API50 CHB/E进行直接鉴定。
真菌:酵母样真菌使用法国生物梅里埃公司YST卡进行鉴定。
1.3.4 分子生物学鉴定
(1)细菌的分子生物学鉴定
挑取细菌平板和乳酸菌平板上的单菌落分别接种于营养肉汤培养基和MRS培养基中,37℃过夜。取1 mL菌液12000r/min离心10min后,弃去上清,按照细菌基因组DNA提取试剂盒提取基因组的说明书规定操作,所得的基因组用超微量紫外分光光度计检测浓度和纯度。
16S rDNA序列扩增所用引物,正向引物为27F:5′-AG AGCCTGGCTCAGTTTGAT-3′;反向引物为1492R:5′-GG TTACCTTGTTACGACTT-3′[11-12]。
PCR反应体系(30μL):ddH2O 19.2μL、10×Buffer3 μL、dNTPs 2.5 μL、引物各1.5 μL、Taq酶0.3 μL、所提取的基因组2 μL。PCR反应条件:95℃预变性10 min;95℃变性30 s,58℃退火30s,72℃延伸30s,35个循环;72℃再延伸10min。PCR产物进行琼脂糖凝胶(1%)电泳检测。
将电泳检测后的PCR产物送至英潍捷基上海贸易有限公司进行测序,获得16S rRNA基因序列。测序结果在美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)分析比对。
(2)真菌的分子生物学鉴定
挑取丝状真菌平板上的菌丝于20 mL的PDA液体培养基,在28℃恒温摇床中200 r/min振荡培养3 d。12 000 r/min离心10 min后,弃去上清,按照酵母基因组DNA提取试剂盒提取基因组的说明书规定操作,所得的基因组用超微量紫外分光光度计检测浓度和纯度。
扩增所用引物序列参照李慧等[13-14]的研究(见表1)。PCR反应体系和PCR反应条件同方法1.3.4,PCR产物进行琼脂糖凝胶电泳检测。

表1 真菌基因扩增引物序列Table 1 Primer sequence of fungi gene amplification
将电泳检测后的PCR产物送至英潍捷基上海贸易有限公司进行测序,获得18S rRNA和ITS基因序列。测序结果在NCBI的GenBank中进行BLAST分析比对。
2 结果与分析
2.1 细菌的鉴定
2.1.1 细菌的菌落及菌体形态分析
通过对污染黄酒及其沉淀物中的细菌进行分离、简单形态学比对后得到3株不同形态的细菌,依次编号为B001、B002和B003。其中菌株B001和B002在营养琼脂培养基上(36±1)℃需氧培养48 h后,菌株B001的菌落形态和细胞形态分别见图1中的001-1、001-2,菌落呈乳白色、圆形、扁平、不透明、边缘不整齐,有芽孢,芽孢椭圆形;菌株B002的菌落形态和细胞形态见图1中的002-1、002-2,培养24 h时,菌落蓝绿色圆形,培养48 h后为乳白色,扁平,不透明,边缘不整齐,革兰氏染色呈阴性,杆状。菌株B003在MRS培养基上,(36±1)℃厌氧培养48 h后,菌落形态和细胞形态见图1中的003-1、003-2,菌落呈圆形、白色、凸起,表面光滑、湿润,边缘整齐,革兰氏染色呈阳性,球状。
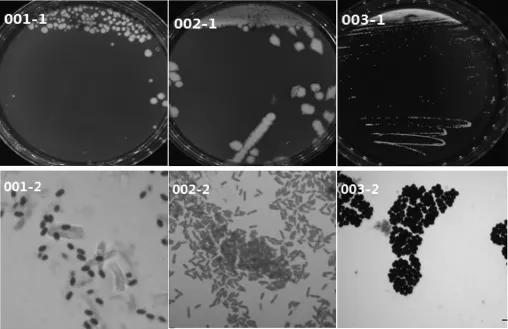
图1 细菌的菌落及细胞形态Fig.1 Colonies and cell morphology of bacteria
2.1.2 细菌的生理生化鉴定结果
利用法国梅里埃VITEK微生物鉴定系统及API鉴定系统对菌株B001、B002和B003的生理生化特征进行鉴定,并与数据库结果进行比对。其中菌株B001的生理生化鉴定结果见表2。由表2可知,菌株B001生理生化鉴定试验结果为解淀粉芽孢杆菌(Bacillus amyloliquefaciens),鉴定百分率为88%。

表2 菌株B001的生理生化鉴定试验结果Table 2 Results of physiological and biochemical identification tests of strain B001

续表
菌株B002的生理生化鉴定结果见表3。由表3可知,菌株B002可初步鉴定为铜绿假单胞菌(Pseudomonasaeruginosa),鉴定百分率为97%。

表3 菌株B002的生理生化鉴定试验结果Table 3 Results of physiological and biochemical identification tests of strain B002
菌株B003的生理生化鉴定结果见表4。由表4可知,B003号菌生化鉴定试验结果为假肠膜明串珠菌(Leuconostoc pseudomesenteroides),鉴定百分率为83%。

表4 菌株B003的生理生化鉴定试验结果Table 4 Results of physiological and biochemical identification tests of strain B003
2.1.3 细菌分子生物学鉴定
将菌株B001、B002、B003的16S rRNA基因序列与Gen-Bank内已知菌株的相应序列进行比对,结果表明,3株菌分别与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)的序列相似度达99%;与铜绿假单胞菌(Pseudomonas aeruginosa)的序列相似度达99%;与假肠膜明串珠菌(Leuconostoc pseudomesenteroides)的序列相似度达99%。
通过形态观察、生理生化试验并结合分子生物学鉴定菌株B001、B002、B003分别为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、铜绿假单胞菌(Pseudomonasaeruginosa)、假肠膜明串珠菌(Leuconostoc pseudomesenteroides)。芽孢杆菌和假肠膜明串珠菌(Leuconostoc pseudomesenteroides)是糖化发酵曲中的菌,芽孢杆菌属的细菌是麦曲中最主要的优势菌,明串珠菌为兼性厌氧菌,是仅次于芽孢杆菌的最主要优势菌,该类菌更适合在低氧压下生长,这与TERASAKI M等[7,15]的研究结果一致。本研究从污染黄酒中还分离出铜绿假单胞菌(Pseudomonasaeruginosa),该属污染菌可从原料、酿造水或环境中引入,尤其是酿造和生产用水[16],这种污染菌会对酒的品质、风味和安全造成影响,需严格控制,谢广发等[6]采用分子生物学手段分析袋装污染黄酒时,也发现主要污染菌是假单胞菌属细菌。
2.2 真菌的鉴定
2.2.1 真菌的菌落、细胞形态观察结果
从黄酒和污染物中分离、纯化得到3株真菌,依次编号为F004、F005和F006。3株真菌在PDA培养基上(28±1)℃需氧培养3~5 d,菌株F004的菌落和细胞形态结果分别见图2中的4-1、4-2,菌落乳白色、湿润、质地均匀、菌体单细胞,腊肠形。菌株F005的菌落和细胞形态分别见图2中的5-1、5-2,菌落平坦,橄榄灰色,有辐射纹,菌丝有分支,孢子椭圆形。菌株F006的菌落和细胞形态分别见图2中的6-1、6-2,菌平坦,丝绒状,落英粉色,闭囊壳球形,子囊孢子圆形,具有典型的红曲菌形态特征。
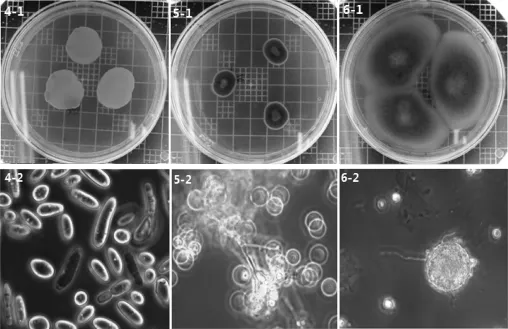
图2 真菌的菌落及细胞形态Fig.2 Colonies and cell morphology of fungi
菌株F004的生化鉴定结果见表5。由表5可知,菌株F004的生化鉴定试验结果为头状螺旋地霉(Saprochaetecapitate),鉴定百分率为92%。

表5 菌株F004的生理生化鉴定实验结果Table 5 Results of physiological and biochemical identification tests of strain F004

续表
2.2.2 分子生物学鉴定
为了进一步确定真菌鉴定结果,将菌株F004的18SrRNA基因序列与GenBank内已知菌株头状螺旋地霉(Saprochaete capitate)的序列进行对比,结果表明二者相似度达98%,结合生理生化反应及形态学分析,将该菌株鉴定为头状螺旋地霉(Saprochaete capitate)。Saprochaetecapitate是本研究首次从黄酒中分离到的污染真菌,之前相关报道仅在乳制品中分离鉴定出该污染菌[17]。
分别将菌株F005及菌株F006测序结果在NCBI数据库中进行ITS序列同源性比较,选取同源性≥99%的菌株序列,运用Mega 6.0软件构建系统发育树,结果见图3。由图3可知,菌株F005为爪哇正青霉(Eupenicillium javanicum)。菌株F006与紫红曲菌(Monascus purpureus)、红色红曲菌(Monascus ruber)及烟色红曲菌(Monascus fuliginosus)亲缘关系比较接近,结合形态学分析,菌株F006很有可能是紫红曲菌或红色红曲菌。由于黄酒酿造生产中会使用红曲作为糖化发酵菌种,本研究将不再对这株菌进行更为深入的鉴定分析。
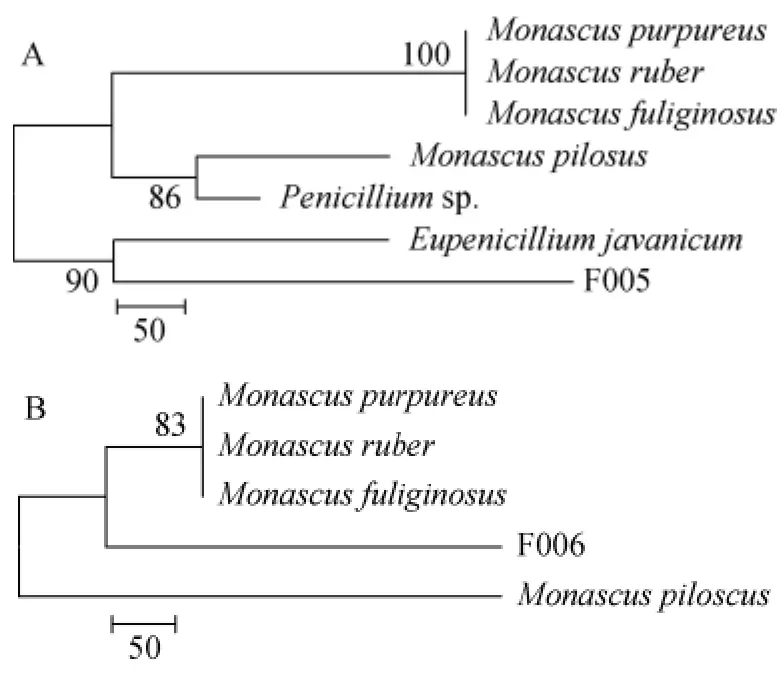
图3 菌株F005(A)及F006(B)的16S rDNA序列的系统发育树Fig.3 Phylogenetic tree of 16S rDNA sequences of strain F005(A)and strain F006(B)
3 结论
黄酒酿造后,一段时间的贮存是提升品质、协调风味的必要途径,但同时黄酒因含有丰富的营养物质,成了部分微生物的良好培养基而容易被污染。在条件控制不当的情况下,引入的污染微生物会严重影响黄酒的稳定性及品质,造成巨大的经济损失甚至食品安全危害[18]。
本研究利用梯度稀释法和划线纯化法对坛装贮存黄酒关键污染微生物进行了分离纯化,得到编号为B001、B002、B003的3株细菌和编号为F004、F005、F006的3株真菌。结合形态学特征观察、生理生化鉴定和分子生物学鉴定的方法对分离得到的菌株进行鉴定,鉴定菌株B001、B002、B003分别为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、铜绿假单胞菌(Pseudomonasaeruginosa)和假肠膜明串珠菌(Leuconostocpseudomesenteroides),菌株F004、F005分别为头状螺旋地霉(Saprochaete capitate)、爪哇正青霉(Eupenicillium javanicum),菌株F006具有紫红曲菌(Monascus purpureus)、红色红曲菌(Monascus ruber)的形态特征,这为后期对这些菌株的控制提供了理论依据。
[1]谢广发.黄酒酿造技术[M].北京:中国轻工出版社,2010:5-10.
[2]康明官.黄酒和清酒生产问答[M].北京:中国轻工出版社,2003:224-279.
[3]谢广发.黄酒酿造新思路[M].北京:中国轻工出版社,2010:15-28.
[4]刘 程,谢广发,孙剑秋,等.我国黄酒酿造微生物的研究进展[J].食品工业科技,2016,37(8):374-380.
[5]刘文容,陈 双,徐 岩.黄酒贮存酸败关键微生物的分离鉴定[J].微生物学通报,2018,45(1):120-128.
[6]谢广发,陈建尧,李旺军,等.酸败袋装黄酒中污染微生物的检测[J].中国酿造,2008,27(12):78-80.
[7]TERASAKI M,FUKUYAMA A,TAKAHASHI Y,et al.Bacterial DNA detected in Japanese rice wine and the fermentation starters[J].Curr Microbiol,2017,74:1432-1437.
[8]章银珠,姚卫蓉.变质传统发酵陈化黄酒微生物的分离和鉴定[J].中国酿造,2008,27(21):62-66.
[9]KIM S A,YUN S J,JEON S H,et al.Microbial composition of turbid rice wine(Makgeolli)at different stage of production in a real processing line[J].Food Control,2015,53:1-8.
[10]章志超,吴 鑫,朱应飞.导致黄酒酸败的食果糖乳杆菌的分离、鉴定及其检测条件优化[J].食品科学,2017,38(3):42-46.
[11]沈敏佳,陆筑凤,刘 颖,等.氨基甲酸乙酯降解酶的基因克隆[J].中国酿造,2014,33(1):56-59.
[12]CHIN H S,FRED B,FLEMING H P,et al.Identifications of predominant bacterial isolates from the fermenting Kinchi using ITS-PCR and partial 16S rDNA sequence analyses[J].Microbiol Biotechnol,2001,16(1):68-76.
[13]李 慧,胡梦龙,蔡 军,等.小麦粉污染霉菌的分离鉴定及产黄曲霉毒素能力的研究[J].食品安全质量检测学报,2015,6(9):3447-3452.
[14]KUMEDA Y,ASAO T.Single-strand conformation polymorphism analysis of PCR-amplified ribosomal DNA internal transcribed spacers to differentiate species ofAspergillussection Flavi[J].Appl Environ Microbiol,1996,62(8):2947-2952.
[15]刘芸雅,毛 健,孟祥勇,等.绍兴黄酒麦曲及发酵过程中细菌群落结构分析[J].中国食品学报,2017,17(1):201-208.
[16]COROLER L,ELOMARI M,HOSTE B,et al.Pseudomonas rhodesiaesp.nov.,a new species isolated from natural mineral waters[J].Syst Appl Microbiol,1996,19(4):600-607.
[17]IVANNAH P,STEPHANIE G,JEAN-PAUL V,et al.Safety assessment of dairy microorganisms:Geotrichum candidum[J].Int J Food Microbiol,2008,126(3):327-332.
[18]张遐耘.袋装黄酒中杂菌的检测[J].中国酿造,2002,21(5):27-28.

