猪繁殖与呼吸综合征病毒Nsp9基因第642位氨基酸突变对病毒复制的影响
李华玮,姬鹏超,王永芬,赵绪永,何 健,赵孟孟
(1.河南牧业经济学院生物工程学院,河南 郑州 450046;2.河南农业大学牧医工程学院,河南 郑州 450002)
猪繁殖与呼吸综合征(PRRS)是一种造成母猪流产、死胎、仔猪呼吸道感染等死亡率较高的疾病,该病的病原是猪繁殖与呼吸综合症病毒(PRRSV)。该病1987年首次在美国报道,随后世界蔓延,我国在1996年报道该病[1],2006年暴发,致大量猪群死亡,2015年又出现新的亚型[2]。对于该种传染病一直未有有效的药物和疫苗。
该病毒的非结构蛋白Nsp9蛋白是主要编码RNA依赖的RNA聚合酶的功能蛋白,该蛋白仅在病毒复制时出现,对诊断灭活苗与弱毒苗具有重要意义[3-5]。之前有文献报道Nsp9基因与病毒毒力相关,并且该基因上存在T细胞和B细胞表位[6-8],与病毒抗利巴韦林耐药性相关[9],Nsp9基因与宿主多种蛋白互相作用促进病毒复制[10-13],并且将弱毒株Ch-1R的Nsp9基因替换到强毒株XH-GD的感染性克隆上,可提高其亲本毒株的滴度[14]。
研究结果表明,强弱毒株的Nsp9基因之间存在12个氨基酸突变[15],究竟是哪一个氨基酸与病毒复制相关尚未可知。本研究在之前构建的PRRSV的XH-GD感染性克隆基础上,通过融合PCR方法设计突变质粒,使Nsp9蛋白第642位氨基酸由组氨酸突变为酪氨酸,其中感染性克隆骨架为强毒株XH-GD,该毒株第642位氨基酸为组氨酸。2006年之前的弱毒株的Nsp9基因第642位氨基酸为酪氨酸。本研究的目的是探索Nsp9基因第642位氨基酸突变之后对病毒复制的影响。结果表明,突变之后病毒滴度未有显著变化,第642位氨基酸不是决定病毒滴度的关键氨基酸,与Nsp9基因转录有关。
1 材料与方法
1.1细胞、菌株和载体 BHK细胞、Marc-145细胞、含有PRRSV XH-GD骨架的感染性克隆pOKA2BCD为农业部兽用疫苗创制重点实验室保存;大肠杆菌JM109感受态细胞,购自宝生物工程(大连)有限公司。
1.2主要试剂与仪器 DMEM以及2xMEM胎牛血清,购自GIBCO公司;AclⅠ、NheⅠ内切酶,购自Thermo Scientific公司;Platinum pfx DNA聚合酶、TRIZol®Reagent,购自 Invitrogen公司;Cy3标记的山羊抗鼠二抗,购自博奥森生物科技有限公司;N蛋白单抗,购自美国VMRD公司;M-MLV反转录试剂盒和荧光定量试剂盒,购自宝生物工程(大连)有限公司。荧光定量仪器,购自美国ABI公司。
1.3突变质粒的构建
1.3.1含有突变位点的引物设计 利用Oigo6设计突变氨基酸Y到H的两对引物,其中第一对扩增A片段上游引物AF序列为5′-TGACTGCCAAAGAACTGGAGAAAC-3′,下游引物AR序列为5′-CTCAGGATTGGACCTGAGTTTTTCCCACATGGA-3′;第二对扩增 B片段上游引物 BF序列为 5′-TCCATGTGGGAAAAACTCAGGTCCAATCCTGAG-3′,下游引物 BR序列为5′-AGATGTTCTGCCCGAACCTCC-3′,该引物由上海生工生物工程技术服务有限公司合成。
1.3.2PCR扩增 分别以 pOK-A2BCD质粒为模板,以AF和AR为引物扩增A片段,以BF和BR为引物扩增B片段,用DNA纯化试剂盒E.Z.N.A.TM Gel Extraction Kit对 PCR 产物进行回收纯化,再以回收的纯化产物为模板,以AF和BR为引物扩增得到目的片段,用 DNA纯化试剂盒E.Z.N.A.TM Gel Extraction Kit对 PCR 产物进行回收纯化。
1.3.3目的片段的酶切与连接 将纯化的目的片段进行AclⅠ、NheⅠ双酶切,酶切之后回收,与酶切过的载体连接,4℃过夜,转到到大肠杆菌JM109感受态细胞中,筛选阳性菌,37℃过夜摇菌,提取质粒。
1.4病毒的拯救 将含有病毒全长的感染性克隆质粒转染BHK细胞,参照Lipofectamine 2000说明书。24 h之后收获细胞,反复冻融,命名为P0。将冻融后的细胞离心,用上清感染长满单层的Marc-145细胞,用血清含量为2%DMEM维持液孵育细胞,48 h之后观察细胞病变,如有病变,参照同样的方法继续往下传代,命名为XH-GD-Y642H,代次为P1-P3代。
1.5拯救病毒的PCR鉴定 为了验证观测细胞病变非污染亲本毒,引入沉默突变FseⅠ酶切位点来进行鉴定,在两侧设计引物进行测定,引物序列:Det-F:5′-CTGAGCTTGGGGTGCTG-3′;Det-R:5′-ATGGCGAATTTCTTTGTACTG-3′。 RNA 提取参照TRIZol®Reagent RNA提取试剂的使用说明书操作,反转录参照M-MLV反转录酶说明书。将得到的PCR纯化产物送至上海生工生物工程技术服务有限公司测序。
1.6拯救病毒的间接免疫荧光鉴定 将拯救病毒第三代以MOI=1的剂量接种Marc-145细胞,感染之后24 h多聚甲醛固定30 min,之后以PRRSV N蛋白单抗为一抗在37℃孵育1 h,PBS清洗3次,之后以1∶200稀释的cy3标记的山羊抗鼠二抗室温孵育1 d,最后PBS清洗3次,在荧光显微镜下观察红色荧光。
1.7拯救病毒的TCID50测定 测定rXH-GD-642第3代病毒和亲本毒rXH-GD第3代病毒的滴度。
操作步骤:用rXH-GD-642第3代病毒和亲本毒rXH-GD第3代病毒,以MOI=1的剂量感染Marc-145和PAM细胞,分别在48 h采集上清液。采集上清液之后加入等量的含2%胎牛血清的维持液,将取出的样品进行TCID50测定。
1.8荧光定量测定Nsp9转录水平 将前述2种病毒以MOI=1的剂量感染Marc-145细胞,24 h采集细胞,提取RNA,反转录,以Nsp9引物进行荧光定量PCR,内参为GAPDH,具体参照文献[16]。
1.9噬斑试验 将拯救出来的病毒第3代倍比稀释,感染Marc-145细胞,1 h之后加入终浓度2%胎牛血清和1%琼脂糖的MEM营养液,48 h后,0.5%结晶紫染色液染色。
1.10数据分析 TCID50结果采用GraphPad Prism软件进行分析,P<0.05视为差异显著。
2 结果与分析
2.1含有突变位点质粒的构建 以感染性克隆模板质粒为模板进行融合 PCR扩增,分别得到了1 500 bp和600 bp左右的A片段和B片段,以上回收的PCR为模板,重新进行新的扩增得到含有突变位点的PCR片段,将该PCR片段进行回收,AclⅠ、NheⅠ双酶切之后连接之前酶切过的感染性克隆产物,转化之后进行菌液PCR鉴定阳性质粒。将阳性菌液送公司测序,测序结果与预期一致,表明质粒构建正确,如图1所示。
图1 突变位点峰
2.2替换病毒的拯救与鉴定 转染之后接种Marc-145细胞,第一代即出现细胞病变,已稳定传至第3代。用鉴别引物进行扩增,得到目的片段,结果见图2。测序结果表明,仍具有引入的沉默突变,非污染亲本毒。
间接免疫荧光试验结果,可见在两种拯救病毒感染的细胞上均有红色可见荧光,进一步表明病毒拯救成功,结果见图3。
图2 菌液PCR扩增
2.3拯救病毒的生物学特性 用MOI=1的剂量接种拯救病毒XH-GD-Y642H或亲本毒XHGD感染Marc-145细胞和PAM细胞48 h,收集上清进行 TCID50测定。结果表明,rXH-GD-
图3 两种拯救病毒免疫荧光实验结果
Y642H和rXH-GD的滴度差异不明显,结果见图4和图5。
图4 两种病毒在Marc-145细胞上的滴度变化
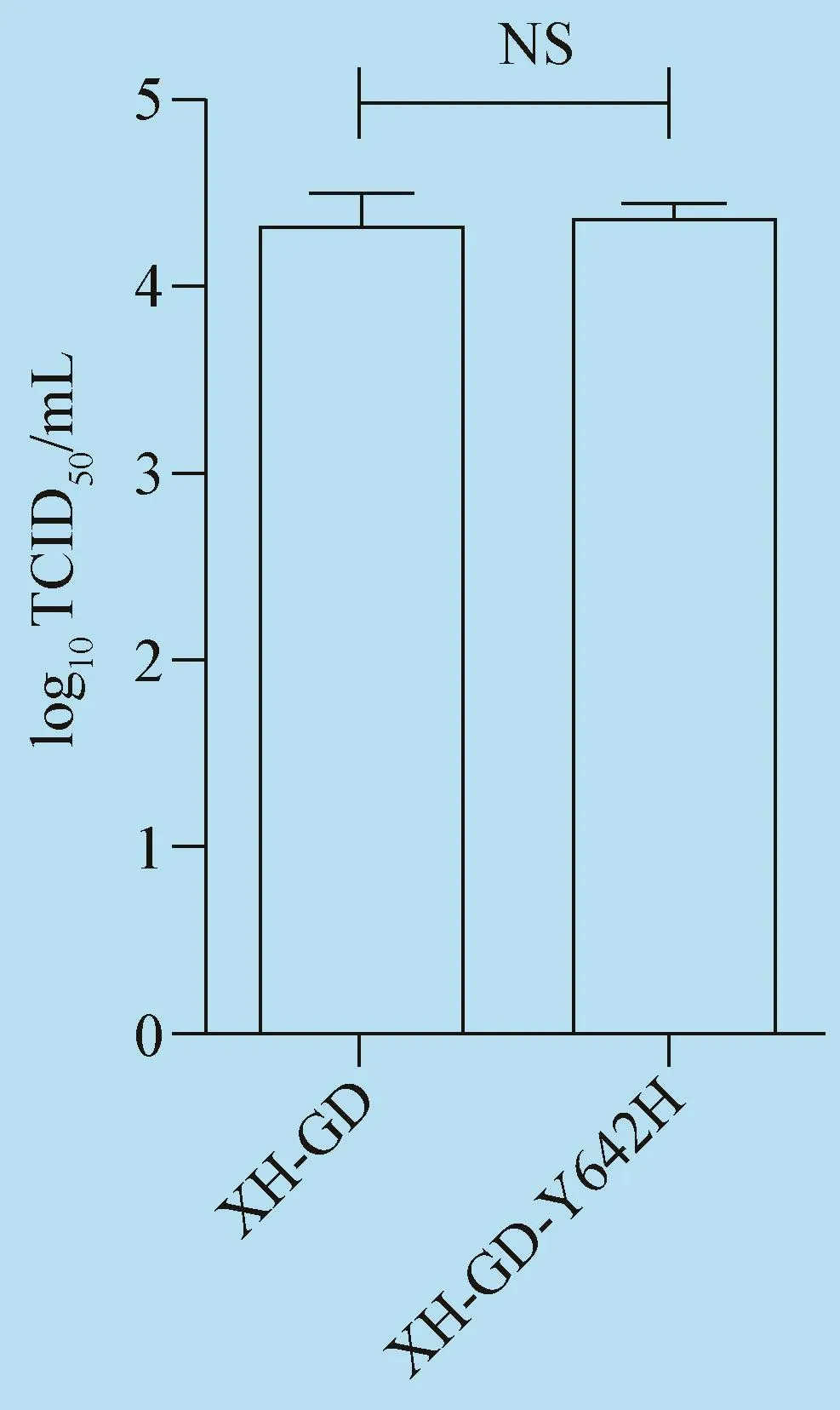
图5 两种病毒在PAM的滴度变化
2.4噬斑试验结果 噬斑试验结果表明,突变之后的病毒噬斑大小与原病毒相比差异不大,见图6。
图6 两种病毒的噬斑大小
2.5Nsp9转录水平 在病毒感染细胞24 h之后,采集样品进行Nsp9相对表达量的测定,结果表明,突变之后病毒Nsp9的mRNA水平有所下降,差异显著,见图7。
图7 两种病毒的转录水平比较
3 讨论
之前的研究结果表明Nsp9主要定位在细胞质,病毒感染会引起该蛋白向细胞核内转移,并且表达量逐步升高,强弱毒株存在12个氨基酸突变,将弱毒Nsp9替换到强毒感染性克隆上可以提高病毒滴度。基于此项结论,将强毒株的突变位点组氨酸,替换为弱毒株的位点酪氨酸,经过病毒拯救之后发现,病毒滴度没有发生明显升高,推测病毒的滴度与第642位氨基酸无显著关系。本试验采用的感染性克隆第642位点初始为组氨酸,突变为弱毒株的酪氨酸,至于突变为其他氨基酸是否会影响病毒的滴度和病毒的复制还需要进一步的试验验证。本试验结果表明,突变之后病毒粒子的噬斑大小未发生变化,病毒Nsp9基因的转录水平有所下降,分析其原因是由于突变之后改变了病毒蛋白的三级结构,间接影响了病毒非结构蛋白的转录。与PRRSV同属的马动脉炎病毒(Equine arteritis virus,EAV)、小鼠乳酸脱氢酶升高征病毒(Lactate dehydrogenase elevating virus,LDV)以及猴出血热病毒(Simian hemorrhagic fevervirus,SHFV)的聚合酶蛋白上,该位点是天门冬氨酸,而不是酪氨酸或者组氨酸,如人工将PRRSV第642位点突变为天门冬氨酸,是否会导致其他生物学特征产生变化,还需要进一步通过反向遗传学验证。
之前有报道在通过反向遗传学突变的PRRSV其他蛋白(Nsp7、GP5a等),会引起对病毒致死突变或者降低病毒滴度或者转录[17],本试验结果与之前保持一致。据此推测只要不破坏病毒基因的高级结构就不会造成病毒致死突变。这一点需通过密码子优化方法进行进一步测试并进一步证明关键氨基酸的作用及其对病毒生物学特性的影响。
Nsp9不仅与宿主蛋白发生作用,而且与病毒毒力,耐药性,IFN-γ等密切相关。已有报道针对Nsp9设计相应的化合物会抑制病毒复制[18-21],PRRSV在全国范围内突变日益严重,而Nsp9突变较其他基因较保守,这也为未来研究该基因以及控制该病奠定了新的方向。本研究为进一步探索病毒Nsp9的复制机理与调控机制奠定了基础。

