大鼠慢性不可预测温和应激与小鼠社会挫败抑郁症模型的建立与行为学评价
肖 婷 马天阳 徐祥清 王克威.2
1. 北京大学药学院药理学系,北京,100871,中国
2. 青岛大学药学院药理学系,青岛,266071,中国
重度抑郁症(major depressive disorder,MDD)是现代社会常见的精神疾病,主要表现为情绪低落,对任何事情不感兴趣,充满孤独感以及具有自杀倾向[1]。据统计,到2020年,抑郁症将成为继心血管疾病之后影响人们生活质量的第二大疾病[2-3]。尽管重度抑郁症给个人和社会生活带来了严重负担,针对重度抑郁症治疗的有效措施却是有限的。究其原因主要是对重度抑郁症的病生理机制不甚了解[4]。因此,有必要建立可靠的疾病动物模型,探究重度抑郁症的病生理过程,发现关键的可干预的分子靶标。
重度抑郁症动物模型必须满足三个标准,即症状相符(face validity)、致病因素一致(construct validity)和能被抗抑郁药治疗(predictive validity)[5-6]。症状相符是指动物模型要与重度抑郁症患者具有相同的表型,例如食欲不振,体质量减轻,快感缺失及社会交往障碍等;致病因素一致是指导致抑郁症的物理心理因素相同,例如遗传因素和环境因素;能被抗抑郁药治疗,是指模型动物的抑郁样表型能被现阶段有效的阳性抗抑郁剂所逆转。目前能满足这三个标准的有急性抑郁动物模型[7-10],医源性抑郁模型[11-12]以及慢性抑郁动物模型[13-14]。急性抑郁动物模型主要用于抗抑郁化合物的筛选,医源性抑郁模型用于研究抑郁症的激素和免疫系统的变化,而慢性抑郁模型主要用于重度抑郁症的发病机制研究。慢性温和不可测应激(chronic unpredicted mild stress,CUMS)模型[15-17]和社会挫败(social defeat,SD)[18-21]模型符合动物模型的三个标准。不同文献CUMS模型和SD模型的评价指标不一致,且模型重复性较差[22],因此,有必要摸索更可靠的造模方法。
在本研究中,针对大鼠CUMS模型,采用简便的应激因子如通宵照明、夹尾和湿笼等进行模型的建立,造模后使用禁水20 h,测试24 h的糖水偏爱实验进行测试。小鼠SD模型连续10 d应激后进行社会交往测试,其测试时间由2.5 min延长为5 min。通过对着两种模型的建立方法和评价指标进行反复调整,以期建立稳定及重复性较好的慢性抑郁模型,并对两种模型的造模特点及优劣势进行了比较。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
Wistar大鼠,♂,体质量(180~250) g;C57BL/6J小鼠,♂,体质量(20~25) g;CD-1小鼠,♂,7~8月退役种鼠,体质量(35~45) g,均购自北京维通利华实验动物技术有限公司。动物饲养在(20±1) ℃环境中,饲养房间昼夜颠倒,晚上8点开灯,早上8点关灯。湿度40%~60%,12 h光照/黑暗循环,水和食物充足,大鼠在尾部用蓝色标记笔编号,小鼠用订制的金属耳标编号。所有涉及本研究动物的研究均遵循2017年新修订版《实验动物管理条例》的指导原则,并已获得北京大学医学部伦理实验动物委员会的批准。
1.1.2 实验试剂
氟西汀,购于Sigma公司,其他所用试剂均为国产。氟西汀(fluoxetine)溶液,大鼠腹腔注射用剂量为10 mg·kg-1,称取相应剂量氟西汀粉末溶于相应体积注射用生理盐水中,超声溶解。配制溶液4 d内用完,常温储存。
1.1.3 实验仪器
大鼠游泳桶的制作尺寸为内径 25 cm、水深45 cm。实验所用旷场为定制的不透明塑料箱,其规格为42 cm(w)×42 cm (d)×42 cm (h)。联合开场视频分析系统(Clever Sys Inc,Leesburg,VA,USA)。
1.2 实验方法
1.2.1 动物模型
1.2.1.1 CUMS模型 CUMS造模方法在Willner方法的基础上加以修改[23]。造模Wistar大鼠连续28 d暴露于不可预测的温和应激中,每天随机两种不同的应激方式,主要的应激因子包括通宵照明、夹尾、湿笼、拥挤、冰水游泳、禁水禁食[24]等。
1.2.1.2 SD模型 SD模型利用同种物种间不同个体的社交冲突来产生情绪上和心理上的刺激,从而造成社交障碍而出现抑郁样表型。本研究在Golden的基础上加以修改[20],选用CD-1雄性小鼠作为攻击鼠(宿主),选择C57BL/6J作为实验鼠(入侵者),利用雄性小鼠的领地意识,当有外来小鼠C57BL/6J入侵的时候,宿主CD-1小鼠便会自发攻击入侵小鼠。社会挫败刺激主要分为两个阶段,第一阶段是5~10 min的身体攻击,实验鼠C57BL/6J进入CD-1的领地,被CD-1连续攻击5~10 min;第二阶段为 24 h 的感官接触[25](Fig.1)。慢性SD模型连续应激10 d,每天进行一次社会挫败刺激。
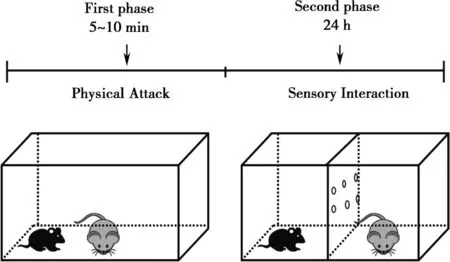
Fig.1 Schematic diagram of social defeat stressor
1.2.2 行为学指标
1.2.2.1 糖水偏爱测试 糖水偏爱测试前,将Wistar大鼠和C57BL/6J小鼠单笼饲养适应环境2 d,d 1给予Wistar大鼠和C57BL/6J小鼠两瓶0.8%的蔗糖水,d 2给予一瓶水和一瓶0.8%糖水,在时间中间点更换两瓶位置。测试当天,Wistar大鼠或C57BL/6J小鼠禁水20 h,之后给予水和0.8%糖水各一瓶,使Wistar大鼠或C57BL/6J小鼠自由饮水24 h,时间中间点更换两瓶位置。造模前先进行糖基线的测试,造模后不再适应环境直接禁水20 h,测试24 h评估造模是否成功。24 h后统计Wistar大鼠或C57BL/6J小鼠饮水情况。计算糖水偏爱率(sucrose preference),取平均值。糖水偏爱率计算公式为[26]:

1.2.2.2 强迫游泳测试 强迫游泳测试(forced swimming test,FST)在 Porsolt的基础上加以改进[27]。强迫游泳属于抑郁症的经典行为学实验,对大、小鼠皆适用,主要用来考察动物的行为绝望[28]。Wistar大鼠游泳桶尺寸为内径25 cm、水深45 cm。将动物放于水中游泳6 min,实验者对后4 min中Wistar大鼠在水中的不动时间进行统计分析,不动的标准为Wistar大鼠只将头部露出水面漂浮于水面,身体不挣扎,不动时间越长,表明动物越绝望。实验过程中,Wistar大鼠要彼此分开,免受视听干扰。要求每次放下一只Wistar大鼠之前,要将水面上漂浮的粪便清理干净,从水中捞起Wistar大鼠后,用毛巾尽可能将其毛发擦干,以防感冒。
1.2.2.3 社会交往测试 社会交往测试(social interaction test,SIT)用以评价社会挫败模型小鼠的社会交往能力。实验所用旷场为定制的不透明塑料箱(Fig.2),其规格为42 cm (w)×42 cm (d)×42 cm (h)。旷场分为两个区,一是围绕金属笼周边14 cm (w)×24 cm (d)的接触区(interaction zone),另一个是与接触区相对应的两个9 cm (w)×9 cm (d)的角落区(corner zone)[20]。测试分为两个阶段,第一阶段为无攻击鼠阶段(target absent),此时接触区中放一个空的金属笼子,将C57BL/6J小鼠头朝角落区方向放于旷场最中间,然后录像记录5 min的活动情况;第二阶段为有攻击鼠阶段(target present),此时在接触区中换一个同样的新金属笼子,并且在金属笼内放上一只陌生的CD-1攻击鼠,然后将C57BL/6J小鼠头朝角落区放于旷场最中间,录像记录5 min的活动情况。实验结束后用视频分析系统分析300 s小鼠在旷场各个区的活动时间。社会交往率(social interaction ratio,SIR) =有攻击鼠存在时C57BL/6J小鼠在接触区持续时间/无攻击鼠存在时C57BL/6J小鼠在接触区持续时间。SIR≥1,表明C57BL/6J小鼠是抵抗鼠(resilient),对此应激不敏感;SIR<1,表明 C57BL/6J小鼠是易感小鼠(susceptible),即为造模成功小鼠。实验中要保持绝对安静,且每阶段放C57BL/6J小鼠进旷场前,都要将粪便处理干净并喷洒75%的酒精去除异味,以免对测试造成干扰。
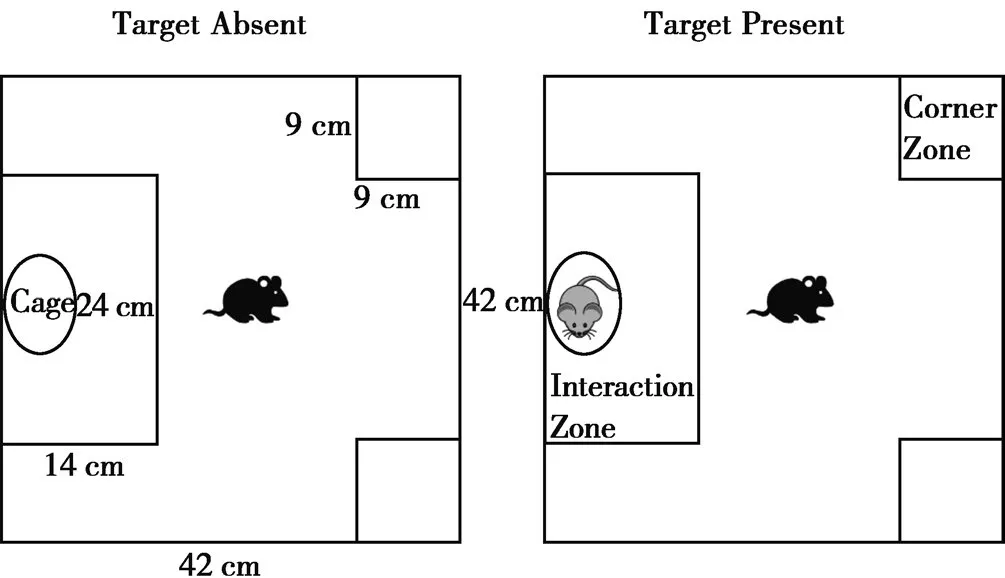
Fig.2 Schematic diagram of social interaction test (SIT)
1.3 统计方法
所有计量资料均以均数±标准差(x-±s)表示,运用SPSS 20.0软件进行统计分析。两组间比较用t检验,多组均数采用方差分析,两两比较采用q检验。P<0.05为差异有统计学意义。
2 结果
2.1 CUMS使Wistar大鼠糖水偏爱率显著降低而使强迫游泳的不动时间显著延长
经过28 d应激,成功建立Wistar大鼠CUMS模型。实验时将大鼠分为空白对照组(control),模型组(CUMS)和氟西汀阳性药组(CUMS + Flu)。造模前,按照糖水偏好率基础值和体质量平均分组,各组糖水偏爱率约80%,体质量为233 g左右。4周造模后,模型组糖水偏爱率降低为69.3%,显著低于空白对照组的81.0%,差异具有统计学意义(P<0.05);氟西汀阳性药组糖水偏爱率为82.1%,表明氟西汀能够使糖水偏爱率恢复(Fig.3C)。从造模第一周开始,CUMS模型组组和氟西汀阳性药组的体质量显著低于对照组(P<0.001),且这种趋势一直持续到第4周(Fig.3B)。4周造模后,对大鼠进行FST行为学测试,CUMS模型组不动时间为131.2 s,空白对照组不动时间为105.1 s,其不动时间明显高于空白对照组(Fig.3D)(P<0.05),CUMS 模型组大鼠表现为行为绝望。氟西汀阳性药组不动时间为108.3 s,与空白对照组相比没有差异,表明不动时间延长趋势能够被阳性药氟西汀所逆转。CUMS应激使Wistar大鼠糖水偏爱率显著降低,体质量减低且FST的不动时间显著延长,符合抑郁症表型,认为此次模型成功(Fig.3)。

Fig.3 Behavior evaluations of CUMS in rats
2.2 慢性SD应激使C57BL/6J小鼠产生社交障碍并降低糖水偏爱率
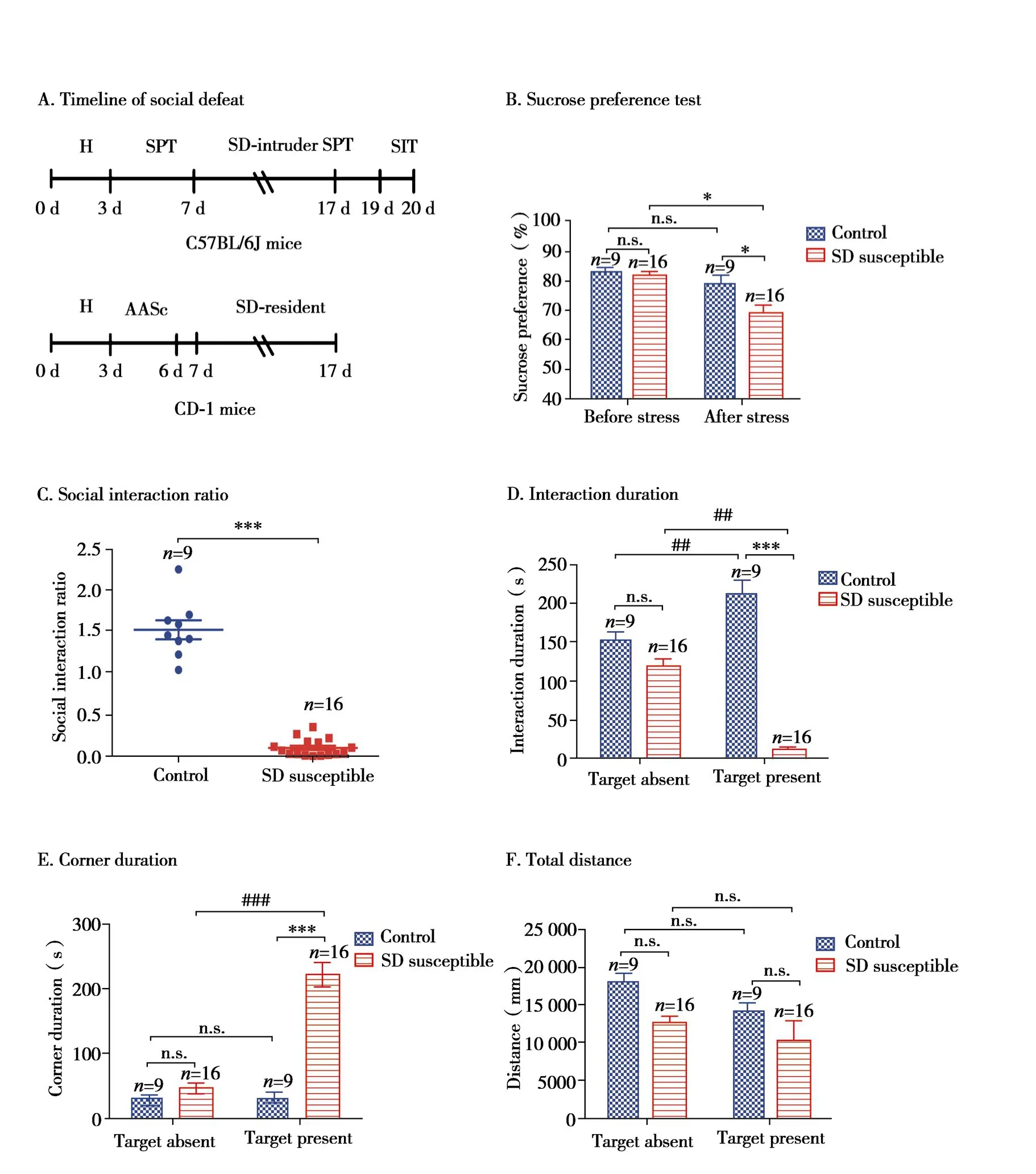
Fig.4 Behavior evaluations of social defeat in C57BL/6J mice
SD模型时间流程如Fig.4A所示,C57BL/6J小鼠作为入侵者被CD-1宿主小鼠连续攻击10 d,每天的社会挫败刺激均为5~10 min的身体攻击和24 h的感官接触(Fig.1)。造模后,将社会交往率小于1的成为敏感鼠(susceptible),大于 1 的成为抵抗鼠(resilient)[20],将敏感鼠作为SD模型成功组,以下数据将模型组(social defeat susceptible)和空白对照组(control)进行评估。造模前,对照组和SD敏感小鼠组的糖水偏爱率分别为82.7%和81.7%,经过连续10 d的应激,对照组和SD敏感小鼠组的糖水偏爱率分别为78.6%和69.2%,SD敏感小鼠组小鼠的糖水偏爱率相比对照组显著降低,差异具有统计学意义(P<0.05)(Fig.4B)。在SIT行为学测试中,当旷场中无攻击鼠时,SD敏感组小鼠在接触区和角落区与对照组相比没有差异(Fig.4D,4E);而当有攻击鼠存在时,与对照组小鼠比较,SD敏感组小鼠在角落区待的时间显著增加(Fig.4E),在接触区停留时间显著减少(Fig.4D),并且 SIR 小于 1(Fig.4C),证明经过应激的SD敏感小鼠产生了社交障碍,致使其减少在接触区与CD-1小鼠的互动。SD敏感小鼠与对照小鼠的总运动路程没有差异(Fig.4F),这表明小鼠经过社会击败应激后自发活动不受影响,小鼠运动能力正常。根据以上结果,认为此次社会挫败小鼠造模成功。
3 讨论
尽管没有动物模型真正能够反映抑郁症病人的症状,但是建立啮齿类动物抑郁症模型仍然非常必要。关于建立CUMS大鼠模型,每天采用两种不同的应激因素对大鼠进行刺激,在糖水偏爱测试过程中发现,前几次都采用禁水24 h,测试1 h,这种测试方式会使禁水大鼠因为口渴而选择就近原则,不一定表现出偏爱糖水行为,所以之后将糖水测试时间改为禁水20 h,测试24 h,以保证大鼠有足够的时间去选择水或者糖水。
总结三次大鼠CUMS的造模过程,可以得出以下结论:①糖水测试次数要少,以免形成记忆;②从数据上分析,似乎糖水基础值大的大鼠比较容易受应激的影响而成模;③由于应激使大鼠体质量下降的较多,在做实验时最好选择体质量大一点的大鼠进行实验。
社会挫败模型是另一常用的慢性抑郁模型。在社会挫败模型中,SIR小于1成为敏感鼠,大于1则成为抵抗鼠[20],这种分类方式能够减少因个体差异性引起整体动物行为学的评估情况(例如CUMS中因个体天生不喜爱喝糖水而影响整体糖水偏爱率评估)。模型一开始采用10 min的身体攻击时间,发现CD-1退役种鼠攻击力太强,C57BL/6J小鼠受外伤严重,因此后期身体攻击时间改为5 min,感官接触时间仍然为24 h。连续10 d的社会挫败应激,每天都会有C57BL/6J小鼠死亡,为了保证造模结束有足够量的样本,建议在实验开始前每组至少20只。
重度抑郁症是多向性疾病,它是由多种因素导致的疾病且具有多种抑郁样表型[29-31]。比较两种慢性抑郁模型CUMS模型和SD模型,CUMS模型模拟人类所受社会生活和环境等多种因素的影响,能较真实反映重度抑郁症的病理发生发展,因此,常用作重度抑郁症的机制研究。SD模型应激因素相对比较单一,但其能模拟人类重度抑郁症致病最重要的因素,因此也常用作机制研究[25]。此外从本研究可以看出,CUMS模型实验周期较长(至少4周),而社会挫败模型实验周期较短(仅为10 d),实验的稳定性和可重复性较高,并且其行为学指标除了糖水偏爱率,还增加了社会交往率,多种行为学指标的统一更能增加模型可信性。此外文献报道称[20],社会挫败应激的影响可以持续一个月,因此筛选抗抑郁剂和评估阳性药引起生理变化时,可以在10 d模型后连续给药观察,这样不会因造模过程中给药带来的外伤刺激影响模型的成败。
CUMS模型和SD模型能使大小鼠糖水偏爱率显著降低而引起快感缺失等抑郁样表型,因此都常用作重度抑郁症的疾病机制研究。本研究通过比较,认为小鼠社会挫败抑郁模型因其实验周期较短,稳定性和可重复性较高等优势,推荐在未来的重度抑郁症研究中首选作为其机制和抗抑郁剂筛选的动物模型。
[1] David V Sheehan,Kazuyuki Nakagome,Yuko Asami,et al.Restoring function in major depressive disorder: A systematic review[J]. J Affect Disord,2017,215: 299-313.
[2] Theo Vos,Ryan M Barber,Brad Bell,et al. Global,regional,and national incidence,prevalence,and years lived with disability for 301 acute and chronic diseases and injuries in 188 countries,1990-2013: a systematic analysis for the Global Burden of Disease Study 2013[J]. Lancet,2015,386(9995): 743-800.
[3] The World Health Organization. The world health report 2001[J]. Geneva: WHO 2001: 19-45.
[4] Vikram Patel,Benedict Weobong,Helen A Weiss,et al. The healthy activity program (HAP),a lay counsellor-delivered brief psychological treatment for severe depression,in primary care in India: a randomised controlled trial[J]. Lancet,2017,389(10065): 176-185.
[5] David H Overstreet. Modeling depression in animal models[J]. Methods Mol Biol,2012,829: 125-144.
[6] Thomas H McCoy,Victor M Castro,Hannah R Rosenfield,et al. A clinical perspective on the relevance of research domain criteria in electronic health records[J]. Am J Psychiatry,2015,172(4): 316-320.
[7] John F Cryan,Cedric Mombereau,Annick Vassout. The tail suspension test as a model for assessing antidepressant activity: review of pharmacological and genetic studies in mice[J]. Neurosci Biobehav Rev,2005,29(4-5): 571-625.
[8] John F Cryan,C Mombereau. In search of a depressed mouse: utility of models for studying depression-related behavior in genetically modified mice[J]. Mol Psychiatry,2004,9(4): 326-357.
[9] Zhou Xin-yu,Liu Lan-xiang,Zhang Yu-qing,et al.Metabolomics identifies perturbations in amino acid metabolism in the prefrontal cortex of the learned helplessness rat model of depression[J]. Neuroscience,2017,343: 1-9.
[10] Daniela Velasquez,Caroline Quines,Renan Pistoia,et al. Selective inhibition of MAO-A activity results in an antidepressant-like action of 2-benzoyl 4-iodoselenophene in mice[J]. Physiol Behav,2017,170: 100-105.
[11] David Baumeister,Stafford Lightman,Carmine M Pariante.The interface of stress and the HPA axis in behavioural phenotypes of mental illness[J]. Curr Top Behav Neurosci,2014,18: 13-24.
[12] Su Chun-lin,Su Chun-wei,Hsiao Ya-Hsin,et al. Epigenetic regulation of BDNF in the learned helplessness-induced animal model of depression[J]. J Psychiatr Res,2016,76: 101-110.
[13] Johanna Schoner,Andreas Heinz,Matthias Endres,et al.Post-traumatic stress disorder and beyond: an overview of rodent stress models[J]. J Cell Mol Med,2017,DOI:10.1111/jcmm.13161.
[14] Fiona Hollis,Mohamed Kabbaj. Social defeat as an animal model for depression[J]. ILAR J,2014,55(2): 221-232.
[15] Qiao Hui,An Shu-cheng,Xu Chang. et al. Role of proBDNF and BDNF in dendritic spine plasticity and depressive-like behaviors induced by an animal model of depression[J].Brain Res,2017,1663: 29-37.
[16] Ryan Wellington Logan,Nicole Edgar,Andrea G Gillman,et al. Chronic stress induces brain region-specific alterations of molecular rhythms that correlate with depression-like behavior in mice[J]. Biol Psychiatry,2015,78(4): 249-258.
[17] Florent Barthas,Muris Humo,Ralf Gilsbach,et al.Cingulate overexpression of mitogen-activated protein kinase phosphatase-1 as a key factor for depression[J]. Biol Psychiatry,2017,DOI: 10.1016/j.biopsych.2017.01.019.
[18] Masakazu Ibi,Liu Jun-jie,Noriaki Arakawa,et al.Depressive-like behaviors are regulated by NOX1/NADPH oxidase by redox modification of NMDA receptor 1[J]. J Neurosci,2017,37(15): 4200-4212.
[19] Caroline Hammels,Ehsan Pishva,Jochen De Vry,et al. Defeat stress in rodents: From behavior to molecules[J]. Neurosci Biobehav Rev,2015,DOI: 10.1016/j.neubiorev.2015.10.006.
[20] Sam A Golden,Herbert E Covington,Olivier Berton,et al. A standardized protocol for repeated social defeat stress in mice[J]. Nat Protoc,2011,6(8): 1183-1191.
[21] Mailton Vasconcelos,Dirson Joao Stein,Rosa Maria de Almeida. Social defeat protocol and relevant biomarkers,implications for stress response physiology,drug abuse,mood disorders and individual stress vulnerability: a systematic review of the last decade[J]. Trends Psychiatry Psychother,2015,37(2): 51-66.
[22] Paul Willner. Reliability of the chronic mild stress model of depression: A user survey[J]. Neurobiol Stress,2017,6:68-77.
[23] Willner P,Towell A,Sampson D,et al. Reduction of sucrose preference by chronic unpredictable mild stress,and its restoration by a tricyclic antidepressant[J].Psychopharmacology (Berl),1987,93(3): 358-364.
[24] Li Wei-dong,Zhu Yan,Shakir M Saud,et al. Electroacupuncture relieves depression-like symptoms in rats exposed to chronic unpredictable mild stress by activating ERK signaling pathway[J]. Neurosci Lett,2017,642: 43-50.
[25] Allyson K Friedman,Barbara Juarez,Stacy M Ku,et al.KCNQ channel openers reverse depressive symptoms via an active resilience mechanism[J]. Nat Commun,2016,7:11671.
[26] Shi Hai-shui,Zhu Wei-li,Liu Jian-feng,et al. PI3K/Akt signaling pathway in the basolateral amygdala mediates the rapid antidepressant-like effects of trefoil factor 3[J].Neuropsychopharmacology,2012,37(12): 2671-2683.
[27] Roger D Porsolt,Le Pichon M,Jalfre M. Depression: A new animal model sensitive to anti-depressant treatment[J].Nature,1977,266: 730-732.
[28] Tomoyuki Tashiro,Yuki Murakami,Akihiro Mouri,et al. Kynurenine 3-monooxygenase is implicated in antidepressants-responsive depressive-like behaviors and monoaminergic dysfunctions[J]. Behav Brain Res,2017,317: 279-285.
[29] Pirooznia M,Wang T,Avramopoulos D,et al. Highthroughput sequencing of the synaptome in major depressive disorder[J]. Mol Psychiatry,2016,21(5): 650-655.
[30] Marcus Rothkirch,Jonas Tonn,Stephan Kohler,et al.Neural mechanisms of reinforcement learning in unmedicated patients with major depressive disorder[J]. Brain,2017,140(4): 1147-1157.
[31] Matthew J Robson,Meagan A Quinlan,Randy D Blakely.Immune system activation and depression: roles of serotonin in the central nervous system and periphery[J]. ACS Chem Neurosci,2017,8(5): 932-942.

